1. Introducción
La piel es la barrera entre el ambiente interno y externo de una persona, además es el Órgano más grande del cuerpo humano [1]. El daño en esta es causado principalmente por quemaduras, heridas crónicas como ulceras venosas, escisión de la piel, tumores y otras afecciones dermatológicas. Según la OMS, cada año se atribuyen 300,000 muertes a quemaduras, mientras que 6 millones de pacientes en todo el mundo sufren quemaduras cada ano. Además, más de 6 millones de personas sufren de úlceras cutáneas crónicas, solo en los Estados Unidos, más de 3 millones de pacientes sufren heridas crónicas [2]. Debido a la presencia de células madre, la epidermis que se encuentra herida es capaz de estimular auto regeneración. Sin embargo, en caso de lesiones profundas o quemaduras, el proceso de sanación no es adecuado, y esto conlleva a una herida crónica [1]. La curación de heridas y por lo tanto, la regeneración del tejido de la piel es un proceso muy bien coordinado que depende de varios factores como el tipo de herida, daño tisular por quemadura, traumatismo físico, condiciones de humedad alrededor de la herida, inflamación e infecciones secundarias [3].
La ingeniería de tejidos ha surgido como un nuevo campo prometedor para el tratamiento de lesiones cutáneas [2]. El principal objetivo es restaurar y mejorar la función de los tejidos, ya sea generando sustitutos nuevos biocompatibles, o bien mediante la reconstrucción de los tejidos [3]. La compleja cascada de técnicas para regeneración de heridas es una fuente primordial de innovación en el campo de la ingeniería de tejidos blandos [4]. Varios sustitutos de la piel (celularizados o acelulares, que contienen componentes dérmicos y/o epidérmicos) están disponibles comercialmente. Sin embargo, debido a la ineficiencia para el tratamiento de heridas y quemaduras graves o grandes, la investigación aún está en progreso. Se consideran diferentes estrategias de ingeniería tisular para abordar los inconvenientes actuales de los sustitutos de la piel, y recientemente se han publicado una gran cantidad de artículos que revisan las estrategias actuales [5].
2. Ingeniería de tejidos
El objetivo de la ingeniería de tejidos es el de desarrollar sustitutos de tejido y árganos para mantener, restaurar o aumentar las funciones de sus contrapartes heridas o enfermas in vivo [6].
En la década anterior se encontraron numerosos productos que muestran potencial en aplicaciones clínicas. Aunque muchos de los productos que entran al mercado son heredados de eras anteriores, las pruebas clínicas exitosas para la aplicación de tejidos diseñados mediante ingeniería de tejidos han sido muy limitadas debido a obstáculos persistentes que evitan el logro de funciones biológicas de constructos celularizados debido a la compatibilidad incompleta con su huésped [6].
Uno de los principales obstáculos que se presentan en la ingeniería de tejidos, es que muchos de los tejidos diseñados no poseen por completo las mismas características que el tejido funcional que están reemplazando. La falta de compatibilidad total se atribuye en parte al poco conocimiento cuantitativo existente relacionado a los mecanismos de respuesta de adaptación que modifican la arquitectura de los tejidos diseñados posterior a su trasplante in vivo [7].
La estrategia actual utilizada en ingeniería de tejidos se basa en el diseno ex-vivo de la expansión biocompatible, seguida de su implantación en las áreas dañadas. Generalmente se utilizan biomateriales variados en la ingeniería de tejidos. El rol de los biomateriales es el de proveer soporte mecánico y transporte de masa temporales para fomentar la adhesión, proliferación y diferenciación celulares, además de controlar el tamaño y forma del tejido regenerado [7].
La clasificación de los sustitutos de piel puede estar basada en la duración del recubrimiento, permanentes, semipermanentes y temporales; también en las características estructurales, epidermico, dermico o dermo-epidérmico; en la composición del sustituto de piel, celular o acelular; y, similarmente se puede basar en el tipo de biomaterial utilizado, biológico (autólogo, alogénico, xenogénico) o sintético (biodegradable, no biodegradable) [1].
3. Anatomía de la piel
La piel es la primera línea de defensa contra el medio exterior y además ayuda a mantener la termorregulación del cuerpo humano [8]. Es el órgano más grande, el más externo y actúa como una envoltura del cuerpo, lo cual, consecuentemente, hace que sea el órgano más propenso a herirse. La piel se encuentra cercanamente integrada a la fascia endoesquelética a través de ligamentos reticulares, venas, nervios y linfáticos [9].
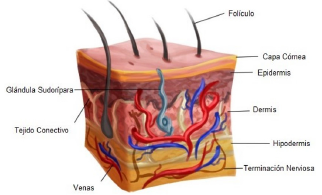
Como se muestra en la figura 1, la piel está conformada por tres capas: epidermis, dermis e hipodermis. La porción externa de la epidermis (capa córnea) es considerablemente más permeable al agua que las capas internas, y además inhibe la entrada de patógenos y otras sustancias ajenas al cuerpo. Posee una estructura multicapa con células extendiéndose desde la membrana basal hasta la dermis. La membrana basal contiene células progenitoras las cuales se diferencian en queratinocitos, y posteriormente los queratinocitos se diferencian y maduran a la vez que se desplazan a la superficie de la piel. La capa queratinizada de células muertas en la piel provee cualidades de barrera a la piel. El pigmento característico de la piel viene dado por la melanina, la cual es producida por los melanocitos presentes en la epidermis [10].
La dermis es la capa más gruesa de las 3 capas. Es un tejido conectivo formado por una matriz extracelular, fibroblastos, células vasculares endoteliales, folículos de pilosos, glándulas sudoríparas, glándulas sebáceas, venas sanguíneas y terminaciones nerviosas. Debajo de la dermis se encuentra la hipodermis, la cual es un tejido adiposo encargado de proveer aislamiento y amortiguación entre la piel y las estructuras del esqueleto como el músculo y los huesos. Además sirve como área de almacenamiento de energía [11].
4. Heridas y su proceso de curación
Una herida se puede definir como una disrupción o daño a una estructura anatómica y sus funciones como consecuencia de un rompimiento de diferente grado de severidad de las estructuras de un órgano. En el caso de la piel, el daño se puede extender hasta otros tejidos y estructuras tales como el tejido subcutáneo, músculos, tendones, nervios, venas y huesos [12].
Para un adulto mamífero es desafiante lograr una recuperación total del tejido epitelial después de haber recibido un daño. Normalmente después del proceso de sanación queda formada una cicatriz que, aunque cumple con los requisitos básicos de prevenir infecciones y deshidratación, también puede ser considerada como desfavorable ya que se pierden atributos sensoriales y termorregulatorios por la ausencia de folículos pilosos, y glándulas sebáceas. Además, debido a su obvia apariencia distinta al resto de la piel, la cicatriz resultante del proceso de sanación puede culminar en consecuencias cosméticas y psicológicas devastadoras, reduciendo la calidad de vida del individuo [13].
La sanación de heridas es un proceso complejo multicelular que involucra fibroblastos, queratinocitos, células endoteliales y células inflamatorias. El proceso de sanación sigue una secuencia ordenada de eventos incorporando tres etapas entrelazadas: fase inflamatoria, fase de proliferación y la fase de remodelación. Las fases del proceso en la recuperación de una herida está reguladas por la comunicación entre distintos grupos de moléculas, incluyendo la matriz extracelular, integrinas, factores tráficos y metaloproteinasas de matriz [14].
La fase inflamatoria es un proceso para prevenir hemorragia por medio de la contención y bloqueo de la sangre dentro de las paredes de las venas dañadas. La hemostasis es un proceso complejo que involucra la interacción de las plaquetas, cascadas de coagulación de plasma, proteínas fibrinolíticas, y citoquinas mediadoras. Al existir una herida del tejido el mecanismo hemostático usa receptores vasculares y extravasculares en coordinación con los componentes de la sangre para sellar el daño al sistema vascular y asilarlo de los tejidos circundantes. Al final de la fase inflamatoria las venas sanguíneas lesionadas se contraen y la sangre filtrada se coagula, contribuyendo al mantenimiento de su integridad [15,16].
La fase de proliferación tiene como objetivo disminuir el área de tejido lesionado por contracción y fibroplasia, estableciendo una barrera epitelial viable para activar queratinocitos. Esta etapa es la responsable del cierre de la herida como tal, lo cual involucra procesos de angiogénesis, fibroplasia y reepitelización. Este proceso empieza en el microambiente de la lesión dentro de las primeras 48 horas y puede permanecer activo hasta 14 días después de la lesión [16].
La fase final de remodelación tiene como principal objetivo el alcanzar la fuerza tensil máxima a través de la reorganización, degradación y resíntesis de la matriz extracelular. En esta etapa de sanación ocurre un intento por recobrar las estructuras normales de tejido, y el tejido granular es gradualmente remodelado formando el tejido cicatrizado el cual es menos celular y vascular, además de exhibir un incremento progresivo en la concentración de fibras de colágeno [16,17].
5. Compuestos biocompatibles promotores de la regeneración de tejidos
Los tipos de compuestos y sustancias utilizadas en ingeniería de tejidos en casi la totalidad de los casos llevan al menos un componente polimérico. Los polímeros diseñados para promover la regeneración de tejidos pueden clasificarse de manera general en naturales y sintéticos (figura 2) [5]. La variedad de tipos, combinaciones y aditivos orgánicos e inorgánicos para el polímero formulado es vasta. Debido a la gran variedad de compuestos promotores de la regeneración de tejidos, la investigación y el esfuerzo por encontrar nuevas alternativas que presenten alta compatibilidad con el tejido vivo son continuos.
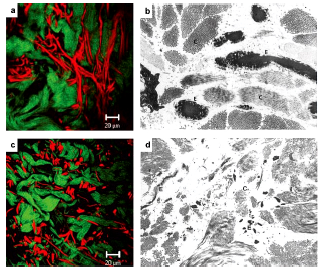
Figura 2 Fibras de colágeno y elastina en una dermis normal (a, b) y en tejido de cicatriz hipertrófico (c, d). En las imagenes por microscopía de excitación por dos fotones (a, c) los grupos de colágeno son verdes y las fibras de elastina rojas. En las imágenes de microscopía electrónica de transmisión (b, d) el colágeno (letra C) es gris claro y la elastina (letra E) es gris oscuro. Mientras que las fibras de elastina gruesas y largas son visibles entre los grupos de colágeno en la dermis normal, en la cicatriz hipertrófica la elastina esta dispersa como fibras delgadas entre los grupos de colágeno [5] .
Polímeros naturales tales como el colágeno, quitosano, ácido hialuráonico, alginato, entre otros, son usados por poseer características que los hacen favorables. Entre estas características las más importantes son su biodegradabilidad, biocompatibilidad y su amplia abundancia. La biodegradabilidad de un determinado material natural es una de las características más importantes, ya que estos están presentes en la matriz extracelular, lo cual hace que las células presenten una respuesta buena de compatibilidad y ritmo de crecimiento [18].
Un caso de uso de polímeros naturales es la investigación de Huan et al. En dicha investigación se sintetizaron, por medio de una reacción de derivatización a base de quitina en medio acuoso con KOH/Urea, derivados cuaternizados de β-quitina, los cuales mostraron cualidades antibacteriales debido a las cargas positivas generadas en la estructura por los grupos acetaamido. Además, las estructuras cuaternizadas de β-quitina mostraron promover la neovascularización, crecimiento de tejido granular y regeneración de fibras de colágeno [19].
Los biomateriales sintéticos pueden ser biomateriales naturales modificados o materiales completamente sintéticos. Este tipo de materiales pueden ser biodegradables o no biodegradables.
Entre los materiales no biodegradables es común el uso de derivados de polietileno, politetrafluoroetileno, polimetilacrilatos, poliacrilamidas, poliáeteres, polisiloxanos, poliuretanos, polietilenglicol entre otros [20]. Este tipo de materiales tienen ventajas tales como la no inmunogenicidad, buena reproductibilidad, adecuadas propiedades mecánicas y formas diseñadas a la medida [18].
Entre otros polímeros sintéticos utilizados se encuentra el polímero de bloque formado por una secuencia de polietilenglicol, poli propilenglicol y polietilenglicol (PPG-PEG-PPG). Este es un polímero ampliamente utilizado en biomedicina debido a sus propiedades únicas en solución, habilidad de autoensamblaje y baja toxicidad [21].
Entre los biomateriales sintéticos biodegradables es común el uso de poliésteres, poli(a-hidroxiácidos), polilactonas, poliortoésteres, policarbonatos, polianhádridos y polifosfacenos. Estos materiales biodegradables pueden ser diseñados de modo que se pueda controlar su cinética de degradación junto con su ritmo de factor de liberación de crecimiento [18,22].
En un caso de biomateriales sinteticos, Dobreikina et al. prepararon una serie de geles a base de poliacrilamida (PAM) con redes semi-interpenetrantes para fines de ingeniería de tejidos. Los geles fueron preparados por polimerización de radicales libres en solución acuosa con PAM como cadena de unión principal con un radio de 1:100 entre el monómero (goma gellan o xantano) y la PAM para la formación de una red semi-interpenetrada. La presencia de polisacáridos a diferentes concentraciones mejora la biocompatibilidad del gel, además de aumentar significativamente el modulo de Young y el potencial eléctrico del gel sintetico. Las estructuras desarrolladas en este estudio tienen la ventaja de que presentan un comportamiento no lineal en la tensión versus deformación, lo cual es característico de los tejidos blandos [23].
6. Avances y técnicas de ingeniería de tejidos
6.1. Impresión 3D
En los últimos 25 años se han logrado avances significativos en el desarrollo de sustitutos diseñados in vitro que imitan la piel humana, ya sea para ser utilizados como injertos para la sustitución de la piel perdida, o para el establecimiento de modelos de piel humana in vitro [24]. El concepto de ingeniería de tejidos se formalizó en 1993, al detallarse las características y aplicaciones de los andamios (soportes) tridimensionales (3D) biodegradables. Los andamios 3D son microestructuras que sirven de base para la colocación de las células y los factores necesarios para la regeneración cutánea; estos deberían ser muy porosos, tener redes de poros bien interconectadas y tener un tamaño de poros consistente y adecuado para la migración e infiltración de células. Posteriormente, de 1993 al 2002, se aplicaron varias técnicas de fabricación convencionales para la producción de andamios 3D, como la union de fibras, la separación de fases, el moldeado y la formación de espuma, etc. Sin embargo, estos métodos tienen un gran inconveniente: no permiten un control suficiente de la arquitectura de los andamios, la red de poros y el tamaño de los poros, lo cual da lugar a andamios 3D inconsistentes y poco ideales, puesto que la simple siembra de células sobre andamios poliméricos preformados no es suficiente para replicar completamente las sofisticadas interacciones de la matriz celular dentro de los tejidos naturales [25,26]. Además, se deben mejorar aspectos del proceso de producción de este sustituto de piel con los métodos mencionados, como el tiempo necesario para producir la superficie requerida para cubrir una quemadura extensa o una herida grande, y la necesidad de automatizar y estandarizar aquellos procesos que se realizan manualmente [24]. Para superar este problema, se propuso el uso de métodos de impresión 3D para fabricar andamios personalizados con tamaño y estructura de poro controlado; esta tecnología se ha convertido en una herramienta flexible en la medicina regenerativa y proporciona una plataforma para enfrentar estos desafíos [24,25].
Las tecnologías utilizadas por los sistemas de bioimpresión 3D permiten una mayor precisión en la relación espacial entre los elementos individuales del tejido deseado [27]. Como resultado, entre 2003 y hasta el presente año, la cantidad de estudios en el campo de la impresión 3D para la ingeniería de tejidos se ha multiplicado, y las técnicas de impresión han mejorado drásticamente, trasladándose de 2D a 3D [25,28]. La bioimpresión, también conocida como creación rápida de prototipos, fabricación sólida de formas libres o fabricación aditiva [26, 27], se puede definir como "el uso de la tecnología de impresión 3D que incorpora células vivas viables con biomateriales para fabricar tejidos u árganos sofisticados" [26]. Debido al alto control del tamaño de la gota y el ritmo de deposición, las impresoras utilizadas en esta tecnología poseen la habilidad de imprimir con alta resolución y exactitud; además, esta tecnología no solo permite la deposición simultánea de diferentes biomateriales y múltiples tipos de células, sino que también proporciona flexibilidad en el diseño y fabricación de construcciones personalizables de tejidos específicos para pacientes, lo que demuestra un gran potencial para la fabricación de construcciones complejas de tejidos multicelulares 3D [18,26-29].
La bioimpresión generalmente contiene los siguientes tres pasos: en primer lugar, recopilar información precisa de tejidos y órganos para la designación del modelo y la selección de materiales; en segundo lugar, transferir la información a una señal electrica para controlar la impresora para imprimir los tejidos; en tercer lugar, crear una estructura estable [29]. Aunque la bioimpresión se ha desarrollado ampliamente en los últimos años, las tecnologías actuales implementadas en la bioimpresión son en su mayoría incapaces de imprimir órganos sólidos funcionales. Las investigaciones han abordado este problema desarrollando plantillas que podrían usarse in vivo para apoyar el desarrollo de órganos sólidos vascularizados, como los huesos [25,30].
Existen muchos tipos de tecnologías de bioimpresión, cuatro de las cuales se utilizan ampliamente en la actualidad (Figura 3): impresion basada en inyección de tinta, impresión basada en extrusión, impresión asistida por laser, impresión basada en DLP -estereolitografía de proyección óptica dinamica (DOPsL)-, y las diferencias clave entre estas cuatro tecnologías de impresión se describen en la Tabla 1. La viabilidad celular puede verse afectada por varios factores, incluida la tecnica de bioimpresión utilizada, la velocidad de impresión y la especie de células de siembra [29,30].
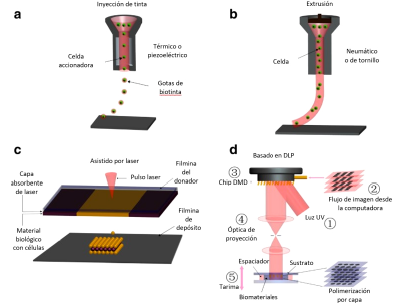
Figura 3 Técnicas de bioimpresión. a La bioimpresora de inyección de tinta expulsa pequeñas gotas de células e hidrogel de manera secuencial para construir tejidos. b La bioimpresora de extrusión utiliza fuerza neumática o manual para extruir continuamente una solución liquida de hidrogel de células. c Esquema del posicionamiento de una impresora laser. D Esquema de la bioimpresora basada en DLP -estereolitografía de proyección óptica dinamica (DOPsL) [29] .
Tabla 1 Comparación de las diferentes técnicas de bioimpresión mencionadas en [29] .
| Variable | Inyección de tinta | Extrusión | Asistido por laser | DLP |
|---|---|---|---|---|
| Proceso de impresión | Serial (gota a gota) | Serial (línea a línea) | Serial (punto por punto) | Paralelo y continuo |
| Velocidad de impresión | Media (mm/s) | Lenta (10-50 μπ/s) | Media (mm/s) | Rapida (mm3/s) |
| Resolución | 50 μπι | 5 μπ | <500nm | 1μππ |
| Viabilidad celular | >85% | 40-80 % | >85% | 85-95 % |
| Elección de material | Termo/pH/foto sensible | Termo/foto sensible | Fotosensible | Fotosensible |
6.1.1. Bioimpresión de inyección de tinta
La aplicación de impresión de inyección de tinta ha sido limitada en comparación con los estudios basados en extrusión, debido a la incapacidad inherente del cabezal de impresión para proporcionar un flujo continuo. Las tintas biológicas con viscosidades inferiores a 10 mPa/s se han imprimido mediante de inyección de tinta. En comparación con otros métodos, la impresión de inyección de tinta ofrece una velocidad de fabricación rapida pero bajas densidades de celda. Los métodos de impresión por inyección de tinta se pueden clasificar en tres grupos: impresión biológica por inyección de tinta continua, impresión biológica por inyección electro-hidrodinámica e impresión biologica por inyección de tinta a demanda. Esta última categoría es la más grande y la más común que consiste en la bioimpresión de inyección de tinta termica, piezoeléctrica y electrostática, mostradas esquemáticamente en la figura 4[30].
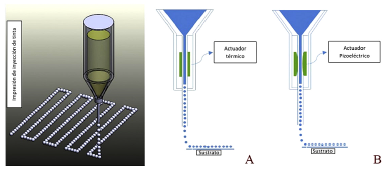
Figura 4 Diagrama esquemático del metodo de impresión de inyección de tinta de gota bajo demanda utilizando Actuadores A) Térmicos y B) piezoeléctricos. Un cabezal de impresión termica emplea un elemento de calentamiento que eleva la temperatura localmente y crea una burbuja que impulsa las gotas a través de la boquilla. Se utiliza una cabeza piezoeléctrica con un material que cambia de forma en la aplicación de voltaje y expulsa las gotitas [30] .
Rimann et al. desarrolló un metodo de impresión todo en uno para la construcción de tejidos blandos usando este tipo de impresión. En este trabajo, se desarrolló y utilizo una tinta biologica basada en polietilenglicol junto con una impresora biologica de inyección de tinta comercial en 3D en desarrollo, la impresión tuvo lugar en ambiente estéril. Para verificar la aplicabilidad de su trabajo, se llevó a cabo una cultura a largo plazo de las estructuras impresas. Los resultados aprobaron la viabilidad y la proliferación de los fibroblastos dérmicos primarios humanos hasta por siete semanas [31].
6.1.2. Bioimpresión por extrusión
La gran popularidad de los métodos basados en extrusión se debe, principalmente, al metodo de procesamiento definido que conduce a la simplicidad, diversidad y previsibilidad de esta tecnica [29,30]. Una amplia gama de biomateriales imprimibles y equipos económicos se encuentran entre las ventajas de la bioimpresión por extrusión. La figura 5 ilustra métodos de impresión comunes basados en la extrusión categorizados en dispensación neumática, accionada por pistón y por tornillo. En la dispensación neumática, la presión del aire proporciona la fuerza motriz requerida, mientras que en la dispensación accionada por pistón y por tornillo, las fuerzas mecánicas vertical y rotacional inician la impresión, respectivamente. Hay tres factores principales para tener en cuenta en la capacidad de impresión a través de la bioimpresión por extrusión: 1) capacidad de ajuste de la viscosidad, 2) fase de bio-tinta antes de la extrusión, y 3) ventana de biofabricación específica del material [30]. La viscosidad puede ser una función de la temperatura o del adelgazamiento por cizallamiento y, por lo tanto, debe ajustarse para diferentes métodos de impresión. Además, la tinta biológica debe estar en una fase líquida para evitar la obstrucción de la boquilla. Finalmente, no todos los biomateriales son imprimibles y los que son imprimibles pueden no imprimirse en una amplia gama de parámetros de procesamiento [29,30]. Esta tecnica fue utilizada por Rees et al. en su investigación, en la cual se consideran dos tipos de estructuras impresas en 3D de nanocelulosa oxidada como apósitos para heridas. El primer tipo se preparo mediante oxidación mediada por (2,2,6,6-tetrametilpiperidin-1-il) oxidanilo (TEMPO) y el segundo tipo se preparó mediante carboximetilación y oxidación de peryodato combinados.
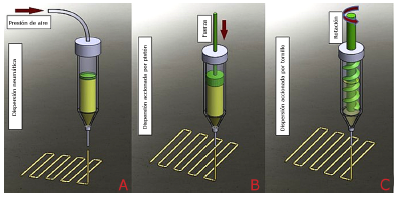
Figura 5 Diagrama esquemático de los métodos comunes de bioimpresión basados en la extrusión: a neumático, b accionado por pistón y c metodo de dispensación atornillado [30] .
La tinta biologica de nanocelulosa producida se usó luego para imprimir estructuras porosas 3D, se estudió para determinar el soporte del crecimiento bacteriano y se demostró que tiene el potencial de transportar y liberar componentes antimicrobianos mientras que no permite el crecimiento bacteriano [30,32]. En otro estudio, se utilizó un hidrogel a base de gelatina, arginato y colágeno para construcciones de tejidos impresos en 3D cargados de células. Una parte integral de este trabajo fue controlar la velocidad de degradation del hidrogel cambiando la relation molar de citrato de sodio presente en el medio al alginato de sodio presente en el hidrogel. La alta tasa de proliferación celular indico la posibilidad de mejorar la bio-tinta de alginato utilizando el método utilizado en este trabajo. Las células madre se encapsularon en una tinta biológica a base de alginato irritado con rayos gamma que se reforzó aún más mediante la adición de fibras de PCL [30,33].
6.1.3. Asistido por lóser
La transferencia directa inducida por láser (LIFT, por sus siglas en inglés) es una técnica que permite la deposición de material de alta resolución en fase sólida o líquida. Si bien existen varias versiones de esta tecnica, en la figura 3c se ilustra esquemáticamente una versión de impresión de material en fase sólida. En un estudio, se empleó la escritura directa por evaporación de matriz asistido por láser, una variación de la técnica LIFT, para la impresión de celdas. Se usó alginato de sodio cargado con células de fibroblastos de ratón NIH 3T3 como tinta biológica junto con cloruro de calcio como agente de reticulación. Se estudiaron los efectos de la gelificación y concentración de alginato, el tiempo de gelificación y la influencia del láser en la viabilidad celular. Se observó que, despuíes de 24 h, un tiempo de gelificación más largo disminuye la viabilidad celular de incubación debido a la reducción de la nutrición y la transferencia de oxígeno a través de la pared gruesa del gel [30].
6.1.4. Bioimpresión a base de estereolitografía
La impresión estereolitográfica se basa en la polimerización de polímeros sensibles a la luz mediante un haz de luz controlado con precisión reflejado por los micro espejos digitales. En comparación con otros métodos, la estereolitografía es una técnica con alta calidad de impresión, velocidad y viabilidad celular. Sin embargo, se han reportado inconvenientes como resultado del uso de este método. Por ejemplo, se ha informado que la fuente de luz UV, que es el método común de polimerización, es dañina para las células de ADN e incluso causa cáncer de piel. Para abordar este problema, los sistemas de bioimpresión de estereolitografía de luz visible han ganado atención. Como ejemplo, Wang et al. empleó un sistema de bioimpresión compuesto por un proyector de haz y mezclas de foto iniciadores a base de PEGDA, GelMA y erosina Y como tintas biológicas.
Los resultados de este trabajo de la bioimpresión de células NIH 3T3 indicaron que el sistema de bajo costo propuesto es capaz de imprimir y curar con luz visible los hidrogeles con una resolución de 50 mm y una viabilidad celular relativamente alta. La Figura 3 muestra esquemáticamente la estereolitografía utilizando un proyector de haz [30,34].
6.2. Andamios polimericos
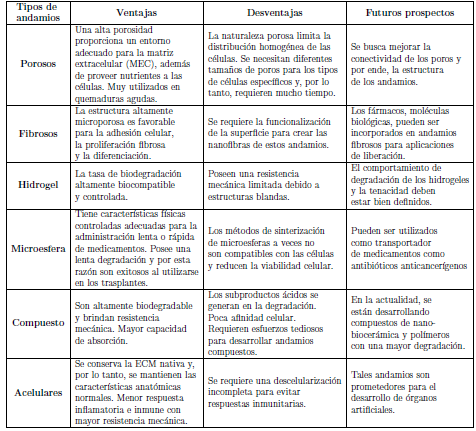
Los andamios pueden estar compuestos de materiales poliméricos sintéticos o absorbibles, naturales, biológicos, degradables o no degradables [3]. Estos andamios deben exhibir ciertas características biológicas, es decir, para apoyar la adhesión, proliferación y diferenciación de los queratinocito. Además, poseen propiedades mecánicas y de degradación apropiadas. Los andamios deben ser suficientemente fuertes y elásticos para un manejo fácil durante la cirugía y para soportar movimientos naturales de los tejidos. Además, dichos andamios deberían degradarse solo después de una curación adecuada, lo que podría llevar mías de 8 semanas [35]. En la tabla 2 se muestran algunos tipos de andamios, con sus respectivas ventajas, desventajas y futuros prospectos.
Para algunas aplicaciones clínicas, se requiere que los andamios se reticulen rápidamente in situ, lo que permite un moldeado óptimo hacia el contorno de la herida. En la actualidad, los hidrogeles naturales utilizados para apoyar la regeneración epidérmica se basan principalmente en el colágeno o la gelatina, que imitan la matriz extracelular dérmica natural, pero a menudo tienen propiedades mecánicas y de degradación insuficiente e incontrolable como se observó anteriormente. Por esta razón se buscan alternativas como gelatina que se puede reticular, es decir, la metacrilamida de gelatina (GelMA) con propiedades mecánicas, de degradación y biológicas ajustables para diseñar la epidermis para las aplicaciones de ingeniería de tejidos de la piel. Resultados revelan que las propiedades mecánicas y de degradación de los hidrogeles desarrollados pueden modificarse facilmente variando la concentración de hidrogel, con módulos elásticos y compresivos ajustados de unos pocos kPa a unos pocos cientos de kPa, y los tiempos de degradación varían de unos pocos días a varios meses [35].
En un estudio, las nanopartículas de plata cargadas con nanofibras de colágeno se fabricaron mediante electro spinning. El objetivo fue crear un entorno óptimo para la cicatrización de heridas utilizando las ventajas intrínsecas de la nanoplata, debido a su amplia actividad antimicrobiana y la nanofibra de colágeno sirve como un componente estructural primario de la matriz extracelular para guiar la adhesión celular, el crecimiento y la diferenciación podrían tener un impacto positivo en el proceso de curación. Un estudio in vivo revelo que la tasa de cicatrización de heridas de las esteras de nanofibras compuestas se aceleró en comparación con las nanofibras de colageno simple. El analisis histologico revelo una reepitelizacion acelerada, la producción de colageno y una mejor contraction de la herida con nanofibras compuestas de AgNPs. Las nanofibras electrohiladas, que muestran una gran promesa para la fabricación de materiales nanoestructurados, podrían ayudar a mejorar la calidad del cuidado de las heridas [36].
Electrospinning es la técnica más utilizada para la fabricación de nanofibras continuas debido a su bajo costo y facilidad de implementación. La prueba de rasguño in vitro indica que la tasa de cierre de la herida del andamio Curdlan/PVA es mejor que el andamio PVA, probablemente debido a las propiedades inmunomoduladoras del biopolímero. Los resultados indican que el andamio Curdlan/PVA puede ser un material ideal para las aplicaciones curativas de heridas [37].
Estudios de la regeneración de tejidos de la piel, utilizan un andamio de hidrogel compuesto de quitina mezclado con polibutilsuccinato y nanopartículas de sulfato de condroitina [38]. La quitina es un apósito ideal que imita la matriz extracelular nativa ya que humedece la interfaz de la herida, es permeable al oxígeno, actúa como una barrera para los microorganismos, puede eliminar el exceso de secreciones y además posee propiedades como la compatibilidad inmunológica y flexibilidad [39]. El polibutilsuccinato (PBS) es un polímero sintetico alifático, biodegradable y biocompatible con excelentes propiedades mecánicas. La concentración de este posee una influencia en la porosidad que es requisito previo para un mejor intercambio de gases y nutrientes. Además, la adición de nanopartículas de sulfato de condroitina (CSnp) incremento la porosidad del andamio, como se observa en el compuesto ternario (Figura 6C). Una porosidad optima es un requisito previo para un mejor intercambio de gases y nutrientes. También aumento la rugosidad del andamio (Figura 6D, E). Esto aumentaría la adsorción de proteínas del andamio y, por lo tanto, aumentaría la unión celular. Este andamio se caracteriza por SEM (microscopio electrónico de barrido), FTIR (espectroscopia de infrarrojo por transformada de Fourier) y se analizo la relation de hinchamiento de los andamios [38]. Los andamios se evaluaron en cuanto a la idoneidad para la aplicación de ingeniería tisular de la piel mediante estudios de citotoxicidad, unión y proliferación celular utilizando fibroblastos dérmicos humanos (HDF). Los estudios de citotoxicidad y proliferación celular que utilizan HDF confirman la idoneidad del andamio para la regeneración de la piel [38].
6.3. Apósitos para heridas
De manera clásica, el tratamiento de la quemadura es realizado mediante el lavado diario de la herida, la extracción del tejido muerto y la colocación de un apósito antibiótico hasta la formación de tejido de granulación y luego el injerto. Se han utilizado diferentes métodos para el cuidado y el apósito del sitio donante debido a la facilitación en la mejora y reducción de los síntomas de la herida y, por lo tanto, implica la posibilidad de un sitio donante desde el mismo lugar posteriormente [40]. La sutura es un metodo que requiere mucho tiempo, destreza profesional y tecnica y puede inducir reacciones inflamatorias, infecciones secundarias, formación de cicatrices y edema de heridas; el cierre y la estabilización adecuados de los márgenes de la herida en su position deseada son eventos críticos que influyen en el éxito de cualquier resultado quirúrgico [41,42]. El grapado requiere el uso de anestésicos, que son caros y pueden generar una aproximación imprecisa de la herida. Por lo tanto, es fundamental desarrollar adhesivos para tejidos que permitan a los cirujanos reemplazar sus tediosas técnicas convencionales de sutura o grapado con técnicas convenientes, no dependientes del operador y seguras [42,43].
Hasta el momento, se han desarrollado varios tipos de apósitos para heridas que incluyen caucho, espuma, nanofibras electrospun, membranas e hidrogel. Entre estos apósitos, el apósito de hidrogel puede mantener un entorno húmedo de la herida, absorber los exudados del tejido, permitir que el oxígeno penetre y enfríe la superficie de la herida, lo que produce un alivio del dolor para los pacientes [44]. En general, los hidrogeles ideales para el apósito para heridas deben tener varias propiedades especiales. Primero, necesitan una fuerza adhesiva adecuada que sea compatible con el fragil tejido de la piel de los pacientes, lo que significa que los adhesivos deben liberarse facilmente de la superficie fragil [42]. La mayoría de los productos adhesivos tradicionales, como los apósitos y vendajes adhesivos o médicos, generalmente tienen una fuerza de adhesión excesiva que es propensa a causar traumas y/o dolores localizados en el paciente, especialmente en pacientes con piel frágil, personas de edad avanzada y niños [42,45]. En segundo lugar, deben ser lo suficientemente resistentes como para coincidir con el comportamiento mecánico de los tejidos de la piel. En tercer lugar, deben eliminarse fácilmente con un trauma local mínimo en la piel del paciente. En cuarto lugar, deberían tener capacidad de re-adherencia para aquellos pacientes que requieren un apósito adhesivo para aplicarse en la misma parte del cuerpo repetidamente durante un periodo prolongado. Finalmente, deben ser biocompatibles, no tóxicos y no irritantes para la piel humana [42]. Los hidrogeles son redes macromoleculares muy hidrófilas, que se producen por reticulación química o física de polímeros solubles, estos pueden absorber y desorber el agua en una dirección reversible, mostrando estímulos ambientales específicos como temperatura, pH y fuerza ionica. Por lo tanto, dicha respuesta fisiologica inteligente de los hidrogeles hacia cambios de variables fisiológicos sugiere su uso en varias aplicaciones biomédicas [46]. Se desea encontrar un hidrogel de autocuración inyectable para heridas con propiedades antiinfecciosas, anti-oxidativas y conductivas que promueva la curación de heridas en la aplicación de curación de heridas, pero su diseno sigue siendo un desafío. Especialmente, el aposito de hidrogel inyectable antibacterial antioxidante electroactivo presentado por Zhao et al. presenta propiedades singulares, como los fármacos de encapsulación in situ, rellenando los sitios de la herida (incluso en un espacio irregular), adhiriéndose a las heridas. Aunque el apósito de hidrogel inyectable llenara el sitio de la herida y se adherirá a esta para proteger el sitio del ambiente externo, la mayoría de los hidrogeles inyectables sin elasticidad robusta pueden experimentar cierta deformación o daño causado por la fuerza mecánica externa después de la aplicación en el sitio de la herida [44].
Zhao desarrolla una serie de hidrogeles conductores inyectables para autocuración basados en quitosano cuaternizado-g-polianilina (QCSP) y polietilenglicol-co-poli(glicerolsebacato) que funciona como grupo benzaldehído como apósito electroactivo antibacteriano, antioxidante para la cicatrización de heridas cutáneas. Estos hidrogeles presentaron buena autocuración, electro-actividad, capacidad de eliminación de radicales libres, actividad antibacteriana, adhesividad, conductividad, índice de hinchamiento y biocompatibilidad. Curiosamente, el hidrogel con una concentración de reticulante optima de 1.5% m/m de PEGS-FA mostró una excelente capacidad de coagulación de la sangre in vivo, y obtuvo resultados significativamente mejores en el proceso de cicatrización de la herida in vivo, en un modelo de defecto cutáneo de espesor completo, que el hidrogel de quitosóan cuaternizado/PEGS-FA y que el apósito comercial (película Tegaderm TM), al regular la expresión genica de los factores de crecimiento, incluidos VEGF, EGF y TGF-b, y al promover el grosor del tejido de granulación y la deposición de colágeno. Resumiendo, el apósito de hidrogel inyectable electroactivo antibacteriano prolongó la vida útil del apósito basándose en la capacidad de autocuracion y promovió significativamente el proceso de curación de heridas in vivo atribuido a sus propiedades multifuncionales, lo que significa que son excelentes candidatos para la cicatrización de heridas de piel de todo espesor [44].
6.4. Técnicas basadas en el uso de células madre
La elección del tipo de célula madre correcto, el cual ayude a la regeneración completa de la piel, es extremadamente importante. Además, su identificación y el aislamiento de poblaciones puras de células madre adultas, la optimización de los protocolos para la siembra de células en matrices y el diseño de la estructura de andamios son factores que deben investigarse más para la optimización de la reparación y regeneración de tejidos [47].
Las propiedades de las células madre, al ser sensibles al micro entorno, pueden verse influidas por muchos factores físicos y químicos, lo cual provoca una baja viabilidad, una proliferación limitada y una diferenciación indeseable en muchos casos [48]. Una estrategia sería utilizar un enfoque combinado de células madre con matrices inteligentes que contienen nanopartículas que puedan imitar el nicho de células madre; dirigir, instruir y permitir la supervivencia de las células madre [49].
Las células madre mesenquimales (MSC) se pueden obtener de varios tejidos, incluida la médula ósea, el tejido adiposo y el cordón umbilical. Se pueden auto renovar, se diferencian de múltiples linajes, y su capacidad para mejorar la cicatrización de heridas cutáneas ha sido bien caracterizada. Las MSC hacen que el cierre de la herida sea rápido, además, aumentan la angiogénesis, promueven la resolución de la inflamación de la herida, regulan la remodelación de la matriz extracelular y fomentan la regeneración de la piel [50]. También, poseen varias ventajas respecto a las aplicaciones clónicas con el fin de reparar o regenerar tejidos dañados, especialmente porque evitan los problemas éticos que involucra el uso de células madre embrionarias [51].
Además, las células madre mesenquimales derivadas de células madre pluripotentes inducidas por el hombre (hiPSC-MSC) son una alternativa prometedora para la terapia de trasplante de células madre. Los exosomas derivados de células madre mesenquimales (MSC-Exos) pueden realizar funciones importantes en la reparación de tejidos lesionados. Sin embargo, hasta el momento, ningún informe ha demostrado el uso de hiPSC-MSC-Exos en la cicatrización de heridas cutáneas, y se tiene poco conocimiento acerca de sus mecanismos subyacentes en la reparacióon de tejidos. De acuerdo con el presente artóculo, el trasplante de hiPSC-MSC-Exos a sitios de la herida dio lugar a una reepitelizacióon acelerada, redujo el ancho de las cicatrices y promovióo la madurez del colóageno. Ademóas, no solo promovióo la generacióon de nuevos vasos, sino que tambióen aceleróo su maduracióon en los sitios de la herida. Hallazgos mencionan que el hiPSC-MSC-Exos puede facilitar la cicatrizacióon de heridas mediante la promocióon de la sóntesis de colóageno y la angiogóenesis. Dichos datos brindan la primera evidencia del potencial de hiPSC-MSC-Exos en el tratamiento de heridas cutóaneas [52].
Por otro lado, en un estudio de las MSC de ratas, se encontróo que las luciferasa-Tg Lewis se trasplantaron por vía intravenosa en un modelo de expansión de tejido de rata para identificar la localización y la transducción. Se utilizó un enfoque sistemático para identificar los genes expresados diferencialmente entre las MSC humanas y los controles estirados mecánicamente. La importancia biológica de estos cambios fue analizada por medio de métodos bioinformáticos. Se cree que el estiramiento mecánico puede promover la regeneración de la piel ya que regula la expresión de MSC de los genes relacionados con la hipoxia, la vascularización, laproliferación celular y una mejora de la MSC trasplantada a la piel expandida [53].
Según estudios realizados, la fibroína de seda (SF) sembrada con MSC ha demostrado tener mayores resultados en los modelos experimentales de cicatrización de heridas en la piel. Rivero, investigo los efectos de la cicatrización de heridas de andamios SF electrohilados celularizados con MSC de jalea de Wharton (Wj-MSCs-SF) por medio de un modelo de férula de herida por escisión de escisión murino. Además, realizaron un examen inmunohistopatológico después del trasplante en el cual se confirmó la presencia de células CD90 positivas similares a fibroblastos humanos infiltrados en la dermis del grupo tratado con Wj-MSCs-SF, que produjo neoangiogenesis, disminución del infiltrado inflamatorio y proliferación de miofibroblastos, menos production de matriz de colóageno y completa regeneracioón epidóermica. Estos resultados, muestran que las Wj-MSC trasplantadas en la herida por medio de un andamio de fibroina de seda promueve la formación de un tejido bien organizado y vascularizado, se mejora la reepitelización de la herida y reducen la formación de tejido cicatricial fibrótico, destacando efectos terapéuticos potenciales de los enfoques de ingeniería de tejidos basados en Wj-MSC para el tratamiento de heridas no curativas. Datos proporcionan pruebas de que una combinación entre el tratamiento de Wj-MSC inyectado en la herida, en conjunto con los andamiajes de SF celularizados que cubrían la parte de la herida presentó una mayor curación de esta, en comparación con los tratamientos individuales y el andamio de SF celularizado [54].
En un estudio, se investigó de métodos alternativos al hidrogel de alcohol polivinílico (PVA) proponiendo el complemento con la terapia con células madre. Lo anterior se debe a una falta de bioactividad para el PVA y la seguridad de la terapia del vástago que limitó su aplicación. En la bibliografía consultada (Figura 7), se encontró un método en el cual se preparó un apósito hecho de PVA (ADSCs / PVA) de células madre derivadas de tejido adiposo (ADSC) para la cicatrización de heridas. Un lado del apósito de PVA se modificó con gelatina foto-reactiva (Az-Gel) mediante irradiacióon ultravioleta (UV) (Az-Gel / PVA) y, por lo tanto, las ADSC podróan adherirse, proliferar en los apóositos de PVA y mantener el otro lado del apóosito sin adherir a la herida. La estructura y la mecóanica de Az-Gel / PVA se caracterizóo mediante microscopóa electróonica de barrido (SEM) e instrumentos de prueba de materiales. Posteriormente, la adhesioón y la proliferacióon de ADSC se pudieron apreciar mediante los recuentos celulares y la tincióon en vivo. Finalmente, se utilizaron experimentos in vitro e in vivo para confirmar el efecto del apósito ADSC / PVA para la cicatrizacioón de heridas. Los resultados mostraron que Az-Gel se inmovilizóo en el PVA y tuvo un poco efecto sobre las propiedades mecóanicas de los hidrogeles de PVA.
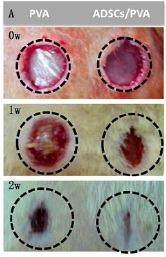
Figura 7 Fotografias de la cicatrización de heridas en ratas después de diferentes periodos de tiempo [47] .
Este, modificado en superficie podría favorecer tanto la adhesión como la proliferacióon de ADSC. Las pruebas de liberacióon de proteínas indicaron que los factores bioactivos secretados por las ADSC podrían penetrar en la herida. Finalmente, los experimentos in vitro e in vivo sugirieron que las ADSC / PVA podrían promover la cicatrización de heridas a través de factores bioactivos secretores de las ADSC. El apósito ADSC / PVA no solo promueve la cicatrización de la herida, sino que también proporcionaría una nueva forma para una segura aplicación de células madre, que tendría un gran potencial para la ingeniería de tejidos de la piel [47].
Conclusiones
Las células madre son responsables directas de la autogeneración, dependiendo del tipo de lesión.
El cuerpo humano no es capaz, por sí solo, de reparar heridas o quemaduras graves y/o de gran tamaño.
La ingeniería de tejidos está limitada por la complejidad natural del órgano cutáneo y la diversidad de variantes existentes entre cada individuo.
Las células madre manipuladas por el ser humano dependen de algún tipo de soporte.
Los polómeros son un componente base en la ingenieróa de tejidos por sus caracterósticas estructurales y bioquómicas.
Todas las tóecnicas analizadas en este artóculo buscan mejorar el proceso de curacióon natural de la piel mediante el uso de polómeros biocompatibles complejos trabajando en conjunto con cóelulas encargadas del proceso de reparacióon natural de este oórgano.
Debido a la capacidad de configuración y personalizacion de las caracterósticas de los andamios generados por bioimpresióon, además de sus notorias ventajas estructurales y fisicoquímicas, esta tecnología es superior a las demás presentadas, por lo tanto, puede ser el futuro de la ingeniería de tejidos.