Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ingeniería
Print version ISSN 0121-4993
rev.ing. no.20 Bogotá Jun./Dec. 2004
Técnica de medición de fuerzas en células animales
Technique for measuring forces on animal cells
Miller Hung Varela
Ing. Mecánico Universidad de los Andes
m-hung@uniandes.edu.co
Alba Ávila
Profesor Asistente, Departamento de Ingeniería Eléctrica y Electrónica, Universidad de los Andes
a-avila@uniandes.edu.co
Juan Carlos Briceño
Profesor Asociado, Departamento de Ingeniería Mecánica, Universidad de los Andes
jbriceno@uniandes.edu.co
Recibido el 27 de septiembre de 2004, aprobado el 9 de octubre de 2004
PALABRAS CLAVES
fibroblastos, transistor de efecto de campo (ISFET), estímulos mecánicos a células
RESUMEN
Se desarrolló un método para acoplar fibroblastos vivos a un dispositivo electrónico, transistor de efecto de campo (ISFET), tratando de dar una visión de las implicaciones de un cultivo celular y las diferentes técnicas necesarias para manipulár el ISFET y su relación con material biológico. Se registraron señales de las células sometidas a estímulos mecánicos aplicados por medio de presión hidrostática de las cuales se obtuvo un valor de voltaje asociado al nivel de presión ejercido sobre el grupo de células. Se estableció una hipótesis relacionada con el comportamiento no lineal de las células a estímulos mecánicos y las posibles mejoras y futuras aplicaciones del método.
ABSTRACT
An experimental method was developed in order to join in vivo fibroblasts to an electronic device, a field effect transistor (ISFET ), attempting to give a general view of the implications and requirements of animal cell culture and the different techniques required to handle the ISFET and its relation with biologic material. Signals from stimulated cells by mechanical means like hydrostatic pressure were registered establishing a value of voltage associated to the level of pressure applied. An hypothesis was established, related with the non linear behavior of the cells to mechanical induced stimulus and the possible improves and future applications of the method.
1. INTRODUCCIÓN
Nuevos sensores definidos como elementos de medición que incorporan material biológico (tejidos, células, enzimas, microorganismos) relacionados con diferentes elementos comúnmente empleados como transductores de diferentes variables físicas pueden ser empleados para medir por medio de señales eléctricas el comportamiento de éstas. Dicho campo promete una gran expansión al lograr combinar las distintas características de dos mundos aparentemente separados, haciendo uniones que permiten tener características tanto de materiales eléctricos como de tejido vivo o material biológico con el fin de establecer nuevos medios para la obtención de señales así como un conocimiento más detallado en el campo de la biología y sus aplicaciones.
En el presente trabajo se realizó un acople de una célula viva, fibroblasto HT1080 con un dispositivo electrónico. Dicho acople consta de una parte eléctrica comprendida por un micro transistor de efecto de campo y un grupo de fibroblastos de la línea HT1080 adheridos sobre la superficie activa del dispositivo electrónico, logrando una interacción que permite detectar cómo son las respuestas, en forma de voltaje, de las células frente a un estimulo mecánico. Con dicho acople se pretende establecer un método adecuado para poder determinar el comportamiento mecánico de diferentes tipos de células in vivo y establecer las bases para emplear el método en diferentes aplicaciones relacionadas con el tema. En el trabajo se estableció una aproximación inicial del comportamiento mecánico de células a compresión empleando un método diferente a los utilizados por Miyazaki (et al.) [1] buscando un procedimiento más simple y fácil de emplear desarrollado con recursos fáciles de adquirir.
2 METODOLOGÍA Y MATERIALES
Para la realización del acople se emplearon fibroblastos provenientes del laboratorio de Genética Humana de la Universidad de los Andes, los cuales pertenecían a la línea HT1080.
A continuación se explicará brevemente el procedimiento realizado.
Las células se obtuvieron a partir de una caja previamente cultivada en el laboratorio de Genética, la cual contenía células de la línea HT1080. Previo al sembrado del sensor se realizó un proceso de esterilización o limpieza del ISFET por medios químicos realizando lavados con agua destilada, ácido clorhídrico 25% y etanol 70%. Luego de la limpieza del ISFET, a partir de la caja de células se realizó el sembrado de éstas en la superficie activa del ISFET. El procedimiento detallado del acople entre el ISFET y las células se encuentra en la tesis de la cual se origina el presente artículo (Hung Universidad de los Andes 2004) [2]. De manera muy general y corta este consistía en lavar la caja de células con PBS, luego agregar tripsina para despegar las células de su caja y posteriormente agregar medio de cultivo para tener las células en una suspensión con una concentración deseada.
Ya tendiendo una suspensión con la células y el ISFET esterilizado, se agregó dicha suspensión en dos tubos de ensayo, uno empelado como medio de control y otro en el cual se tenía el ISFET ubicado de manera horizontal con el fin de facilitar la adherencia de las células sobre la superficie de ésta. Los tubos fueron cerrados e incubados por tres días manteniendo el ISFET de manera horizontal. Posterior a la incubación se retiró el ISFET y éste fue colocado en un montaje que permitió la aplicación de presión hidrostática, que consistía en una columna de agua graduada de 1000 ml a la cual se le abrieron agujeros roscados en los que se introdujeron machos plásticos de 3/8". Lo anterior con el fin de conectar mangueras para controlar la altura de la columna de agua, ya que estas se encuentran espaciadas cada 50ml (ver FIG 1). En la parte inferior de la columna se abrieron agujeros para introducir el ISFET acoplado con la células y otro con el fin de hacer circular agua (Ver FIG 2). Por ultimo se emplearon tapones de caucho de 8 mm de diámetro interior, empleados en tubos de ensayo para tapar la salida de agua a través de los machos. Se dejaron libres únicamente dos en los cuales se conectaron mangueras que permitieron la circulación de agua. La circulación de agua se hizo con el fin de mantener una temperatura de 37º C y evitar así la muerte de las células. Se empleó un baño térmico T101, de un reómetro Brookfield, y una termocupla tipo K y un termómetro Omega HH21 con el propósito de controlar la temperatura del agua.
FIG1. COLUMNA PRESIÓN HIDROSTÁTICA
FIG2 CONEXIÒN MONTAJE COLUMNA
Para el manejo de la señal del ISFET se realizó una búsqueda de las características eléctricas de los fibroblastos y según Kamkin (et al). [4] se encontró el voltaje en fibroblastos de diferentes especies. (ver Tabla 2)
TABLA 2. PROPIEDADES ELÉCTRICAS DE FIBROBLASTOS. ADAPTADO DE [4]
Con los rangos de voltajes establecidos se realizó un análisis de las magnitudes basado en el artículo de Offenhausser (et al 2001) [5] al igual que en el artículo de Kamkin (et al 2003) [4],[6]. En estos se encuentran las magnitudes y rangos en los cuales se pueden tener variaciones en el voltaje. Para el manejo de la señal se construyó un filtro pasivo con una frecuencia de corte de 3 Hz que fue empleado por Offenhausser y Wolfgang en "Cell transistor hybrid systems and their potential application"[7] y S. Ingenbrandt en "bakside contacted field effect transistir for extracelluar signal recording" [8] donde se emplean frecuencias similares para el caso de estudio donde se realizan acoples parecidos. Posteriormente se registró la señal empleando un osciloscopio portátil FLUKE 105B que registra la diferencia de voltaje generada por el ISFET y la almacena en un computador a partir del cual se genera un archivo de texto con los datos de la señal. También es posible realizar el montaje empelando un sistema de adquisición de datos como el AT-MIO-16XE-50, finalmente existe la posibilidad de manejar la señal generada por medio de circuitos análogos donde ésta es amplificada y posteriormente filtrada empleando configuraciones de seguidores de voltaje y diferenciadores o en su defecto amplificadores de instrumentación. Dichos datos se pasaron a Excel y se generaron las curvas de voltaje contra tiempo a presión constante. A partir de esto se establecieron los voltajes característicos de cada curva a presión constante y se realizó una gráfica de presión contra voltaje, a la cual se le realizaron distintas regresiones con el fin de establecer la más adecuada y la que concordara con el comportamiento fisiológico esperado. (ver FIG 6)
3 RESULTADOS Y DISCUSIÓN
A continuación se presentan gráficas donde se pueden encontrar las respuestas del ISFET al estimular las células adheridas a este utilizando presión generada de forma hidrostática.
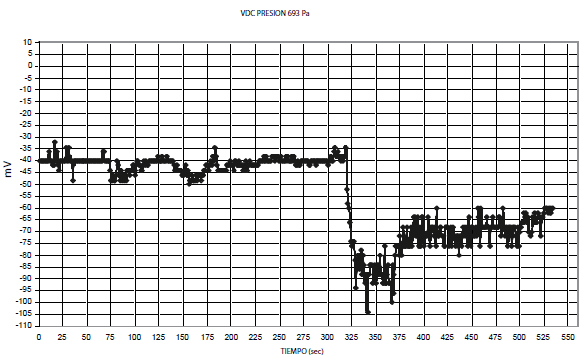
Al observar las gráficas se pueden establecer zonas donde la señal presenta voltajes relativamente constantes y posteriormente se encuentra un cambio brusco debido a la respuesta de las células, la cual puede tardar entre 30 y 400 seg. Después de cierto tiempo la respuesta de las células tiende a ser estable por lo cual se puede asociar un voltaje a la presión ejercida y este voltaje puede ser relacionado con un potencial inducido mecánicamente.(ver FIG 3 y 4) Lo anterior muestra que con este método es posible relacionar el voltaje obtenido con la respuesta de células a estímulos externos.
FIG 3 RESPUESTA EN mV A 693 Pa
FIG 4 RESPUESTA EN mV A 1040 Pa
Finalmente hay una curva de presión contra voltaje con su respectivas regresiones que muestra el valor de R 2 para cada regresión. (ver FIG 5) El rango de presión que fue empleado para estimular las células variaba aproximadamente entre 500 y 2100 Pa, lo cual no fue suficiente: se esperaba un comportamiento logarítmico y con dicho rango de presiones no fue posible construir una curva que mostrara claramente dicho comportamiento.
FIG 5 mV contra Presión Aplicada y regresiones
Se puede ver que existen tres modelos que se podría decir siguen de una manera adecuada el comportamiento. Aunque al analizarlos se ve que uno de ellos, el cúbico, puede ajustar muy bien los datos pero en el que el comportamiento fisiológico no es coherente.
En el caso de la metodología empleada en este proyecto se llegó a establecer un método adecuado para establecer unos pasos para medir
la respuesta a fuerzas en células. Sin embargo es recomendable realizar cambios con el propósito de mejorar aspectos que posteriormente permitan obtener resultados más precisos y confiables que permitan desarrollar más a fondo el proyecto y lograr que su aplicación sea más consolidada.
En los pasos necesarios para realizar un cultivo de células o manipularlas es necesario tomar las precauciones adecuadas de asepsia e higiene con el fin de evitar contaminación al realizar los procedimientos. Dichos procedimientos son los que permiten un adecuado cultivo y acople, es necesario desarrollar una técnica para limpieza del ISFET más rigurosa, que en un futuro permita realizar el acople de células más especializadas que requieren mejores condiciones.
Debido a las diferentes características de las células, las condiciones para realizar un acople entre un elemento biológico y uno eléctrico con el fin de fabricar un biosensor, deben cambiar de acuerdo al propósito del sensor y al tipo de elemento biológico a utilizar, ya que como se observó cada grupo o clase de célula tiene un comportamiento muy diferente.
Para generar la adhesión de las células sobre la superficie del sensor se siguió el procedimiento de acople células ISFET. Con este método el Grupo de Ingeniería Biomédica logró generar por primera vez adhesión en ciertas zonas de la superficie del sensor de forma no controlada, lo cual posteriormente permitirá mejorar las técnicas y lograr tener un control muy preciso sobre la adhesión. Para poder controlar de una manera más adecuada se pueden usar recubrimientos sobre la superficie empleando elementos que utilizan las células para generar adherencia como lo es la fibronectina. Los recubrimientos de colágeno no deben ser empleados ya que, aunque generan adhesión de las células, se polarizan e interfieren con el funcionamiento del ISFET.
En el transcurso del experimento se pudo ver que el ISFET es sensible a ruido generado por la circulación de agua, en lo posible se debe evitar que el agua golpee directamente el sensor, claramente esto se refleja en los inicios de la señal registrada.
La respuesta de las células puede tener tiempos que varían entre dos minutos y media hora: lo demuestra el hecho de que las señales que no cambian a lo largo del tiempo, repentinamente cambian debido a la reacción de las células. La señal generada por el sensor depende del voltaje que es aplicado a las células, debido a que las condiciones en las que se hacen las pruebas no son las más adecuadas para su supervivencia, las células mueren a medida que pasa el tiempo y también pueden separarse de la superficie del ISFET lo cual afecta la respuesta. Con la metodología es posible establecer un valor de voltaje asociado a la presión que se le aplica a las células. La señal obtenida oscila durante un tiempo y posteriormente llega a puntos donde se estabiliza por ciertos periodos, los cuales son tomados como el valor del voltaje característico. Con las señales obtenidas se llegó a la conclusión de que un modelo cúbico se ajusta muy bien a los puntos, pero esto no tiene sentido fisiológico ya que no es lógico que a medida que se aumenta la presión el valor del voltaje aumente rápidamente. Lo anterior debido a que en el rango de aplicación de presión sólo se cubren puntos iniciales por lo cual no se observa de una manera adecuada el comportamiento.
Se tiene la hipótesis de que para el caso de aplicar presión y no destruir la célula se tiene un comportamiento logarítmico, ya que el voltaje del grupo de células debe llegar a una condición estable y la magnitud de éste debe tender a un valor constante o debe estar limitado por una asíntota.
Al comparar los resultados obtenidos con las pruebas realizadas por Hiroshi Miyazaki [1], pruebas a tensión, Olivier Thoumine y Albrecht Ott [11] a compresión, se puede establecer que es necesario encontrar una forma de manejar un rango de presión más amplio, que permita obtener más puntos y de esta forma lograr establecer si existe una relación con los datos de los artículos. Con los datos obtenidos se puede pensar que el método puede ser útil y es posible llegar a definir un método sólido para la medición de fuerzas a nivel celular, para lo cual es necesaria la utilización de montajes más elaborados que permitan manejar rangos de presión más amplios y que a su vez permitan mantener condiciones de temperatura más controladas. Igualmente es necesario contar con equipos de laboratorio que permitan cultivar diferentes tipos de células, manipular la ubicación de las células y que estén en la capacidad de aislar una célula con el fin de obtener mediciones más controladas.
Finalmente se espera que este trabajo sirva como primer enfoque para el inicio de biosensores, que permita el desarrollo de elementos no solo útiles en la medición de propiedades mecánicas sino en diversas aplicaciones.
REFERENCIAS BIBLIOGRÁFICAS
[1] HIROSHI MIYAZAKI, YOSHITAKA HASEGAWA, KOZABURO HAYASHI. Tensile Property of Fibroblsats form The Rabbit Patellar Tendon. Universidad de Osaka. [ Links ]
[2] HUNG, BRICEÑO, AVILA. Metodología para la medición de respuesta a fuerzas en células animales. Tesis Universidad de los Andes, 2004. [ Links ]
[3] TABIMA DIANA. Desarrollo de una Metodología para la Preparación y evaluación de Matrices Biodegradables Usadas para el crecimiento de Fibroblastos. Tesis Magíster Ing Mecánica, Universidad de los Andes, 2003. [ Links ]
[4] KAMKIN et al. "Contribution of Fibroblasts to Mechanoelectric Feedback in Healthy and Diseased Hearts". En Progress in Biophysics & Molecular Biology 82 (2003) 111-120. [ Links ]
[5] INGENBRANDT, YEUNG, KRAUSE, OFFENHAÜSSER. "Cardiomyocyte transisitors hybrids for sensor application". En Biosensors and Bioelectronics 16 (2001) 565-570. [ Links ]
[6] KAMKIN et al. Contribution of Fibroblasts to Mechanoelectric Feedback in Healthy and Diseased Hearts. Russian States Medical University. [ Links ]
[7] OFFENHAÜSSER, WOLFGANG. "Cell transistor hybrid systems and their potential applications". En Trends in Biotechnology Vol.19 No.2 February 2001. [ Links ]
[8] INGEBRANDT S. "Backsided contacted field effect transistors array for extracellular signal recording". En Biosensors and Bioelectronics 18 (2003) 429-435. [ Links ]