Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ingeniería
Print version ISSN 0121-4993
rev.ing. no.27 Bogotá Jan./June 2008
Caracterización superficial en fase gas y líquida de carbones activados
Superficial Characterization in Gas and Liquid Phase of Activated Carbons
Liliana Giraldo
Ph.D. Profesora Asistente, Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá D.C., Colombia.
Vanessa García
Departamento de Química, Facultad de Ciencias, Grupo de Investigación en Sólidos Porosos y Calorimetría, Universidad de los Andes, Bogotá D.C., Colombia.
Juan Carlos Moreno
Ph.D. Director del Departamento de Química e investigador del Grupo de Investigación en Sólidos Porosos y Calorimetría, Facultad de Ciencias, Universidad de los Andes. Bogotá D.C., Colombia.
jumoreno@uniandes.edu.co
Recibido 10 de noviembre 2006, aprobado 2 de agosto de 2007
PALABRAS CLAVES
Adsorción, carbón activado, decoloración, índice de azul de metileno.
RESUMEN
Se determinó el área superficial de carbones activados obtenidos a partir de cascarilla de café y cáscara de coco, mediante isotermas de adsorción de N2 a 77K. Se compararon los resultados con aquellos obtenidos con un método comúnmente utilizado, el índice de azul de metileno, y se encontró una buena correlación entre las dos áreas determinadas por éste método. Se muestra que los dos métodos permiten realizar un análisis complementario de una superficie porosa.
KEY WORDS
Activated carbon, adsorption, blue methylene index, decolouration.
ABSTRACT
The superficial area of an activated carbon obtained from coffee husk and coconut shell was determined, by means of isotherms of adsorption of N2 to 77K and the results they area compared with the method of index blue of methylene, finding an good correlation between the two areas determined by this method. This research shows that both methods allow making a complementary analysis of a porous surface.
INTRODUCCIÓN
Los sólidos porosos poseen en su interior cavidades o túneles que reciben el nombre de poros. Éstos constituyen la parte más importante en la estructura de un carbón activado, ya que determinan sus propiedades texturales, las cuales se relacionan con la adsortividad y determinan la superficie específica a lo largo del sistema poroso, facilitando la difusión y la adsorción [1, 2, 3]. El carbón activado es un término general que se aplica a toda una serie de productos derivados de materiales carbonosos; es un material amorfo que presenta un área superficial excepcionalmente alta, medida por adsorción de nitrógeno, y se caracteriza por tener una proporción de microporos (poros menores que 2 nanómetros). Estas características le confieren propiedades adsorbentes excepcionales que pueden ser aprovechadas en diferentes áreas. Durante el proceso de obtención de carbones activados, es posible modificar tanto los procesos de carbonización y de activación, para modificar sus propiedades texturales y químicas. Además, este material es comúnmente utilizado para la retención de contaminantes gaseosos, en el tratamiento de aguas residuales y en la purificación de agua para el consumo humano [4]. Una de las ventajas de este material es su uso para retirar sustancias altamente tóxicas que se encuentran a muy bajas concentraciones [4]. Para aplicaciones en fase líquida, los carbones activados más utilizados son los pulverizados; y sus usos mas frecuentes son: decoloración y purificación de azúcares, procesos químicos, minería (extracción de oro), purificación de diferentes materiales, farmacia, purificación del agua (tanto para la potabilización a nivel público como doméstico), medicina, tratamiento de aguas residuales, máscaras antigás, filtros de purificación y controladores de emisiones de automóviles, entre otros muchos usos.
Esta presentación en polvo posee un máximo de 30 m m de diámetro y le confiere una gran superficie interna y pequeños poros. Adicionalmente, en la industria, el carbón activado se encuentra en pelets y gránulos [5,6].
Bajo el microscopio electrónico, la estructura del carbón activado muestra una gran cantidad de poros y de grietas. Al realizar una toma de microfotografías con gran aumento, se logra observar los poros más pequeños. La evaluación de la adsorción se hace generalmente mediante la adsorción de nitrógeno gaseoso a 77K a diferentes condiciones de presión relativa (P/Po).
En general, cualquier material orgánico con proporciones relativamente altas de carbono es susceptible de ser transformado en carbón activado. Los carbones activados obtenidos industrialmente pueden provenir de madera y residuos forestales u otros tipos de biomasa (turba, lignito y otros carbones minerales) así como de diferentes polímeros y fibras naturales o sintéticas. Existen, no obstante, algunas limitaciones. No serán adecuados para preparar carbones activados aquellos materiales carbonosos que pasen por un estado fluido o pseudo-fluido durante su carbonización, dado que durante la resolidificación de esta fase suelen formarse estructuras ordenadas en los carbones resultantes. No resultan adecuados, por tanto, los carbones coquizables, salvo que se eliminen sus propiedades coquizantes mediante una oxidación previa, por ejemplo. Del mismo modo, tampoco resultan adecuados los residuos termoplásticos. Los factores que hay que tener en cuenta para elegir un precursor adecuado son: buena disponibilidad y bajo coste, bajo contenido en materia mineral y que el carbón resultante posea unas buenas propiedades mecánicas y capacidad de adsorción. Los residuos de madera, las cáscaras de coco y frutos secos, así como las semillas de algunas frutas junto con los carbones minerales y el coque de petróleo, son los precursores más usados.
La adsorción es un proceso por el cual átomos, iones o moléculas son atrapados o retenidos en la superficie de un material, en contraposición a la absorción, que es un fenómeno de volumen.
En química, la adsorción de una sustancia es su acumulación en una determinada superficie. El resultado es la formación de una película líquida o gaseosa en la superficie de un cuerpo sólido o líquido. Considérese una superficie limpia expuesta a una atmósfera gaseosa; en el interior del material, todos los enlaces químicos (ya sean iónicos, covalentes o metálicos) de los átomos constituyentes están satisfechos. En cambio, por definición, la superficie representa una discontinuidad de esos enlaces. Para esos enlaces incompletos, es energéticamente favorable el reaccionar con lo que se encuentre disponible y por ello se produce de forma espontánea. La naturaleza exacta del enlace depende de las particularidades de los especímenes implicados, pero el material adsorbido es generalmente clasificado como fisisorbido o quimisorbido. La cantidad de material que se acumula depende del equilibrio dinámico que se alcanza entre la tasa a la cual el material se adsorbe a la superficie y la tasa a la cual se evapora; a su vez, éstas normalmente dependen de forma importante de la temperatura. Cuanto mayor sea la tasa de adsorción y menor la de desorción, mayor será la fracción de la superficie disponible que será cubierta por material adsorbido en el equilibrio.
Para estos procesos resultan interesantes materiales con una gran superficie interna (y por lo tanto poco volumen), ya sea en polvo o granular, como el carbón activo, y que llevan asociados otros fenómenos de transporte de material, como el macro transporte y micro transporte de los reactantes.
La complejidad de la estructura del carbón activado ha llevado a la aplicación de muchas técnicas experimentales para su caracterización. Existen métodos de prueba que permiten comparar sus características más importantes, como: área de superficie, tamaño de poro, número de yodo, índices de adsorción de fenol, índices de adsorción de azul de metileno, densidad, tamaño, humedad, cenizas, resistencia a la abrasión y otros parámetros aplicables a las especificaciones del carbón [7].
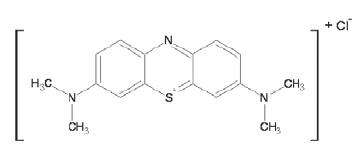
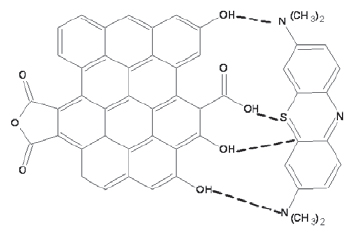
Existen diferentes métodos para determinar las propiedades adsorbentes de los carbones activados. Entre ellos se encuentran la determinación del área superficial, de la porosidad y los ensayos de adsorción, como el índice de azul de metileno, la adsorción de yodo y la adsorción de fenol, entre otras. El índice de azul de metileno (Figura 1) es un ensayo de decoloración que indica la capacidad de un sólido poroso de adsorber una molécula que, por su tamaño, no puede acceder a todos los microporos. Su tamaño molecular es aproximadamente de 0.84 nm. El valor de azul de metileno se define como el número de mililitros de una disolución estándar de azul de metileno que es decolorada por 0.1g de carbón activado.
Figura 1. Estructura del Azul de Metileno.
Las isotermas de adsorción de azul de metileno o ion 3,7 bis (dimetilamino) fenoltiazin 5- ionio es una técnica utilizada para deducir el área superficial a partir de la adsorción en equilibrio de un gas bajo condiciones isotérmicas, aplicando generalmente el modelo de Langmuir o BET. La determinación de la porosidad del carbón activado requiere el uso combinado de varias técnicas. Para los macroporos y la parte de más tamaño de los mesoporos se recomienda la porosimetría de mercurio. Dicha técnica se basa en la penetración de mercurio en los poros mediante presión. Para determinar el volumen y la distribución de los mesoporos y de los microporos, la técnica más utilizada es la adsorción de gases, normalmente N2 a 77K.
En este trabajo se caracterizaron los carbones provenientes de cascarilla de café con diferentes % de impregnación con ácido fosfórico y cáscara de coco, empleando el índice de azul de metileno, las isotermas desde solución acuosa obtenidas con este colorante e isotermas de adsorción de nitrógeno, con el fin de encontrar una correlación entre el área superficial obtenida por cada uno de estos métodos.
MATERIALES Y MÉTODOS
TRATAMIENTO DEL PRECURSOR
Carbonización
Siguiendo el método propuesto por Suárez-García et al. [8], se impregnaron muestras de cascarilla de café con soluciones acuosas de H3PO4 de diferente concentración, con el fin de variar el contenido del agente impregnante. Dicho contenido es expresado como (Xp, %p/p), y definido como (g H3PO4 /g de cascarilla de café) x 100. Las relaciones de impregnación manejadas fueron de 30, 60, 100 y 150 % p/p.
Posterior a la impregnación, las muestras fueron secadas en un horno, a 383 K durante un periodo de 4 horas en atmósfera de aire, con el propósito de retirar la humedad excesiva que le suministra la solución y después se procedió a la activación.
Activación
Los carbonizados obtenidos fueron sometidos a una activación química. Este tratamiento se llevó a cabo en un horno tubular con un reactor de cuarzo, a una velocidad de calentamiento constante de 10 Kmin-1, con un flujo de Argón (99.999% de pureza) a 50 cm3 min.-1 STP; condiciones que fueron mantenidas durante el calentamiento y el enfriamiento. En cada caso se usó 10g del material impregnado. La temperatura óptima de activación fue de 723 K [9,10] y un tiempo de residencia de 1 hora. Después del enfriamiento a temperatura ambiente del residuo sólido de la pirolisis, éste fue lavado con agua mili-Q destilada, hasta disminuir la conductividad del agua de lavado a < 5 mScm-1.
Las cáscaras de coco se trituraron y tamizaron hasta un tamaño de partícula entre 1-2 mm, y se impregnaron con H3PO4 al 100% p/p. Luego se procedió a activarlas bajo las mismas condiciones empleadas para la cascarilla de café.
El carbón activado resultante fue secado durante 12 horas en un horno al vacío y posteriormente se almacenó en recipientes plásticos, en atmósfera de nitrógeno, para evitar la oxidación de la superficie.
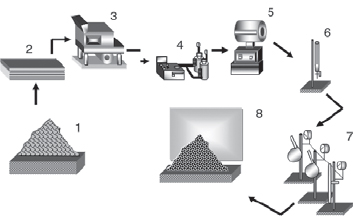
Un esquema que indica en resumen la forma de obtener los CA´s se muestra en la Figura 2.
Figura 2. Esquema de obtención de los carbones activados: 1. Recepción del material de partida 2. Zona de examen en el laboratorio 3. Molienda y tamizado 4. Gases para la síntesis 5. Horno de reacción 6. Medida del flujo de gases 7. Trampa de gases 8. Muestras de carbón activado para análisis.
PROPIEDADES ADSORBENTES
Adsorción física: Caracterización de la textura porosa
La textura porosa fue analizada mediante isotermas de N2, utilizando un equipo de adsorción volumétrica automático (ASAP 2010, Micromeritics). Todo el proceso de obtención y de caracterización hasta aquí reportado fue llevado a cabo en los laboratorios del Instituto Nacional del Carbon (INCAR) en Oviedo España [10].
Las muestras fueron desgasificadas 12 horas a 523 K antes de todas las medidas de adsorción. La pureza del N2 utilizado en estas pruebas era de un 99,999%. Las isotermas de adsorción de N2 fueron analizadas empleando las ecuaciones de BET y Dubinin-Radushkevich (DR).
Ensayos de adsorción.
Isotermas de adsorción desde solución acuosa e índice de azul de metileno
Los carbonizados obtenidos a partir de cascarilla de café, fueron denominados CAA y el de cáscara de coco identificado como CACC; éstos se mantienen en un desecador mientras son utilizados para realizar las isotermas de adsorción desde solución acuosa de azul de metileno.
El azul de metileno (Merck, R.A.) fue secado a 383 K por 2 horas antes de ser usado. Las soluciones de azul de metileno fueron preparadas con agua destilada. La concentración de las estas soluciones se analizó midiendo las absorbancias en un espectrofotómetro Genesys Analyst UV-VIS a una longitud de onda de 668 nm. Empleando diferentes concentraciones de azul de metileno, se construyó la curva de calibración.
Decoloración de la solución de azul de metileno: Isotermas desde solución acuosa
Este procedimiento se repite para obtener la isoterma de adsorción del colorante sobre cada uno de los carbones activados, adicionando diferentes soluciones de azul de metileno en concentraciones que varían entre 10 y 200 mgL-1, para mantener el volumen constante 25 mL. Los intervalos de tiempo encontrados para la decoloración fueron 24, 20 y 3 horas en agitación constante, previa a cada lectura de absorbancia.
Finalmente, se tomó nota del volumen total de la solución de azul de metileno decolorada por la muestra. El anterior procedimiento fue llevado a cabo a 298 K. A cada muestra se le ajustó el pH a 7 al adicionar gotas de soluciones de ácido clorhídrico o de hidróxido de sodio diluidas (0,1 mol.L-1).
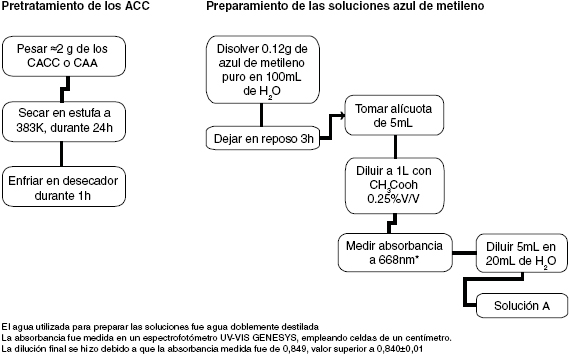
Figura 3. Esquema de los pre-tratamientos y preparación de las soluciones de azul de metileno.
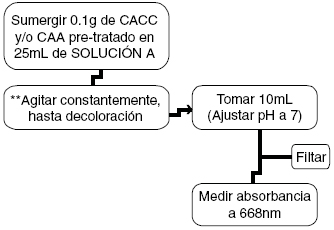
Figura 4. Esquema para obtener las isotermas de adsorción desde solución acuosa para el AM.
RESULTADOS Y DISCUSIÓN
ADSORCIÓN FÍSICA: CARACTERIZACIÓN DE LA TEXTURA POROSA
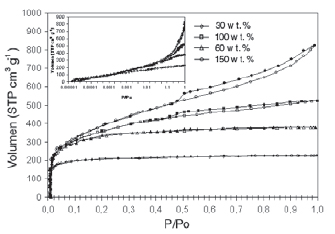
La Figura 5 muestra las isotermas de adsorcióndesorción de N2 a 77K para los CAA obtenidos con H3PO4 a diferentes relaciones de impregnación. En la parte superior de esta figura se insertaron los datos a baja presión trazados en una escala semi-logarítmica. Para los CAA de % p/p 30, se obtuvo isotermas del tipo Ia; lo que confirma que el material es microporoso y el llenado de microporos tiene lugar a muy bajas presiones p/p0 [7].
Para los CAA de %p/p 60, se obtuvo isotermas del tipo Ib. Comportamiento característico de un material microporoso en el cual el llenado de los microporos ocurre en poros más anchos que en el rango de las isotermas tipo Ia; por lo cual se observa un aumento en la cantidad adsorbida con respecto a las isotermas de %p/p 30, a medida que aumenta la presión.
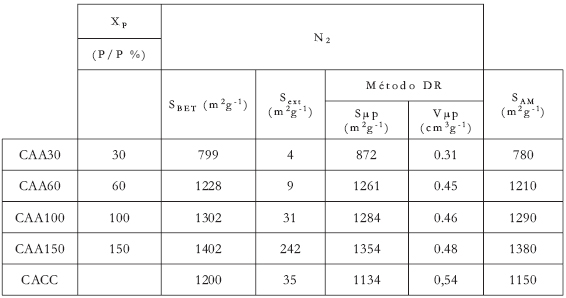
La Tabla 1 muestra los parámetros texturales deducidos desde las isotermas de adsorción. Se identifican los carbones con CAA y un número que corresponde al % de impregnación de ácido fosfórico para esta serie de carbones y el obtenido desde cáscara de coco (CACC).
A partir del análisis con N2 se observa que la superficie específica BET (SBET) y de microporos (Smp (DR,N2)) aumenta proporcionalmente con el incremento de Xp; este aumento es fuerte desde Xp= 30% a 60%. Además, se encuentran valores de áreas superficiales de 799 hasta 1402 m2g-1.
El área específica fue calculada mediante la siguiente ecuación [11]:
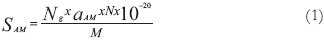
Donde S AM es el área específica en 10-3 km2kg-1, correspondiente al azul de metileno; Ng es el número de moléculas de azul de metileno adsorbidas en la monocapa sobre el carbón activado, kg.kg-1 (o Ng = Nm*M); a AM es el área ocupada por una molécula de azul de metileno = 197,2 A [12]; N es el número de Avogadro, 6,02x1023 mol-1; y; es el peso molecular del azul de metileno, 373,9 g.mol-1. Usando la ecuación (1) se calculó el área a partir de la adsorción del AM, obteniendo los resultados que se reportan en la Tabla 1.
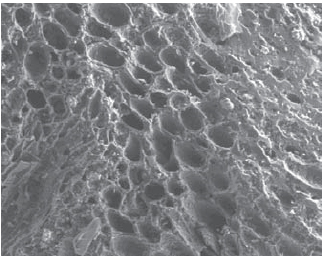
En la Figura 6 se muestra una microfotografía de barrido electrónico, SEM, con un aumento X 500-10 mm, para el carbón obtenido desde cáscara de coco; se puede apreciar la morfología en detalle. Es apreciable la macroporosidad del material, desarrollada durante el proceso de activación, importante para el acceso de las moléculas desde solución a acuosa (en este caso, azul de metileno) a los microporos.
ENSAYO DE ADSORCIÓN: INDICE DE AZUL DE METILENO (AM)
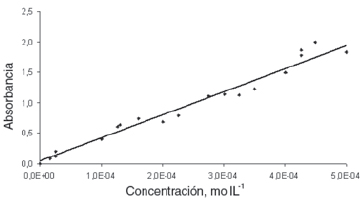
A partir de la curva de calibración de azul de metileno, Figura 7, se analizan las cantidades de azul de metileno adsorbidas sobre los carbones estudiados. Los resultados se ajustaron a una línea recta y se obtuvo un buen coeficiente de correlación, R2 de 0,997. El alto coeficiente de correlación en el ajuste de la curva de calibración del azul de metileno (AM) permite que se pueda considerar que el coeficiente de extinción molar es constante en el rango de concentraciones investigado. Así, la concentración del azul de metileno puede ser determinada con buena precisión. El valor del coeficiente de extinción molar obtenido desde la pendiente es 4.3x10-4 [13, 14, 15]. Durante la experimentación, se establece que la adsorción de azul de metileno sobre el vidrio donde se llevan a cabo los mismos es despreciable.
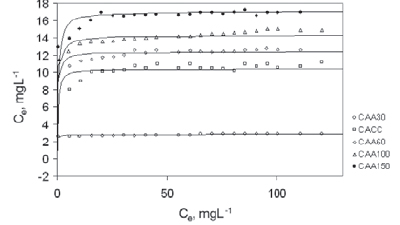
En la Figura 8 se muestran las isotermas desde soluciones acuosas de azul de metileno a 298 K; se muestra un comportamiento tipo I ó Langmuir, característico de sólidos fundamentalmente microporosos. En estas isotermas se puede ver que hay un aumento en la cantidad de azul de metileno adsorbida con el incremento de la concentración hasta llegar a un punto de saturación, en el cual el aumento de la concentración no causa un incremento significativo.
Figura 5. Isotermas de adsorción-desorción a 77K, para los CAA preparados a diferentes relaciones de impregnación [10].
Figura 6. Microscopia electrónica de barrido electrónico, para el CACC.
Figura 7. Curva de calibración de concentración de azul de metileno (AM) en función de la absorbancia.
Figura 8. Isoterma de adsorción de azul de metileno 120mg/L a 298 K.
Tabla 1. Parámetros textuales deducidos a partir de la adsorción de N2 a 77K y el índice de azul de metileno, sobre los CA´s preparados a diferentes relaciones de impregnación (Xp) y cáscara de coco. Las unidades de área superficial (S) y de volumen de poro (V) están en m2g-1 y cm3g-1, respectivamente.
Este ensayo de adsorción a partir de una solución estándar de 120 mgL-1 de azul de metileno, en la cual se sumergieron los carbones activados obtenidos en este trabajo, muestra que el material obtenido (tanto los obtenidos a partir de cascarilla de café y de coco) es excelente para la retención de moléculas de un tamaño molecular pequeño, ya sea que se encuentren disueltas en un efluente acuoso.
La forma lineal del modelo de la isoterma de Langmuir está dado por la ecuación:

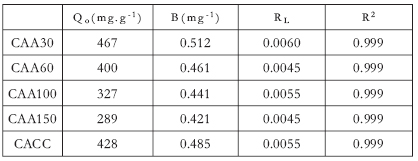
Donde Ce es la concentración de equilibrio del adsorbato (AM) (mg/L), qe es la cantidad de adsorbato adsorbido por unidad de masa de adsorbato (mg.g-1), y Q o y b son las constantes relacionadas con la capacidad de adsorción y velocidad de adsorción, respectivamente. Al graficar Ce/qe en función de Ce, se obtiene una línea recta con pendiente 1/Qo. Esto indica que la adsorción de AM sobre los carbones estudiados se ajusta al comportamiento de isoterma tipo Langmuir. Las constantes de Langmuir b y fueron calculadas a partir de las isotermas que se muestran en la Figura 8. Una vez linealizadas se muestran en la Tabla 2.
Tabla 2. Constantes de las isotermas de Langmuir para el AM, a 298 K
Los datos experimentales dentro del modelo de la isoterma de Langmuir muestran que la naturaleza de la superficie es homogénea para los carbones estudiados, tanto los que se obtuvieron de cáscara de café a diferentes impregnaciones de H3PO4 y cáscara de coco; por ejemplo, la unión de azul de metileno/CAA, tiene igual energía de activación de adsorción. Los resultados muestran, además, la formación de un cubrimiento en monocapa del AM a nivel externo sobre la superficie de los carbones obtenidos. Observaciones similares ya se han reportado en la literatura [12], para el colorante Naranja ácida 10 sobre carbones activados obtenidos desde residuos agrícolas de bagazo de caña de azúcar y para la adsorción directa de colorantes sobre carbones activados obtenidos de otros residuos [13] y para la adsorción de Rojo de Congo sobre carbones activados obtenidos desde cáscaras de materiales lignocelulósicos [14].
Las características esenciales de las isotermas de Langmuir pueden ser expresadas en términos de un parámetro de equilibrio adimensional (RL) [15]:

Donde b es la constante de Langmuir y Co es la concentración más alta de AM en mg.L-1. El valor de RL indica que el tipo de isoterma puede ser desfavorable (RL > 1), lineal (RL = 1), favorable (0 < RL <1) o irreversibe RL = 0.
Valores entre 0.0045 y 0.0060 fueron encontrados y confirman que los carbones activados estudiados y obtenidos en este trabajo favorecen la adsorción de AM.
Esta isoterma es de tipo Langmuir, generalmente asociada con adsorción en monocapa [16, 17, 18, 19]. Sin embargo, su pendiente inicial no se encuentra muy cerrada respecto al eje y. Esto muestra que la afinidad de azul de metileno (AM) respecto al carbón bajo estudio es moderado; en otras palabras, la afinidad puede describirse en función de las fuerzas de Van de Waals. La isoterma de Langmuir muestra que la cantidad de azul de metileno adsorbida se incrementa con el incremento de la concentración hasta el punto de la saturación. Mientras se encuentren sitios disponibles, la adsorción del azul de metileno puede incrementarse; pero en cuanto los sitios ocupen la concentración de éste sobre el carbón, ya no se incrementará. En la Figura 9 se observa que la adsorción del AM varía entre 2 y 17,44 mg.mL-1; se asume que la adsorción es completa como monocapa sobre la superficie carbonácea como se muestra en el plato de las isotermas de adsorción de la misma figura.
Figura 9. Esquema de interacción entre el azul de metileno y los grupos funcionales del los carbones activados
Un esquema de la interacción entre la molécula de azul de metileno y la superficie del carbón se muestra en la Figura 9. Lo cual indica la importancia de ajustar el pH durante el proceso de la obtención de las isotermas desde solución acuosa. Adicionalmente, esto repercutirá en la determinación final del área de cada carbón.
CONCLUSIONES
Se obtuvo materiales carbonosos a partir de materiales lignocelulósicos y se caracterizaron texturalmente. Se utilizó la técnica del índice de azul de metileno para evaluar las áreas de los diferentes carbones obtenidos y se compararon con las obtenidas por el método de las isotermas de adsorción de Nitrógeno a 77 K. Las áreas obtenidas para estos CA´s se encuentran entre rangos de 750 a 1200m2.g-1. Se observa buena correlación entre ambas técnicas. Se realizaron un análisis detallado mediante el modelo de Langmuir, el cual manifiesta que la molécula de azul de metileno es muy afín a la superficie del carbón activado.
REFERENCIAS
[1] C.J. Castro. Influencia del hinchamiento en el área superficial de diferentes carbonizados. Trabajo de Grado. Departamento de Química. Universidad Nacional. Bogotá, 1978. Catalysis reviews, Vol.8, No.1, 1973 pp. 80-102. [ Links ]
[2] Centro Nacional de Investigaciones Científicas. Ministerio de Educación Superior. Ediciones ENPES, La Habana, 1987. [ Links ]
[3] S. R. García. Caracterización de carbonizados por microscopía electrónica de barrido y química superficial. Trabajo de Grado. Departamento de Química. Universidad Nacional. Bogotá, 1996. [ Links ]
[4] O. Jiménez. Preparación de carbón activado a partir de distintos tipos de material vegetal colombiano de desechos con posible aplicación en la remoción de fenol en agua residuales. Trabajo de Grado. Departamento de Química. Universidad Nacional. Bogotá, 2000. [ Links ]
[5] M.V. López-Ramón, F. Stoeckli, C. Moreno-Castilla. Carbon, 1999. [ Links ]
[6] B. J. Ramírez. Efecto del pre-hinchamiento y la oxidación en área superficial de carbonizados utilizando carbones aglomerantes. Trabajo de Grado. Departamento de Química. Universidad Nacional. Bogotá, 1997. [ Links ]
[7] F. Rouquerol, J.Rouquerol, K. S. W. Sing. Adsorption powers and porous solids. Principles, methods and applications. San Diego, Ca: Academic Press, 1999. [ Links ]
[8] F. Suárez García, A. Martínez Alonso A, J. M. D. Tascón. Journal of Analytical and Applied Pyrolysis. No. 62, 2002, pp. 93-109. [ Links ]
[9] G.A. Ávila. Obtención de carbón activado a partir de ripio de café. Trabajo de grado. Departamento de Química. Universidad Nacional. Bogotá, 1991. [ Links ]
[10] M. C. Baquero, L. Giraldo, J. C. Moreno, F. Suarez, A. Martínez-Alonso and JMD. Tascon. Journal of Analytical and Applied Pyrolysis, No.70, 2003, pp. 779-784. [ Links ]
[11] S.J. Gregg, K.S.W. Sing. The physical adsorption of gases by nonporous solids: type II isotherm. Adsorption, surface area and porosity. Academic Press, 1982, pp. 41-110. [ Links ]
[12] D. Gram. Characterization of physical adsorption system. III. The separate effects of pores size and surface acidity upon the adsorbent capacities of activated carbons. Journal of Physical Chemistry, No.59, 1955, pp. 896-900. [ Links ]
[13] K. Bergmann and C.T. O'Konski. A spectroscopic study of methylene blue monomer, dimmer and montmorillonite. Journal of Physical, No.67, 1963, pp.2169-2177. [ Links ]
[14] W.T. Tsai, C.Y. Chang, M.C. Lin, S.F. Chien, H.F. Sun, M.F. Hsieh. Adsorp tion of acid dye onto activated carbons prepared from agricultural waste bagasse by ZnCl2 activation. Chemosphere No.45, 2001, pp. 51–58. [ Links ]
[15] N. Yalcin, V. Sevinc. Studies of the surface area and porosity of activated carbons prepared from rice husk. Carbon No. 38, 2000, pp. 1943–1945. [ Links ]
[16] C. Namasivayam, D. Kavitha. Removal of Congo red from water by adsorp tion onto activated carbon prepared from coir pith, an agricultural solid waste. Dyes Pigments No. 54, 2002, pp. 47–58. [ Links ]
[17] T.W. Weber, R.K. Chakkravorti. Pore and solid diffusion models for fixed-bed adsorbers. AIChE J. No.20, 1974, pp. 228. [ Links ]
[18] C.H. Giles and A.P. De Silva. Molecular sieve effects of powders towards dyes. Measurement of porosity by dye adsorption. Transactions of the Faraday Society. No. 65, 1968, pp. 1943-1951. [ Links ]
[19] Toles C. Marshall WE. Johns MM. Carbon No. 37, 1999, pp.1207. [ Links ]