Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de Ingeniería
versão impressa ISSN 0121-4993
rev.ing. n.31 Bogotá jan./jun. 2010
Degradación fotocatalítica del ibuprofeno empleando dióxido de titanio
Photocatalytic Degradation of Ibuprofen Using Titanium Dioxide
Marcela Papamija
Ingeniera Química. Departamento de Ingeniería Química, Universidad de los Andes. Bogotá D.C., Colombia. marcepapa@hotmail.com
Víctor Sarria
PhD. en Ciencias. Profesor asociado, Departamento de Química, Universidad de los Andes. Bogotá D.C., Colombia. vsarria@uniandes.edu.co
Recibido 1 de Abril de 2009, modificado 19 de Noviembre de 2009, aprobado 4 de Diciembre de 2009.
RESUMEN
En este artículo se presenta la exploración de la degradación de un contaminante emergente, el ácido 2-(p-isobutilfenil) propiónico (ibuprofeno, IB), en solución acuosa, por medio de fotocatálisis Heterogénea. Se evaluó la eficiencia de la degradación de este antiinflamatorio usando dióxido de titanio Degussa P-25 en suspensión o inmovilizado en anillos de vidrio. Se evaluó el efecto de la cantidad de catalizador en suspensión (0, 50 y 200 mg/L de TiO2). Los resultados indican que con 200 mg/L de TiO2 y 50 mg/L de IB se obtiene de mayor eficiencia con una remoción de 80,64% de IB en 240 minutos.
PALABRAS CLAVES
Aguas residuales, catalizador, fotocatálisis heterogénea, procesos de oxidación avanzada.
ABSTRACT
This study explores the degradation of an emerging contaminant, ibuprofen (IB) in water through photocatalysis heterogeneous. For this aim, the efficiency of the degradation of this anti-inflammatoty using titanium dioxide Degussa P-25 in suspension or immobilized on a glass rings, was evaluated. The effect of the amount of catalyst in suspension, tested 0, 50 and 200 mg/L TiO2 was also evaluated. The results of this study show that, the best results of 80.64% degradation of initial IB were obtained during 240 minutes with 200 mg/L TiO2 and 50 mg/L of IB.
KEY WORDS
Advanced oxidation processes, catalyst, heterogeneous photocatalysis, wastewater.
INTRODUCCIÓN
Debido al avanzado desarrollo industrial y tecnológico que ha venido experimentando Colombia y al gran aumento de las industrias, se ha incrementado la emisión de residuos contaminantes en fase líquida; por tanto, es importante encontrar una forma efectiva de tratar estos contaminantes o de implementar procesos para la descontaminación de los efluentes.
A diferencia de las aguas residuales domésticas, los efluentes industriales contienen con frecuencia sustancias peligrosas que no se eliminan por un tratamiento convencional, ya que presentan concentraciones elevadas de contaminantes o dada la naturaleza química de éstos. Muchos de los compuestos orgánicos en aguas residuales industriales son objeto de regulación especial, debido a su toxicidad o a sus efectos biológicos a largo plazo. En estudios recientes se ha demostrado la presencia de compuestos farmacéuticos en ríos y lagos; pesar de que su concentración es relativamente baja, estos compuestos pueden provocar consecuencias toxicológicas considerables [1]. Las aguas residuales industriales de empresas farmacéuticas tienen contaminantes importantes como el diclofenaco, naproxeno, sertralina, tamoxifen e ibuprofeno [2, 3, 4]. El ácido 2-(p-isobutilfenil) propiónico, comercialmente disponible como ibuprofeno (IB) (Figura 1), es un medicamento, de la familia de los antiinflamatorios no esteroideo, utilizado contra problemas musculares y desordenes inflamatorios. El IB se ha convertido en un foco importante de investigación, ya que es un micro contaminante emergente con un alto impacto económico y ambiental, que se ha reportado en concentraciones en el rango de 0,49 a 990 μg/L [3, 4].
Figura 1. Estructura química del ácido 2-(p-isobutilfenil) propiónico
Dentro de las alternativas actualmente exploradas para remediación de aguas contaminadas, se están estudiando los llamados Procesos Avanzados de Oxidación (POAs). Los POAs hacen parte de una familia de tecnologías que utiliza la elevada capacidad oxidante del radical hidroxilo (·OH). Los POAs se diferencian entre sí en la forma en la que los generan y los más estudiados utilizan combinaciones de ozono, peróxido de hidrógeno, radiación ultravioleta y fotocatálisis [3]. Uno de los aspectos más importantes de la fotocatálisis consiste en trabajar con un material disponible como el dióxido de titanio (TiO2). El TiO2 es un material semiconductor, relativamente económico y muy estable químicamente.
La foto-catálisis heterogénea sobre dióxido de titanio es uno de los procesos más estudiados. El TiO2 es un semiconductor que cumple la función de catalizador, por lo tanto, aumenta la velocidad de reacción sin alterar el equilibrio; se activa con la luz ultravioleta y produce radicales (· OH), los cuales oxidan la materia orgánica del contaminante. La remoción del contaminante ocurre cuando el catalizador (TiO2) es irradiado por la luz UV. Esta fuente de energía excita a un electrón promoviéndolo desde la banda de valencia (baja energía) hacia la banda de conducción (alta energía), lo cual deja un hueco positivo en la primera banda. El mecanismo se muestra a continuación:
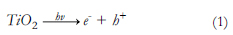
Este hueco, al entrar en contacto con el agua (H2O) o con un ion OH- , produce los radicales hidroxilo (· OH).


Las especies formadas logran modificar químicamente a la sustancia contaminante y la convierten en sustancias intermediarias inofensivas y biodegradables para el medio ambiente.
En [4], se realiza una interesante recopilación de estudios recientes (1997-2007) orientados a la exploración de los POAs como alternativas para la degradación de residuos farmacéuticos. Se destaca el uso de la fotocatálisis heterogénea y también la aplicación sobre diversos compuestos. No obstante, el ibuprofeno ha recibido una menor atención. Se resaltan los estudios realizados a escala de laboratorio, en los que se explora la aplicación de ondas de ultrasonido [5] y de varios sistemas híbridos sono-fotocatálisis, TiO2/Fe2+/sonolisis y sono-Foto-Fenton. Con este último sistema, se alcanzaron remociones del IB hasta del 95% y de remoción del carbono orgánico disuelto, hasta del 66% [6]. El IB ha sido objeto igualmente de estudios exploratorios en sistemas fotocatalíticos a escala piloto usando radiación solar [7]. Este estudio presenta resultados promisorios respecto a esta alternativa de tratamiento para el IB.
Así pues, en este artículo se presentan los resultados experimentales de la degradación del ácido 2-(p-isobutilfenil) propiónico (ibuprofeno, IB), en solución acuosa, por medio de fotocatálisis heterogénea usando TiO2 a escala de laboratorio.
METODOLOGÍA
MATERIALES Y REACTIVOS EMPLEADOS
Se utilizó ibuprofeno comercial, agua ultra pura Milli-Q e hidróxido de sodio para aumentar el pH de la solución hasta pH = 8,0. Se trabajó este pH, dado que se ha reportado una mayor solubilidad del IB en agua a este valor [8]. Para lograr una buena solubilización, se sometió la solución a ultrasonido durante 20 minutos. El TiO2 fue Degussa P-25, que es una mezcla de 80% anatasa y 20% rutilo con un área superficial de aproximadamente 50 m2/g.
EVALUACIÓN DE LA FOTODEGRADACIÓN
Se estudió el efecto de la cantidad del catalizador TiO2 Degussa P-25 (0, 50 y 200 mg/L) y el efecto de la presentación del catalizador, sea en suspensión o inmovilizado. Se trató una solución sintética con ibuprofeno como contaminante a diferentes concentraciones (25 y 50 mg/L). Se trabajó con concentraciones más elevadas que las reportadas en medios naturales, dado que se espera que los PAOs puedan ser útiles en situaciones de contaminaciones puntuales y concentradas, tales como efluentes de unidades de producción de industrias farmacéuticas, y no en situaciones diluidas, como cuerpos de aguas abiertos (ríos, lagos, etc.).
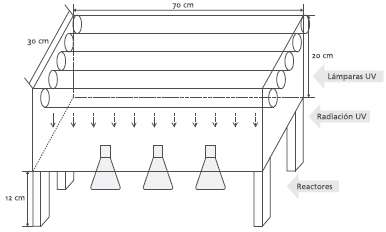
Una vez preparada la solución con IB, se agrega a cada una de las 3 muestras las diferentes cantidades de catalizador 0, 50 y 200 mg/L. Cada una de estas muestras se dispuso en erlenmeyers de 100 mL cada uno, para llevarlos al reactor y empezar la degradación. Los experimentos de fotodegradación del IB se realizaron en una caja de aluminio equipada con 5 lámparas de luz ultravioleta Lexmana de 32W. Las lámparas dispuestas en la parte superior de la caja presentan un espectro de emisión en la región de 300 a 400 nm, con un máximo a 360 nm de longitud de onda.
El reactor totalmente aislado de la luz visible cuenta con un sistema de ventilación para mantenerlo a una temperatura constante dentro del reactor de 40°C, luego de dejar precalentar por una hora.
Figura 2. Esquema del fotorreactor ultravioleta empleado para los experimentos de fotodegradación del ibuprofeno
INMOVILIZACIÓN DEL CATALIZADOR
Para la inmovilización del TiO2 en anillos de vidrio, se utilizó el método de impregnación simple (basado en mecanismos de difusión) seguido de calcinación. Los anillos de vidrio fueron puestos en contacto con una suspensión de 500 mg/L de TiO2 y luego se procedió a calcinar en una mufla 47900 Barnstead, en la cual se realizaron incrementos de temperatura a una velocidad de 5°C/minuto durante 2 horas hasta alcanzar 600°C [9].
SEGUIMIENTO DE LAS CINÉTICAS DE DEGRADACIÓN
Las cinéticas de degradación fueron seguidas utilizando cromatografía líquida de alto rendimiento (HPLC). Se usó un equipo Waters 2695 acoplado a un detector de arreglo de diodos Waters 996. Se empleó como fase móvil una mezcla de 20 mM de fosfato de sodio como solución buffer (pH 7), acetonitrilo en proporción 65%:35% y un flujo volumétrico de 1 mL/min. Se utilizó una columna analítica (Allsphe- re ODS 2-5 pm), con una longitud de 250 mm, temperatura 20 ± 3 °C. El método empleado fue isocráti- co, se inyecto 10 pl de muestra y el tiempo de corrida fue de 20 min por muestra.
RESULTADOS Y DISCUSIÓN
COMPARACIÓN DEL TIO2 EN SUSPENSIÓN VS. INMOVILIZADO
Siguiendo el método de inmovilización del TiO2 presentado en la parte experimental, por diferencia de peso seco se obtuvo indirectamente la cantidad de catalizado fijado a la superficie de los anillos de vidrio y se consiguió un valor de 50 mg TiO2/g Vidrio. Se utilizaron 0,1 g de vidrio con catalizador soportado, para obtener una cantidad de TiO2 en suspensión de 5 mg TiO2/100 mL (50 mg/L) que fuese equivalente a la cantidad utilizada en los experimentos en suspensión.
La Figura 3 presenta la comparación de la evolución de la concentración de IB en función del tiempo de tratamiento fotocatalítico con TiO2 inmovilizado, en anillos de vidrio y en suspensión.
Figura 3. Evolución de la concentración de ibuprofeno en función del tiempo de tratamiento foto catalítico con [TiO2]= 50 mg/L inmovilizado en anillos de vidrio y en suspensión
La eficiencia de degradación al término de 240 min (4 horas) del TiO2 inmovilizado en anillos de vidrio fue del 42% y para el dióxido de titanio en suspensión a la misma cantidad de catalizador fue del 75%. Con esto, se puede observar que para los dos casos presentados las eficiencias mayores de degradación de IB corresponden al TiO2 en suspensión. Lo anterior se puede atribuir a que el TiO2 en suspensión no presenta elevadas limitaciones de transferencia de masa, ya que éste circula a través de todo el montaje, amplía el área de contacto y se facilita así la transferencia de masa. Con respecto a esta última, el soporte hace que se creen límites entre el reactante y el producto debido a que actúa como una barrera que obstaculiza el flujo de electrones [10]. Además, al soportar el dióxido de titanio en los anillos de vidrio no se puede predecir si quedó perfectamente distribuido el catalizador, esto genera acumulación de TiO2, lo cual impide que todo éste se active con la luz y se generen los radicales oxidantes. Lo anterior hace que la superficie de TiO2 activada sea menor con respecto a la que se genera en suspensión [11].
EFECTO DE LA CANTIDAD DE CATALIZADOR TIO2 EN SUSPENSIÓN Y DE LA CONCENTRACIÓN INICIAL DE IB
La cantidad de catalizador y la concentración inicial de IB son variables primordiales en la fotocatálisis heterogénea, porque pueden afectar la velocidad de reacción y disminuir la energía de activación requerida.
Basados en resultados previos [12] en los cuales se han encontrado cinéticas de degradación de pseudo primer orden, los perfiles de concentración de IB respecto al tiempo de degradación pueden ser correlacionados mediante la velocidad de reacción de fotocatálisis. Al emplear el método integral para una reacción de primer orden, como se muestra a continuación:

Donde Kap es la constante aparente, Ca corresponde a la concentración de IB y r es la velocidad de reacción. Tomando como límites de la integral Ca =Cao en t =0, se obtiene la relación:
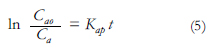
La ecuación 5 ayuda a realizar una linealización que permite aproximar este experimento a un modelo de reacción de pseudo primer orden.
Al usar esta misma ecuación, se determina la constante de velocidad de reacción aparente Kap, que equivale a la pendiente de la regresión lineal de cada uno de los perfiles para las diferentes concentraciones de TiO2. En la Figura 4 se compara el comportamiento de la Kap de la reacción con respecto a la cantidad de TiO2 para dos concentraciones de IB, 25 y 50 mg/L, respectivamente. Si inicialmente se considera la curva para IB 50 mg/L, cuando se usa 0 mg/L de TiO2, se reporta una constante de velocidad aparente de 0,0002 min-1; esto es el reflejo de procesos de fotolisis, poco significativos. La Kap se hace más grande a medida que incrementa la cantidad de catalizador de 0 a 50 mg/L y alcanza valores máximos cercanos a 0.006 min-1.
Para valores superiores a 50 mg/L de TiO2 no se observa un cambio significativo de la Kap. Este comportamiento se puede atribuir a: (i) la formación de compuestos intermedios altamente oxidados, sobre los cuales es más difícil realizar una oxidación suplementaria; (ii) un efecto de pantalla provocado por las partículas de TiO2 que impiden la entrada de la irradiación al seno del reactor, lo que disminuye la eficiencia cuántica del proceso.
Figura 4. Evolución de la constante aparente de reacción Kap vs. la cantidad de catalizador TiO2 a dos diferentes concentraciones iniciales de ibuprofeno
Para la concentración de IB de 25 mg/L se observa que la curva toma valores mayores de Kap con respecto a 50 mg/L de IB. Se alcanza un valor máximo de la Kap de 0,011 min-1. Esto indica que la degradación ocurre a mayor velocidad en concentraciones bajas de contaminante. Lo anterior se puede atribuir debido a que existe menos competencia por los sitios activos disponibles en una cantidad de catalizador determinada[13]
CONCLUSIONES
Se evaluó la eficiencia de la fotocatálisis heterogénea para la degradación de ibuprofeno en solución acuosa. Se evaluó el catalizador TiO2 Degussa P-25 en suspensión comparado con el inmovilizado en anillos de vidrio. La mayor eficiencia se obtuvo con el TiO2 en suspensión, lo cual es atribuible a que se presenta una menor limitación por fenómenos de transferencia de masa entre el catalizador y el contaminante por degradar.
Se encontró que la cantidad de TiO2 tiene un efecto en la fotodegradación de ibuprofeno y que el mejor valor en el rango evaluado fue de 50 mg/L. Con esta cantidad de TiO2 se alcanzó un porcentaje de fotodegradación de 80.64% en un tiempo igual a 240 minutos.
Se verificó la importancia que tiene la concentración inicial del contaminante IB como un factor determinante en la fotodegradación. Se halló que a menor concentración de éste se obtiene una mayor constante de velocidad aparente Kap. Sin embargo, son necesarios más trabajos en este sentido con el fin de determinar una concentración óptima de contaminante en el rango evaluado, al igual que trabajar con concentraciones cercanas a las reportadas en los cuerpos de agua. Adicionalmente, se deberá poder responder a un balance de masa completo, siguiendo la evolución del carbono orgánico disuelto y de la biocompatibilidad de los intermediarios de degradación.
AGRADECIMIENTOS
Los autores agradecen a la Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República de Colombia, por el apoyo económico al proyecto 273 de 2009.
REFERENCIAS BIBLIOGRÁFICAS
[1] F. Méndez-Arriaga, S. Esplugas, J. Giménez. "Photocatalytic degradation of non-steroidal anti-inflammatory drugs with TiO2 and simulated solar irradiation". Water research. Vol.42, No. 3, February 2008, pp. 585-594. [ Links ]
[2] E. R Cooper, T. Siewicki, K. Phillips. "Preliminary risk assessment database and risk ranking of pharmaceuticals in the environment". Science of The Total Environment. Vol. 398, No. 1-3, 15 July 2008, pp 26-33. [ Links ]
[3] C. Lacey, G. McMahon, J. Bones, L. Barron, A. Morrissey, J.M Tobin. "An LC–MS method for the determination of pharmaceutical compounds in wastewater treatment plant influent and effluent samples". Talanta. Vol. 75, No. 4, May 2008, pp 1089-1097. [ Links ]
[4] M. Klavarioti, D. Mantzavinos, D. Kassinos. "Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes". Environment International, Vol 35, No 2, February 2009, pp. 402-417. [ Links ]
[5] F. Méndez-Arriaga, R. Torres, C. Petrier, S. Esplugas, J. Giménez, C. Pulgarin. "Ultrasonic treatment of water contaminated with ibuprofen". Water Research. Vol. 42, No.16, October 2008, pp. 4243-4248. [ Links ]
[6] F. Méndez-Arriaga, R. Torres, C. Petrier, S. Esplugas, J. Giménez, C. Pulgarin. "Mineralization enhancement of a recalcitrant pharmaceutical pollutant in water by advanced oxidation hybrid processes". Water Research. Vol. 43, No. 16, September 2009, pp. 3984-3991. [ Links ]
[7] F. Méndez-Arriaga, M. Maldonado, J. Giménez, S. Esplugas, S. Malato. "Abatement of ibuprofen by solar photocatalysis process: Enhancement and scale up". Catalysis Today. Vol. 144, No. 1-2, 15 June 2009, pp. 112-116. [ Links ]
[8] E.L. Guisado, M.E. Gil, M.A. Camacho, A.I. Torres. "Estudio de solubilidad de ibuprofeno en medio acuoso: Elaboración de una formulación liquida de uso pediátrico". VI Congreso de la Sociedad Española de Farmacia Industrial y Galénica (SEFIG), 3ª Jornadas de Tecnología Farmacéutica (AEFI). Tecnología Farmacéutica. pp. 161-164. Fecha de consulta: 8 de septiembre del 2008. Disponible en: http://www.sefig.org/doc/Congreso%20Granada/TF/042_TF.pdf. [ Links ]
[9] J. Marín, J. A. Navío, L. A. Ríos, G. Restrepo. "Soporte de Nuevas Películas de TiO2 y TiO2/SiO2 sobre Gránulos de Poliéster para Aplicación en Fotocatálisis". Química Nova, Vol. 19, No. 6, 2008, pp. 9-20. [ Links ]
[10] A. E. Cassano, O. Alfano, R. J. Brandi, C. A. Martín. "Diseño de reactores para fotocatálisis: conceptos fundamentales". En Eliminación de contaminantes por fotocatálisis heterogénea. M.A. Blesa (ed.). La Plata, Argentina: Cyted, 2001. Fecha de consulta: 8 de septiembre del 2008. Disponible en: http://www.cnea.gov.ar/xxi/ambiental/CYTED/16cap10.pdf. [ Links ]
[11] J. B. Gálvez, S. M. Rodríguez, J. Peral, B. Sánchez, A. Cardona. "Diseño de reactores para fotocatálisis: evaluación comparativa de las distintas opciones". En Eliminación de contaminantes por fotocatálisis heterogénea. M.A. Blesa (ed.). La Plata, Argentina: Cyted, 2001. Fecha de consulta: 8 de septiembre del 2008. Disponible en: http://www.cnea.gov.ar/xxi/ambiental/CYTED/17cap11.pdf. [ Links ]
[12] L. Gomez, V. Sarria. "Fotodegradación heterogénea de Bisfenol-A en agua con dióxido de titanio". Química Nova. Vol. 32, No. 5, 2009, pp. 1164-1169. [ Links ]
[13] A. Coelho, C. Sans, A. Agüerac, M. J.Gómez, S. Esplugas and M. Dezottia. "Effects of ozone pre treatment on diclofenac: intermediates, biodegradability and toxicity assessment". Science of The Total Environment. Vol.407, No. 11, 15 May 2009, pp. 3572-3578. [ Links ]