Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de Ingeniería
versão impressa ISSN 0121-4993
rev.ing. no.36 Bogotá jan./jun. 2012
Modelo de hemodilución normovolémica extrema en porcinos conscientes para evaluar soluciones de reanimación
A Model of Extreme Normovolemic Hemodilution in the Conscious Swine to Evaluate Resuscitation Fluids
Juan David Pérez Coronado(1)*, Sergio David Galvis Forero(2)*, Andrew Akbar Shalá Vásquez(3),Jaime Ramón Cabrales Arévalo(4),Pedro Josué Cabrales Arévalo(5),Juan Carlos Briceño Triana(6)
(1) MD. MSc Ciencias Biomédicas, jd.perez31@uniandes.edu.co
(2) Médico Veterinario, Universidad de la Salle. sd.galvis26@uniandes.edu.co
(3) MSc en Ciencias Biomédicas Universidad de los Andes. Bogotá, Colombia. a-shala@uniandes.edu.co
(4)MD, especialista en cardiología y hemodinamia. Fundación Cardioinfantil-Instituto de Cardiología. Bogotá, Colombia. jcabrales@cardioinfantil.org
(5) PhD. MSc Ingeniería Biomédica. Instituto de Bioingeniería La Jolla. California, Universidad de California, San Diego. pcabrales@ucsd.edu
(6) PhD Ingeniería Biomédica, Ingeniero Mecánico. Profesor Titular, Universidad de los Andes. Bogotá, Colombia. jbriceno@uniandes.edu.co
(*)Asistente proyectos grupo Ingeniería Biomédica Universidad de los Andes. Bogotá, Colombia.
Recibido 15 de abril de 2011, modificado 13 de octubre de 2012, aprobado 29 de octubre de 2012
Palabras claves
Modelo experimental, porcino, consciente, hemodilución normovolémica, perfluorocarbono, hemosustituto.
Resumen
Se desarrolló un modelo de hemodilución normovolémica extrema (HNE) en porcinos conscientes con 4 niveles de intercambio de sangre hasta un hematocrito <6%. En cada nivel se extrajo 40% de la volemia y se reemplazó con igual volumen con almidón hidroxietílico. Se encontró hipoxia tisular con hemoglobina (Hb) <3g/dl a las 2 horas después, luego del último intercambio. Sobrevivieron 4 de 10 porcinos. Solo la Hb presentó diferencia estadísticamente significativa luego de la instrumentación con Hb <10.4 g/dl en los porcinos no sobrevivientes. Durante la HNE se encontró aumento de frecuencia cardíaca y gasto cardíaco, presión arterial divergente, aporte de oxígeno y resistencia vascular sistémica disminuida.
Key words
Experimental model, swine, conscious, normovolemic hemodilution, normovelemic, perfluorocarbon, hemosubstitute.
Abstract
A model of ENH (Extreme Normovolemic Hemodilution) in the conscious swine was developed. A 4 level blood exchange was performed down to 6% hematocrit. In each level 40% of total blood volume was withdrawn and replaced with the same volume of hydroxyethyl starch. Below hemoglobin (Hb) 3g/dl and 2 hours after last exchange there was tissue hypoxia. 4 of 10 animals survived and only Hb after instrumentation had statistical difference with Hb <10.4 g/dl in non-surviving animals. During ENH there was tissue hypoxia, increase heart rate and cardiac output, divergent blood pressure, decrease oxygen delivery and systemic vascular resistance.
INTRODUCCIÓN
Las principales causas de muerte en el mundo y en Colombia se relacionan con hemorragia por trauma [1, 2]. Dentro del tratamiento para estas entidades frecuentemente se requiere el uso de transfusiones sanguíneas [3, 4, 5, 6]. Sin embargo, en los últimos años se han realizado esfuerzos para ajustar las indicaciones de transfusiones sanguíneas debido a los riesgos que este procedimiento implica y, asimismo, la limitación de donantes de sangre [7, 8]. Las emulsiones de perfluorocarbono (PFC), junto con las soluciones de hemoglobina, son las dos principales tecnologías para desarrollar medios de transporte artificial de oxígeno por su gran afinidad con los gases respiratorios y su aplicación potencial principal, es decir, mejorar el suministro de oxígeno en situaciones donde se requieren transfusiones sanguíneas por un déficit en el aporte tisular de oxígeno (DO2 ) [7, 9].
Para evaluar la eficacia en el transporte de oxígeno de la emulsión in vivo se requiere implementar modelos experimentales que simulen y reproduzcan estas situaciones [10].
En los últimos años, el Grupo Ingeniería Biomédica (GIB) de la Universidad de los Andes y FCI (Fundación Cardioinfantil) realizaron trabajos de investigación sobre emulsiones de PFC con modelos de choque hemorrágico y de hemodilución normovolémica [11, 12, 13, 14]. Sin embargo, algunos de estos trabajos se realizaron en especies pequeñas (murinos y lepóridos) lo que dificultó técnicamente los procedimientos y mediciones [11, 12, 13]. Los modelos de hemodilución normovolémica utilizados anteriormente tenían pocos niveles de intercambio, cortos tiempos de evaluación y medición de pocas variables como hematocrito y diferencia arteriovenosa de oxígeno [12]. Con la metodología de choque hemorrágico, se observó disminución del DO2 que se atribuyó tanto a disminución del contenido arterial de oxígeno por pérdida de glóbulos rojos como la disminución del volumen intravascular, lo cual dificultó la valoración de la capacidad transportadora de oxígeno de la emulsión [15, 16]. Por esto, se vio la necesidad definir, desarrollar y estandarizar un modelo experimental que permitiera la evaluación del impacto hemodinámico y metabólico de la emulsión de PFC y su comparación con las soluciones expansoras de plasma. Se determinó desarrollar una metodología basada en el procedimiento de hemodilución normovolémica, utilizado en cirugía, que induce un estado de anemia mientras se mantiene el volumen sanguíneo con un fluido acelular [17]. Esto reduce la capacidad de transporte de oxígeno de la sangre por disminución del contenido arterial de oxígeno, pero altera en menor proporción el volumen intravascular, siendo el escenario ideal para la evaluación in vivo del transporte de oxígeno por la emulsión de PFC.
DESARROLLO
Objetivo
Estandarizar e implementar un modelo de hemodilución normovolémica extrema (HNE) en porcinos conscientes para la evaluación de soluciones de reanimación.
METODOLOGÍA
Para el desarrollo del modelo de HNE se utilizaron 23 porcinos raza Yorkshire desde 5 Kg hasta 20 Kg con 6 horas de ayuno de sólidos, provenientes del mismo sitio de cuidado. Estos recieron anestesia general para la instrumentación, luego de la recuperación de consciencia –de los porcinos–, después de 2 horas, se procedió a realizar intercambios normovolémicos sobre una mesa de restricción y, luego del último intercambio, se esperaron 2 horas más. Durante los experimentos se determinaron la metodología anestésica, el peso necesario de los porcinos, el tipo de monitoría, el sistema de medición de gasto cardíaco, y los tiempos y variables de medición para el modelo. Posteriormente, el modelo se implementó y se obtuvieron valores basales, criterios de exclusión para la hemodilución y se evaluaron los resultados hemodinámicos y metabólicos preliminares. No se utilizó emulsión de PFC.
Desarrollo del modelo hemodilución normovolémica extrema en porcinos conscientes
Los experimentos se desarrollaron en la Sala de Cirugía Experimental de la Fundación Cardioinfantil. El protocolo fue evaluado y aprobado por el Comité de Ética de Experimentación Animal de la FCI y por el Comité de Ética de Investigación de la Universidad de los Andes.
•Selección anestesia. Para la instrumentación se determinó anestesia intravenosa debido a que con anestesia inhalada los porcinos presentaban fiebre.
•Método de instrumentación. Para la colocación de los dispositivos de medición se utilizaron técnicas de inserción directa a través de disección y vía percutánea por punción. Se presentaron mayores complicaciones, principalmente, en los procedimientos por punción como lesión de vena cava superior y de ventrículo derecho. Se determinó instrumentación con técnica por disección.
•Intercambio normovolémico hiperóxido. Se determinaron 4 niveles de intercambio (I1-I4) de 1 hora de duración (30 minutos de intercambio, 30 minutos de recuperación) con el fin permitir la estabilización de los mecanismos compensatorios. Se extrajo el 40% de la volemia en cada nivel. Para reponer el mismo volumen de sangre extraído se determinó la utilización de solución Hydroxyetyl Starch (HES) al 6% que permite una mayor normovolemia y un mayor tiempo en el compartimento intravascular [18]. Se utilizó FiO2 de aire ambiente (0,21) en I1 a I2 y posteriormente se incrementó a FiO2 de 1 en los últimos 2 intercambios debido a que la hiperoxia mejora la probabilidad de supervivencia [19].
•Selección de variables a determinar. Se determinó medir gasto cardíaco (GC), presión arterial invasiva, presión cuña (PC), presión arteria pulmonar (PAP), presión venosa central (PVC), resistencia vascular sistémica (RVS). Gases arteriovenosos con pH, lactato, base exceso, HCO3-, presión de O2, presión de CO2, saturación de O2, aporte de O2 (DO2), consumo de (VO2) y tasa de extracción de O2. Hemoglobina (Hb) y hematocrito (Hcto).
•Elección sistema de medición del GC. Se realizaron mediciones con ecocardiograma transtorácico (ECO-TT) y catéter Swan-Ganz/Gasto Cardíaco Continuo (SG-CCO de Edwards Lifesciences, Vigilance II®). Se encontró que el ECO-TT es observador dependiente, había baja disponibilidad del equipo y aumentaba el estrés del animal. Se determinó uso de SG-CCO. El peso mínimo para el uso de SG-CCO fue 16 Kg.
•Tiempo de recuperación. Con el fin de garantizar la recuperación total del animal, se probaron tiempos de recuperación entre la instrumentación y el inicio de la hemodilución de 48 horas y 1 semana. Posterior a este tiempo se encontraron daños o desinserción de los catéteres por lo que se definió la realización de la hemodilución el mismo día de la instrumentación con 2 horas para recuperación de consciencia.
RESULTADOS
•Valores basales. Se realizaron 2 mediciones basales antes de la hemodilución. La primera, durante la instrumentación bajo anestesia (basal) y, la segunda, luego de recuperar la consciencia (I0). La Hb basal encontrada fue 11.2 g/dl +/-1.5. La principal diferencia entre basal e I0 fue el pH y PaCO2 encontrando: pH entre 7,35-7,48 con anestesia y entre 7,52-7,56 conscientes con valores de PaCO2 menores. Esto sugiere alcalosis respiratoria secundaria a hiperventilación del porcino mientras está consciente (figura 1).
•Criterios inclusión.Porcinos de 16-18 kg raza Yorkshire macho o hembra con 6 horas de ayuno de sólidos, provenientes del mismo sitio de cuidado.
•Criterios de exclusión.Se evaluaron 10 porcinos, 4 sobrevivieron las 4 hemodiluciones con las 2 horas posteriores y 6 presentaron muerte prematura en diferentes niveles de intercambio. Se analizaron la diferencia entre los 2 grupos en las variables medidas en Basal e I0. No se encontró diferencia estadística (p<0,05) en la medición basal, mientras que en I0, la Hb fue el único valor con diferencia significativa (p=0,04) y se encontró en un rango entre 9,2 y 10,4 g/dl. Se estableció como criterio de exclusión una Hb < 10,4 g/dl luego de la instrumentación.
•Hemoglobina crítica y hemodilución extrema. Para utilizar adecuadamente el PFC es necesario conocer en qué momento (nivel de Hb) debe administrarse. En la Hb crítica se considera el valor de Hb a partir del cual los mecanismos compensatorios son ineficientes para mantener un adecuado VO2 y es un detonante para la transfusión [17]. En humanos sanos se ha encontrado tolerancia hasta Hb de 5 g/dl con cambios en conciencia pero no en el consumo oxígeno, siendo considerada hemodilución severa debajo de Hb 6 g/dl [20]. Durante los experimentos se encontraron cambios hemodinámicos desde los primeros niveles de Hb (figura 2a), pero solo debajo de 3 g/dl de Hb se observó dependencia del VO2 sobre el DO2 y aumento considerable de los marcadores de hipoxia tisular (figura 2b ). Se determinó Hb < 3 g/dl como Hb crítica.
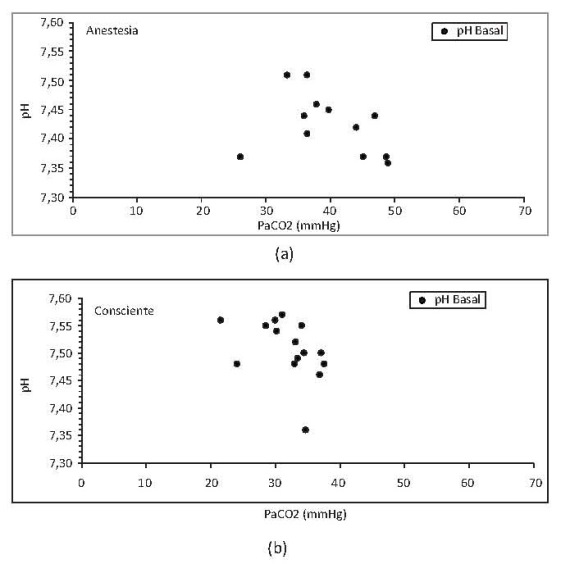
Figura 1. Relación de pH y PaC02 durante anestesia (a) y consciencia (b). Los valores son media medias. Se incluyen porcinos de N15 a N23.
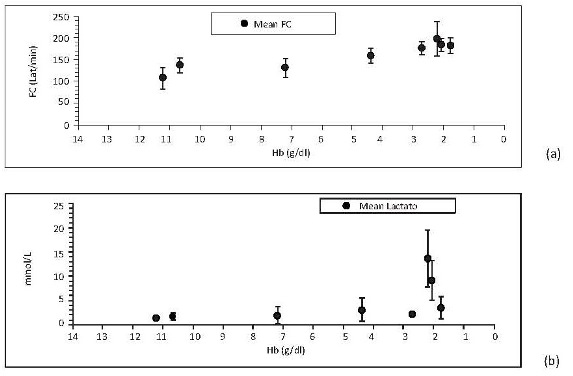
Figura 2. (a) Cambios Frecuencia cardíaca con disminución de Hb. (b) Lactato respecto a la hemoglobina.
Valores dados en media +/-desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios, N17, N19, N20 y N22 a N23.
La metodología de hemodilución debe intercambiar el volumen necesario de sangre para llevar a los porcinos por debajo del nivel de Hb crítico establecido (hemodilución extrema). Se observó que este nivel de Hb crítica (< 3 gr/dl) se alcanza luego del tercer intercambio (I3). La Hb final es < 2 gr/dl (< 6% Hct) (figura 3). Se determinó que el PFC se debe utilizar desde el inicio de I3 (antes del punto de Hb crítica).
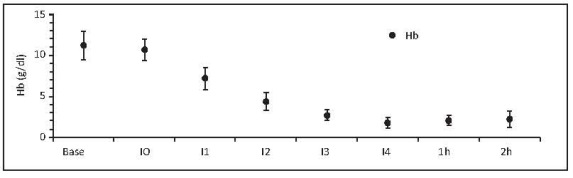
Figura 3. Hemoglobina respecto al tiempo. Los valores son medias +/- desviación estándar. Se incluyen porcinos de N15 a N23. Base, medición basal; I0, medición consciente 2 horas después de la instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4.
•Duración hemodilución extrema.Aunque se presentaron cambios hemodinámicos desde los primeros intercambios (figura 4a), los marcadores de hipoxia tisular se observaban significativamente aumentados durante las 2 horas posteriores al último intercambio (figura 4b).
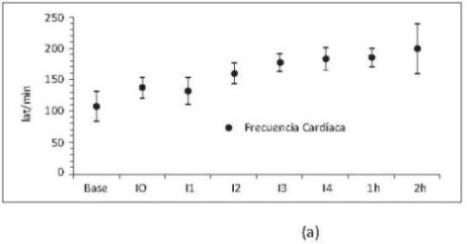
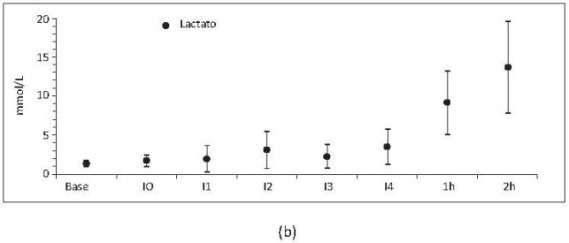
Figura 4.Frecuencia cardíaca (a) y lactato (b) respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de la instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h y 2h, 1 y 2 horas después de intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20 y N22 a N23.
RESULTADOS HEMODINÁMICOS
1. Gasto cardíaco (GC) y frecuencia cardíaca (FC)
Se encontró aumento de FC y GC desde los primeros niveles de hemodilución. Se observó disminución del DO2 a pesar del aumento del GC (figura 5a), lo que evidencia que la caída del DO2 en la hemodilución es producida principalmente por la disminución del contenido arterial de oxígeno secundario a la pérdida de glóbulos rojos (figura 5b).
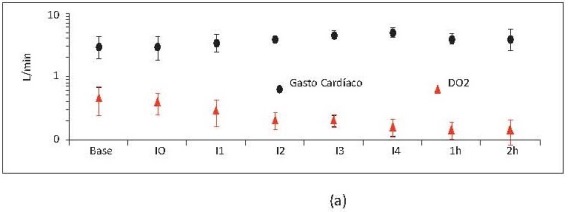
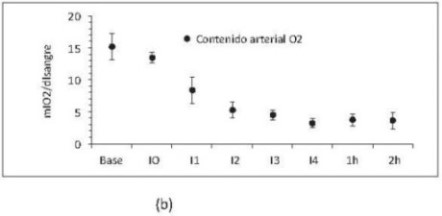
Figura 5. Gasto cardíaco (L/minuto) y DO2 (ml O2/ min) respecto al tiempo. (b) Contenido arterial de oxígeno (ml O2 /dl sangre) respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20 y N22 a N23.
2. Presión venosa central (PVC)
Se mantuvo dentro del rango considerado como normal (0-8 mmhg, figura 6). Como indicador de precarga, la PVC puede indicar que el animal está normovolémico.
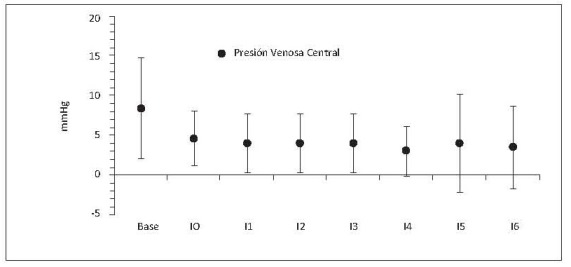
Figura 6. Presión venosa central respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20, N22, N23.
3. Presión arterial y resistencia vascular sistémica .
La presión arterial de perfusión o presión arterial media (PAM) se mantuvo constante durante los primeros 2 intercambios (I1-I2) (figura 7a), y se observó simultáneamente divergencia entre la presión sistólica (PAS) y diastólica (PAD) (figura 7b). El aumento de la PAS puede ser secundario al aumento del trabajo cardíaco como mecanismo compensatorio para mantener la presión de perfusión. Mientras que la disminución de la PAD se atribuye a la caída de la resistencia vascular sistémica (figura 8).
La disminución de la RVS se atribuye al cambio en la viscosidad sanguínea y al efecto vasodilatador de los mediadores infamatorios asociados a la hipoxia tisular.
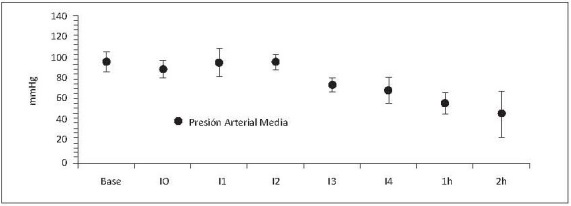
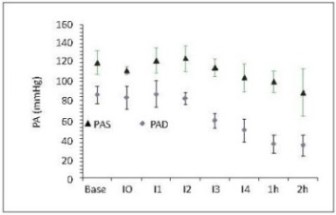
Figura 7. (a) Presión arterial media (mmHg) respecto al tiempo. (b) Presión arterial sistólica (PAS) y diastólica (PAD) respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20,N22,N23.
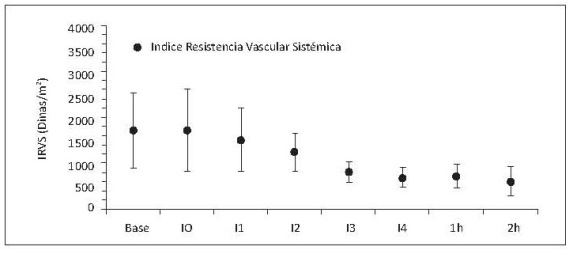
Figura 8. Índice de resistencia vascular sistémica (RVS/m2 ) respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20 y N22 a N23.
HALLAZGOS METABOLISMO O2
1. Estado ácido-base.
Se observó alcalosis marcada presente durante los 4 niveles de intercambio (I1-I4) secundaria a la hiperventilación que posteriormente cae durante las 2 horas después de I4 (figura 9a). En las fases finales (1h-2h) se presentó acidosis metabólica (figura 9b) secundaria a la hipoxia tisular.
2. Marcadores de Hipoxia tisular
Los marcadores de hipoxia tisular se observaron significativamente aumentados durante las 2 horas posteriores al último intercambio (figura 10).
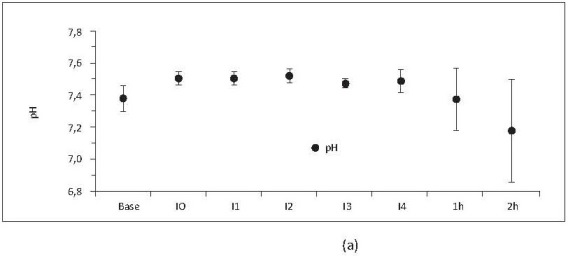
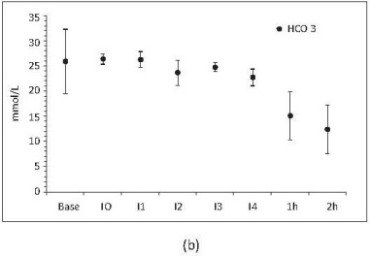
Figura 9. (a) pH respecto al tiempo. (b) HCO3- respecto al tiempo. Base, medición basal; I0, medición consciente 2 horas después de instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h, 1 hora después del intercambio 4; 2h, 2 horas después del intercambio 4. Valores en media +/- desviación estándar. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20 y N22 a N23.
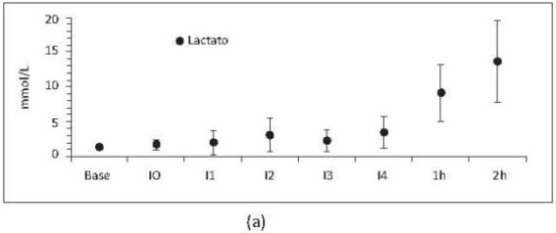
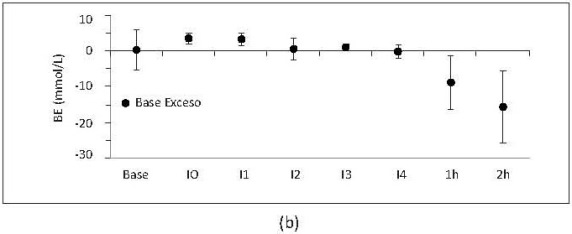
Figura 10. Lactato (a) y base exceso (b) respecto al tiempo. Los valores son medias +/- desviación estándar. Se incluyen porcinos de N15 a N23. Base, medición basal; I0, medición consciente 2 horas después de la instrumentación; I1, intercambio 1; I2, intercambio 2; I3, intercambio 3; I4, intercambio 4; 1h y 2h, 1 y 2 horas después de intercambio 4. Incluye porcinos de 16 Kg que sobreviven 4 intercambios N17, N19, N20 y N22 a N23.
CONCLUSIONES
Se obtuvo un modelo experimental de Hemodilución Normovolémica extrema en porcinos conscientes para ser implementado en la evaluación de diferentes soluciones de reanimación. Este modelo permite la evaluación del hemosustituto en una especie animal mayor, provee un mejor escenario para la determinación del transporte de oxígeno de un hemosustituto in vivo, y para la medición de variables secundarias a la hipoperfusión tisular y la posible intervención del PFC. Al realizar el modelo en los animales conscientes se disminuyen las variables de confusión como la anestesia y se obtienen valores más cercanos a la realidad. El modelo se debe realizar en porcinos de más de 16 kg de peso. Se deben realizar 4 hemodiluciones del 40% de la volemia de los porcinos y esperar 2 horas adicionales para evidenciar un claro aumento de los marcadores de hipoxia tisular. La técnica de inserción de los catéteres por disección y el protocolo anestesia intravenosa están definidos, así como el volumen, el nivel y el tiempo de los intercambios. Aunque la mayoría de porcinos se utilizaron para establecer el modelo, la metodología se está implementando y se han obtenido resultados hemodinámicos y metabólicos preliminares que incluyen: marcada hipoxia tisular con Hb <3g/dl y a las 2 horas, luego del último intercambio, aumento de frecuencia cardíaca y del gasto cardíaco, presiones arteriales sistémicas divergentes, aporte de oxígeno y resistencia vascular sistémica disminuidas. Se requiere continuar la implementación del modelo para mejorar el conocimiento de este escenario que permita una mejor interpretación de los resultados cuando se administre la emulsión de PFC. Este modelo de hemodilución es la base actual de experimentación animal para la evaluación de hemosustitutos en el Grupo de Ingeniería Biomédica de la Universidad de los Andes y la Fundación Cardioinfantil.
REFERENCIAS BIBLIOGRÁFICAS
[1] M. Peden, G. Sharma. The injury chart book: a graphical overview of the global burden of injuries. Geneva: World Health Organization, 2002.pp 34-46. [ Links ]
[2] L .Forero, J. González, Forensis Datos para la vida. Bogotá: Instituto Nacional de Medicina Legal y Ciencias Forenses, 2007. [ Links ]
[3] D. Kauvar, R. Lefering, C. Wade. "Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations". J Trauma, June 2006, Vol., 60 Suppl:S3, pp.11 [ Links ]
[4] J. Mantilla, J. Puentes, "Hemorragia y trauma, avances del estudio Crash 2 en Colombia. Hemorragia y trauma". Revista Colombiana de Cirugía Vol., 24 No. 3 July/Sept. 2009, pp.175-83 [ Links ]
[5] C. Ordoñez. Cuidados intensivos y Trauma. Bogotá: Distribuna, 2002, pp. 3-44 [ Links ]
[6] Cheryl H, Keith R. "The evaluation and management of shock" Clinics in Chest Medicine Vol., 24 Nov, 2003, pp. 775– 789 [ Links ]
[7] B. Spiess, R. Counts. "Capítulo 10" En Perioperative transfusión medicine. New York: Williams and Wilkings, 1998, pp.157-168 [ Links ]
[8] "Risk of Blood transfusion". US department of Health. National heart lung and blood institute. Fecha de consulta: 29 de marzo de 2011, Disponible: http://www.nhlbi.nih.gov/health/dci/Diseases/bt/bt_risk.html. [ Links ]
[9] J. Riess, Oxygen Carriers, Raison dEtre, Chemistry, and Some Physiology. Chem.Rev. Vol.,101 No. 9, 2001, pp. 2797-2920 [ Links ]
[10] A. Ayala, P. Wang. "Shock Models: Hemorrhage". Surgical Research Vo1., 116 No. 6 December, 2002 pp.330. [ Links ]
[11] I. Rincón, J. Briceño. "Effects of Ringers lactate and oxyfluor as resuscitative fluids in a model of hemorrhagic shock in the rabbit" ASAIO Transactions Vol., 42 No. 2 April, 1997, pp.24-47 [ Links ]
[12] A. Silva, T. Gardeázabal, J. Briceño (noviembre 2007) "Evaluación en un modelo animal de hemodilución normovolémica de un nuevo hemosustituto transportador de oxigeno basado en perfluorocarbonos: efectos de la viscosidad, osmolaridad, y concentracion del perfluorocarbono en la emulsion" Presentado en: Día de la investigación de la Fundación Cardioinfantil. [ Links ]
[13] T. Gardeazabal, J. Briceno, "Advances on manufacturing and in vivo evaluation of PFC-based oxygen carriers" ASAIO Journal. Vol., 52 No. 2 March, 2006, pp. 60A. [ Links ]
[14] I. Rincón, J. Briceño. "Implementation of a model of hemorrhagic shock for evaluation of the safety of use of oxygen-carrying hemosubstitutes". ASAIO Transactions Vol., 42 No. 2 March, 1996 pp.1-132 [ Links ]
[15] D. Pachón. Reanimación hipotensiva en choque hemorrágico de porcinos. Tesis de pregrado. Universidad de los Andes: Bogotá, 2009. [ Links ]
[16] J. Pérez. Estandarización e implementación de un modelo animal experimental para la evaluación de un hemosustituto basado en perfluorocarbono. Tesis Maestría. Universidad de los Andes. Bogotá, 2010. [ Links ]
[17] T. Monk. "Acute Normovolemic Hemodilution". Anesthesiology Clin. Vol., 23 No. 6 June, 2005, (s1): s9-s15 [ Links ]
[18] S. Jones, C. Whitten. "Influence of Crystalloid and Colloid Replacement Solutions on Hemodynamic Variables During Acute Normovolemic Hemodilution" Journal of Clinical Anesthesia Vol., 16 No. 1 2004, pp.11–17. [ Links ]
[19] A. Pape. "Hyperoxic ventilation increases the tolerance of acute normovolemic anemia in anesthetized pigs". Crit Care Med Vol., 34 No. 5 2006, pp. 23-45. [ Links ]
[20] R. Weiskopf, M. Viele. "Human cardiovascular and metabolic response to acute, severe isovolemic anemia" JAMA Vol., 279 No. 3 January, 1998, pp. 217– 21. [ Links ]













