Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de Ingeniería
versão impressa ISSN 0121-4993
rev.ing. no.37 Bogotá jul./dez. 2012
Estudio de ventajas energéticas en un proceso de destilación reactiva por método de flujos internos y externos
Study of Energetic Advantage in a Reactive Distillation Process Using Internal and External Streams Method
Diana Catalina Cubides Román(1)*,Carlos Ariel Cardona Alzate(2)*,Yu A. Pisarenko(3)
(1) M.Sc en Ingeniería Química. Estudiante de doctorado Universidade Estadual do Norte Fluminense Darcy Ribero. Río de Janeiro, Brasil. dianacubides@yahoo.com
(2) Ph.D. en Ingeniería Química. Profesor Asociado. ccardonaal@unal.edu.co
(3) Ph.D. en Ingeniería Química. Academia Estatal de Tecnología Química Lomonosov. Moscú, Rusia. Pisarenko_yu@mail.ru
(*) Universidad Nacional de Colombia, Sede Manizales. Manizales, Colombia.
Recibido 31 de octubre de 2011, aprobado 16 de noviembre de 2012.
Palabras claves
Destilación, energía, metodología, reacciones químicas.
Resumen
Este trabajo desarrolla un método para comparar los gastos energéticos entre las confguraciones secuencial (reacción¬separación) y simultánea (destilación reactiva), analizando los fujos internos y externos de un proceso. Como ejemplo se utilizó una reacción tipo: A + B ⇄ C + D; con temperaturas de saturación: TC σ < TA σ < TB σ < TD σ. Los resultados son discutidos analizando las curvas de residuo del caso industrial de trans-esterificación de acetato de metilo con formiato de propilo formando acetato de propilo y formiato de metilo. De esta manera se demostró científicamente la ventaja de la destilación reactiva sobre los procesos convencionales para este tipo de procesos.
Key words
Chemical reactions, distillation, energy, methodology.
Abstract
This work develops a method to compare the energy expenses between sequential (reactionseparation) and simultaneous (reactive distillation) configurations, analyzing the internal and external process fows. As example was used the reaction of the type: A + B ⇄ C + D; with saturation temperatures : TC σ < TA σ < TB σ < TD σ. The results are discussed based on the residual curves for the industrial case of trans-esterification of methyl acetate with propyl formiate to obtain propyl acetate and methyl formiate.
INTRODUCCIÓN
Durante los últimos años ha habido un gran auge de publicaciones de procesos integrados reacción y separación simultáneas, especialmente en la destilación reactiva. Sin embargo, el desarrollo de métodos rápidos que permitan realizar comparaciones es un área que aún no ha sido extensamente desarrollada a pesar de sus beneficios explícitos.
Algunas comparaciones entre los procesos tradicionales de reacción seguida de separación con los simultáneos (en este caso destilación reactiva) han sido realizadas con base en el número de unidades [1, 2], analizando los procesos en estado estacionario [3, 4, 5, 6 y 7] y el costo óptimo total anual (incluyendo equipos) para un proceso de isomerización A⇄B [8]. También se consideraron los gastos energéticos para una reacción tipo A⇄B, con A menos volátil que B [9] y con A más volátil que B [13]. En algunos casos, para comparar los procesos simultáneos con los consecutivos, éstos se deben modelar, simular e, incluso, hacer pruebas a nivel piloto. Este procedimiento resulta inconveniente por los tiempos, costos y, además, no necesariamente arrojará resultados óptimos. Esto incentiva la búsqueda de alternativas que, basadas en la teoría, comparen procesos en función de los parámetros de salida más importantes.
En aras de contribuir al desarrollo sostenible, la comparación de gastos energéticos no es necesariamente el único punto de comparación, –aunque sí el más común–. A nivel integral se deberían incluir parámetros como impactos ecológicos, sociales, etc., que, por lo general, necesitan cálculos finales. Un ejemplo de este tipo de comparación puede ser encontrado en [12].
A partir de un ejemplo [11, 13] se desarrolló un procedimiento que utiliza balances de materia y considera la relación directa entre los gastos energéticos y los fujos internos y externos. En la generalización de este procedimiento se propone utilizar una serie de pasos que dependen del tipo de reacción y de las temperaturas de ebullición. Las expresiones que se obtienen permiten comparar cualitativamente los gastos energéticos en función de la fracción molar en fase vapor, con diferentes valores para la relación entre las constantes inversas y directas de reacción.
MÉTODO DE FLUJOS INTERNOS Y EXTERNOS
El objetivo de este método es desarrollar expresiones matemáticas a partir de balances de masa que relacionen las fracciones molares de productos con el volumen de reactor y los reflujos, y por lo tanto, con los gastos energéticos. En el caso de la destilación reactiva, incluimos la ecuación de equilibrio de fases y consideramos efectividad infinita de separación de la columna, mezcla zeotrópica (sin azeótropos), curva de equilibrio fásico convexa y composición en el plato de alimentación igual a la composición de alimentación.
La expresión final de los gastos energéticos (S) varia con el tipo de reacción, las distribuciones de volatilidades relativas y, en consecuencia, los diagramas de proceso. Además, relaciona el reciclo externo (R) y el reflujo (l) con los fujos de alimentación, el volumen de reactor y las constantes de velocidad de reacción directa e inversa (en el caso de reacciones reversibles).
Para obtener las expresiones que serán comparadas se siguen las siguientes etapas:
1. Considerar los gastos energéticos totales como la suma del reciclo externo y reflujo:

2. Plantear los esquemas de proceso para los procesos secuencial y de destilación reactiva de acuerdo con las presiones de vapor de las sustancias involucradas; considerar el reflujo de reactivos recuperados en la salida.
3. Realizar los balances de materia globales y por componente en estado estacionario.
a. Secuencial: mezclador, reactor y torre de separación.
b. Simultáneo: mezclador, plato de reacción, zona de agotamiento y/o enriquecimiento.
Se obtienen 3C balances en cada caso, donde C es el número de sustancias involucradas. Los balances por componente en el reactor o en el plato de reacción involucran la velocidad de reacción (aparición de productos o desaparición de reactivos), además cuando el proceso es simultáneo el equilibrio fásico es una ecuación adicional.
4. Definir la alimentación como una mezcla de reactivos puros.
5. Con base en el esquema, realizar un balance para reactivos en la zona de la columna (rectificación o agotamiento) desde donde sale la recirculación, la expresión debe estar en términos del reciclo interno (l) como función de la recirculación (R) con sus respectivas fracciones molares de líquido y de vapor.
6. Con los balances de materia y las especificaciones definidas obtener una expresión que relacione la fracción molar de líquido en función del fujo de alimentación, el volumen de reacción, la recirculación y las constantes de reacción inversa y directa (en algunos casos también se necesita la expresión de la fracción molar de líquido en la recirculación).
7. Finalmente se reemplazan las ecuaciones que se obtienen en el paso 6 para obtener el reflujo interno que puede ser sustituido en la ecuación de gastos energéticos (1). Para el proceso simultáneo se obtiene una expresión que relaciona el reciclo (R) con el fujo de alimentación, el volumen de reacción, las constantes de reacción inversas y directas y la fracción molar de vapor.
Los gastos energéticos están asociados a la cantidad de flujo, que representan las corrientes de recirculación o reflujo, y por lo tanto las unidades son las mismas de los fujos. Esta relación directa (a mayor reciclo o reflujo, mayores gastos, las expresiones molares serán usadas de aquí en adelante como "gastos energéticos"). La comparación con este método debe ser realizada desde un punto de vista cualitativo por la estructura de las ecuaciones obtenidas, y debido al tipo de esquemas tecnológicos de los que se parte.
UTILIZACIÓN DEL MÉTODO DE FLUJOS INTERNOS Y EXTERNOS CON LA REACCIÓN A+B ⇄ C+D
Primero se parte de la ecuación de velocidad de reacción como r = k+ x1A x1B - k- x1C x1D y considerando: x1A = x1B; x1C = x1D; x1A + x1B + x1C + x1D = 1, se obtiene:

Para plantear los esquemas tecnológicos para esta reacción es necesario definir la distribución de temperaturas de saturación con la que se va a trabajar, considerando el caso industrial con que se corroboran los resultados, las temperaturas de saturación son:TC σ < TA σ < TB σ < TD σ.
Proceso secuencial
Considerando los productos con temperaturas de saturación extremas se plantea el esquema de la figura 1.a, donde la recirculación de reactivos al reactor se toma de una parte intermedia de la torre de separación.
Figura 1 (a)Diagrama esquemátco del proceso secuencial para una reacción tipo A+B ⇄ C+D con distribución de temperaturas de saturación TC σ < TA σ < TB σ < TD σ (b)Esquema de la zona de agotamiento de la columna..
F es el flujo de alimentación al sistema, R es el flujo de recirculación a la corriente que entra al reactor, G es la corriente resultante de F y R, L es el flujo que sale del reactor y entra a la columna, W es la corriente de salida fondos, D la de destilados, l es el reflujo interno de la columna xji es la fracción molar de líquido en la corriente j para i.
Con base en la figura 1. se realizaron los siguientes balances:

Teniendo en cuenta la figura 1.a se extrae el esquema de la zona de rectificación, Figura 1.b, que es la base para realizar el balance para reactivos en esta zona

Sumando las ecuaciones se (15) y (16) y despejando l se obtiene

Sustituyendo en la ecuación de gastos energéticos y reorga-nizando:
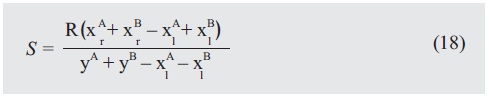
Ahora es necesario hacer algunas consideraciones: Aumento constante del reciclo hasta alcanzar estado estable, ausencia de reactivos en las corrientes de fondos y destilado xAw+ x Bw+ +xAD+xBD = 0 y alimentación pura con recirculación solo de reactivos xAg + xBg = 1.
De la ecuación (8) con (3), (2), las condiciones mencionadas y resolviendo la ecuación para x1A:
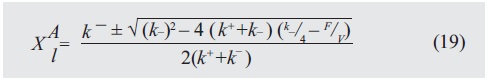
Con (7) y (8) es posible obtener una expresión para xrA , que se considera igual a xrB.
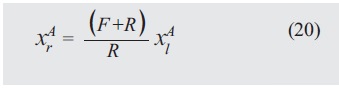
Sustituyendo (19) en (20):
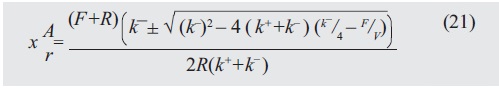
La expresión para comparar se obtiene sustituyendo (19) y (21) en los gastos energéticos (1):

Proceso simultáneo
Para la configuración y distribución de temperaturas de saturación que se está analizando se planteó el esquema de la figura 2, en el cual se observa que la zona de reacción se encuentra en una etapa intermedia de la torre y que en este caso se considera la misma etapa de alimentación.
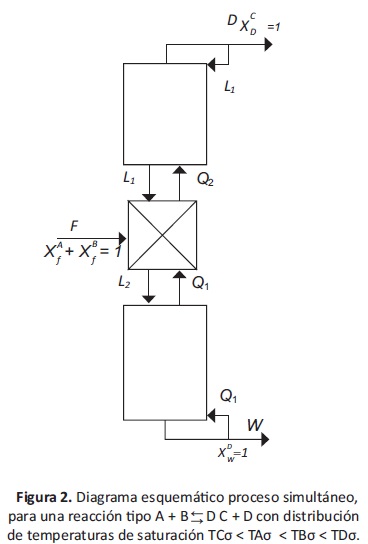
Donde F es el flujo de alimentación al sistema, Li las corrientes de líquido que circulan dentro de la torre, Qi son los flujos de vapor que dentro de la torre. W es la corriente de salida fondos, D es la de destilados y xij es la fracción molar de líquido en la corriente j para la i.
Los balances realizados de acuerdo con este esquema son:


Las condiciones a considerar son: conversión total, XAD = XBD = XAW = XBW = 0 todo el C producido sale por destilados, XCD = 1; todo el D producido sale por fondos, XDW = 1; alimentación de solo reactivos, XAƒ+ XBƒ=1; conservación de materia F=D+W. Considerando los gastos energéticos; como:

Con las condiciones, la velocidad de reacción y los balances de materia se obtiene:

Para obtener XA1 partiendo de la ecuación

Sustituyendo XA1 en la ecuación (37) y despejando W

y sustituyendo en (36) se obtiene la expresión de los gastos energéticos:
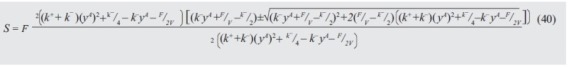
Para realizar una comparación gráfica de las dos expresiones obtenidas (22 y 40) con respecto a los gastos energéticos S, variamos los valores de la fracción molar en fase vapor en la torre (de 0 a 1) y usamos 4 valores diferentes de la relación entre las constantes de velocidad de reacción directa e inversa (k+, k-, ). Los valores asignados fijos fueron: la corriente de reflujo R=100, el volumen de reactor V= 5, y el flujo de alimentación F=100. La figura 3.a para el proceso secuencial y la figura 3.b para el simultáneo permiten comparar cuál proceso tiene menores gastos energéticos al aumentar o disminuir la composición de la fracción vaporizada.
Figura 3 Gastos energéticos en función de la fracción molar de vapor para la A+B ⇄ C+D con temperaturas de saturación TC σ < TA σ < TB σ < TD σ. y valores de k+/k-, [0.01, 1, 10, 100]. (a) Proceso secuencial (b)Proceso simultáneo.
DISCUSIÓN DE UN CASO INDUSTRIAL
A continuación se utilizan los resultados antes obtenidos en función del proceso de de trans-esterificación de acetato de metilo con formiato de propilo para obtener acetato de pro-pilo y formiato de metilo. La reacción de trans-esterificación que se usa en la industria es:
CH3COOCH3 + HCOOC3H7 ⇄ HCOOCH3 + CH3COOC3H7
Donde las formulas químicas y temperaturas de ebullición se presentan en la tabla 1. Se cumple la distribución de temperaturas de saturación antes utilizada: TC σ < TA σ < TB σ < TD σ. y corresponde al tipo de reacción A+B ⇄ C+D.
Debido a que las sustancias son homólogas, el sistema es ideal y no presenta azeotropía como fue demostrado en [15].
Tabla 1 Fórmulas y temperaturas de ebullición normal para las sustancias involucradas en la producción de acetato de propilo por transesterificación
La constante de equilibrio de esta reacción es cercana a 1 y no depende de la temperatura [14]. Partiendo de una mezcla inicial estequiométrica de reactivos se logra solo una conversión de equilibrio de 0,5 en un reactor convencional.
El diagrama de fases se muestra en la figura 4.a, donde las líneas de destilación abierta salen del formiato de metilo (nodo inestable) y llegan al acetato de propilo (nodo estable), lo que permite concluir que existe gran facilidad para obtenerlos como destilado y fondos respectivamente; mientras que, en el caso del punto de sustancia pura de acetato de metilo y formiato de propilo, se comportan como sillas, pues las líneas de destilación abierta nunca llegan a tocarlos y por lo tanto no es posible separarlos totalmente.
Este caso fue sintetizado en [14] y el análisis de la estática sobre el que se basó el diseño demostró la posibilidad de alcanzar los estados estables con conversión cercana a 98% (figura 4.b). El proceso industrial sintetizado por Balashov [14] –el esquema tecnológico más conveniente– es un proceso de destilación reactiva que se resume en la figura 4.c.
Figura 4. [a] Diagrama de fases [b] Esquema de líneas de interacción química y trayectoria tentativa [c] Esquema tecnológico de destlación reactiva para la transesterificación de acetato de metilo con formiato de propilo para obtener acetato de propilo y formiato de metilo.
CONCLUSIONES
La figura 3. obtenida con los métodos de flujos internos y externos muestra cómo la configuración simultánea es más conveniente desde el punto de vista energético, con la reacción A+B ⇄ C+D y distribución de temperaturas de saturación TC σ < TA σ < TB σ < TD σ , con cualquiera de los cinco valores de relación de las constantes de velocidad (k+, k-, ) encontrando diferencias entre los valores de hasta 10. Se observa que, con el aumento de las constantes de velocidad, los gastos energéticos aumentan y, que a su vez, una mayor fracción molar de vapor disminuye los gastos energéticos en el porceso secuencial, mientras que en el paso simultáneo, aumenta (nunca llegando a ser del mismo orden).
Por otro lado, en el análisis de la estática de la reacción de trans-esterificación de acetato de metilo con formiato de propilo se concluye que usar la destilación reactiva es la mejor opción pues posibilita la obtención del acetato de propilo y formiato de metilo como productos puros, lo que puede interpretarse como un menor consumo energético en función de los rendimientos.
Considerando la naturaleza diferente de los métodos y las consideraciones hechas, podemos concluir que ambas metodologías son útiles para determinar la conveniencia o no de una reacción con distribuciones de temperaturas de saturación específicas. El procedimiento seguido en el método de flujos internos, para el ejemplo desarrollado, sirve como base para encontrar expresiones que permitan analizar otros tipos de reacción (diferentes cantidad de reactivos / productos y valores de las constantes de distribución) y temperaturas de saturación.
AGRADECIMIENTOS
Dirección de Investigaciones Universidad Nacional de Colombia sede Manizales por la financiación de la Investigación CFIA-116 "Aplicación de la Destilación Reactiva en Colombia. Producción de Acetatos y Aditivos Oxigenantes".
REFERENCIAS BIBLIOGRÁFICAS
[1] M.F. Malone, M.F. Doherty, G. Buzad. "Reactive Distillation by Design". Trans. IchemE, Vol. 70 Part A, 1992, pp. 448 - 458 [ Links ]
[2] M.F. Malone, M.F. Doherty. "Reactive Distillation". Industrial Engineering Chemical Research. Vol. 39 No. 1 Nov, 2000, pp. 3953 - 3957 [ Links ]
[3] Y.A. Pisarenko, L.A. Serafmov, C.A. Cardona. "Optimization of Reactive Distillation Process". Theoretical Foundations Of Chemical Engineering. Vol. 33 No. 5 1999, pp. 455 [ Links ]
[4] L. A. Serafmov, yu. A. Pisarenko. N. N. Kulov. "Coupling chemical reaction with distillation: Thermodynamic analysis and practical applications" Chemical Enginee-ring Science Vol. 54 No. 10 May, 1999, pp. 1383 - 1388 [ Links ]
[5] Yu.A. Pisarenko, L.A. Serafmov, C.A. Cardona, D.L. Efremov, A.S. Shuwalov. "Reactive Distillation Design: Analysis of the Process Statics". Reviews in Chemical Engineering. Vol. 16 No. 2 Jun, 2001, pp. 253 - 327 [ Links ]
[6] M.A. Agudelo, I.C. Paz, C.A. Cardona (2002, jun). "Vinyl acetate production by reactive distillation: analysis of feasible steady states based on the phase and chemical equilibrium". Presentado en: VI Iberoamerican Conference on Phase Equilibria and Fluid Properties for Process Desing. [ Links ]
[7] L.G. Matallana. (2003, jun). "Análisis de la Existencial de Estados Estables Múltiples en la Obtención de Diisopropil Eter por Destilación Reactiva". Presentado en: IV European Congress of Chemical Engineering. [ Links ]
[8] E. Stein, A. Kienle, 1. Gangadwala "Theoretical Methods for the Development of Reactive Distillation Processes" MaxPlanck Institute. Dic 2002. Disponible: http://www.mpimagdeburg.mpg.de/research/ projects/1056/1071/1072 [ Links ]
[9] A.L. Paiva, F.X. Malcata. "Comparison of the Performance of Integrated and Sequential Reaction and Separation Units in Terms of Recovery of a Desired Product". Chemical Engineering Science. Vol. 55 Feb, 2000 pp. 589 - 599 [ Links ]
[10] A.V. Solokhin, S.A. Blagov. "Reactive-Distillation is an Advanced Technique of Reaction Process Operation". Chemical Engineering Science. Vol. 51 No 11 1996, pp. 2559 - 2564. [ Links ]
[11] A.V. Solokhin, S.A. Blagov, V.S. Timofeev. "Analysis Of Energy Expenditures In Systems With Selective Mass Transfer To The Surrounding Medium". Theoretical Foundations of Chemical Engineering. Vol. 31 No. 1 Jan - Feb 1997, pp. 49 - 54 [ Links ]
[12]V.F. Marulanda, C.A. Cardona. (2003, Sep). "Análisis del Impacto Ambiental Generado en las Tecnologías para la Producción de Butilacetato". Presentado en: IV European Congress of Chemical Engineering. [ Links ]
[13]A.V. Solokhin, S.A. Blagov, V.S. Timofeev. "Análisis Comparativo del Sistema Reactor-Columna y Destilación Reactiva con Base en los Gastos Energéticos". 1995. Trad. Carlos Ariel Cardona. Universidad Nacional de Colombia. Sede Manizales. 2002 [ Links ]
[14]M.I. Balashov. "Physico-chemical Fundaments and Technological Principles for Reactive Distillation Process Organization", DSc Dissertation (Lomonosov Institute of Fine Chemical Technology Moscow). 1980 [ Links ]
[15] Y. Pisarenko, C.A. Cardona, L.A. Serafmov. "Reactive Distillation Processes. Advances in Research and Practical Application". Moscú Ed. Lutich, 2000, pp. 268 [ Links ]













