Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.15 no.2 Bogotá July/dic. 2007
ARTÍCULO
CULTIVO DE CÉLULAS DE LINAJE OSTEOGÉNICO DE PERIOSTIO DE PORCINO PARA LA EVALUACIÓN DE UN BIOMATERIAL OSTEOGENIC CELL CULTURE FROM PORCIN PERIOSTEUM FOR BIOMATERIAL EVALUATION LINA M. DÍAZ, Biólogaa, MARIEN VILLAMIL, Microbiólogaa, CLAUDIA L. BERNAL, Bacteriólogaa, MARTHA L. TORRES, Microbióloga, M.Sca, JAMUNA, K. THEVI, Ciencia de Materialesb, FADZIL A. ZAKARIA, Ciencia de Materiales, Ph.D. b Y JOSÉ F. MIKÁN, Biólogo, Ph. D.a a Grupo de Biotecnología en Salud, Laboratorio de Investigaciones, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia. * Correspondencia: jfmikan@umng.edu.co. Dirección Postal: Transversal 3 No 49-00 Bogotá, Colombia. fadzil@sirim.my. Postal address: Lot 34 Jalan Hi-Tech 2/3, Kulim Hi-Tech Park, 09000 Kulim, Kedah, Malaysia. El objetivo del presente trabajo fue establecer un cultivo de células osteoprogenitoras de porcino para el estudio de la diferenciación de osteoblastos en un material híbrido de apatita carbonatada, CAp (patente en proceso No. PI 20042321 preparado en AMREC-SIRIM Berhad) y células autólogas, que en el futuro pueda ser empleado como un material para injertos óseos. A partir de la digestión enzimática de periostio de huesos de fetos porcinos se obtuvieron células que se cultivaron con y sin factores de diferenciación y para verificar formación de tejido osteogénico, se realizaron pruebas bioquímicas y moleculares. Se sembraron células sobre CAp de síntesis húmeda y seca y sobre Thermanox (Th) como control. Por microscopia electrónica de barrido (SEM) se determinó la adherencia y la disposición celular a los materiales utilizados, observándose adherencia y crecimiento celular en los tres soportes utilizados, sin diferencias significativas al comparar los tratamientos y controles. Para confirmar la presencia de calcio en la matriz extracelular se realizó difractometría de rayos X. Los resultados obtenidos indican que estos cultivos expresaron marcadores bioquímicos y moleculares de la línea osteogénica, lo que nos hace pensar que este es un modelo adecuado para estudiar la funcionalidad de un material híbrido de CAp sintética y células osteoprogenitoras autólogas derivadas de periostio. Palabras clave: biomateriales, células madre, periostio, apatita carbonatada. Abstract Key words: biocompatible materials, stem cells, periosteum, carbonate apatite. Introducción La capacidad normal para reparar las fracturas óseas se encuentra alterada con frecuencia en diversas patologías (osteoporosis, fracturas especialmente difíciles, enfermedad periodontal, etc.), al igual que en el envejecimiento. La cirugía reconstructiva para la reparación y corrección de tejido óseo perdido ha llevado a la búsqueda de métodos que faciliten la recuperación de los pacientes que sufren estas afecciones. En ese sentido, la ingeniería de tejidos -o ingeniería celular- aplica los principios de la ingeniería, de la ciencia de materiales y de las ciencias biológicas, en la obtención de sustitutos biológicos que puedan restaurar, mantener, o mejorar la función tisular. Este nuevo campo permite también el diseño de biosoportes para células activas, que controladas con factores de crecimiento, puedan generar nuevos tejidos como cartílago y hueso para la restauración de tejidos dañados. El objetivo principal es buscar células sanas, no inmunogénicas, fáciles de aislar, con alta sensibilidad y rápida respuesta a las señales del ambiente que se puedan inducir in vitro al linaje celular que se requiera y que puedan ser trasplantadas con éxito al paciente; también busca moléculas bioactivas que conduzcan procesos de diferenciación y de maduración celular (1). Una de las estrategias más atractivas trata de conocer el procedimiento de reclutamiento de células progenitoras a partir de células madre pluripotenciales y su posterior amplificación y diferenciación in vitro hacia los distintos tipos de células mesenquimales. La ingeniería de tejidos surgió en parte como respuesta a problemáticas que se presentan en implantes de diferente tipo y básicamente pretende desarrollar materiales híbridos, compuestos de sustratos naturales o sintéticos y de células específicas del tejido en cuestión (1). Las células osteoprogenitoras derivadas de las células madre, ubicadas en la capa interna del periostio, pueden ser responsables de la generación de nuevo tejido óseo cuando se diferencian a osteoblastos. El cultivo de estas células puede ser utilizado para evaluar la viabilidad, osteoconductividad, osteogenicidad y la citotoxicidad de los biomateriales de uso en ingeniería tisular (2). Entre los tratamientos empleados para la reconstrucción ósea están los implantes con biomateriales, definidos como aquellas sustancias que al ser implantadas al tejido adyacente, favorecen e incrementan la formación del tejido óseo (3-5). Los fenómenos determinantes en el proceso de integración de un implante al hueso ocurren en la superficie de contacto entre el implante y el tejido adyacente, denominada laminae limitantes. Se ha observado que cuando se recubre dicha zona de unión con periostio autólogo o alogénico, hay una aceleración en el proceso de reparación, e integración del implante en el tejido óseo (6,7). Entre los materiales sintéticos utilizados como soportes de tejido óseo están aquellos fabricados con fosfatos de calcio, entre ellos la hidroxiapatita cristalina, el fosfato tricálcico, el vidrio cerámico, los cuales son una forma impura de hidroxiapatita (Ca10(PO4)6(OH)2), que incluye carbonato en el cristal como mayor contaminante (2% al 8% en peso) y se asemejan al mineral de huesos y dientes. Se sabe que el carbonato puede ubicarse en dos lugares dentro de los cristales de hidroxiapatita: sitio A, donde substituye iones OH - y sitio B, donde reemplaza iones PO3-4, denominándose apatita carbonatada (8). Dada su mayor similitud con el mineral del hueso, la apatita carbonatada es una de las cerámicas más prometedoras para el reemplazo óseo, ya que al incluir el carbonato dentro del cristal se mejoran, teóricamente, las propiedades de osteoconducción y osteogénesis de las hidroxiapatitas puras que se usan actualmente. La importancia de la presencia del carbonato en el cristal radica en que el material se hace más reactivo con soluciones de fluidos simulados, facilita la formación de material amorfo sobre la cerámica y por consiguiente, facilita la infiltración de los diferentes tipos celulares que residen en el tejido óseo, principalmente osteoblastos y osteoclastos, lo que genera una mejor integración del implante por parte de dicho tejido (5,9). El propósito de este trabajo fue establecer el cultivo in vitro de células provenientes del periostio de fetos porcinos y probar su capacidad osteogénica, para tratar de proporcionar un conocimiento básico que pueda ser aplicado en el diseño de materiales híbridos y específicamente en la caracterización biológica de una apatita-carbonatada (CAp) para futuras aplicaciones en ortopedia y en odontología. Este trabajo se realizó en la Facultad de Medicina de la UMNG (Universidad Militar Nueva Granada), en convenio con AMREC (Advanced Materials Research Centre) -SIRIM Berhad (Standard and Industrial Research Institute of Malaysia). Materiales y métodos Obtención y cultivo de células de periostio. Los procedimientos para la obtención y el cultivo de las células de periostio de fetos porcinos (suministrados por Frigoríficos San Martín de Bogotá) de cuatro a doce semanas de gestación, fueron aprobados por el comité de Ética de la Universidad Militar Nueva Granada. Los procedimientos de extracción de huesos y periostio se basaron en los protocolos reportados en la literatura (10 -16). Luego de la extracción de los huesos (húmeros, fémures, omoplatos y cráneos) se hicieron cortes bajo el estereoscopio para extraer el periostio. Los segmentos de periostio se lavaron con solución de sales balanceadas de Hank (HBSS) más estreptomicina (10 mg)-penicilina (10.000 U) (Sigma cat No P3539) y su digestión se hizo con colagenasa tipo II (100 U por ml en HBSS) (Gibco cat No 17101-015) en agitación a 37º C durante una ó dos horas. Como control se utilizaron células obtenidas de los segmentos de periostio a los que se les realizó el mismo tratamiento pero sin colagenasa. Este procedimiento se repitió seis veces. El cultivo se hizo a una concentración de 2x104 células por cm2 en el medio 60/40 el cual está compuesto por 60% de medio Dulbeco modificado por Eagle (DMEM) (Gifco cat No 31600-026) y 40% (v/v) de medio completo con trazas de elementos (MCDB-201) (Sigma cat No M6770), más 10% de suero fetal bovino (SFB) (v/v) y se incubó a 37º C en atmósfera húmeda y 5% de CO2. Al tercer día de cultivo se eliminaron las células no adherentes y se hicieron recambios semanales con medio suplementado con SFB, cuya concentración se disminuyó gradualmente hasta llegar al 2% (v/v). Cuando se alcanzó una confluencia de células del 70% se hicieron subcultivos a los que se les calculó la tasa de proliferación y la viabilidad. Duplicación de la población. La duplicación de la población se determinó sembrando 1,7x103 células por cm2 en placas de 24 pozos por triplicado con medio 60/40 suplementado con factores de diferenciación osteogénica (1 x 10-8 M de dexametasona (Dex) y 50 μΜ de L-ascorbato-2 fosfato y con medio 60/40 sin estos factores. Su evaluación y la determinación de la viabilidad celular se hicieron en los días 8, 15 y 23 del cultivo, con azul tripán. La duplicación de la población (n) se calculó utilizando la ecuación:
b Biomaterials Programme, Advanced Materials Research Centre (AMREC), SIRIM Berhad.
Resumen
en donde N es el número de células sembradas en el tiempo cero y NH es el número de células en los diferentes tiempos (16-18). La tasa de multiplicación o número de generaciones por unidad de tiempo (r), la cual es expresada como duplicación de la población a las 24 horas, se calculó con la ecuación:
Criopreservación. El pellet de células provenientes de cultivo se reconstituyó en una solución de criopreservación compuesta por 10% de N-Dimetil sulfoxido (DMSO), 50% de SFB y 40% de medio 60/40 (60% DMEM - 40% MCDB-201). Los criotubos se dejaron durante 24 h a -70ºC y luego se almacenaron en nitrógeno líquido.
Diferenciación osteogénica. Las condiciones utilizadas en el ensayo para determinar la diferenciación osteogénica se tomaron de la literatura (15,19-21) y se modificaron en nuestro laboratorio. Se sembraron 96 pozos por triplicado con 3x103 células; 48 pozos con medio 60/40 más 10-8 M de Dex y 50 μM de L-ascorbato-2 fosfato y 48 pozos sólo con medio 60/40. Los cultivos se incubaron por 23 días a 37º C con cambios semanales de medio. A las células de los días cero, ocho, quince y 23 se les determinaron los marcadores bioquímicos y moleculares (22-23).
Determinación de marcadores bioquímicos y moleculares. La actividad de la fosfatasa alcalina (ALP) se midió cuantitativamente por el método reportado en 1998 por Solchaga y col. (15), que se basa en el principio de la reacción enzimática cuantificable del p-nitrofenilfosfato como sustrato cromogénico soluble, del cual se libera p-nitrofenol por la acción de la enzima. La determinación cualitativa se realizó utilizando el método descrito por en 1999 por Encina y col. (24), que se basa en la observación de un precipitado rojo del complejo Naftol-AS-MX y fast violet B en los cultivos positivos para la actividad enzimática. Para determinar la mineralización de la matriz extracelular se cuantificó el contenido de calcio por colorimetría (método del complejo calcio-O-cresolftaleína) (25, 26) y para determinar cualitativamente los depósitos de calcio se utilizó la técnica de von Kossa, que se basa en la formación de precipitados de plata sobre áreas donde se encuentra fosfato de calcio (15,25, 27).
Para la detección de la expresión de los genes específicos de la línea osteogénica como son los de osteocalcina, osteopontina, runx2 y osterix (osx) se utilizó la técnica de trascripción inversa (iniciadores oligo-dT, SuperScrip II Reverse Transcriptase) y la reacción en cadena de la polimerasa (RT-PCR) (21, 26, 28, 29). En la RT se siguieron las recomendaciones del fabricante de la enzima empleada (INVITROGEN cat No. 18064-022).
Para el diseño de los iniciadores usados se realizó un alineamiento de secuencias humanas y de otros mamíferos con el programa de alineamiento de secuencias múltiple "Clustal W" (biology work bench en: http://workbench.sdssc.edu (Tabla 1).
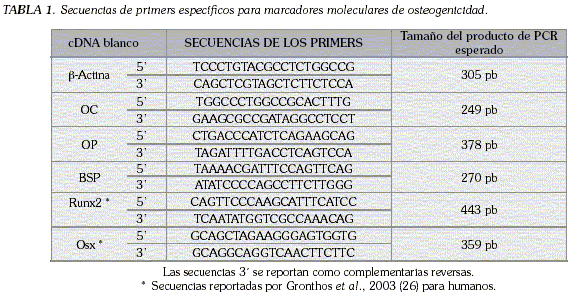
Como control positivo de la expresión de dichos genes se usó la línea celular de osteoblastos humanos obtenida de la ATCC referencia CRL-11372 (American Type Culture Colection) y como control del cADN se amplificó el gen de la β-actina. La extracción de cADN se hizo por el método de trizol (Gibco-BRL Life Technologies cat No.15526). Para estandarizar las condiciones de la PCR en el laboratorio se utilizó el cADN de las células CRL-11372 incubadas en condiciones de diferenciación.
Ensayos de adhesión y proliferación celular sobre apatita carbonatada (CAp). Estos ensayos se hicieron en el Instituto de Investigaciones Médicas de Malasia (IMR). Se utilizaron por cada pozo de 1,76 cm2, células de periostio cultivadas sobre dos piezas de CAp de 0,4 x 0,3 x 0,1cm (patente en proceso No. PI 20042321 preparado en AMREC-SIRIM Berhad) fabricada por síntesis húmeda por el método convencional de precipitación a partir de soluciones acuosas (F), o por síntesis seca por reacción del estado sólido (J), y como control, células cultivadas sobre láminas de Thermanox® (Th) Plastic Coverslips EMS (Catalog No 72274) (dos láminas por pozo cortadas a las mismas dimensiones). Para la adherencia celular se sembraron 5 x 104 células por cm2 por pozo, con medio sin factores de diferenciación en cajas de 24 pozos y se incubaron por tres días. Para la proliferación celular se sembraron 1 x 104 células por cm2 por pozo y se incubaron por 16 días bajo las condiciones ya mencionadas. Las células se separaron de los materiales utilizados por tripsinización, se contaron en cámara de Neubauer y finalmente se calculó el número de células por cm2 de material. Estos procedimientos se repitieron cinco veces.
Microscopía electrónica de barrido. Se realizó microscopia electrónica de barrido a las células de periostio de fetos de porcino por el método reportado por Hing y col. (30).
Espectrometría de rayos X. Para la espectrometría de rayos X se utilizó el microscopio electrónico LEO 1525-12-95, que permite la determinación de la composición química del material prueba (la matriz extracelular de las células que crecieron sobre apatita carbonatada), en áreas de aproximadamente 1 nm2.
Análisis estadístico. Los análisis se realizaron empleando el programa R© versión 2.1.1. Se realizó análisis de varianza (ANOVA) y análisis de varianza para estructuras factoriales, utilizando un intervalo de confianza de μ±1-α( σ/¡revisar!Ön), para un α del 0,05. En los casos de significancia se aplicó el test de comparación múltiple de Tukey.
Resultados
Obtención y cultivo de células de periostio. En los cultivos de células provenientes de los fetos de diferentes semanas de gestación se observaron diferencias en la cantidad de células extraídas, en la morfología y en el porcentaje de viabilidad. Se obtuvo un mayor número de células a las dos horas de digestión y no se observaron diferencias en su morfología entre los dos tiempos utilizados. La población celular obtenida presentó heterogeneidad en cuanto a morfología, tamaño y capacidad de adhesión a los platos de cultivo. Se observó adhesión de células a las 24 horas de cultivo, pero la homogeneidad en tamaño y morfología se alcanzó a los siete días de cultivo. En los primeros subcultivos (pasaje uno al tres) la morfología de las células fue fibroblastoide. Después del tercer subcultivo, con más de dos semanas de incubación en la misma placa, se observó un cambio de la morfología fibroblastoide a semicuboidal, triangular o estrellada, característica de células en diferenciación. La viabilidad de las células obtenidas de los explantes fue 77% y la de los cultivos establecidos fue del 93% al 98%, datos que concuerdan con otros reportes (16). Las células obtenidas de cráneo formaron colonias a los siete días de cultivo, con morfología menos aguzada que la de los otros huesos. Con el fin de trabajar con células de características homogéneas, sólo se emplearon células de húmero, fémur y omoplato en los ensayos de diferenciación. La viabilidad promedio en el momento de la congelación fue de 97,5%, a los siete días de congeladas de 92,5% y a los 120 días de 89%. No se observaron cambios en la morfología de las células después de la congelación. Duplicación de la población. Los valores obtenidos de la duplicación de la población y de la tasa de multiplicación fueron de 3,6 y 0,01 respectivamente, a los 15 días de cultivo. Aunque se observó una tendencia de aumento en la población control, esta no fue significativa (P=0,3691), como tampoco lo fue en los indicadores de la edad de los cultivos in vitro. Ensayos de diferenciación osteogénica. En los días uno a ocho del ensayo se observó una pequeña monocapa en el centro de cada pozo de cultivo, tanto en el control como en el tratamiento. Después de este tiempo las células tratadas empezaron a formar colonias alrededor de la monocapa inicial y en el control, ésta continuó aumentando homogéneamente desde la periferia (Figuras 1A y 1B). Después del día quince se formaron otras capas de células sobre la monocapa inicial en los dos cultivos (Figura 1B). La morfología celular en los dos cultivos cambió gradualmente a través del tiempo, de fibroblastoides a semicuboidales.

Análisis de marcadores bioquímicos y moleculares
Fosfatasa alcalina. La determinación cuantitativa del promedio de actividad ALP mostró una diferencia significativa entre el control y el tratamiento a través del tiempo (análisis de varianza P = 0,002). Se observó que la expresión de ALP es mucho menor en los días cero y ocho que en los días quince y 23 para el tratamiento (prueba de Tukey). La cinética de la expresión de ALP durante 23 días mostró una actividad más alta en el tratamiento que en el control en los días 15 y 23 (Figura 2).

En la determinación cualitativa, en el día cero la coloración fue negativa para los dos cultivos. En los otros tiempos la coloración fue positiva y en mayor proporción para el tratamiento. Las células positivas para ALP generalmente estaban agrupadas en colonias y su morfología era semicuboidal o estrellada (Figura 3).

Mineralización de la matriz extracelular. Se observaron precipitados negros, correspondientes a plata precipitada sobre depósitos de calcio solamente en el día 23 en los dos cultivos (Figura 4). La presencia de dichos precipitados se dio en pocos lugares de cada pozo de cultivo y sólo fueron visibles microscópicamente. No se hallaron diferencias significativas en el número de puntos negros contados en diez áreas distintas de las placas entre el control y el tratamiento (P=0,57), pero sí en los diferentes tiempos (P=0,0082), lo que demuestra que en las células con tratamiento hubo un aumento del contenido de calcio a través del tiempo (Figura 5).


Trascripción revesa y reacción en cadena de la polimerasa (RT-PCR). La expresión del gen runx2 se detectó en los tiempos 8, 15 y 23 en los cultivos tratados y no tratados con factores (Figura 6B), mientras que la del gen osterix sólo se observó en el día ocho del cultivo con tratamiento (Figura 6D). En cuanto a los genes que codifican proteínas de la matriz ósea, se detectó mARN para osteopontina en todos los tiempos en los dos cultivos (Figura 6C) y de osteocalcina, en los días cero, 15 y 23 en las células inducidas (Figura 6E). En la Figura 6A se observa la amplificación de la β-actina.

Ensayos de adhesión y proliferación celular sobre apatita carbonatada. En los ensayos realizados sobre la CAp F, J y sobre Th se observó que en todos hay adherencia y crecimiento de las células de periostio porcino. Se presentó adherencia y crecimiento celular sobre el soporte de CAp independiente de la fabricación, el cual es semejante al obtenido sobre Th. A pesar de que la tasa de duplicación de la población obtenida para el soporte J (0,005) es ligeramente más alta que la de la CAp F (0,004) y el control (0,004), esta diferencia no es significativa en cuanto a la adherencia celular (P=0,047) ni en el crecimiento celular (P=0,913) entre las células cultivadas sobre las dos apatitas (F y J) y sobre Th usado como control (Figura 7A, 7B).
Tampoco hubo una diferencia significativa (P=0,06) en las tasas de multiplicación obtenidas en el día quince del ensayo de duplicación de la población para el cultivo estándar (el control con medio estándar y el tratamiento suplementado con factores de diferenciación) y las obtenidas para el ensayo de crecimiento celular sobre CAp.

Microscopia electrónica de barrido. Las imágenes de microscopia electrónica de barrido (SEM) permitieron comparar detalles de la adherencia y la disposición celular a los dos tipos de CAp y el material control. En este último, las células se extienden formando una sola monocapa, mientras que en los dos tipos de CAp se observan varias capas de células, lo que sugiere un crecimiento tridimensional sobre el material evaluado (Figura 8).

Se pueden apreciar vesículas de secreción en las células cultivadas sobre Th y material particulado en la matriz extracelular de aquellas cultivadas sobre CAp (Figura 9).

Por análisis de espectrometría de rayos-X del material particulado de la matriz extracelular (Figura 10), se obtuvo que la composición de tales partículas secretadas por las células es C, N, O y Ca, lo que esta en concordancia con matriz extracelular calcificada.

Discusión
Se han descrito varios estudios sobre el proceso de reparación de defectos óseos usando células aisladas de periostio, que evidencian que este tejido puede ser fuente de células osteoprogenitoras (12-17). En este trabajo se establece el cultivo de periostio en un modelo porcino, dado que la relación tamaño: volumen de órganos es muy semejante a la del humano (por lo que los ensayos preclínicos se aproximan mejor a los clínicos), con el objetivo de evaluar un biomaterial. La población celular obtenida inicialmente fue heterogénea, dadas las características del tejido (que contenía capa fibrosa y osteogénica) y la posible inclusión de hueso cortical al momento de la incisión, situación que fue reportada por Brownlow y col. (10). Sin embargo, las células con capacidad de adherirse y de proliferar con el tiempo, se seleccionaron con los subcultivos, lográndose un producto final más homogéneo. En cuanto a los cambios morfológicos que se observaron, estos concuerdan con la información reportada en otras investigaciones para el cultivo de periostio en otros organismos (11,12,15,16,20,31,33). De igual manera, también hubo concordancia entre el doblaje poblacional alcanzado en nuestro experimento y los reportados por Spitzer y col., quienes en ensayos con células de conejo alcanzaron un doblaje poblacional de 2,7 y una tasa de multiplicación de 0,011 (16). En el cultivo de las células obtenidas a partir del periostio de cráneo se observaron agrupaciones semejantes a las denominadas "unidades formadoras de colonia semejantes a fibroblasto", característica de los cultivos de células madre mesenquimales (31-35) (Figura 3D). Esto se pudo originar por la presencia de células mesenquimales residentes en las suturas del cráneo fetal, o por la agrupación de las células nódulos de calcificación, tal como se ha reportado para células osteoprogenitoras obtenidas de otras fuentes (15,20). Así mismo, se observó alta viabilidad de las células después de la digestión enzimática del periostio (90,5%) y un efecto no deletéreo con la criopreservación, por lo que sugerimos criopreservar células con pocos pasajes celulares y de poco tiempo en cultivo in vitro (18, 20, 36- 38). Las células inducidas después de ocho días de cultivo mostraron la formación de agrupaciones correspondientes a lo que varios autores llaman nódulos de calcificación, en los que las células comprometidas en osteogénesis se aglomeran antes de iniciar la precipitación de fosfatos de calcio (15,39-41). Las células inducidas también mostraron expresión de ALP significativamente mayor a partir del día quince, lo que coincide con lo descrito en otros trabajos de inducción con células de diferentes orígenes que utilizaron los mismos factores (11,20,43). En ambos cultivos de periostio (inducidos y no inducidos), se observaron precipitados de calcio hasta el día 23, observación que igualmente concuerda con trabajos desarrollados con periostio y médula ósea de diferentes organismos, concomitante con una caída en la actividad ALP (11, 15,17,26). En cuanto a los marcadores moleculares, a partir del día ocho se detectó la expresión del factor de trascripción relacionado a runt (runx2) tanto en cultivos inducidos como no inducidos (como ya se mencionó, el runx2 desencadena y regula la expresión de las proteínas de la matriz ósea). Esta aparente diferenciación celular independiente de inductores podría indicar que las células de periostio de porcino estarían predireccionadas a la línea osteogénica, aunque según los trabajos de Nakashima y col., la expresión de runx2 lo que indica es bipotencialidad, ya que se trata de un factor de trascripción implicado también en la diferenciación de condrocitos, siendo la expresión de osterix, posterior a la de runx2, un indicador más contundente de osteogénesis (44). Nosotros detectamos osterix en las células inducidas en el tiempo ocho, pero en ningún tiempo para las no inducidas. Al respecto se ha sugerido que los factores de trascripción relacionados con runx2 y con osterix cumplen funciones de activación y de regulación de los marcadores osteogénicos tanto en conjunto, como de forma individual; se sabe que algunos genes requieren la expresión de los dos factores de trascripción, mientras que otros sólo requieren osterix, o sólo runx2 (44). La osteopontina, cuya función en el tejido óseo está relacionada con la adherencia celular y con la resorción del hueso (45), se detectó en todos los tiempos, tanto en las células inducidas como no inducidas, sugiriendo que bajo las condiciones de cultivo establecidas, las células están encaminadas a la línea ósea. El hecho de que osteopontina se expresara antes que osterix podría explicarse por las diferentes vías de regulación de la expresión génica para esta proteína. Se conoce por ejemplo que la presencia de fosfato inorgánico desencadena una cascada que induce la expresión de osteopontina (45) y que en ratones "knockout" para osterix, hay sin embargo expresión de osteopontina en las células mesenquimales (46). De otro lado la osteocalcina, cuya expresión detectamos en los días 15 y 23 de células no inducidas (no se detectó en los demás cultivos), se sabe que está implicada en el control de la mineralización de la matriz ósea y que se expresa exclusivamente en la línea osteoprogenitora (47). Nuestro resultado concuerda con la expresión del factor de trascripción relacionado con runx2 y con el resultado positivo en los marcadores bioquímicos, hecho reportado también en los estudios de Oyajobi y col. quienes encontraron en ensayos in vitro con células de médula ósea, que el contacto celular por si solo, induce la expresión de osteocalcina (41). La ausencia de expresión de osteocalcina en los días 15 y 23 en las células inducidas podría atribuirse a la presencia de dexametasona en el medio de cultivo, de acuerdo con el trabajo de Richard y col. en el que se demostró que tal expresión es inhibida por Dex (10-8M) en ausencia de 1,25 dihidroxi-vitamina D3 en medios de cultivo de células de médula ósea (21). Se esperaba que la expresión de los genes que codifican los factores de trascripción de runx2 y de osterix se diera primero, o simultáneamente, a la expresión de los genes de osteocalcina y de sialoproteina ósea, pero esto sólo ocurrió con runx2 y osterix, se detectó sólamente en el día ocho en las células inducidas. La expresión de osteocalcina en las células no inducidas se puede atribuir al contacto celular, el cual fue evidente después de ocho días de cultivo. También se sugiere que dicha expresión fue regulada por el factor de trascripción runx2, ya que su expresión se dio desde el día ocho. En cuanto a las células inducidas, se sabe que los factores de diferenciación Dex 10-8M y L-ascorbato 2 fosfato (50 μM) incrementan la expresión de PA y la mineralización de la matriz, siendo posible que en los días 15 y 23 la presencia de Dex en el medio haya inhibido la expresión de osteocalcina, sin impedir necesariamente la mineralización de la matriz extracelular y alterando probablemente su regulación. En cuanto al funcionamiento de la CAp, nuestros resultados indican que cumple con los requerimientos básicos de crear un microambiente favorecedor de la adherencia celular, así como de su migración, proliferación, función y diferenciación (9, 31). El hecho de haber detectado una mineralización de la matriz a los 16 días de cultivo de las células sobre CAp y a los 23 días en los platos, se podría explicar por los métodos de detección utilizados, siendo más sensible SEM que el de von Kossa. Sin embargo, no se puede descartar la posibilidad de que el biomaterial pueda tener algún efecto acelerador en la mineralización. Por otra parte, al comparar las tasas de multiplicación (r) en el cultivo realizado en Colombia sobre cajas y en el cultivo realizado en Malasia sobre CAp, no se encuentran diferencias significativas, lo que indica que las condiciones de cultivo establecidas en nuestro trabajo para las células de periostio porcino son reproducibles y que CAp permite un crecimiento celular de forma similar al de las cajas de cultivo comúnmente empleadas. La microscopia electrónica de barrido nos permitió observar una diferencia en la forma de crecimiento de las células sobre Th y CAp. Mientras que en Th fue bidimensional debido a que la laminilla permite la extensión de las células a lo largo y ancho, en CAp se presentó en tres dimensiones debido a que las propiedades de porosidad, tamaño de grano y rugosidad del material proporcionan profundidad, lo que permite el crecimiento de varias monocapas en diferentes direcciones. Los resultados de nuestro trabajo nos permiten concluir que se logró establecer un modelo porcino para el aislamiento, incremento y diferenciación de osteoblastos, obtenidos a partir de los osteoprogenitores presentes en el periostio de fetos porcinos. Los periostios digeridos con colagenasa que dieron lugar a los cultivos con los que se incrementó el número de células se congelaron y descongelaron meses después, sin que se presentara mayor perdida de la viabilidad. A juzgar por la expresión de marcadores bioquímicos y moleculares, tanto los cultivos inducidos como los no inducidos diferenciaron en osteoblastos. Las células cultivadas sobre CAp de síntesis seca y síntesis húmeda dieron lugar a la expresión de mARN característicos de osteogenesis, tanto en medio de diferenciación con y sin factores, mostrando un desarrollo similar a los cultivos en cajas. El conteo celular y los análisis fisicoquímicos y de SEM mostraron que las células semejantes a osteoblastos sintetizaron matriz extracelular calcificada, indicando que este modelo es útil para el estudio de la funcionalidad de un material hibrido de CAp y de células autólogas derivadas de periostio. Agradecimientos Al Dr. Shamsul Muhamad y al Dr. Santhana del "Institute for Medical Research" de Malasia por la utilización de sus los Laboratorios y la colaboración con la microscopía electrónica. Al "Ministry of Science Technology and Innovation" por la financiación del proyecto (Grant 09 01 01 0031 EA001). Al Sr. Husaini Abdul Jalil por su ayuda en preparación y corte de muestras de CAp. A la Universidad Militar Nueva Granada por la financiación del proyecto registrado con el código MED- 2004-004. Al frigorífico San Martín por la donación de los fetos porcinos. Referencias 1. Ringe J, Kaps C, Burmester G, Sitiinger M. Stem cells for regenerative medicine: Advances in the Engineering of Tissues and Organs. Naturwissenschafen 2002;89:338-51. [ Links ] 2. Muschler G F, Midura R J. Conective tissue progenitors: practical concepts for clinical applications. Clinical Orthopaedics and Related Research 2002;395:66-80. [ Links ] 3. Anselme k. Osteoblast adhesion on biomaterials. Biomaterials 2000; 21:667-81. [ Links ] 4. Cerroni L, Filocamo R, Fabbri M, Piconi S, Caropreso S, Condó S. Growth of osteoblast-like cells on porous hydroxyapatite ceramics: an In vitro study. Biomolecular Engineering 2002;19:119-24. [ Links ] 5. Costantino P, Hiltzik D, Govindaraj S, Moche J. Bone healing and bone substitutes. Facial Plastic Surgery 2002;18(1):13-26. [ Links ] 6. Beniker D, McQuillan D, Livesey S, et al. The use of acellular dermal matrix as a scaffold for periosteum replacement. Orthopedics MaySuplement. [serie en linea] 2003;26. [citado 20 enero 2005] Disponible en: http://www.orthobluejornal.com/supp/0503/beniker.asp. [ Links ] 7. Neel M. The use of periosteal replacement Membrane for bone graft containment at allograft-host juctions after tumor resection and reconstruction with bulk allograft. Orthopedics May Suplement. [serial on line] 2003;26. [citado 20 enero 2005] Disponible en: http://www.orthobluejournal.com/supp/0503/neel.asp [ Links ] 8. Krajewski A, Mazzocchi M, Buldini P L, Ravaglioli A, Tinti A, Taddei P, Fagnano C. Synthesis of carbonated hydroxyapatites: efficiency of the substitution and critical evaluation of analytical methods. Journal of Molecular Structure 2005;744-747: 221-228. [ Links ] 9. Doi Y, Shibutani T, Moriwaki Y, Kajimoto T, Iwayama Y. Sintered carbonate apatites as bioresorbable bone substitutes. Journal of Biomedical Materials Research 1998;39(4):603-10. [ Links ] 10. Bronwlow H, Reed A, Joyner C and Simpson A. Anatomical effects of periosteal elevation. Journal of Orthopaedic Research 2000;18:500-02. [ Links ] 11. Declercq H, Verbeeck R, De Ridder L, Schacht E, Cornelissen M. Calcification as an indicador of osteoinductive capacity of biomaterials in osteoblastic cell cultures. Biomaterials 2005;26:4964-74. [ Links ] 12. Fang H, Hall B K. In vitro differentiation potential of the periosteal calls fron a membrane bone, the quadratojugal of the embryonic chick. Developmental Biology 1996;180:701-12. [ Links ] 13. Iwasaki M, Nakahara H, Nakata K, Nakase T, Kimura T, Ono K. Regulation of proliferation and osteochondrogenic differentiation of periosteum-derived cells by transforming growth factor-? and basic fibroblast growth factor. The Journal of Bone and Join Surgery 1995; 77:543-54. [ Links ] 14. Schecroun N, Delloye Ch. In vitro growth and osteoblastic differentiation of human bone marrow stromal cells supported by autologous plasma. Bone 2004;35:517-24. [ Links ] 15. Solchaga L A, Cassiède P. Apatita carbonatadalan A. Different response to osteo-inductive agente in bone marrow-and periosteum-derived cell preparations. Acta Orthop Scan 1998;69(4):426-32. [ Links ] 16. Spitzer R, Perka C, Lindenhayn K, Zippel H. Matrix engineering for osteogenic differentiation of rabbit periosteal cells using tricalcium phosphate particles in a three-dimensional fibrin culture. Journal of Biomedical Materials Research 2001;59(5):1091-99. [ Links ] 17. Jaquiéry C, Schaeren S, Farhadi J, Mainil-Varlet P, Kunz C, Zeilhofer H, et al. In vitro osteogenic differentiation and in vivo bone-forming capacity of human isogenic jaw periosteal cells and bone marrow stromal cells. Annals of Surgery 2005;242(6):859-68. [ Links ] 18. Davis J M. Basic Cell Culture: A Practical Approach. New York: Oxford University Press;1994. p. 301 [ Links ] 19. Hung S C, Chen N J, Hsieh S L, Li H, Ma H L, Lo W H. Isolation and characerization of size-sieved stem cells from human bone marrow. stem cells 2002;20:249-58. [ Links ] 20. Jaiswal N, Haynesworth S E, Caplan A I, Bruder S P. Osteogenic differentiation of purified, culture-expanded human mesenchymal stem cells in vitro. Journal of Celular Biochemitry 1997;64:295-312. [ Links ] 21. Rickard D J, Kassem M, Hefferan T, Sarkar G, Spelsberg T, Riggs L. Isolation and characterization of osteoblast precursor cells from human bone marrow. Journal of Bone & Mineral Research 1996;11(3):312-24. [ Links ] 22. D'ippolito G, Schiller C, Perez-Stable C, Balkan W, Roos B, Howard G. Cooperative actions of hepatocyte growth factor and 1,25-Dihydroxyvitamin D3 in osteoblastic differentiation of human vertebral bone marrow stromal cells. Bone 2002;31(2):269-75. [ Links ] 23. Manuey J R, Kaplan D L, Volloch V. Matrix-mediated retention of osteogenic differentiation potencial by human adult bone marrow stromal cells during ex vivo expansion. Biomaterials 2004;25:3233-43. [ Links ] 24. Encina N R, Brillotte W G, Hofmann M C. Immunomagnetic islation of osteoprogenitors fron human bone marrow stroma. Laboratory Investigation 1999;79(4):449-64. [ Links ] 25 Gilbert S. Developmental Biology. Fifth edition. Sunderland, Massachusetts. USA. Sinauer Associates Inc;1997. Chapter 9. p. 918. [ Links ] 26. Gronthos S, Shaoqiong C, Wang C, Robey P, Songtao S. Telomerase accelerates osteogenesis of bone marrow stromal stem cells by upregulation of CBFA1, osterix, and osteocalcin . Journal of Bone & Mineral Research 2003;18(4):716-22. [ Links ] 27. Dragoo J L, Lieberman J R, Lee R, Deugarte D A., Lee Y, Zuk P A, et al. Tissue-engineered bone from BMP-2-transduced stem cells derived from human fat. Plastic and Reconstructive Surgery 2005;115(62):1665-73. [ Links ] 28. Diefenderfer D L, Osyczka A M, Garino J P, Leboy P S. Regulation of BMP-induced transcription in cultured human bone marrow stromal cells. The Journal of Bone and Joint Surgery 2003;85(3):19-28. [ Links ] 29. Gronthos S, Zannettino A, Graves S, Ohta S, Hay S, Simmons P. Differential cell surface expression of the STOR-1 and alkaline phosphatase antigens on dscrete-dvelopmental sages in pimary cultures of human bone cells. Journal of Bone & Mineral Research 1999;(1):47-56 [ Links ] 30. Hing K. In vitro performance of porous hydroxyapatite for bone replacement. University of Cambrige. Massachusetts, United States. 1996; Chapter 6 p. [ Links ] 31. Declercq H, Van den Vreken N, De Maeyer E, Verbeeck R, Schacht E, De Ridder L, Cornelissen M. Isolation, proliferation and differentiation of oseteoblastic cells to study cell/biomaterial interactions: comparison of different isolation techniques and source. Biomaterials 2004;25:757-68. [ Links ] 32. DiGirolamo C, Stokes D, Colter D, Phinney D, Class R., Prockop D. Propagation and senescence of human marrow stromal cells in culture: a simple colony-forming assay identifies samples with the greatest potential to propagate and differentiate. British Journal of Hematology 1999;107(2):275-81. [ Links ] 33. Gitelman H. An improved automated procedure for the determination of calcium in biological specimens. Analytical Biochemistry 1967;20:521-31. [ Links ] 34. Marshak D. Stem cell biology. Woodbury, NY, USA: Cold Spring Harbor Laboratory Press;2001.p.560 [ Links ] 35. Thomson B M, Bennett J, Dean V, Triffitt J, Meikle M C, Loveridge N. Preliminary characterization of porcine bone marrow stromal cell: skeletogenic potential, colony-forming activity and response to dexamethasone, transforming growth factor and basic fibroblast growth factor. Journal of Bone & Mineral Research 1993;8(10):1173-83. [ Links ] 36. Bruder S, Jaiswal N, Haynesworth S. Growth kinetics, self-renewal and the osteogenic potential of purified human mesenchymal stem cells during extensive subcultivation following cryopreservation. Journal of Cellular Biochemistry 1997;64:278-94. [ Links ] 37. Hurwitz D, Kirchgesser M, Cerril W, Galanopoulos T, McGrath C, Emami S, et al. Systemic delivery of human growth hormona or human factor IX in dogs by reintroduced genetically modified autologous bone marrow stromal cells. Human Gene Therapy 1997;8:137-56. [ Links ] 38. Ramírez G, Vera V, Villamil L. Cultivo de Células Animales. ED. Universidad Nacional de Colombia. Bogotá, Colombia; 2005 p.143. [ Links ] 39. Takamizawa S, Maehata Y, Imai K, Senoo H, Sato S, Hata R. Effects of ascorbic acid and ascorbic acid 2-phosphate, a long-acting vitamin C derivative, on the proliferation and differentiation of human osteoblast-like cells. Cell Biology 2004;28(4):255-65. [ Links ] 40. Kobayashi T, Kronenberg H. Minireview: Transcriptional regulation in development of bone. Endocrinology 2005;146(3):1012-17. [ Links ] 41. Oyajobi B, Lomri A, Hott M. Isolation ond characterization of human clonogenic oxteoblast progenitors inmunoselected fron fetal bone marrow stroma using STRO-1 monoclonal antibody. Journal of Bone and Mineral Research 1999;14(3):351-61. [ Links ] 42. Lian J B. Biology of Bone Mineralization. Current Opinion in Endocrinology & Diabetes 2006;13:1-9. [ Links ] 43. Arnold U, Lindenhayn K, Perka C. In vitro cultivation of human periosteum derived cells in bioresorbable polymer- TCP-composites. Biomaterials 2002;23:2303-10. [ Links ] 44. Nakashima K, Zhou X, Kunkel G, Zhang Z, Min Deng J. The novel zinc finger containing transcription factor osterix is required for osteoblast differentiation and bone formation. Cell 2002;108:17-29. [ Links ] 45. Ohyama Y, Akira N, Yukiko M, Teruo A, Masaki N. Spaciotemporal association and bone morphogenetic protein regulation of Sclerostin and Osterix expresión during embryonic osteogenesis. Endocrinology 2004; 145(10):4685-92. [ Links ] 46. Beck G, Knecht N. Osteopontin regulation by inorganic phosphate is ERK1/2-, protein kinase C-, and proteasome-dependent. The Jornal of Biological Chemistry 2003;278(43):41921-29. [ Links ] 47. Boskey A, Gadaleta S, Gundberg C, Doty B, Ducy P, Karsenty G. Fourier transformed infrared microspectroscopic analysis of bones of osteocalcin deficient mice provides insight into the function of osteocalcin. Bone 1998;23(3):187-96. [ Links ] 48. Paredes R, Arriaga G, Cruzat F, Villagra A, Olte J, Zaidi K, Van Wijnen A, Lian J, et al. Bone-Specific transcription factor Runx2 interacts with the 1,25-dihydroxyvitamin D3 receptor to-regulate rat osteocalcin gene expression in osteoblastic cells. Molecular and Cellular Biology 2004; 24(20):8821-61. [ Links ]














