Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.15 no.2 Bogotá July/dic. 2007
ARTÍCULO
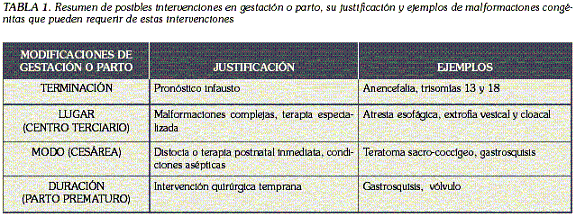
PASADO, PRESENTE Y FUTURO DE LA CIRUGÍA FETAL FETAL SURGERY. PAST, PRESENT AND FUTURE STUART HOSIE VENATOR, M.D. Cirujano Pediatra, Ph.D.a* a Profesor de Cirugía Pediátrica, Technische Universität München, Jefe Servicio de Cirugía Pediátrica Hospital München. * Correspondencia: stuart.hosie@kms.mhn.de. Dirección postal: Hospital München Schwabing, Kölner Platz 1, D-80804 München, República Federal Alemana. La mayor disponibilidad y calidad de la ecografía prenatal ha llevado a un incremento en el diagnóstico in útero de malformaciones congénitas, siendo, además del tratamiento estandarizado postnatal o de la terminación del embarazo, varias las consecuencias terapéuticas: modificación del lugar del parto (centro de cuidado terciario), modo del parto (sección cesárea) y duración de la gestación (parto prematuro). Casos muy seleccionados, en los que el progreso de la gestación causa deterioro progresivo de los órganos afectados, llevando a danos irreversibles e incompatibles con la vida extrauterina, se consideran como candidatos potenciales para cirugía fetal. Ejemplo de ellos son la uropatía obstructiva bilateral extrema, el teratoma sacrococcígeo gigante, la malformación adenomatoidea quística congénita pulmonar y la hernia diafragmática congénita. En la presente revisión se discute la fisiopatología de estas malformaciones y las estrategias terapéuticas fetales, al igual que los resultados obtenidos y las perspectivas futuras. Palabras clave: terapia fetal, malformaciones congénitas. Abstract Key words: fetal therapy, abnormalities. Introducción Los avances en la ecografía materna fetal han llevado a un incremento en el diagnóstico prenatal de malformaciones congénitas y hasta hace algunos anos, las consecuencias del diagnóstico prenatal de estas malformaciones eran muy limitadas y las opciones terapéuticas eran también mínimas. Existía la posibilidad de la terminación del embarazo, o la de seguir con la gestación e intentar salvar al recién nacido con una terapia postnatal óptima. Hoy en día ya se cuenta con otras posibilidades terapéuticas como son la de modificar el lugar del parto (centro terciario), la de definir el modo de parto (sección cesárea) o la de modificar la duración de la gestación (parto prematuro) (1-4). Posibilidades terapéuticas Terminación del embarazo. Se favorece en los casos de malformaciones múltiples que llevarían a la muerte neonatal irremediable, a pesar de una terapia postnatal máxima. Ejemplos de ello son la anencefalia y las anomalías cromosomales como la trisomía 13 o la trisomía 18 (5, 6). Modificación del lugar del parto. En pacientes con malformaciones complejas que requieren de una terapia postnatal multimodal inmediata, el parto se debe hacer en un centro terciario que posea la infraestructura personal y material necesaria. El transporte intrauterino, es decir, remitir la gestante a un centro terciario para que el parto y la terapia neonatal se efectúen en allí, es preferible al transporte postnatal de un recién nacido en estado crítico, no sólo por los considerables e innecesarios riesgos adicionales que se generarían y que aumentarían significativamente la morbimortalidad postnatal, sino también, porque se incrementarían desproporcionadamente los costos y el esfuerzo logístico. Pacientes con anomalías complejas, como por ejemplo la extrofia vesical o cloacal, la atresia esofágica y el mielomeningocele (MMC), deberían ser remitidos en útero a un centro terciario (7). Modificación del modo de parto. Las malformaciones que con probabilidad causarían distocia fetal se benefician de un parto por cesárea. Tal es el caso de pacientes con teratomas sacrococcígeos gigantes o con hidrocefalia relevante. Otras malformaciones, por ejemplo la gastrosquisis, el onfalocele roto, o el MMC, que también requieren de una terapia postnatal inmediata bajo condiciones asépticas, se benefician igualmente de un parto por cesárea (8-10). Modificación de la duración de la gestación. El parto prematuro representa una ventaja potencial para el feto, cuando éste requiere de una intervención quirúrgica temprana. Es el caso de malformaciones en las que la gestación a término lleva a un dano progresivo e irreversible de los órganos afectados, como sucede con la uropatía obstructiva extrema, la gastrosquisis, el vólvulo y el hidrops fetal (8,11). En estos casos se debe sopesar el potencial beneficio de una intervención temprana, contra el riesgo inherente a la prematuridad. La Tabla 1 representa una sinopsis de éstas alternativas.
Recibido: Abril 13 de 2006. Aceptado: Julio 11 de 2007.
Resumen
Además, existe una variedad de malformaciones congénitas, que en casos extremos son incompatibles con la vida extrauterina, ya que los órganos afectados han sufrido un dano irreversible durante el desarrollo embrionario y fetal y los neonatos morirán irremediablemente a pesar de una terapia postnatal intensiva máxima. Si fuese posible detener el deterioro progresivo intrauterino del órgano u órganos afectados, e inclusive permitir una recuperación intrauterina de ellos, cambiaría de manera radical el pronóstico para estos neonatos, siendo este el razonamiento que ha llevado al desarrollo de la cirugía fetal: corregir un defecto in útero, para permitir la normalización o la recuperación de los órganos afectados y mejorar así el pronóstico postnatal (10, 12-19). En la Tabla 2 se resumen algunos tipos de malformaciones que en caso extremo llevan a muerte neonatal.

Condiciones para la consideración de terapia fetal
A continuación se plantean una serie de prerrequisitos para considerar la terapia fetal (1, 2):
1. La comprensión de los procesos fisiopatológicos que conllevan al deterioro de los órganos afectados, causantes a su vez de muerte fetal.
2. El conocimiento de la historia natural de la malformación, es decir, de la evolución postnatal de los fetos afectados. Aquí se incluyen datos como el índice de mortalidad perinatal, al igual que información acerca de morbilidad temprana y tardía.
3. El reconocimiento de los pacientes con una malformación congénita dada, que se pueden beneficiar de una terapia fetal. Debe hacerse un diagnóstico de la malformación fetal durante la gestación suficientemente temprano, que permita el inicio de una terapia fetal.
4. La existencia de criterios definidos para el diagnóstico prenatal, que permitan predecir con seguridad un pronóstico reservado, a pesar de un tratamiento postnatal óptimo.
5. El desarrollo de modelos experimentales que simulen los procesos fisiopatológicos de la malformación de manera reproducible, así como de las técnicas terapéuticas fetales para los mismos.
6. La corroboración de la efectividad y de la seguridad de las técnicas de terapia fetal en modelos más cercanos a la situación humana, típicamente modelos con primates.
7. La preparación de un protocolo detallado para la terapia humana, que deberá ser interdisciplinario y tener en cuenta todo tipo de eventualidades, las posibles complicaciones y su respectivo tratamiento.
8. La verificación de que la terapia fetal revierte, sea parcial o totalmente, los danos causados por la malformación y la demostración de que las técnicas se pueden llevar a cabo con un riesgo mínimo para la madre y para el feto.
9. El voto afirmativo del comité de ética médica, igualmente interdisciplinario.
10. Una información amplia y completa para los padres, que comprenda las diferentes opciones terapéuticas, incluyendo el pronóstico de la terapia postnatal sin tratamiento fetal. También deberá incluir una descripción exacta de los procedimientos y de los riesgos maternos y fetales, enfatizando en la naturaleza experimental del tratamiento.
Resumen de la evolución y del estado actual de las actividades terapéuticas fetales en diferentes malformaciones congénitas
Uropatía obstructiva. Las valvas uretrales posteriores pueden causar, en casos extremos, hidronefrosis bilateral con displasia renal e insuficiencia renal bilateral. La consecuente oliguria conlleva a un oligohidramnios y éste a su vez, a una hipoplasia pulmonar que causa insuficiencia respiratoria al recién nacido. Como la mortalidad en esta constelación llega al 95%, los pacientes que la padecen se hacen candidatos potenciales para cirugía fetal (20, 21). Para seleccionar los pacientes que se pueden beneficiar de la terapia fetal se deben realizar tres punciones de la vejiga fetal en un período de 48 a 72 horas, con el objeto de analizar la orina respecto a los electrolitos, la osmolaridad y el contenido de proteínas, teniendo en cuenta que la orina de la primera punción corresponde al contenido vesical, la de la segunda a la orina del tracto urinario superior y la de la tercera, a la orina producida recientemente por los riñones fetales. Si los análisis de las tres punciones consecutivas muestran una tendencia decreciente en los valores de electrolitos, osmolaridad y proteínas, los riñones fetales aun conservan alguna función y solamente estos pacientes se pueden beneficiar de una terapia fetal, ya que en los demás la función renal habrá sufrido un daño irreversible (3, 22, 23).
Inicialmente la terapia consistía en un shunt vesico-amniótico a través de un catéter doble "pigtail", pero desafortunadamente no existe evidencia del beneficio de ésta modalidad terapéutica. Las complicaciones, especialmente el desalojo del catéter, se observa en el 45% de los pacientes y la mortalidad llega al 56%, incluyendo a todos los pacientes en los cuales el tratamiento no conllevó a una normalización del volumen del líquido amniótico. El 88% de los pacientes presentan insuficiencia renal a pesar de la descompresión aparente de los riñones fetales, es decir, el tratamiento no ha llevado a los resultados esperados (13, 24-29). Algunos grupos de trabajo están experimentando actualmente con una opción diferente: el posicionar un vesicoscopio en la vejiga fetal, e incidir las valvas de manera anterógrada. Aún es muy temprano para evaluar definitivamente el resultado de ésta terapia, pero posiblemente sea un paso en la dirección adecuada, ya que se obvian las complicaciones asociadas al catéter y se permite una actividad cíclica fisiológica de la vejiga (30).
Teratoma sacrococcígeo (TSC). Es la malformación más frecuente del recién del recién nacido, causada por transformación maligna y con estructuras de las tres hojas embrionarias (31, 32). La mortalidad postnatal es baja y la originada por los tumores que se diagnostican prenatalmente llega al 50%, causada por un robo vascular como consecuencia de su gran perfusión, que lleva a insuficiencia cardiaca y a hidrops fetal con placentomegalia. La ecografía muestra una masa intrapélvica o en el sacro-cóccix, que puede ser sólida, quística o mixta. Los diagnósticos diferenciales incluyen mielomeningocele, o uropatía obstructiva (33-35).
En casos de signos de hidrops fetal, como efusión pleural o pericárdica, ascitis, edema subcutáneo, cardiomegalia o placentomegalia, el pronóstico fetal es muy pobre y la mortalidad es cercana al 100% (36). En estos casos es pertinente la pregunta acerca de la indicación de una intervención fetal, que consiste en la resección de la masa por laparotomía e histerotomía maternas, utilizando una grapadora (37, 38).
Malformación adenomatoidea quística congénita pulmonar (MCQAP). Se trata de una masa ecogénica del pulmón fetal, con o sin áreas quísticas (39). La resonancia nuclear magnética permite una representación anatómica muy precisa de éste tipo de lesiones (40). Ocasionalmente las estructuras quísticas grandes pueden comprimir el tejido pulmonar ipsilateral, causar una desviación del mediastino y comprimir el pulmón contralateral, pero en la mayoría de los casos el pronóstico postnatal es excelente (41, 42). En raras ocasiones el desplazamiento mediastinal puede conllevar a una reducción del volumen de eyección cardiaca y a un hidrops fetal, que inevitablemente causa la muerte del feto y justifica la terapia fetal, que consiste en la resección de la lesión con la ayuda de una grapadora, una vez efectuadas laparotomía e histerotomía maternas, al igual que toracotomía fetal. En caso de grandes estructuras quísticas se puede intentar la aplicación de un shunt tóraco-amniótico. Adzick reporta una serie de 22 pacientes, de los cuales once sobrevivieron al procedimiento fetal. En seis de los pacientes que murieron, la causa de muerte fue bradicardia fetal (4,14, 43, 44).
Hernia diafragmática congénita (HDC). Consiste en la herniación de los órganos abdominales en el tórax a través de un defecto diafragmático; la malformación ocurre con una incidencia de 1:500 a 1:5000 de nacidos vivos y en el 90% el lado afectado es el izquierdo. La compresión de los pulmones durante la fase pseudoglandular del desarrollo pulmonar conlleva a hipoplasia de las vías respiratorias, de la vasculatura pulmonar y de los alvéolos (46-48) y los vasos pulmonares no solamente muestran alteraciones anatómicas, sino también fisiolpatológicas, reaccionando muy sensiblemente a noxas como hipoxia y acidosis, causando vasoconstricción e hipertensión pulmonar (46,47,49). La intensidad de la sintomatología es variable y depende del momento de aparición de la herniación durante la gestación y del volumen de los órganos herniados al tórax. Las manifestaciones clínicas, que cubren un amplio espectro, pueden ser mínimas o incluir un síndrome de dificultad respiratoria neonatal con hipertensión pulmonar, no compatibles con la vida extrauterina, siendo este último grupo el que se beneficiaría de un tratamiento fetal (50).
La ecografía prenatal muestra la herniación de los órganos abdominales dentro del tórax, con desplazamiento del mediastino hacia el lado contralateral y como criterios ecográficos prenatales de mal pronóstico postnatal están demostrados la herniación del hígado al tórax ("liver up") y el índice pulmón/circunferencia craneal desfavorable ("lung to head ratio" LHR), índice que se calcula midiendo el área del pulmón contralateral a la hernia y dividiéndola por la circunferencia craneal, en donde un valor menor de uno se considera de mal pronóstico(51-53).
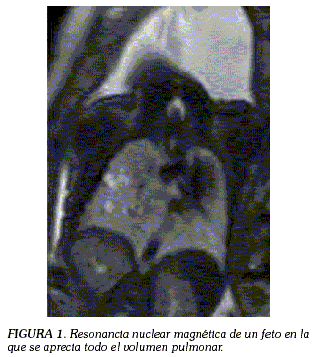
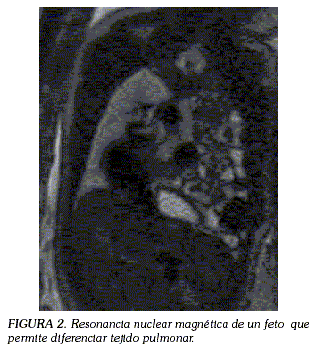
La resonancia nuclear magnética fetal facilita una magnífica representación de los detalles anatómicos, permitiendo diferenciar, entre otros, el tejido pulmonar del tejido hepático y hacer una medición exacta del volumen pulmonar (Figuras 1 y 2) (54).
Terapia fetal
Los pacientes con defectos diafragmáticos en los que el hígado está desplazado hacia el tórax y tienen pronóstico reservado serían quienes se beneficiarían de un procedimiento fetal. Desafortunadamente, los primeros intentos de corregir el defecto por cirugía fetal no fueron exitosos y la reposición del hígado hacia el abdomen causaba angulación y compresión de las venas umbilicales que llevaban a la muerte del feto (55).
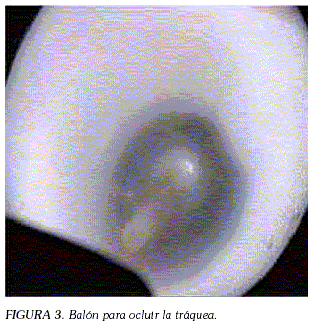
Una observación muy diferente llevó a una vía de solución alternativa: la atresia congénita de las vías respiratorias superiores causa hiperplasia e hipertrofia pulmonares y el líquido amniótico se produce parcialmente en los pulmones. Como el incremento de la presión hidrostática intrapulmonar conlleva al crecimiento de los pulmones ("CHAOS: congenital high airway obstruction syndrome) o síndrome de obstrucción congénita de la vía aérea superior) se ha venido utilizando este principio para tratar la hipoplasia pulmonar en fetos con HDC (56-58). Inicialmente, con incisión cervical fetal, disección de la tráquea y aplicación de clips para ocluirla, a través de laparotomía e histerotomía materna (50) y posteriormente, de manera fetoscópica. A pesar de la reducción del trauma quirúrgico por este procedimiento seguían persistiendo los riesgos de prematuridad y de lesión de los nervios laríngeos recurrentes (52), por lo que actualmente la oclusión traqueal fetal se lleva a cabo por medio de un trocar de 3 mm de diámetro aplicado por punción percutánea. Se efectúa una laringoscopia fetal y se aplica un balón desacoplable (Figura 3) con el cual se ocluye la tráquea (59, 60), para posteriormente extraer el balón, ya sea por un procedimiento similar al final de la gestación, o durante la sección cesárea, aplicando el llamado "EXIT" (ex utero intrapartum treatment o tratamiento extra uterino intraparto), en el que se realiza la sección cesárea exponiendo únicamente la cabeza fetal, manteniendo relajado el útero y conservando íntegro el cordón umbilical para mantener al feto bajo la circulación útero-placentaria. De ésta manera se dispone del tiempo suficiente para retirar el balón intratraqueal y para intubar al feto antes de ligar el cordón umbilical (61-63).
En el año 2003 se publicaron los resultados de un estudio prospectivo aleatorizado realizado por el grupo de Michael Harrison en San Francisco. En el se comparó la sobrevida a los 90 días, al igual que la morbilidad materno-fetal, entre pacientes tratados mediante oclusión traqueal fetal y pacientes que recibieron el tratamiento postnatal estandarizado. El estudio se suspendió después de evaluar 24 pacientes, ya que la sobrevida de los pacientes del grupo del tratamiento postnatal estándar fue inesperadamente elevada, del 77%, en comparación con el 73% de los pacientes del grupo de terapia fetal, concluyéndose en esta experiencia que la oclusión traqueal fetal no llevó a mejorar el pronóstico postnatal (64). En esta serie, que tomó como criterio de selección un LHR menor de 1,4 como criterio de pronóstico reservado, todos los pacientes con LHR entre 1,07 y 1,4 sobrevivieron, pero por tratarse de un valor de LHR demasiado elevado, se considera que la selección no fue la más adecuada por lo que se recomendaría repetir el estudio efectuando una selección más rígida de los pacientes de pronóstico reservado, en la que el LHR sea menor de de uno o de 0,9.
Conclusiones
El refinamiento en el diagnóstico prenatal de las malformaciones congénitas permite no sólo la detección temprana y detallada de las mismas, sino también la predicción del pronóstico prenatal para el recién nacido. En esta dirección, la cirugía fetal se presenta como un área nueva e interdisciplinaria, que tiene como meta reducir el deterioro de los órganos afectados por algunas malformaciones congénitas durante el desarrollo fetal, sin que exista evidencia irrefutable de que éste tipo de tratamiento tiene un real efecto positivo. La adecuada selección de los pacientes, junto con el desarrollo de nuevas técnicas de diagnóstico y de métodos terapéuticos, hará de esta área un componente integral dentro del armamento terapéutico que le brinden los centros hospitalarios especializados a los pacientes con este tipo de patologías.
Referencias
1. Harrison MR. The rationale for fetal treatment: selection, feasibility and risk. En: Harrison MR, Evans MI, Adzick NS, Holzgreve W (editores). The unborn patient. The art and science of fetal therapy. Philadelphia: Saunders; 2001. p. 32-52. [ Links ]
2. Shaaban AF, Kim HB, Flake AW. En: Ziegler MM, Azizkhan RG, Weber TR (editores). Operative Pediatric Surgery. New York: Mc Graw Hill; 2003. p. 21-35. [ Links ]
3. Harrison MR, Golbus MS, Filly RA. Management of the fetus with a correctable congenital defect. JAMA. 1981; 246: 774-777. [ Links ]
4. Hobbins JC, Grannum PAT, Berkowitz RL, Silverman R, Mahoney MJ. Ultrasound in the diagnosis of congenital anomalies. J Obstet Gynecol. 1979; 134: 331-345. [ Links ]
5. Hogge WA, Schonberg SA, Golbus MS. Chorionic villous sampling: experience of the first 1000 cases. Am J Obstet Gynecol. 1986; 154: 1249-1252. [ Links ]
6. Golbus MS Loughman WD, Epstein CJ, Halbasch G, Stephens JD, Hall BD. Prenatal genetic diagnosis in 3000 amniocenteses. N Engl J Med. 1979; 300: 157-163. [ Links ]
7. Touloukian RJ, Hobbins JC. Maternal ultrasonography in the antenatal diagnosis of surgically correctable fetal anomalies. J Pediatr Surg. 1980; 15: 373-377. [ Links ]
8. Bond SJ, Harrison MR, Filly RA, Callen PW, Anderson RA, Golbus MS. Severity of intestinal damage in gastroschisis: Correlation with prenatal sonographic findings. J Pediatr Surg. 1988; 23: 520-525. [ Links ]
9. Harrison MR, Adzick NS. The fetus as a patient: Surgical considerations. Ann Surg. 1990; 213: 279-291. [ Links ]
10. Harrison MR. Fetal surgery. West J Med. 1990; 159: 341-349. [ Links ]
11. Harrison MR, Golbus MS, Filly RA, Nakayama DK, Callen PW, de Lorimier AA, Hricak A. Management of the fetus with congenital hydronephrosis. J Pediatr Surg. 1982; 17: 728-742. [ Links ]
12. Crombleholme TM, Harrison MR, Langer JC, Longaker MT, Anderson RL, Slotnick NS, et al. Early experience with open fetal surgery for congenital hydronephrosis. J Pediatr Surg. 1988; 23: 1114-1121. [ Links ]
13. Crombleholme TM, Harrison MR, Golbus MT, Longaker MT, Langer JC, Callen PW, et al. Fetal intervention in obstructive uropathy: prognostic indicators and efficacy of intervention. Am J Obstet Gynecol. 1990; 162: 1239-1244. [ Links ]
14. Adzick NS, Harrison MR, Glick PL, Golbus MS, Anderson MR, Mahony BS, et al: Fetal cystic adenomatoid malformation of the lung: prenatal diagnosis and natural history. J Pediatr Surg. 1985; 20: 483-488. [ Links ]
15. Hu LM, Davies P, Adzick NS, Harrison MR, Reid LM. The effect of intrauterine pneumonectomy in lambs. A morphometric study of the remaining lung at term. Am Rev. Respir Dis. 1987; 135: 607-612. [ Links ]
16. Harrison MR, Adzick NS, Jennings RW, et al. Antenatal intervention for congenital cystic adenomatoid malformation. Lancet. 1990; 336: 965-967. [ Links ]
17. Adzick NS, Harrison MR, Flake AW, Howell LJ, Golbus MS, Filly RA. Fetal surgery for cystic adenomatoid malformation of the lung. J Pediatr Surg. 1993; 28: 806-812. [ Links ]
18. Harrison MR, Adzick NS, Estes JM, Howell LJ. A prospective study of the outcome of fetuses with congenital diaphragmatic hernia. JAMA. 1994; 271: 382-384. [ Links ]
19. Langer JC, Harrison MR, Schmidt KG, Silverman NH, Anderson RL, Goldberg JD, et al. Fetal hydrops and death from sacrococcygeal teratoma: rationale for fetal surgery. Am J Obstet Gynecol. 1989; 160: 1145-1150. [ Links ]
20. Nakayama DK, Harrison MR, de Lorimier AA. Prognosis of posterior urethral valves presenting at birth. J Pediatr Surg. 1986; 21: 43-45. [ Links ]
21. Housley HT, Harrison MR. Fetal urinary tract abnormalities. Natural history, pathophysiology and treatment. Urol Clin North Am. 1998; 25: 63-73. [ Links ]
22. Johnson MP, Corsi P, Bradfield W, Hume RF, Smith C, Arias F, et al. Sequential urinalysis improves evaluation of fetal renal function in obstructive uropathy. Am J Obstet Gynecol. 1995; 173: 59-65. [ Links ]
23. Qureshi F, Jacques SM, Seifman B, Quintero R, Evans MI, Smith C, et al. In utero fetal urine analysis and renal histology do correlate with the outcome in fetal obstructive uropathies. Fetal Diagn Ther. 1996; 11: 306-312. [ Links ]
24. Johnson MP. Fetal obstructive uropathy. In: Harrison MR, Evans MI, Adzick NS, Holzgreve W (editores) The unborn patient. The art and science of fetal therapy. Philadelphia: Saunders; 2001. p. 259- 286. [ Links ]
25. Coplen DE. Prenatal intervention for hydronephrosis. J Urol. 1997; 157: 2270-2277. [ Links ]
26. Hassan S, Mariona L, Kasperski S, et al. Complications of vesicoamniotic shunting. Am J Obstet Gynecol. 1997; 176: s83. [ Links ]
27. Manning FA, Harrison MR, Rodeck C. Catheter shunts for fetal hydronephrosis and hydrocephalus: Report of the international fetal surgery registry. N Engl J Med. 1986; 315: 336-340. [ Links ]
28. Coplen DE, Hare JY, Zderic SA, Canning DA, Snyder HM 3rd, Duckett JW. 10-year experience with prenatal intervention for hydronephrosis. J Urol. 1996; 156: 1142-1145. [ Links ]
29. Holmes N, HarrisonMR, Baskin LS. Fetal surgery for posterior urethral valves: long term postnatal outcome. Pediatrics. 2001; 108: E7. [ Links ]
30. Quintero RA, Hume R, Smith C, Johnson MP, Cotton DB, RomeroR, Evans MI. Percutaneous fetal cystoscopy and endoscopic fulguration of posterior urethral valves. Am J Obstet Gynec. 1995; 172: 206-209. [ Links ]
32. Grosfeld J, Ballantine T, Lowe D, Baehner RL. Benign and malignant teratomas in children: Analysis of 85 patients. Surgery: 1976; 80: 297-305. [ Links ]
32. Gross R, Clatworthy H, Meeker I. Sacrococcygeal teratomas in infants and children. Surg Gnecol Obstet. 1951; 92: 341-354. [ Links ]
33. Holzgreve W, Mahony BS, Glick PL, Filly RA, Harrison MR, de Lorimier AA. Sonographic demonstration of fetal sacrococcygeal teratoma. Prenat Diagn. 1985; 5: 245-257. [ Links ]
34. Kuhlmann RS, Warsof SL, Levy DL, Flake AJ, Harrison MR. Fetal sacrococcygeal teratoma. Fetal Ther. 1987; 2: 95-100. [ Links ]
35. Flake AW, Harrison MR, Adzick NS, Laberge JM, Warsof SL. Fetal sacrococcygeal teratoma. J Pediatr Surg. 1986; 21: 563-566. [ Links ]
36. Bond SJ, Harrison MR, Schmidt KG, Silverman NH, Flake AW, Slotnick RN, et al. Death due to high-output cardiac failure in fetal sacrococcygeal teratoma. J Pediatr Surg. 1990; 25: 1287-1291. [ Links ]
37. Flake AW. The fetus with sacrococcygeal teratoma. En: Harrison MR, Evans MI, Adzick NS, Holzgreve W (editores). The unborn patient. The art and science of fetal therapy. Philadelphia: Saunders; 2001. p. 315- 324. [ Links ]
38. Paek BW, Jennings RW, Harrison MR, Filly RA, Tacy TA, Farmer DL, et al. Radiofrequency ablation of human fetal sacrococcygeal teratoma. Am J Obstet Gynecol. 2001; 184: 503-507. [ Links ]
39. Sakala EP, Perrott WS, Grube GL. Sonographic characteristics of antenatally diagnosed extralobar pulmonary sequestration and congenital cystic adenomatoid malformation. Obstet Gynecol Surv. 1994; 49: 647-655. [ Links ]
40. Quinn TM, Hubbard AM, Adzick NS. Prenatal magnetic resonance imaging enhances prenatal diagnosis. J Pediatr Surg. 1998; 33: 312-316. [ Links ]
41. Adzick NS, Harrison MR, Glick PL, Golbus MS, Anderson RL, Mahony BS, et al. Fetal cystic adenomatoid malformation of the lung: Prenatal diagnosis and natural history. J Pediatr Surg. 1985; 20: 483-488. [ Links ]
42. Thorpe-Beeston JG, Nicolaides KH. Cystic adenomatoid malformation of the lung: Prenatal diagnosis and outcome. Prenat Diagn. 1994; 14: 677-688. [ Links ]
43. Adzick NS, Harrison MR, Crombleholme TM, Flake AW, Howell LJ. Fetal lung lesions: Management and outcome. Am J Obstet Gynecol. 1998; 179: 884-889. [ Links ]
44. Adzick NS. The fetus with a lung mass. En: Harrison MR, Evans MI, Adzick NS, Holzgreve W (editores). The unborn patient. The art and science of fetal therapy. Philadelphia: Saunders; 2001. p. 287- 296. [ Links ]
45. Adzick NS, Kitano Y. Fetal surgery for lung lesions, congenital diaphragmatic hernia and sacrococcygeal teratoma. Semin Pediatr Surg. 2003; 12: 154-167. [ Links ]
46. Harrison MR, Jester JA, Ross NA. Correction of congenital diaphragmatic hernia in utero I. The model: Intrathoracic balloon produces fetal pulmonary hypoplasia. Surg. 1980; 88: 174-182. [ Links ]
47. Harrison MR, Bressack MA, Churg AM, de Lorimier AA. Correction of congenital diaphragmatic hernia in utero II. Simulated correction permits fetal lung growth with survival at birth. Surg. 1980; 88: 260-268. [ Links ]
48. Adzick NS, Harrison MR, Glick PL, Nakayama DK, Manning FA, de Lorimier AA. Diaphragmatic hernia in the fetus: prenatal diagnosis and outcome in 94 cases. J Pediatr Surg. 1985; 20: 357-361. [ Links ]
49. Adzick NS, Outwater KM, Harrison MR. Correction of congenital diaphragmatic hernia in utero IV. An early gestational fetal lamb model for pulmonary vascular morphometric analysis. J Pediatr Surg. 1985; 20: 673-680. [ Links ]
50. Flake AW. Fetal surgery for congenital diaphragmatic hernia. Semin Pediatr Surg. 1996; 5: 266-274. [ Links ]
51. Lipshutz GS, Albanese CT, Feldsein VA, Jennings RW, Housley HT, Beech R, et al. Prospective analysis of lung-to-head-ratio predicts survival for patients with prenatally diagnosed congenital diaphragmatic hernia. J Pediatr Surg. 1997; 32: 1634-1636. [ Links ]
52. Harrison MR, Mychaliska GB, Albanese CT, Jennings RW, Farrell JA, Hawgood S, et al. Correction of congenital diaphragmatic hernia in utero IX: fetuses with poor prognosis (liver herniation and low lung-to-head-ratio) can be saved by fetoscopic temporary tracheal occlusion. J Pediatr Surg. 1998; 33: 1017-1022. [ Links ]
53. Albanese CT, Lopoo J, Goldstein RB, Filly RA, Feldstein VA, Calen PW, et al. Fetal liver position and perinatal outcome for congenital diaphragmatic hernia. Prenatal Diagn. 1998; 18: 1138-1142. [ Links ]
54. Hubbard AM. Ultrafast fetal MRI and prenatal diagnosis. Semin Pediatr Surg. 2003; 12: 143-153. [ Links ]
55. Harrison MR, Adzick NS, Flake AW, Jennings RW, Estes JM, MacGillivray TE, et al. Correction of diaphragmatic hernia in utero VI. Hard-earned lessons. J Pediatr Surg. 1993; 28: 14411-1418. [ Links ]
56. Crombleholme TM, Albanese CT. The fetus with airway obstruction. En: Harrison MR, Evans MI, Adzick NS, Holzgreve W (editores) The unborn patient. The art and science of fetal therapy. Philadelphia: Saunders; 2001. p. 357- 372. [ Links ]
57. Lim FY, Crombleholme TM, Hedrick HL, Flake AW, Johnson MP, Howell LJ, et al. Congenital high airway obstruction syndrome: natural history and management. J Pediatr Surg. 2003; 38: 940-945. [ Links ]
58. DiFiore JW, Fauza DO, Slavin R, Peters CA, Fackler JC, Wilson JM Experimental fetal traqueal ligation reverses the structural and physiological effects of pulmonary hypoplsia in congenital diaphragmatic hernia. J Pediatr Surg. 1994; 29: 248-256. [ Links ]
59. Papadakis K, Luks FI, Deprest JA, Evrad VE, Flageole H, Miserez M, et al. Single-port tracheoscopic surgery in the fetal lamb. J Pediatr Surg. 1998; 33: 918-920. [ Links ]
60. Deprest J, Gratacos E, Nicholaides KH. Fetoscopic tracheal occlusion (FETO) for severe congenital diaphragmatic hernia: evolution of a technique and preliminary results. Ultrasound Obstet Gynecol. 2004; 24: 121-126. [ Links ]
61. Bouchard S, Johnson MP, Flake AW, Howell LJ, Myers LB, Adzick NS, et al. The EXIT procedure: experience and outcome in 31 cases. J Pediatr Surg. 2002; 37: 418-426. [ Links ]
62. Hedrick HL. Ex utero intrapartum therapy. Semin Pediatr Surg. 2003; 10: 190-195. [ Links ]
63. Hirose S, Farmer DL, Lee H, Nobuhara KK, Harrison MR. The ex utero intrapartum treatment procedure: looking back at the EXIT. J Pediatr Surg. 2004; 39: 375-380. [ Links ]
64. Harrison MR, Keller RL, Hawgood SB, Kittermann JA, Sandberg PL, Farmer DL, et al. A randomized trial of fetal endoscopic tracheal occlusion for severe fetal congenital diaphragmatic hernia. N Engl J Med. 2003; 349: 1916-1924. [ Links ]














