Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.16 no.1 Bogotá Jan./June 2008
ARTÍCULO ORIGINAL
IMPACTO DE UNA POLÍTICA DE RESTRICCIÓN DE USO DE ANTIBIÓTICOS EN LA UNIDAD NEONATAL DEL HOSPITAL MILITAR CENTRAL
THE IMPACT OF AN ANTIBIOTIC RESTRICTION POLICY IN THE INTENSIVE CARE UNIT AT THE HOSPITAL MILITAR CENTRAL
IMPACTO DE UMA POLITICA DE RESTRIÇÃO DE USO DE ANTIBIÓTICOS NA UNIDADE NEONATAL DO HOSPITAL MILITAR CENTRAL DE BOGOTA
CLARA ESPERANZA GALVISa*, ANA CRISTINA MARIÑOa, JENNIFER MONROYa Y HÉCTOR POSSOb
a Servicio de Pediatría, Hospital Militar Central, Bogotá, D.C., Colombia.
b Centro de Investigaciones, Facultad de Medicina, Universidad Militar Nueva Granda, Bogotá, D.C., Colombia.
* Correspondencia: gdclari@gmail.com. Dirección postal: Servicio de Pediatría, Hospital Militar Central, Octavo piso Tr. 3 No. 49-00, Bogotá, D.C., Colombia.
Recibido: Febrero 26 de 2008. Aceptado: Marzo 19 de 2008.
Resumen
Teniendo en cuenta que el uso indiscriminado de antibióticos de amplio espectro ha favorecido la aparición de resistencia bacteriana a múltiples drogas, se realizó un estudio de intervención cuasiexperimental entre enero de 2002 y enero de 2006 en la unidad de cuidados intensivos neonatal (UCIN) del Hospital Militar Central de Bogotá (HMC), en el que se restringió el uso de cefalosporinas de 3ª generación cambiándolas por antibióticos no asociados con inducción de beta-lactamasas de espectro extendido (BLEEs), utilizando piperazilina-tazobactam y cefepime. En el estudio se hizo comparación antes y después de la política de restricción antibiótica en infecciones nosocomiales por gérmenes gram negativos, encontrándose que de 2880 pacientes que ingresaron a UCIN, el 24,5% tuvo diagnóstico de infección y de ellos, el 30,7% correspondió a infecciones hospitalarias. De los gérmenes aislados el 49% correspondió a bacterias gram negativas, con una producción de BLEEs en el 51% de los aislados de Klebsiella pneumoniae, de 28% en los de Escherichia coli, de 14% en los de Acinetobacter baumannii y de 7% en los de Serratia. En el 70% de los casos con presencia de BLEEs se habían utilizado cefalosporinas de III generación.
Luego de la restricción de cefalosporinas de III generación se observó una importante disminución en los aislamientos de los gérmenes productores de resistencia betalactámica (del 20% en el primer periodo, se bajó a menos del 4% en el segundo), es decir que el riesgo producir BLEEs disminuyó casi cinco veces, con una razón de prevalencia de 4,91(IC 95%: 1,14-21,09) y un valor de p=0,031 respecto al periodo anterior, pudiéndose concluir que la adopción de una política de restricción en el uso de antibióticos tuvo un significativo efecto reductor en la incidencia de BLEEs en la UCIN de nuestro hospital, disminuyendo a su vez los costos, pues se redujo el uso de carbapenems.
Palabras clave: Resistencia bacteriana a múltiples drogas, infección hospitalaria, resistencia beta-lactámica.
Abstract
Considering that the indiscriminate use of wide spectrum antibiotics has favour the appearance of bacterial resistance to multiple drugs, a quasi-experiemental intervention study was performed between January 2002 and January 2006, in the neonatal intensive care unit (NICU) of the Hospital Militar Central in Bogotá (HMC), in which the use of cephalosporins of 3th generation was restricted and changed for antibiotics non associated with the induction of beta-lactamases of extended spectrum (ESBLs), by the use of piperacillin-tazobactam and cefepime. A comparison was done before and after the restriction policy was applied in nosocomial infections produced by gram-negative bacteria. It was found that 24, 5% out of 2880 patients were diagnose with infections and among them, 30,7% were nosocomial infection. 49% of isolated germs were Gram-negative bacteria from which 51% of Klebsiella pneumoniae, 28% of Escherichia coli, 14% of Acinetobacter baumannii and 7% of Serratia isolates produced ESBLs. In 70% of the ESBLs cases, cephalosporins of 3er generation were used.
After restriction of cephalosporins of 3 th generation an important decreased in the number of beta-lactamic resistance isolates were observed (from 20% during the first period to less than 4 % during the second), which means that the risk of ESBLs production decreased five times, with a ratio of prevalence of 4,91 (IC 95%: 1,14-21,09) and a p value of 0,031 with respect to the previous period. It can be conclude that the adoption of a restriction policy in the use of antibiotics had a significant reductor effect on the incidence of ESBLs in NICU of our Hospital, which implies a reduction of costs as the use of carbapenems was also reduced.
Key words: Drug resistance multiple bacterial, cross infection, beta-lactam resistance.
Resumo
Tendo em conta que o uso indiscriminado de antibióticos de amplo espectro favoreceu a aparição de resistência bacteriana a numerosos medicamentos, realizou-se um estudo de intervenção experimental entre janeiro de 2002 e janeiro de 2006 na unidade de terapia intensivos neonatal (UTIN) do Hospital Militar Central de Bogotá, no que se restringiu o uso de cefalosporinas de III geração mudando-as por antibióticos não associados com indução de beta-lactamasas de espectro estendido (BLEEs), utilizando piperazilina-tazobactam e cefepime. No estudo se fez comparação antes e depois da política de restrição antibiótica em infecções nosocomiais por bactérias gram negativos, encontrando-se que de 2880 pacientes que ingressaram a UTIN, o 24,5% teve diagnóstico de infecção e deles, o 30,7% correspondeu a infecções hospitalares. Dos germens isolados o 49% correspondeu a bactérias gram negativas, com uma produção de BLEEs no 51% dos isolados de Klebsiella, de 28% nos de Escherichia coli, de 14% nos de Acinetobacter e de 7% nos de Serratia. No 70% dos casos com presença de BLEEs se tinham utilizado cefalosporinas de III geração.
Depois da restrição de cefalosporinas de III geração se observou uma importante diminuição nos isolamentos dos germes produtores de resistência beta-lactámica (do 20% no primeiro período, baixou-se a menos do 4% no segundo), isto é que o risco produzir BLEEs diminuiu quase cinco vezes, com uma razão de prevalência de 4,91(IC 95%: 1,14-21,09) e um valor de p=0,031 com respeito ao período anterior, podendo-se concluir que a adoção de uma política de restrição no uso de antibióticos teve um significativo efeito redutor na incidência de BLEEs na UTIN de nosso hospital, diminuindo a sua vez os custos, pois se reduziu o uso de carbapenems.
Palavras-chave: Resistência bacteriana a múltiplas drogas, infecção hospitalar, resistência beta-lactâmica.
Introducción
Las infecciones nosocomiales se consideran un problema de salud pública. Según datos de la Organización Mundial de la salud (OMS), aproximadamente el 20 % de los recién nacidos (RN) en países en vías de desarrollo presentan un cuadro de infección y de ellos, el 1% fallece por sepsis neonatal. En países desarrollados la incidencia oscila entre 1/500 a 1/1600 recién nacidos vivos (RNV), siendo de cerca de 1/1000 en recién nacidos a término (RNT) y de 1/230 en recién nacidos de bajo peso (RNBP) en hospitales de nivel III. De los ingresos a unidades de cuidado intensivo (UCI), entre el 15% y el 40% corresponden a infección, con una mortalidad que varía entre el 10% y el 80% (1).
La resistencia bacteriana es reconocida como una amenaza mundial, considerándose hoy en día como la consecuencia inevitable del uso de antibióticos; en Estados Unidos por ejemplo, el CDC (Centres for Disease Control and Prevention) estableció como una de sus prioridades, la lucha contra la resistencia bacteriana(2). La diseminación de las bacterias multiresistentes en el ámbito hospitalario principalmente en las UCI también es tema de gran preocupación, agravada por el aumento en el uso indiscriminado de antibióticos de amplio espectro que indiscutiblemente ha favorecido la aparición de patógenos multiresistentes y por ende, incrementos en la morbimortalidad y en los costos hospitalarios.
En el caso de los neonatos, cuyo sistema inmune no está totalmente desarrollado, se facilita la aparición de infecciones, asociadas a otros factores de riesgo claramente descritos en la literatura como son la corioamnionitis materna, la ruptura prematura de membranas, la prematurez(3), la estancia prolongada en UCI, los procedimientos invasivos y el previo uso de antibióticos en la madre(4, 5). Estos factores, aunados a la dificultad en el diagnóstico por una clínica inespecífica y a que los hallazgos de laboratorio reportan cambios muy sutiles, han llevado al sobretratamiento con antibióticos(6).
En los RNT y en los RNBP los bacilos Gram negativos son una causa importante de infecciones nosocomiales(7), siendo Escherichia coli, Klebsiella pneumoniae, Enterobacter, Serratia y Pseudomonas(8) los gérmenes aislados con más frecuencia. Como muchos de estos patógenos son resistentes a los antimicrobianos comúnmente empleados, cada UCIN debe conocer los patrones de susceptibilidad antibiótica.
Las BLEEs, cuya distribución es mundial, se definen como un grupo numeroso y heterogéneo de enzimas que hidrolizan cefalosporinas de tercera generación y aztreonam, siendo inhibidas por el ácido clavulanico, por el tazobactam y en menor grado por el sulbactam(9). En gérmenes Gram negativos su producción constituye el mecanismo predominante de resistencia a los antibióticos betalactamicos(10) y el uso extensivo de antibióticos de amplio espectro está asociado con importantes cambios en los microrganismos implicados en las infecciones neonatales y en su susceptibilidad a los antibióticos(11, 12). Ejemplo de ello es el uso rutinario de cefalosporinas de tercera generación como terapia empírica, el cual promueve la aparición de brotes de organismos productores de BLEEs, motivo que no hace recomendable esta práctica(13, 14). En América Latina la aparición de BLEEs se ha incrementado hasta niveles del 45%(15) y en Colombia se ha reportado entre el 12% y el 71%(16, 17).
La restricción de cefalosporinas de 3ª generación y el reemplazo por antibióticos no asociados a producción de BLEEs (piperazilina, tazobactam y cefipime) permite recuperar la sensibilidad antibiótica y un menor uso de carbapenems, con la correspondiente disminución de costos (18, 22).
Metodología
Se realizó un estudio cuasiexperimental de comparación antes y después de la implementación de una política de restricción antibiótica en infecciones nosocomiales por gérmenes Gram negativos entre enero de 2002 y enero de 2006 en la UCIN del Hospital Militar Central, sin utilizar grupo control.
La muestra se conformó por todos los recién nacidos menores de un mes de edad corregida (que toma en cuenta la diferencia de semanas entre la semana de nacimiento y la semana 40) que ingresaron a la UCIN entre enero de 2002 y enero de 2006, con sospecha de infección clínica (fiebre, inestabilidad hemodinámica, distermias, mala perfusión, polipnea) o paraclínica (leucocitosis > 35.000 o leucopenia < 5000, PCR positiva y relación cayados neutrófilos >0,2). A todos se les realizó dos cultivos y sus respectivos antibiogramas, antes y después de la política de cambio antibiotico, comparándose la presencia de resistencia dada por la presencia de betalactamasas de espectro extendido en los reportes de laboratorio clínico.
Las variables tenidas en cuenta fueron edad, sexo, peso, estancia hospitalaria, factores de riesgo, uso de antibióticos en la madre, procedimientos invasivos, uso de antibióticos previos en el RN y reportes de cultivos con microorganismo aislado y prueba de sensibilidad (en cuanto a edad, sexo, peso y procedimientos invasivos, los dos grupos fueron comparables). La variable dependiente que se tomó en cuenta fue la resistencia dada por BLESS
Inicialmente se aplicó un formulario estandarizado para la recolección de datos, los que se analizaron con el programa SPSS 13.0. Para la comparación de los promedios se usaron pruebas de significancia estándares (t-student), y para la comparación de proporciones pruebas no paramétricas (χcuadrado y prueba exacta de Fisher), usándose el valor de p= <0,05 como límite de significancia.
Resultados
De 2880 pacientes que ingresaron a UCIN en el lapso de tiempo estudiado, el 24,5% tuvo diagnóstico de infección, con una tasa de infección nosocomial del 7,53%. El 49% de los gérmenes aislados correspondió bacterias Gram negativas, el 45% a Gram positivas y el 6% a hongos. Los casos de infección por gérmenes Gram negativos se dividieron en dos grupos, cada uno de dos años, antes y después del cambio de política en el uso de antibióticos con restricción de cefalosporinas de 3ª generación y de su reemplazo por antibióticos no asociados a inducción de producción de BLEEs (piperazilina/tazobactam-cefipime), manteniendo las mismas políticas de asepsia y de antisepsia en los dos periodos, sin observar diferencias relevantes en cuanto a las variables analizadas (Tabla 1) y manteniendo el mismo porcentaje (15%) de pacientes remitidos.
En el primer periodo se presentaron 56 casos de infección y en el segundo periodo 50. Los gérmenes Gram negativos que se aislaron correspondieron en un 51% de los casos a Klebsiella pnemoniae, en un 28,3% a Escherichia coli, en un 14,1% a Acinetobacter baumannii y en un 6,6% a Serratia. En cuanto a la producción de BLEEs, el 46% correspondió a Klebsiella pnemoniae, el 23% a Escherichia coli, el 23% a Acinetobacter baumannii y el 8% a Serratia marcences.
Los factores de riesgo asociados a la presencia de BLEEs se establecen en la tabla 2, apreciándose que uso de antibiótico previo, la prematurez y el antecedente de infección materna son los de mayor riesgo. Para cada grupo, el promedio de estancia en días fue de 22,53 y de 17 días respectivamente.
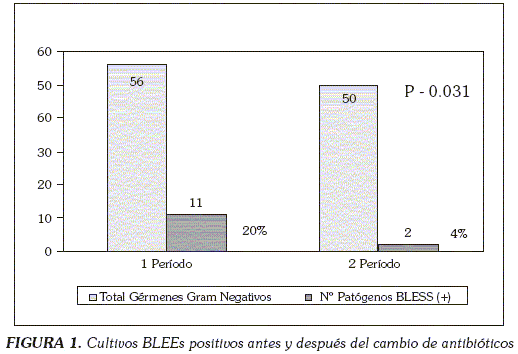
El riesgo de ser productor de BLESS disminuyó casi cinco veces con una razón de prevalencia de 4,91(IC 95%: 1,14-21,09) y con un valor de p = 0,031 respecto al periodo anterior (Figura 1). En el 70% de los casos en que se aislaron patógenos productores de BLEEs, se habían utilizado cefalosporinas de 3ª generación. En el segundo periodo se encontraron solamente dos casos de BLEEs, uno por K. pneumoniae y otro por A. baumannii.
Discusión
La frecuencia de las infecciones intrahospitalarias es mayor en instituciones de alto índice ocupacional y en servicios de alto riesgo como son las unidades de cuidado intensivo, las salas de maternidad, las salas de parto y las unidades de quemados(23) A escala mundial, aproximadamente catorce millones de personas hospitalizadas presentan infecciones nosocomiales anualmente, cifra que en Estados Unidos asciende a dos millones y en Europa hasta siete millones de pacientes.(24)
En América Latina la aparición de patógenos Gram negativos productores de BLEEs se ha incrementado a niveles hasta del 45%(25), y en Colombia, en donde el fenómeno se viene detectando desde 1990, no se cuenta con datos exactos de su incidencia y prevalencia. Sin embargo, hay reportes en unidades pediátricas y neonatales que hablan de rangos entre el 12% y el 71%(26). En el Hospital Militar Central, para el año 2004, solamente en la Unidad de Cuidado Intensivo Neonatal y Pediátrica se encontró una incidencia de infección nosocomial del 20%.
Teniendo en cuenta que la restricción de cefalosporinas de 3ª generación y su reemplazo por antibióticos no asociados a inducción de producción de BLEES (piperazilina/tazobactam-cefipime) permite recuperar sensibilidad antibiótica, un menor uso de carbapenems y su consecuente disminución de costos (27-31), se debiera de evitar el uso rutinario de este antibiótico como terapia empírica, reduciéndose de esta manera la promoción de brotes de microrganismos productores de BLEEs. La mayoría de estudios reportados se han realizado en unidades de cuidado intensivo de adultos y sólo recientemente en la literatura pediátrica se empiezan a encontrar reportes sobre políticas de restricción antibiótica (32, 33), que como la practicada en este trabajo, tuvo resultados exitosos.
La tasa de infección nosocomial en la UCIN del HMC fue de 7,53%, demostrada por la positividad de cultivos realizados en el 24,5% de las muestras procesadas, datos que coinciden con otras series a internacionales (27-33).
Dentro de las medidas establecidas para el control y prevención de la aparición de betalactamasas de amplio espectro se encuentra la prevención de la diseminación de paciente a paciente, el uso de barreras de contacto (lavado estricto de manos, uso de alcohol isopropílico), el fortalecimiento de los laboratorios clínicos, el seguimiento y conocimiento estricto de la flora bacteriana de cada institución, la optimización en la selección y en la duración de la terapia empírica antimicrobiana, la restricción del uso de antimicrobianos y la prescripción aprobada por los comités de infecciones(34), las cuales ya están implementadas en el HMC. La restricción en el uso de cefalosporinas de 3ª y de 4ª generación y su sustitución por drogas alternativas tipo carbapenem como el imipenem, o por la combinación de un antibiótico betalactámico con un inhibidor de betalactamasas tal como piperacilina–tazobactam(35) se realizó en este estudio, demostrándose una reducción significativa en la incidencia infecciones por patógenos productores de BLEES, posterior al cambio en la política antibiótica(36).
Es importante resaltar que cuando no se cuenta con estudios experimentales controlados, los estudios de evaluación de impacto de una intervención no son fáciles de interpretar. De hecho, en los estudios de evaluación de impacto de antes y después, como sucede en este caso, los cambios en el efecto observado no siempre se pueden atribuir en su totalidad a la instauración de la medida implementada (política de restricción de uso de antibióticos). Sin embargo y pese a las limitaciones, se trata de herramientas útiles para evaluar impacto en medidas de salud pública y son de amplio uso en varios y previos contextos. Son muchas las razones, dentro de ellas la de carácter ético, que no siempre facilitan la realización de ensayos clínicos que evalúen este tipo de medidas.
Referencias
1. Khalid H. Definitions of bloodstream infection in the newborn. Pediatr Crit Care Med. 2005;6(3):232-39. [ Links ]
2. Siegel R, Jackson M. Management of multidrug resistant organisms in Healthcare. The Healthcare infection Control practices Advisory committee. 2006. [ Links ]
3. Urrea M, Pons M, Krauel X, Latorre C, Martin M, Campins M. Nosocomial infections in paediatric and neonatal intensive care units. Journal of Inf. 2007;54:212-220. [ Links ]
4. Towers C, Briggs G. Antepartum use of antibiotics and early-onset neonatal sepsis: the next 4 years. Am J Obstet Gynecol. 2002;187:495–500. [ Links ]
5. Joachim F. Physicians ability to diagnose sepsis in newborns and critically ill children. Pediatr Crit Care Med. 2005;6(3):132-38. [ Links ]
6. Jeffrey G. Diagnosis and management of bacterial infections in the neonate Pediatr Clin N Am. 2004:51:939–959. [ Links ]
7. Van der Zweta W, Fetterb G. Nosocomial infections in a Dutch neonatal intensive care unit: surveillance study with definitions for infection specifically adapted for neonates. Journal of Hospital Infection. 2005;61:300–311. [ Links ]
8. Villegas MV, Kattán JN, Quinteros MG, Casellas JM. Prevalence of extended spectrum beta-lactamases (ESBLs) in Europe and in the rest of the world: differences and similarities with south America. Clin Microbiol Infect. 2007;4:42-50. [ Links ]
9. Paterson J. Bottom line- dont use cephs vs. ESBL producers. JCM. 2001;39:2206-11. [ Links ]
10. Torres JA, Villegas MV, Quinn JP. Current concepts in antibiotic-resistant Gram negative bacteria. Expert. Rev. Anti Infect. Ther. 2007;5(5):833-843. [ Links ]
11. Kaltan J, Suarez C, Correa A, Villegas M.V. Mecanismos de resistencia bacteriana en Gram negativos. CEDEIM. 2005: 3-6. [ Links ]
12. Jacoby G, Muñoz-Price LS. The new beta-lactamases. N Eng J Med. 2005;352(4):380-391. [ Links ]
13. Benjamin B, Stoll B. Infection in late preterm infants. Clin Perinatol. 2006;33:871–882. [ Links ]
14. Benjamin D, DeLong E. Mortality following blood culture in premature infants: increased with gram-negative bacteremia and candidemia, but not grampositive bacteremia. J Perinatol. 2004;24:175–80. [ Links ]
15. Sandrea L, Pas-Montes A. Enterobacterias productoras de betalactamasas de expectro extendido aisladas de hemocultivos en un hospital universitario de Venezuela. Kasmera. 2007;35(1):15-25. [ Links ]
16. Villegas MV, Correa A, Perez F, Zulluaga T, Radice M. The Colombian Nosocomial Resistance Study Group. CTX –M-2 beta lactamase in a Klebsiella pneumoniae clinical islate in Colombia. Antimicrob Agent Chemother. 2004;48(2):629-631. [ Links ]
17. Miranda MC, Perez F, Zuluaga T, Olivera MR, Correa A. Grupo de Resistencia Bacteriana Nosocomial de Colombia. Biomedica. 2006;26:424-433. [ Links ]
18. Fifel O, Friedman S, Bardenstein R. Disminución de las Infecciones Intrahospitalarias multiresistentes en neonatos después de sustituir ceftazidima por piperazilina-tazobactam en el tratamiento antibiótico empírico. Acta Paeditric. 2003;92:1205-1207. [ Links ]
19. Schuchat A, Zywiki SS, Dinsmoor M. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case control study. Pediatrics. 2000;105:21–26. [ Links ]
20. Hyde TB, Hilger TM, Reingold A, Farley MM, OBrien KL, Schuchat A. Trends in incidence and antimicrobial resistance of early-onset sepsis: population-based surveillance in San Francisco and Atlanta. Pediatrics. 2002;110:690–695. [ Links ]
21. Stoll BJ, Hansen N, Fanaroff A. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med. 2002;347:240–247. [ Links ]
22. Lee N. Yuen K. Clinical Role of B-lactam/B-lactamase inhibitor combinations. Drugs. 2003;63(14):1511-1524. [ Links ]
23. Mahieu L, De Muynck A, De Dooy J. Prediction of nosocomial sepsis in neonates by means of a computer weighted bedside scoring system (NOSEP-score). Crit Care Med. 2000;28:2026–2033. [ Links ]
24. Rahal J. Extended-spectrum B-lactamases: how big is the problem? Clin Microbiol Infect. 2000:(2): 2-6. [ Links ]
25. Negri M. Morosini J. Antibiotic resistance in hospital infections: The role of the newer cephalosporins. Clin Microbiol Infect. 2000;6(3):95-97. [ Links ]
26. Secretaría Distrital de Salud. Protocolos de Vigilancia en Salud Pública. 2001:75-82. [ Links ]
27. Fifel O, Friedman S, Bardenstein R. Disminución de las Infecciones Intrahospitalarias multiresistentes en neonatos después de sustituir ceftazidima por piperazilina-tazobactam en el tratamiento antibiótico empírico. Acta Paeditric. 2003;92:1205-1207. [ Links ]
28. Schuchat A, Zywiki SS, Dinsmoor M. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case control study. Pediatrics. 2000;105:21–26. [ Links ]
29. Hyde TB, Hilger TM. Trends in incidence and antimicrobial resistance of early-onset sepsis: population-based surveillance in San Francisco and Atlanta. Pediatrics. 2002;110:690–695. [ Links ]
30. Stoll BJ, Hansen N, Fanaroff A. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med. 2002;347:240–247. [ Links ]
31. Lee N. Yuen K. Clinical Role of B-lactam/B-lactamase inhibitor Combinations. Drugs 2003;63(14): 1511-1524. [ Links ]
32. Metjian T, Prasad P. Evaluation of an antimicrobial stewardship at pediatric teaching hospital. Pediatr Infect Dis J. 2008;27:106–111. [ Links ]
33. Kilbride D, Powers RJ. Sheehan M. implementation of evidence-based potentially better practices to decrease nosocomial infections. Pediatrics. 2003;111:519–533. [ Links ]
34. Schito S. Is antimicrobial resistance also subject to globalization? Clin Microbiol Infect. 2002;8(3):1-8. [ Links ]
35. Perry C. Markham A. Piperaziline/tazobactam: an update review of its use in the treatment of bacterial infections. Drugs. 1999;57(5):805-843. [ Links ]
36. Bush K. New B-Lactamases in Gram Negative Bacteria: Diversity and Impact on the selection of antimicrobial therapy. CID 2001;32:1085-1089. [ Links ]














