Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.16 no.1 Bogotá Jan./June 2008
ARTÍCULO DE REVISIÓN
DERRAME PLEURAL EOSINOFÍLICO POR HIDATIDOSIS HEPÁTICA. PRESENTACIÓN DE CASO CLÍNICO Y REVISIÓN DE LA LITERATURA
EOSINOPHILIC PLEURAL EFFUSION BY HEPATIC HYDATIDOSIS: CASE REPORT AND LITERATURE REVIEW
DERRAME PLEURAL EOSINOFÍLICO POR HIDATIDOSIS HEPÁTICA. APRESENTAÇÃO DE CASO CLÍNICO E REVISÃO DA LITERATURA
ALIRIO BASTIDASa*, JUAN CARLOS VELÁSQUEZb Y CARLOS E. PÉREZ M.c, d
a Servicio de Medicina Interna, Hospital Militar Central, Bogotá, D.C., Colombia.
b Clínica del Country, Bogotá, D.C., Colombia.
c Facultad de Medicina, Universidad de la Sabana, Bogotá, D.C., Colombia.
d Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, D.C., Colombia.
* Correspondencia: aliriorodrigo@yahoo.com. Dirección postal: Servicio de Medicina Interna, Hospital Militar Central, Tr. 3 No. 49-00, Bogotá, D.C., Colombia.
Recibido: Noviembre 27 de 2007. Aceptado: Enero 30 de 2008.
Resumen
La hidatidosis, producida por estados larvales del género Echinococcus es una entidad infrecuente en nuestro medio y la información local corresponde a reportes y a series de casos, sin que se tenga una información precisa acerca de su epidemiología y manejo, en especial para los casos complicados. A continuación se presenta un caso de hidatidosis hepática que se manifestó como un derrame pleural eosinofílico comprobado por serología y manejado con terapia combinada con albendazol y con la técnica de PAIR (punción, aspiración, instilación, reaspiración), reportada por primera vez en Colombia con un resultado exitoso. También se hace una revisión de la literatura acerca del compromiso toráxico en esta condición, definiendo los aspectos más relevantes a tener en cuenta en su etiología, fisiopatología, manifestaciones clínicas y manejo.
Palabras clave: Hidatidosis, Echinococcus, derrame pleural.
Abstract
Echinococcosis due to larval stages from the Echinococcus is an infrequent disease in our environment and there is no precise local information about its epidemiology and management, especially in complicated cases, having only available information through series of cases and reports. We present a case of hepatic hydatidosis that appeared as an eosinophilic pleural effusion serologically confirmed, treated with combined therapy with albendazol and the percutaneous aspiration-injection-reaspiration drainage technique (PAIR) which was for the first time reported in Colombia with successful results. In our country, there is few written literature about this entity, on account of which it is valuable to review the most relevant issues about its diagnosis and therapy.
Key words: Echinococcosis, Echinococcus, pleural effusion.
Resumo
A equinococose, produzida por estados larvais do gênero Echinococcus é uma entidade infreqüente em nosso meio e a informação local corresponde a reportes e a séries de casos, sem que se tenha uma informação precisa a respeito de sua epidemiologia e manejo, em especial para os casos complicados. A seguir se apresenta um caso de equinococose hepática que se manifestou como um derrame pleural eosinofílico comprovado por sorologia e manejado com terapia combinada com albendazol e com a técnica de PAIR (punção, aspiração, instilação, re aspiração), reportada pela primeira vez em Colômbia com um resultado bem sucedido. Também se faz uma revisão da literatura a respeito do compromisso torácico nesta condição, definindo os aspectos mais relevantes a ter em conta em sua etiologia, fisiopatologia, manifestações clínicas e tratamento.
Palavras-chave: Equinococose, Echinococcus, derrame pleural.
Caso Clínico
Paciente de 31 años de edad, natural, residente y procedente de Quibdó (Chocó), remitido al servicio de urgencias del Hospital Militar Central de Bogotá por un cuadro clínico de doce días de evolución que inició con dolor pleurítico en hemitórax derecho y disnea leve. Seis días después del inicio de los síntomas decidió consultar, realizándose rayos X de tórax que reveló derrame pleural derecho (Figura 1), para el que se inició manejo antibiótico con ampicilina sulbactam. Como luego de seis días de tratamiento se observó persistencia del derrame, se remite al Hospital Militar Central de Bogotá.
El paciente, previamente sano y consumidor ocasional de licor y cigarrillo, negó pérdida de peso, historia de tuberculosis, contacto con sintomáticos respiratorios y antecedentes quirúrgicos, traumáticos y transfusionales. Tampoco tenía historia de alergias ni de enfermedades de transmisión sexual. Veinte días antes había sufrido un cuadro clínico consistente en malestar general, tos con expectoración hialina que posteriormente se tornó amarillenta y que se autolimitó tres días después de su inicio.
Al examen físico de ingreso se encontraba en buenas condiciones generales, con signos vitales normales y mucosas húmedas. En el tórax había matidez a la percusión en el tercio inferior del hemitórax derecho y disminución del murmullo vesicular ipsilateral. No se auscultaban estertores, los ruidos cardíacos rítmicos, sin soplos y el abdomen sin hepatomegalia ni esplenomegalia. El cuadro hemático de ingreso no mostró alteración, la velocidad de sedimentación se encontraba en 20, la función renal, los electrolitos y los tiempos de coagulación fueron normales y los gases arteriales mostraron alcalosis metabólica sin trastorno de oxigenación.
En urgencias se suspendieron los antibióticos, se le realizó una ecografía y una punción torácica sin que se lograra obtener muestra para su estudio, por lo que se decidió su hospitalización. Durante las 24 horas posteriores a la misma el paciente permaneció estable, se le repitió toracentesis guiada por ecografía y se obtuvieron 150 ml de un líquido turbio, amarillo, con pH de 7,4. La glucemia fue de 83 mg, la LDH de 211 mg y la albúmina de 2,9 g. El cuadro hemático mostró 2.160 hematíes por mm3 y 11.150 leucocitos por mm3, con un 6% de neutrófilos, un 17% de linfocitos y un 77% de eosinófilos. La tinción de Gram, la tinción de ZN y el cultivo de líquido pleural fueron negativos y el test de adenosina deaminasa (ADA) fue de 61 U/L (valor normal: 31). Se tomó radiografía de control, visualizándose derrame pleural derecho sin neumotórax.
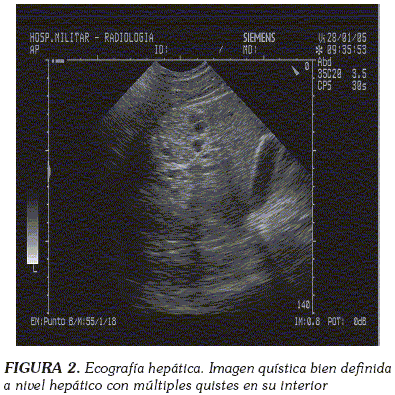
Se realizó una biopsia pleural en la que se observaron abundantes eosinófilos y linfocitos sin granulomas; una ecografía hepática que evidenció en el hígado una imagen quística bien definida con quistes en su interior (Figura 2); una tomografía computarizada toraco-abdominal que mostró, en varios cortes, múltiples quistes de densidad heterogénea compatibles con hidatidosis (Figura 3) y una resonancia nuclear magnética en la que se visualizó un área quística en la zona 6 hepática, sin descartar solución de continuidad en diafragma (Figura 4). Finalmente se realizó una serología para Echinococcus spp. que resultó positiva.
Hidatidosis
Agente etiológico
La enfermedad hidatídica, causada por los estados larvarios de tenias del género Echinococcus es una zoonosis poco frecuente en nuestro medio (1). El ser humano la adquiere al ingerir los huevos del céstodo, que normalmente se expulsan en las heces de los huéspedes definitivos (vertebrados carnívoros). Como los estados larvarios se pueden instaurar en diversos órganos, la enfermedad se expresa con una gran variedad de síntomas clínicos (2,3). Las cuatro especies, E. granulosus, E. multilocularis, E. vogeli y E. oligarthus tienen un patrón geográfico y una presentación clínica establecidas (1-3).
E. granulosus, el más prevalente a nivel mundial, produce hidatidosis en cerca del 90% de los casos y la enfermedad que ocasiona se conoce como hidatidosis unilocular. Es más frecuente en el Mediterráneo, en el Medio y Lejano Oriente y en las zonas más bajas de Sur América. E. multilocularis, ubicado en la región holoártica, es el agente de la hidatidosis alveolar, caracterizada por su curso agresivo y por el mal pronóstico, debido al crecimiento infiltrativo de las lesiones. El E. vogeli y el E. oligarthus son los responsables de la enfermedad hidatídica poliquística o multilocular reportada en Centro y Sur América (1-4), aunque sigue siendo discutido por algunos, el papel patógeno de E. oligarthus en la hidatidosis humana.
Ciclo de vida del parásito
El ser humano, que se comporta en este caso como huésped intermediario accidental, adquiere la hidatidosis al ingerir los huevos de Equinococcus en alimentos, agua, u otras fuentes contaminadas con las heces de los huéspedes definitivos, que en general son mamíferos carnívoros como perros y zorros (1-4), condición que excluye el contagio de hombre a hombre. Luego de la ingesta de los huevos, los embriones u oncosferas se liberan en el intestino delgado, penetran la pared y por la circulación porta y luego por la circulación sistémica, alcanzan primordialmente el hígado (65-70%) y en segundo lugar en el pulmón (25%), en donde se vacuolan y se inicia el proceso de formación de los quistes, constituidos por una capa acelular y por una capa germinativa, ambas de origen parasitario, llenos en su interior de líquido hidatídico. Estos quistes son fértiles cuando la capa germinativa da lugar a protescólices, e infértiles, cuando los protescólices no se forman, desconociéndose las razones exactas que llevan a uno u otro desarrollo. A medida que crece, el quiste se llenas de protoscólices, de quistes hijos y de ganchos que se desprenden de los proteescólices y que tienen una morfología característica en las diferentes especies de Echinococcus. Como respuesta a la invasión parasitaria, el huésped genera la formación de la capa adventicia más externa. Con menor frecuencia, los quistes pueden tener múltiples localizaciones: muscular (5%), ósea (3%), renal (1%), cardíaca (1%), esplénica (1%), pancreática (1%), neurológica (1%), ocular, subcutáneo, etc. Se debe tener en cuenta que un 20% a 40% de los pacientes albergan múltiples quistes (1-4).
Para que el ciclo del metacéstodo se complete es indispensable que las vísceras de los huéspedes intermediarios -que contienen las hidátides- sean ingeridas por los huéspedes definitivos. En la forma unilocular, es el perro quien come las vísceras de ovejas; en la multilocular, el zorro quien come las vísceras de roedores y en la poliquística, los perros de monte los que comen las vísceras de las guaguas o pacas (1-4). Cuando esto sucede las capas del quiste se desintegran dejando libres los proteoescólices, que posteriormente se desarrollan a parásitos adultos en el intestino delgado, a cuya mucosa se adhiereren por medio de ganchos que se encuentran en el escólex. Como la infección con parásitos adultos es múltiple, la eliminación de huevos en la materia fecal es abundante, facilitando así la generación de nuevos ciclos (1-4).
Epidemiología
La enfermedad hidatídica es endémica en el Oriente Medio, en el Mediterráneo, en el Sur de Latinoamérica, en Australia, en India y en el Noroccidente de China, con una incidencia que está en un rango de 1 a 220 casos por 100.000 habitantes dependiendo del área geográfica. En Grecia, por ejemplo, es de 13 por 100.000 habitantes, en algunas provincias de Argentina de 143 por 100.000 habitantes en Hinjand, provincia de China, de 197 por 100.000 habitantes y en Turkana, distrito de Kenia, de 220 por 100.000 habitantes. En Estados Unidos los casos reportados corresponden en su mayoría a inmigrantes, o a viajeros que provienen de áreas altamente endémicas (6, 7). Las formas unilocular y alveolar son las presentaciones de mayor impacto en las áreas endémicas y en Colombia, en donde sólo se ha descrito la forma poliquística, se la considera una entidad poco frecuente, desconociéndose su incidencia (8).
El derrame pleural eosinofílico, definido como un recuento mayor de 10% de eosinofilos del conteo diferencial de células en el líquido pleural (9, 10) es poco frecuente en la enfermedad hidatídica, se produce por la ruptura de quistes hepáticos, pulmonares o mediastínicos (11,12) y dependiendo de la región geográfica estudiada, se considera a la hidatidosis como su causa, en un pequeño porcentaje de los casos (13, 14). En Turquía, por ejemplo, hasta un 6% de la hidatidosis pulmonar se complica con derrame pleural (15).
Fisiopatología e inmunología
Al igual que la cisticercosis, la hidatidosis es un parasitismo invasivo que afecta las vísceras sólidas y que induce una reacción inmune, acompañado de eosinofilia, de infiltración de neutrófilos y de elevación de la inmunoglobulina E, no siempre suficiente para erradicar la infección (16-18). La migración de neutrófilos y de eosinófilos es seguida de fibrosis local, lo que conduce a encapsulación del quiste, a que se limite el estímulo antigénico y a que se disminuya la respuesta inflamatoria. Un quiste hidatídico plenamente conformado está constituido, además de la capa germinal (o endoquiste) y de la capa proteica laminar (o ectoquiste), ambas de origen parasitario, por una cápsula externa densamente fibrosa (o periquiste), que se desarrolla como respuesta inmune al parásito y que contiene vasos sanguíneos que proveen de nutrientes al parásito (19-21).
La respuesta inmune contra el quiste limita la diseminación de los protoescólices después de la infección inicial y sus defectos se relacionan con enfermedad progresiva y diseminada, tal y como se observa en pacientes con infección por VIH en fases avanzadas (22). La activación temprana de una respuesta Th1 se relaciona con protección, mientras que la polarización hacia una respuesta Th2 se relaciona con susceptibilidad (23,24). En la infección por E. multilocularis se ha observado un incremento en la expresión de interleuquinas Th2 como son la IL-3, IL-4 y IL-10 y una elevada producción de IL-5, relacionadas con el carácter progresivo de esta enfermedad (25,26). A medida que el quiste envejece, o cuando hay liberación de antígenos parasitarios por drenaje del quiste a una cavidad del cuerpo, a un conducto o a un vaso sanguíneo, se incrementa la respuesta inmune, de manera que la producción sérica de anticuerpos específicos permanece detectable por muchos años y la reacciones de hipersensibilidad tardía también son positivas (27, 28).
La pleura se compromete cuando hay ruptura de un quiste y exposición de los antígenos en la cavidad, hecho que genera un reclutamiento de eosinófilos y que involucra procesos de adhesión, extravasación y llegada a los tejidos similares de otros leucocitos (29). Los eosinófilos son atraídos al espacio pleural por factores quimiotácticos como la IL5, que interviene tanto en la proliferación, como en la migración (30) y por las eotaxinas 1 y 2, miembros de la familia C-C de quimioquinas, que juegan un papel fundamental al unirse al receptor CCR-3 expresado en eosinófilos. Las eotaxinas tienen la habilidad de seleccionar eosinófilos para dirigir su migración y para estimular la actividad inflamatoria en las células a las que son atraídos (31). Finalmente está el papel la proteína básica mayor, una proteína catiónica segregada por los gránulos de los eosinófilos que si bien es tóxica para los parásitos, también causa lisis a las células epiteliales de mamíferos y que en conjunto con las citocinas y quimiocinas, llevan a un derrame de tipo eosinofílico en el espacio pleural (29-31).
Características clínicas
La fase inicial de infección primaria es siempre asintomática y se identifica durante la realización de radiografías de rutina o por otras causas (32). El periodo de incubación no es claro, pudiendo ser de pocos meses a varios años; en muchas ocasiones la enfermedad es adquirida en la edad pediátrica pero sólo se diagnostica durante la tercera o cuarta década de vida (21). Los síntomas aparecen cuando el quiste ejerce efecto de masa sobre las estructuras subyacentes, o cuando hay ruptura o sobreinfección bacteriana de los mismos, hechos que generan una gran variedad de síndromes clínicos, dependiendo del órgano comprometido (8,33-38). Durante el crecimiento del quiste, pequeñas cantidades de su contenido pueden pasar a la circulación sistémica sensibilizando al paciente y cuando eventualmente se dan rupturas espontáneas, o como consecuencia de un acto quirúrgico, se pueden presentar reacciones alérgicas severas con choque anafiláctico y muerte (39-42). La eosinofilia está presente en el 20% al 40% de los casos y suele asociarse a rupturas recientes (43).
En cuanto a la presentación clínica, esta depende del agente etiológico. La hidatidosis unilocular (E. granulosus) se presenta generalmente con un quiste único limitado por tres membranas y su mortalidad es menor del 5%; la forma alveolar (E. multilocularis) es más grave, no tiene membranas limitantes y su mortalidad puede alcanzar del 75% al 100%; finalmente la forma poliquística (E. vogeli) que es la que creemos corresponde al caso ilustrado, se presenta con la formación de varios quistes, sobre todo a nivel hepático y tiene una mortalidad reportada hasta del 75% (43, 44).
Si bien el compromiso pleural puede ser secundario a la diseminación hematógena del contenido quístico desde un foco distante, es más frecuente que la se deba a la ruptura de quistes intrapulmonares, intrahepáticos o mediastínicos (45-47). El gradiente de presión entre las cavidades pleural y abdominal favorece la dirección del quiste hepático hacia el tórax y la compresión e isquemia del diafragma, secundaria a la inflamación alrededor del quiste, junto con la acción química de la bilis en el diafragma, en el pulmón y en la pleura, favorecen igualmente el drenaje hacia esta cavidad. Como después de una ruptura alrededor del 90% de los quistes pierden su fertilidad, la hidatidosis pleural es rara y solamente ocurre en menos del 10% de los episodios (48-50).
Cuando un quiste hidatídico se rompe dentro del espacio pleural el paciente inicia de inmediato el cuadro agudo de la enfermedad, con dolor torácico, disnea y ocasionalmente entra en choque (51). En alrededor del 50% de los pacientes, la ruptura ocurre simultáneamente dentro del espacio pleural y dentro del árbol traqueobronquial (42,52). Frecuentemente los eosinófilos están presentes en el líquido pleural, a menos que se infecte secundariamente (53).
Diagnóstico
En áreas endémicas para hidatidosis el diagnóstico se hace relativamente fácil con el cuadro clínico, con los hallazgos radiológicos, con los test serológicos y con la intradermorreacción positiva (54-56). El compromiso pleural, tema central de esta revisión, es sospechado después del examen citológico del derrame pleural, en el que se demuestren los protoescólices. En áreas no endémicas, por el contrario, los médicos no están familiarizados con la presentación clínica y el diagnóstico es usualmente accidental (57).
Para la infección parasitaria el diagnóstico se basa en:
1) Presencia de masas quísticas al examen físico y comprobado por métodos radiológicos; 2) Hallazgos radiológicos; 3) Pruebas serológicas positivas; 4) Comprobación parasitológica de las membranas del quiste y de los ganchos (57-59).
La enfermedad hidatídica se puede sospechar fuertemente por los hallazgos en estudios radiográficos (58,60) y estos a su vez sirven para su clasificación, su seguimiento (61) y la verificación de ruptura y sus complicaciones (62-64).
Radiografía de tórax: En ella se pueden detectar los quistes a nivel pulmonar y también se pueden visualizar quistes calcificados en otros órganos, proceso que ocurre principalmente a nivel del hígado (65).
Ultrasonido: Es el procedimiento diagnóstico de elección para casos hepáticos, aunque pueden existir hasta un 10% de falsos positivos debido a la presencia de quistes serosos, abscesos o tumores. Las principales características de la enfermedad hidatídica incluyen la demostración de septos dentro del quiste y la formación de quistes hijos (66). La ecocardiografía, por otra parte, se ha utilizado también en la evaluación radiológica de quistes cardiacos (67).
En la actualidad se dispone de una nueva clasificación internacional de imágenes ecográficas para la hidatidosis por E. granulosus, que podría aplicar para E. vogeli y que se puede utilizar para orientar el tratamiento y permitir comparaciones a nivel mundial (66,68). En cuanto a la ocasionada por E. multilocularis, existe el sistema de clasificación imagenológica PNM, en la que P corresponde a la localización hepática del parásito, N al compromiso extrahepático o de órganos vecinos y M a la presencia o ausencia de metástasis a distancia, la cual habla del compromiso de la infección (69).
Tomografía axial computarizada (TAC): Son hallazgos casi patognomónicos la presencia en quistes intactos y de quistes hijos libres, o adheridos a la capa germinal interna. La tomografía, junto con la ecografía, tiene una alta sensibilidad y especificidad, además de que se pueden utilizar en la aspiración percutánea del quiste, de aplicación en el diagnóstico y tratamiento. La tomografía puede dar una aproximación a la situación del quiste; los quistes no complicados tienen forma ovoide con una pared bien definida y bordes que realzan con el medio de contraste: El "signo del menisco" o "signo creciente", caracterizado por la presencia de aire entre el periquiste y la membrana externa, aparece como un crecimiento continúo que destruye los bronquiolos y es considerado por algunos autores como un signo de amenaza de ruptura. El quiste roto se puede manifestar con diferentes signos radiológicos; el "signo del cumbo" o "señal en cáscara de cebolla" se define por la presencia de menisco y un nivel de aire líquido en el endoquiste; el "signo de la azucena en agua" representa el endoquiste que flota en una cavidad parcialmente llena de fluido, si el endoquiste flota en una cavidad llena de fluido se diría de una "masa dentro de la cavidad" (70). La ruptura también se puede relacionar con consolidación adyacente al quiste (70). En la infección por E. vogeli las lesiones poliquisticas demostradas en el TAC que comprometen el hígado o el espacio peritoneal, pueden hacer el diagnóstico (71,72).
Resonancia nuclear magnética: Su utilidad se basa principalmente en la identificación exacta de las características del quiste, tanto en su pared como en su contenido interno. También en la detección de los cambios que se presentan después de la administración del tratamiento y de las complicaciones, como sucede en el caso de ruptura en los diferentes órganos (73,74).
Pruebas serológicas: Son útiles para el diagnóstico y para el seguimiento de los pacientes después del tratamiento quirúrgico o farmacológico (75). Su sensibilidad y especificidad varía de acuerdo a la técnica utilizada, al órgano comprometido y a la especie involucrada y algunos de ellos (76). Algunos de ellos también se usan en la identificación de animales infectados. La intradermorreacción de Casoni, usada en el pasado y basada en la respuesta celular retardada, no es específica y ya no se recomienda (63).
Para la enfermedad unilocular es de elección la detección de anticuerpos mediante diferentes técnicas como ELISA, hemaglutinación indirecta, aglutinación por látex o inmunoblot. Los test de inmunofluoresencia y la inmunoelectroforesis contra el antígeno 5 también tienen aplicación. La medición de IL-4 y la PCR para determinar la expresión de RNA mensajero en las células mononucleares son utilizadas en el seguimiento (77).
En el caso de la forma alveolar el diagnóstico se basa en la combinación de los hallazgos tomográficos y los test serológicos; éstos, tienen además un papel complementario en la detección temprana de la infección, situación importante en esta variedad, ya que el inicio del tratamiento en fases iniciales puede tener impacto en la mortalidad. Los test usados son el Em2 (un antígeno nativo, específico de especie y aislado del metacéstodo de E. multilocularis) y el Em2 plus ELISA, una combinación del Em2 con una proteína recombinante designada II/3-10, la cual se ha utilizado como método de tamizaje en la población (78). El seguimiento se puede realizar con Em2 plus ELISA y con el antígeno Em18, un producto de la degradación del antígeno Em10 de Echinococcus por medio de una proteasa de cisterna, cuya presencia da información de la actividad del quiste (79, 80).
Comprobación parasitológica: La aspiración citológica es particularmente útil en la detección de lesiones pulmonares, renales y en las que los métodos imaginológicos y serológicos no logran confirmar el diagnóstico. La viabilidad de los protoescólices aspirados se puede determinar microcópicamente con varias tinciones, entre ellas la de Ziehl-Neelsen y la tricrómica (81). Los anticuerpos monoclonales contra el Ag-5 se pueden usar para la detección del mismo, en aspirados con aguja fina en pacientes con sospecha de hidatidosis (82).
Complicaciones
Las complicaciones se relacionan con las reacciones alérgicas que pueden ir desde urticaria, hasta un choque anafiláctico (39,40,83) y también con la compresión y la ruptura, las cuales son importantes desde el punto de vista terapéutico. La ruptura se puede presentar hacia el tracto biliar con colangitis y formación de fístulas secundarias, hacia la cavidad pleural, hacia el pulmón y el árbol bronquial, o hacia el peritoneo (12,15,50,84). Debido al la capacidad amiloidogénica de los hidátides, se la relaciona también con el desarrollo de amiloidosis secundaria (85).
Diagnóstico diferencial
El diagnóstico diferencial de la hidatidosis, independiente del órgano afectado, incluye procesos tumorales y abscesos. En cuanto al derrame pleural eosinofílico, la etiología es diversa y puede tener como causas neumotórax, hemotórax, asbestosis pulmonar, infecciones por hongos y micobacterias, traumatismos, neumonías eosinofílicas y derrames paraneumónicos en fase de resolución (86,87).
Tratamiento
El manejo del quiste hidatídico combina la técnica quirúrgica y el tratamiento farmacológico; la extracción de la lesión de manera quirúrgica puede ser curativa y la utilización de quimioterapia es la base para las lesiones no resecables (88). Los procedimientos quirúrgicos se pueden realizar de manera convencional, sea por vía laparoscópica, o mediante drenaje percutáneo, PAIR, cuyas sigla responde a los procedimientos involucrados (P: punción bajo monitoreo ultrasonográfico; A: aspiración del contenido quístico; I: instilación con fármacos antiescolicidas; R: reaspiración de la solución) (88-89).
El tratamiento médico se basa en la utilización de albendazol o mebendazol (90), sin embargo se ha propuesto la utilización de anfotericina B para los casos refractarios y experimentalmente la aplicación de soluciones benzoimidazólicas por punción directa sobre los quistes (91,92). La elección del tratamiento depende de las características clínicas del paciente, del tipo de infección, de la integridad del quiste y del grado de compromiso, dividiendo de esta manera el quiste hidatídico en complicado y no complicado (93,94).
Quiste hidatídico no complicado: La terapia combinada es el método de elección en este caso (89,95), ya que la sola quimioterapia no garantiza la destrucción del quiste (96). Se puede utilizar albendazol a dosis de 10 mg/kg/día dividido en dos tomas y la técnica de PAIR o la cirugía, obteniendo así mayores tasas de éxito y disminución en las recaídas. Esta terapia es eficiente para quistes de gran tamaño o para la presencia de múltiples quistes (97,98-103). La duración de la terapia con albendazol debe ser como mínimo de tres meses, pudiéndose prolongar según la respuesta del paciente. El mebendazol 40-50 mg/kg/día dividido en tres tomas es menos eficaz que el albendazol y la combinación de prazicuantel a dosis de 25 mg/kg/día, en combinación con el albendazol, es más eficaz que la utilización de albendazol sólo y se reserva para casos complicados (94,104).
Hasta el momento no hay suficiente nivel de evidencia para decidir entre el tratamiento quirúrgico radical (pericistectomía y resección hepática) o el conservador (procedimientos que dejan cavidad residual). Sin embargo y en casos seleccionados con fácil acceso quirúrgico, se puede optar por el método radical y cuando hay riesgo de ruptura, o complicaciones por el método conservador (94). La aproximación laparoscópica se considera segura (105,106), sin embargo se necesitan estudios en los que se evalúe la tasa de recurrencia y la omentoplastia asociada con cirugía radical o conservadora y eficiente para prevenir la formación de abscesos profundos (107).
En el caso de la hidatidosis alveolar el albendazol sólo es parasitostático y la quimioterapia se puede prolongar hasta por dos años. La dosis utilizada es de 20mg/kg/día, asociada con una sobrevida aproximada del 80% a los diez años, comparada con menos del 25% en los controles históricos. De ahí la importancia de la detección temprana de la infecciones por E. multilocularis en zonas endémicas (108,109). La cirugía con extracción quirúrgica de la lesión puede ser curativa y el trasplante hepático puede ser empleado en pacientes con equinococosis alveolar. Sin embargo, la inmunosupresión terapéutica puede producir proliferación de metacéstodos remanentes y reactivar sitios metastáticos inaparentes (108,109).
Quiste hidatídico complicado: es un término que se refiere a las complicaciones derivadas de la ruptura del quiste y a la formación de fístulas hacia el tórax, el intestino o el árbol biliar. Su manejo implica una mayor complejidad y existe poco nivel de evidencia acerca de la aproximación quirúrgica o del manejo conservador. En la actualidad se recomienda el estudio cuidadoso de cada paciente, con un manejo individualizado a criterio del médico tratante, siendo oportunas las recomendaciones de centros con experiencia en esta patología para la decisión terapéutica final (48,110-12).
Prevención
La prevención se basa en la aplicación de intervenciones en el control de la infección en los huéspedes definitivos y en las medidas de educación para disminuir el riesgo de transmisión en el hombre como huésped intermediario. En cuanto a las intervenciones en de los huéspedes definitivos se encuentra el control de la población de perros y de zorros, la utilización veterinaria de antiparasitarios como el prazicuantrel y la utilización de vacunas recombinantes (113-115). Para la prevención en el ser humano la educación es el mejor método, basada en medidas de higiene básica y en evitar actividades de riesgo como son las salidas al campo, o acampar en lugares de alta prevalencia (117). En Colombia, el control de los huéspedes definitivos es difícil debido a su distribución silvestre, siendo necesaria la sospecha clínica para un diagnóstico y tratamiento temprano.
Discusión
Describimos un caso de hidatidosis hepática que debutó con derrame pleural eosinofílico, que si bien es una entidad de baja incidencia en nuestra región, entra como parte del diagnóstico diferencial de derrame pleural eosinofílico en pacientes que por sus características sociodemográficas son susceptibles a la infección. Los hallazgos imaginológicos permiteron la sospecha del quiste y su probable ruptura en el espacio pleural, como complicación. En nuestro medio, son estos estudios la principal herramienta diagnóstica para los casos en que se sospecha hidatidosis. De acuerdo a la naciente experiencia, al paciente del caso se le realizó punción, aspiración e instilación con alcohol como parte del tratamiento, con resultados muy satisfactorios. Si bien es una técnica que se utiliza mucho en otras latitudes, es la primera vez que se reporta en nuestro país, con tan buenos resultados.
Agradecimientos
Al servicio de Radiología Del Hospital Militar Central con los Doctores Carlos Triana Radiólogo Intervencionista e Iván Mantilla Residente de Radiología, por la colaboración prestada para el desarrollo del caso y a Mayerly Zapata, Residente de Medicina Interna.
Referencias
1. Botero D, Restrepo M. Parasitosis titulares por larvas de helmintos. En: Botero D, Restrepo M, editores. Parasitosis Humanas. Medellín: CIB; 2003. p. 150-172. [ Links ]
2. King C. Cestodes (Tapeworms). In: Mandell F, Douglas C, editors. Principles and Practice of infectious Diseases. New York: Mosby; 2006. p. 1120- 36. [ Links ]
3. Gottstein B. Hydatid Disease. 2nd edition. London: Mc Graw Hill; 2003. [ Links ]
4. McManus P, Zhang W, Li J, Bartley P. Echinococcosis. The Lancet. 2003;362:1295-304. [ Links ]
5. Rodrigues R, Peixoto J, Figueiredo R, Magalhâes R, Gomes D. An Autochthonous Case of Echinococcus vogeli Rausch and Bernstein, 1972 Polycystic Echinococcosis in the State of Rondônia, Brazil. 2002;97(1):123-126. [ Links ]
6. Schulte C, Krebs B, Jelinek T, Nothdurit D, Von Sonnenburg F, Lôscher T. Diagnostic Significance of Blood Eosinophilia in Returning Travelers. Brief Reports. 2002;34:407-11. [ Links ]
7. Chieki M. Echinococcosis - an Emerging Parasite in the Immigrant Population. American Family Physician, 2002;66:817-820. [ Links ]
8. Gómez G, Córdoba E, Córdoba A. Quiste hidatídico hepático. Rev Col Gastro. 2003;18(3):183-186. [ Links ]
9. Sahn SA, Heffner JE. Pleural fluid analysis. In: Light RW, Lee G, editors. Textbook of Pleural Diseases. New York: Oxford University Press; 2003. p. 1125-136. [ Links ]
10. Evers RJ, Reller LB. Pleural space infections, Microbiology and antimicrobial therapy. Semin Respir Infect. 1999;14:18-30. [ Links ]
11. Aktogu S, Erer O, Yalçin Y, Yuncu G, AydogDu Z. Hydatid Cyst Presenting as an Eosinophilic Pleural Effusion, Case Report. Respirology. 2007;12:462–464. [ Links ]
12. Ahuja SR, Karande S, Koteyar SR, Kulkarni MV. Hepatic Hydatid Cyst Rupturing into Sub-diaphragmatic Space and Pericardial Cavity, Case Report. J Postrad Med. 2001;47:37-39. [ Links ]
13. Martínez M, Cases E, Cordero P, Hidalgo M, Perpiña M, Sanchis F, et al. Diagnostic utility of eosinophils in the pleural fluid. Eur Respir J. 1999;15:166-169. [ Links ]
14. Villena V, López A, Echave J, Alvarez A, Martín P. Estudio prospectivo de 1000 pacientes consecutivos con derrame pleural. Etiología del derrame y características de los Pacientes. Arch Bronconeumol. 2002;38(11):21-26. [ Links ]
15. Ozvaran MK, Ersoy Y, Uskul B, Unver E, Yalcin E, Baran R, et al. Pleural Complications of Pulmonary Hydatid Disease. Respirology. 2004;9:115-119. [ Links ]
16. Bresson S, Lance M, Meyer JP. Cellular immunity in experimental Echinococcus multilocularis infection, Sequential and comparative phenotypic study of the periparasitic mononuclear cells in resistant and sensitive mice. Clin Exp Immunol. 1990;82:378-383. [ Links ]
17. Pearce E, Tarleton R. Inmunology of infectious disease. 2nd Ed. Washington: Mosby; 2002. [ Links ]
18. Azab M, Bishara S, Ramzy R, Oteifa N, EL-Hoseiny L, Ahmed M. The evaluation of HLA-DRB1 antigens as susceptibility markers for unilocular cystic echinococcosis in Egyptian patients. Parasitol Res. 2004;92:473-477. [ Links ]
19. Ferreira AM, Irigoin F, Breijo M, Sim RB, Diaz A. How Echinococcus granulosus deals with complement. Parasitol Today. 2000;16:168-172. [ Links ]
20. Dixon JB. Equinococcosis. Comp Immunol Microbiol Infect Dis. 1997;20:87-94. [ Links ]
21. Ammann RW, Eckert J. Cestodes; echinococcus. Gastroenterol Clin North Am. 1996;25:655-89. [ Links ]
22. Hunter C, Sher A. Innate Immunity to Parasitic Infections. 3rd Ed. Washington: Mosby; 2002. [ Links ]
23. Gottstein B, Felleisen R. Protective immune mechanisms against the Metacestode of Echinococcus multilocularis. Parasitology today. 1995;9:320-326. [ Links ]
24. Da-Zhong, Fu-Rong, Bartholomot B, Vuitton DA, Craig PS. Serum sIL-2r, TNF-alfa and IFN gama in alveolar echinococcosis. Brief Reports, World J Gastroenterol. 2004;10(24):3674-3676. [ Links ]
25. Baron RW, Tanner CE. The effect of immunosuppression on secondary Echinococcus multilocularis infections in mice. Int J Parasitol 1976;6:37-42. [ Links ]
26. Mansfield JM, Olivier M. Immune Evasion by Parasites. 2nd Ed. Washington; Mosby; 2002. [ Links ]
27. Baily G. Cestote infections. 2nd Ed. New York: Mc Graw Hill; 2003. [ Links ]
28. Winn T, Kwiatkowski D. Patology and Pathogenesis of Parasitic Infections. In: Stefan K, editor. Inmunology of infectious disease. Washington: Mosby; 2002. p. 112-135. [ Links ]
29. Kalomenidis I, Mohamed K, Lane K, Puebles S, Barnette R, Rodríguez M, et al. Pleural Fluid Levels of Vascular Cell Adhesión Molecule-1 are Elevated in Eosinophilic Pleural Effusions. Chest. 2003;124:159-166. [ Links ]
30. Rothemberg M. Eosinofilia. New Engl Jour Med. 1998;338(22):1592-1600. [ Links ]
31. Kalomenidis I, Stathopoulos G, Randal B, Guo Y, Stokes R, Blackwell T, et al. Eotaxin-3 and Interleukin-5 Pleural Fluid Levels Are Associated With Pleural Fluid Eosinophilia in Post-Coronary Artery Bypass Grafting Pleural Effusions. Chest. 2005;127:2094-2100. [ Links ]
32. Vasen W, Florentino RM. Clinical Manifestations and Late Complications of the Hepatic Hydatid Cyst: report of 4 cases. Acta Gastoenterol Latinoam. 2004;34(2): 83-87. [ Links ]
33. Medina M, Pareja M. Quiste hidatídico de partes blandas. Rev Esp Patol. 2003;36(1):91-94. [ Links ]
34. Miranda R, Merchak A, Ferrier P, Villaroel A, Edding O. Quiste hidatídico caridopericárdico: presentación de dos casos clínicos. Rev Chil Radiol. 2002;8:123-126. [ Links ]
35. Komedromos T, Lieb D, Baraboutis J. Unusual presentation of a pericardial cyst Case Report. Heart Vessels. 2004;19:49-51. [ Links ]
36. Sapkas G, Machinis T, Chloros G, Fountas K, Themistocleous G, Vrettados G. Spinal Hydatid Disease, a Rare but Existent Pathological Entity: Case Report and Review of the Literature. Southern Medical Journal. 2006;99(2):178-183. [ Links ]
37. Erbil Y, Barbaras U, Baspinar I, Deveci U, Kapran Y, Bozbora A, et al. Hydatid Cyst of the Thyroid Gland, Case Report. Infect Dis Clin Pract. 2005;13:318-320. [ Links ]
38. Kiresi DA, Karabacadoglu A, Ôdev K, Karakose S. Uncommon Locations of Hydatid Cysts. Acta Radiológica 2003;44:622-636. [ Links ]
39. Delgado V, Garcia MT, Rodríguez VM, Sánchez O, Baeza O. Shock anafiláctico secundario a rotura espontánea de quiste hidatídico esplénico. Rev Esp Alergol Inmunol Clin. 1997;12(4):242-247. [ Links ]
40. Teoh L, Kerrigan A, May M, Van Asperen P. Pseudo food allergy, Instructive Case. J. Paediatr Child Health. 2005;41:63-64. [ Links ]
41. Bûyûk Y, Akcay A, Ûzûn I, Aybar Y, Cin Ô, Kurnaz G. Non-ruptured hydatid cyst can lead to death by spread of cyst content into bloodsream: an autopsy case. European Journal of Gastroenterology and Hepatology. 2005;17(6):671-673. [ Links ]
42. Lewall D, McCorkell S. Rupture of Echinococcal Cyst: Diagnosis, Clasification and Clinical Implications. AJR. 1986;146:391-394. [ Links ]
43. Sultan M. Hydatid Disease: Current status and recent advances. Annals of Saudi Medicine. 2003;22:56:63. [ Links ]
44. Polat K, Baik A, Selebi F. Hepatic alveolar echinococcosis: Clinical report from an endemic region. Can J Surg. 2002;45(6):415-419. [ Links ]
45. Ozvaran M, Ersoy Y, Uskul B, Unver E, Yalcin E, Baran R, et al. Pleural complications of pulmonary hydatid disease. Respirology. 2004;9:115-119. [ Links ]
46. Garcia A, Llladó L, Torras J, Ramos E, Rafecas A. Hidatidosis hepática gigante con fístula quistopleural e hidatosis pleural. Cir Esp. 2007;92(3):177-179. [ Links ]
47. Aguilar X, Fernández J, Magarolas R, Surí A, Vidal F, Richart C. An unusual presentation of secondary pleural hidatidosis. Eur Respir J. 1998;11:243-245. [ Links ]
48. Tarek K, Sadok E, Habiba H, Khaoula B, Sawssen H, Incaf M, et al. Hydatid Disease of the Liver with Thoracic Involvement. Word J. Surg. 2001;25:40-45. [ Links ]
49. Antonio D, Luigi M, Sergio C, Enrico L, Oreste N, Daniele C. Thoracic Extensión of Hydatid Cysts of the Liver. Surgery, Gynecology and Obstetrics. 1990;170:233-238. [ Links ]
50. El Hassane K, Abderahman E, Abdellatif B. Thoracic Rupture of Hepatic Hidatidosis. Ann Thorac Surg. 2001;72:1883-1886. [ Links ]
51. Kakisaka T, Sato N, Kamiyama T, Nakagawa T, Nacanishi K, Matsushita M, et al. Hepatopulmonary Fistula Caused by Alveolar Echinococcosis: Report of a Case. Surg Today. 2006;36:937-940. [ Links ]
52. Carel R, Schey G, Bruderman I. Chyliform Pleural Efusión, An Inusual Manifestation of Hepatothoracic Echinococcus Cysts. Chest. 1975;68(4):598-599. [ Links ]
53. Ertugrul I, Kôklû S, Kôksal A, Coban S, Basar Ô, Ibis M, et al. Treatment of Bronchobiliary Fistula Due to an Infected Hydatid Cyst by a Nonsurgical Approach. Digestive Diesases and Sciences. 2004;49(10):1595-1597. [ Links ]
54. Sayek I, Timaksiz MB, Dogan R. Cystic hydatid disease: current tends in diagnosis and management. Surg Today. 2004;34(12):987-996. [ Links ]
55. Kem P. Echinococcus granulosus infection: clinical presentation, medical treatment an outcome. Langenfecks Arch Surg. 2003;388(6):413-420. [ Links ]
56. Craing P. Echinococcus multilocularis. Curr Opin Infect Dis. 2003;16(5):437-444. [ Links ]
57. Kuzucu A. Parasitic diseases of the respiratory tract. Curr Opin Pulm Med. 2006;12(3):212-221. [ Links ]
58. Richter J, Hetz C, Haussinger D. Ultrasound In Tropical and Parasitic Diseases. The Lancet. 2003;362:900-902. [ Links ]
59. Gottstein B, Reichen J. Hydatid lung disease (echinococcosis/hydatidosis). Clin Chest Med. 2002;23:397-408. [ Links ]
60. Kilic D, Tercan F, Sahin E, Bilen A, Hatipoglus A. Inusual Radiologic Manifestations of the Echinococcus Infection in the Thorax. J Torca Imaging. 2006;21:32-36. [ Links ]
61. Reuter S, Buck A, Manfras B, Kratzer W, Martin H, Karge K, et al. Structured treatment interruption in patients with alveolar echinococcosis. Chest. 2004;39(2):509-517. [ Links ]
62. Kjossev K, Losanoff J. Classification of hydatid liver cysts. Journal of Gastroenterology and Hepatology. 2005;20:352-350. [ Links ]
63. Antonopoulos P, Tavernaraki K, Charalampopoulos G, Constantinidis F, Petroulakis A, Dorsos Ch. Hydatid hepatic cysts rupture into the biliary tract, the peritoneal cavity, the thoracic cavity and the hepatic subcapsular space: specific computed tomography findings. Abdom Imaging. 2007;25:107-120. [ Links ]
64. Ôrmeci N, Kir M, Coban S, Tûzûn A, Ekiz F, Erdem H, et al. The Usefulness of Endoscopic Tetrograde Cholangiopancreatograph and 99mTc-Labeled Algumin Macroaggregates in Diagnosing Hydatid Disease Fistulae. Dig Dis Sci. 2007;52:1410-1414. [ Links ]
65. Lendener M, Spaulding W, Sanders E. Pulmonary Manifestations of Parasitic Infecstations. Canad. Med. Ass J. 1964;91:421-434. [ Links ]
66. Pawlowski ZS, Eckert J, Vuitton DA. Echinococcosis in humans: clinical aspects, diagnosis and treatment. Chest. 2001;24:145-154. [ Links ]
67. Nemes A, Geleijnse M, Van Geuns RJ, Caliskan M, Soliman O, MxGhie J, et al. Evaluation of pericardial hydatid cysts by different echocardiographic imaging modalities. Int J Cardiovsc Imaging. 2006;22:647-651. [ Links ]
68. Peter K. Echinococcus granulosus infection: clinical presentation, medical treatment and outcome. Langenbecks. Archives of Surgery. 2003;388:413–420. [ Links ]
69. Coskun A, Ozturk M, Karahan OI, Erdogan N, Isin S, Gulec M. Alveolar echinococcosis of the liver: correlative color Doppler US, CT, and MRI study. Acta Radiol. 2004;45(5):492-8. [ Links ]
70. Martínez S, Restrepo S, Carrillo J, Betancorut S, Franquet T, Varón C, et al. Thoracic Manifestations of Tropical Parasitic Infections: A Pictorial Review. Radiographics. 2005;25(1):135-155. [ Links ]
71. Leow C, Lau W. Sofá-Tissue Images. Hydatid Disease of the Liver. JCC. 2000;43(5):330-331. [ Links ]
72. Halvorsen R, Korobkin M, Foster W, Silverman P, Thompson W. The Variable CT Appearance of Hepatic Abscesses. AJR. 1984;142:941-946. [ Links ]
73. Von Sinner W, Strake L, Clark D, Sharit H. MR Imaging in Hydatid Disease. AJR. 1991;157: 741-745. [ Links ]
74. Lupetin A, Dash N. Intrahepatic Ruptura of Hydatid Cyst: MR Findings Case Report. AJR. 1988;151:491-492. [ Links ]
75. Force L, Torres JM, Carrillo A. Evaluation of eight serological tests in the diagnosis of human echinococcosis and follow-up. Clin Infec Dis. 1992;15:473-480. [ Links ]
76. Chamekh M, Gras-Mass H, Bossus M. Diagnostic value of a synthetic peptide derived from Echinococcus granulosus recombinant protein. J Clin Invest. 1992;89:458-464. [ Links ]
77. Mylak P, Nahorski W, Pletklewicz H, Nickisch M, Stolarczyk J, Kacpizak E, et al. Moleuclar Confirmation of Human Alveolar Echinococcosis in Poland. CID. 2003;(37) e121-e125. [ Links ]
78. Verastegui M, Moro P, Guevara A. Enzyme-linked immunoelectrotransfer blot test for diagnosis of human hydatid disease. J Clin Microbiol. 1992;30:1557-1561. [ Links ]
79. Rausch RL, Wilson JF, Schantz PM, McMahon BJ. Spontaneous death of Echinoccus multiolocularis: cases diagnosed serologically by Em2-ELISA and clinical significance. Am J Trop Med Hyg. 1987;36:576-785. [ Links ]
80. Ito A, Sako Y, Yamasaki H, Mamuti W, Nakaya K, Nakao M. Ishikawa Y.Development of Em18-immunoblot and Em18-ELISA for specific diagnosis of alveolar echinococcosis. Acta Trop. 2003;85(2):173-82. [ Links ]
81. Clavel A, Varea M, Doiz O, López L, Quílez J, Castillo FJ, et al. Visualization of Hydatid Elements: Comparison of Several Techniques. Journal of Clinical Microbiology. 1999;37(5):1561-1563. [ Links ]
82. Ito A, Sako Y, Ishikawa Y, Nakao M, Nakaya K. Differential serodiagnosis of cystic and alveolar echinococcosis using native and recombinant antigens in Japan. Southeast Asian J Trop Med Public Health 2001;32 Suppl 2:111-5. [ Links ]
83. Vitton D. Echinoccosis and Allergy. Clinical Reviews in Allergy and Immunology 2004;26(2):93-104. [ Links ]
84. Antonio D, Luigi M, Sergio C, Enrico L, Oreste N, Daniele C. Thoracic Extensión of Hydatid Cysts of the Liver. Surgery, Gynecology and Obstetrics. 1990;170:233-238. [ Links ]
85. Salles M, Ortiz V, Riera E, Olive A. Secondary amyloidosis induced by hydatid cyst. Med Clin. 2004;123(13):519. [ Links ]
86. Rubins JB, Rubis HB. Etiology and Prognostic significance of eosinophilic pleural effusions. A prospective study. Chest. 1996;110:1271-1274. [ Links ]
87. Samman Y, Wali S, Abdelaal M, Mohsin T, Krayem B. Chronic Eosinophilic Penumonia Presenting With Recurrent Masive Bilateral Pleural Efusión: case report. Chest. 2006;119:968-970. [ Links ]
88. Hankins J. Management of Complicated Hepatic Hydatid Cyst. Annals of Surgery. 1963;158(6):1020-1034. [ Links ]
89. Reuter S, Back A, Grebe O, Nüssle-Kügele K, Kern P, Manfras B. Salvage Treatment with Amphotericin B in Progresive Human Alveolar Echinoccosis. Antimicrob Agents Chemother. 2003;47:3586-3591. [ Links ]
90. Reuter S, Jensen B, Buttenschoen K, Kratzer W, Kern P. Benzimidazoles in the treatment of alveolar echinococcosis: a comparative study and review of the literature. J Antimicrobial Chemotherapy. 2000;46:451-456. [ Links ]
91. Yahya P, Kemal Ö, Mustafa H, Bilal D. Percutaneous Sonographically Guided Treatment of Hydatid Cysts in Sheep: Direct Injection of Mebendazole and Albendazole. J Ultraound Med. 2003;22:797-803. [ Links ]
92. Chadli D, Haouet K, Fingerhut A. Treatmet of Hydatid Cyst of the Liver: Where is the evidence?. World Journal of Surgery. 2004;2:147-158. [ Links ]
93. Kilic D, Findikcioglu A, Bilen A, Zafer K, Hatipoglu A. Managament of Complicated Hydatid Cyst of the Thorax. ANZ J. Surg. 2007;77:752-757. [ Links ]
94. Smego R, Bhatti S, Khalig A, Asin Bed M. Percutaneous Aspiration-Injection-Reaspiration Drainage Plus Albendazole or Mebendazole for Hepatic Cystic Echinococcosis: A Meta-analysis. CID. 2003;37:1073-1083. [ Links ]
95. Bean W, Rodan B. Hepatic Cysts: Treatment with Alcohol. AJR. 1985;144:237-241. [ Links ]
96. Karacglanoglu M, Faruk Ô, Bozkurt S, Deniz S, Baratas G, Coskun A, et al. Effect of Different Pharmacologic and Chemical Agents on The Integrity of Hydatid Cyst Membranes. AJR. 2004;183:465-469. [ Links ]
97. Ustûnsôz B, Akhan O, Kamiloglu M, Somuncu I, Sahin M, Cetiner S. Percutaneous Treatment of Hydatid Cysts of the Liver: Long-Term Results. ARJ. 1999;172:91-96. [ Links ]
98. Haddad M, Sammak B, Al-Karawi M. Percutaneus Treatment of Heterogenous Predominantly Solid Echopattern Echinococcal Cysts of the Liver. Cardiovasc Intervent Radiol. 2000;23:121-125. [ Links ]
99. Men S, Hekimoglu B, Yûcesoy C, Srda S, Baran I. Percutaneous Treatment of Hepatic Hydatid Cysts: An Alternative to Surgery. ARJ. 1999;172: 83-89. [ Links ]
100. Khuroo M, Wani N, David G, Khan B, Yatoo G, Shah A, et al. Percutaneous Drainage Compared With Surgery For Hepatic Hydatid Cysts. N Engl J Med. 1997;337(13):991-997. [ Links ]
101. Durakhasa CU, Sander S, Seltiralti V, Tireli GA, Tosyali AN, Mutus M. Pulmonaty Hydatid Disease in Children: outcome of surgical treatment combined with perioperative albendazole therapy. Pediatr Surg Int. 2006;22:173-178. [ Links ]
102. Giorgio A, Tarantino L, Francica G, Mariniello N, Aloisio T, Soscia E, et al. Unilocular Hydatid Liver Cysts: Treatment With US-Guided, Double Percutaneous Aspiration and Alcohol Injection. Radiology. 1992;184:705-710. [ Links ]
103. Khawaja G, Mohammad G. Modified PAIR Technique for Percutaneous Treatment of High-Risk Hydatid Cysts. Cardiovasc. Intervent Radiol. 2005;28:200-208. [ Links ]
104. Aggarwal P, Wali JP. Albendazole in the treatment of pulmonary echinococcosis. Thorax. 1991;46:599. [ Links ]
105. Ornaque I, Cugat E, Marco C, Souto JM, Peláez X, Gutierrez S, et al. Resección de Quiste Hidatídico Hepático por Laparoscopia bajo Anestesia General con Perfusión de Remifentanilo. Rev. Esp. Anestesiol. Reanim. 2003;50:46-49. [ Links ]
106. Ôzaslan E, Bayraktar Y. Endoscopio Therapy in the Management of Hepatobiliary Hydatid Disease. J Clin Gastroenterol. 2002;35(2):160-174. [ Links ]
107. Hofstetter C, Segovia E, Vara-Thorbeck R. Treatment of Uncomplicated Hydatid Cyst of the Liver by Closed Marsupialization and Fibrin Glue Obliteration. World J. Surg. 2004;28:173-178. [ Links ]
108. Wilson JF, Rausch RL, McMahon BJ. Parasiticidal effect of chemotherapy in alveolar hydatid disease: review of experience with mebendazole and albendazole in Alaskan Eskimos. Clin Infect Dis. 1992;15:234. [ Links ]
109. Emre A, Ôzden I, Bilge O, Ôkten A, Acuna B, Rozanes I, et al. Alveolar Echinococcosis in Turkey Experience from an Endemic Region. Digestive Surgery. 2003;20(4):301-305. [ Links ]
110. Erdogan A, Ayten A, Kabukcu H, Demircan A. One-Stage Transthoracic Operation for the Treatment of Right Lung and Liver Hydatid Cysts. World J Surg. 2005;29:1680-1686. [ Links ]
111. Tocchi A, Mazzoni G, Micccini M, Drumo A, Cassini D, Colace L, et al. Treatment of Hydatid Bronchobiliary Fistulas: 30 years of experience. Liver International. 2007;2:209-214. [ Links ]
112. Ertugrul I, Kôklû S, Kôksal A, Coban S, Basar Ô, Ibis M, et al. Treatment of Bronchobiliary Fistula Due to an Infected Hydatid Cyst by a Nonsurgical Approach. Digestive Diseases and Sciences. 2004;49(10):1595-1597. [ Links ]
113. Gemmell MA. Australasian contributions to an understanding of the Epidemiology and Control of Hydatid Disease Caused by Echinococcus granulosus-past, present and future. Int J Parasitol. 1990;20:431-456. [ Links ]
114. Heath DD, Holcman B. Vaccination against Echinococcus in Perspective. Acta Trop. 1997;67:37-41. [ Links ]
115. Lightowlers MW, Flisser A, Gauci CG, Heath DD, Jensen H, Rolfe R. Vaccination against cysticercosis and hydatid disease. Parasitol Today. 2000;16:191-196. [ Links ]














