Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Med
versão impressa ISSN 0121-5256versão On-line ISSN 1909-7700
rev.fac.med v.16 n.2 Bogotá jul./dez. 2008
ARTÍCULO DE REVISIÓN
TUMOR DE CÉLULAS GERMINALES
GERM CELL TUMOUR
TUMOR DE CÉLULAS GERMINALES
YOVANY RODRÍGUEZ P.a* Y JAVIER I. GODOY M.D.b
a Residente I del Programa de Hematología y Oncología, Universidad Militar Nueva Granada, Bogotá, D.C., Colombia.
b Jefe del Servicio de Hematología y Oncología, Hospital Militar Central, Bogotá, D.C., Colombia.
* Correspondencia: yovrod2000@yahoo.com. Dirección Postal: Tr. 3 No. 49-00 Servicio de Hematología y Oncología, Hospital Militar Central, Bogotá, D.C., Colombia
Recibido: Octubre 10 de 2008. Aceptado: Diciembre 15 de 2008.
Resumen
Los tumores de células germinales son neoplasias que se derivan de las células germinales primordiales. Histológicamente se clasifican como tumores seminomatosos o no seminomatosos, dividiéndose estos últimos, según la diferenciación celular, en carcinoma embrionario, coriocarcinomas, tumor del saco vitelino y teratoma maduro e inmaduro. Se trata de los carcinomas sólidos más frecuentes en varones entre 20 y 35 años y corresponden al 90% de los tumores testiculares, cursando en testículo como una masa de consistencia dura, usualmente asintomática y no dolorosa. Su origen embrionario, así como la migración desde el intestino primordial hasta los túbulos seminíferos, explican la aparición de tumores de células germinales mediastinales y retroperitoneales. En la presente revisión se hace la descripción de las características embriológicas, patológicas y clínicas de la enfermedad, así como su estadificación y tratamiento.
Palabras clave: tumor de células germinales, carcinoma embrionario, coriocarcinoma, teratoma, cáncer testicular
Abstract
Germ Cell Tumours are malignancies derived from primordial germ cells. They are classified as seminomatous and non seminomatous, the latter divided based on the cellular differentiation as Embrionary germ cell, Choriocarcinomas, Yolk salk tumors and mature and inmature teratoma. They are the most frequent tumors in men between the ages of 20 and 35 and correspond to 90% of testicular tumors found as non-symptomatic hard painless testicular masses. Their embryologic origin as well as their migration from the primordial gut toward the seminiferous tubules explains the emergence of GCT in the mediastinum and retroperitoneum. In this review there is a description about embryologic, clinical and pathologic characteristics of the disease, as well as staging and treatment.
Key words: neoplasms germ cell and embryonal, carcinoma embryonal, choriocarcinoma, teratoma, testicular neoplasms
Resumo
Os tumores de células germinais são neoplasias derivadas das células germinais primordiais. Classificam-se como tumores seminomatosos ou não seminomatosos, dividindo-se estes últimos, segundo a diferenciação celular, em carcinoma embrionário, coriocarcinomas, tumor do saco vitelino e teratoma maduro e imaturo. Trata-se dos carcinomas sólidos mais freqüentes em varões entre 20 e 35 anos e correspondem ao 90% dos tumores testiculares, cursando em testículo como uma massa de consistência dura, usualmente assintomática e não dolorosa. Sua origem embriológica, bem como a migração desde o intestino primordial até os túbulos seminíferos, explica a aparição de tumores de células germinais mediastinais e retroperitonais. Na presente revisão se faz a descrição das características embriológicas, patológicas e clínicas da doença, bem como sua estadifição e tratamento.
Palavras-chave: neoplasias embrionárias de células germinativas,coriocarcinoma, carcinoma embrionário, teratoma, neoplasias testiculares
Introducción
Los tumores de células germinales (TCG), cuya causa no está claramente establecida, se derivan de las células germinales primordiales, que en la vida embrionaria migran desde el sistema nervioso central primitivo hasta localizarse en las gónadas. Se cree que un bloqueo en la maduración de las células germinales, iniciado desde la vida fetal, e inducido posiblemente por alteraciones en el microambiente celular pueda originarlos, con una presentación masculina en el 90% de los casos, pudiendo causar también neoplasias ováricas (1,2). Representan el uno por ciento de todos los cánceres masculinos, corresponden al 90% de los cánceres testiculares y son los tumores sólidos más frecuentes en hombres entre 20 y 35 años, habiendo tres picos de mayor incidencia: la infancia, entre los 20 y los 40 años y a los 60 años (1,2).
Son más comunes en varones de raza blanca, con una relación de 5:1 con respecto a la raza negra y de 3:1 con respecto a los asiáticos (3, 5). Hay sin embargo, un estudio reciente en los Estados Unidos, en que contrario a los adultos, los jóvenes estadounidenses de raza asiática y del Pacífico Sur, lo desarrollan más que los adolescentes blancos, posiblemente por causas ambientales que requieren de más exploración (3). Su incidencia se ha duplicado en los últimos 40 años con un incremento anual del 3% al 6%, posiblemente por edad materna avanzada y por la teoría que postula un posible efecto carcinogénico de sustancias similares a estrógenos y antiandrógenos tanto en la vida fetal como durante la primera infancia (2,5), añadiendo que hay estudios recientes que rebaten esta teoría (3). La afectación familiar sólo se ha descrito entre el 1% y el 3% de los casos (5).
Generalmente se localizan en retroperitoneo como primario, o por diseminación temprana de un primario testicular, siendo rara la localización mediastinal como primario (del 2% al 5% de todos los tumores germinales y del 50% al 70% de todos los TCG extragonadales). Corresponden también al 2% de las neoplasias intracraneales, con predominio de la región pineal (51%) y supraselar (30%), habiendo localizaciones menos frecuentes como el sacro, la tiroides, los senos paranasales y los tejidos blandos de cabeza y cuello (1,5). Los enfoques multidisciplinarios para el éxito de su tratamiento vienen dando como resultado, tasas de supervivencia mayores al 90% en muchos casos (4).
Clasificación
Histológicamente los TCG se han clasificado en dos grandes grupos, seminomatosos y no seminomatosos, los cuales se diferencian en su comportamiento biológico, en el pronóstico y también en la respuesta al tratamiento, sea esta quimioterapia o radioterapia (4,5,6). Mientras los seminomas aparecen con más frecuencia en la cuarta década de vida, los no seminomatosos lo hacen en la tercera, teniendo más de un tipo celular, incluso el sinomatoso. Sin embargo, la definición de seminoma puro excluye la presencia de algún elemento no seminomatoso (4) Además, la Organización Mundial de la Salud (OMS) ha propuesto la siguiente clasificación de los TCG (7):
• Neoplasia intratubular de células germinales no clasificada
• Tumores de un sólo tipo histológico (formas puras)
* Seminoma
Seminoma con células sincitiotrofoblásticas (subtipo)
* Seminoma espermatocítico
Seminoma espermatocítico con sarcoma (subtipo)
* Carcinoma embrionario
* Tumor saco vitelino
• Tumores trofoblásticos
* Coriocarcinoma
* Neoplasma trofoblástico
* Coricarcinoma monofásico
* Tumor trofoblástico placental
• Teratoma
* Quiste dermoide
* Teratoma monodérmico
* Teratoma con células somáticas malignas
• Tumores mixtos (con más de un tipo histológico)
* Mixto embrionario y teratoma
* Mixto teratoma y seminoma
* Mixto coriocarcinoma, teratoma y embrionario
* Otros.
Embriología
El estadio inicial en la maduración embrionaria es el blastocito, a partir del cual se genera el trofoblasto, el epiblasto y el hipoblasto, derivándose de los dos últimos el mesodermo, el endodermo y el ectodermo (8). Las células primordiales germinales (PGC) que se encuentran dentro del epiblasto, migran del endodermo hacia la cuarta semana de gestación y a partir de la quinta semana, el endodermo se convierte en el intestino anterior y posterior, estando dentro de este último las PGC, que para este momento del desarrollo ya presentan los marcadores tumorales que caracterizaran las células germinales: OCT3/4, c-KIT y fosfatasa alcalina placentaria. El intestino posterior va formando una estructura de forma tubular, que posteriormente da origen al tracto gastrointestinal, momento en el que las PGC migran en dirección de la hendidura genital, de donde se derivarán los genitales masculinos y todas sus estructuras, incluyendo los túbulos seminíferos, en los que se localizarán posteriormente las células gonadales. Esta migración explica la presentación en retroperitoneo y mediastino de los tumores de células germinales (8,9,10).
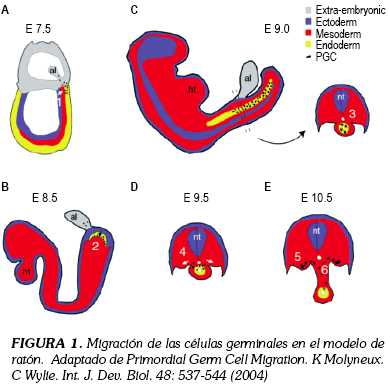
Las células madre embrionarias (pluripotenciales) son las que dan origen a las PCG, las cuales, una vez diferenciadas, comienzan a migrar hacia la hendidura genital. Posterior al desarrollo de los túbulos seminíferos, las PGC se ubican en su interior, tomando el nombre de gonocitos, los cuales realizan su división celular por mitosis. En las mujeres las PGC se diferencian hacia oogonia, para posteriormente entrar en meiosis y formar los oocitos, que a la postre harán parte del folículo primordial. A diferencia de las mujeres, en quienes la división celular se realiza mas tempranamente, los gonocitos masculinos sólo entran en meiosis hasta la pubertad (8). Estos mecanismos de diferenciación celular requieren de señales de crecimiento intracelular para producir progresión en las diferentes etapas de ciclo (G1-S-G2), entre ellos los complejos CDK4/Ciclina 2 y el gen supresor de tumores p53, entre otros.
Aspectos genéticos
El TCG se origina de una lesión precursora, el carcinoma in situ, el que por una serie de alteraciones genéticas y epigenéticas progresa a seminoma, pudiendo desarrollarse este hacia un tumor no seminomatoso. El carcinoma in situ se origina durante la vida fetal de una célula germinal diploide, que después de eventos aneuploidicos y de inestabilidad cromosomal, conducen a la futura invasión de los tumores seminomatosos y no seminomatosos, observándose en ambos similares disrupciones genómicas, pero diferentes características morfológicas y perfiles de expresión genética (11). Una posible causa para los TGC es planteada en la hipótesis del síndrome de disgenesia testicular, en el que por alteración en la función de las células de Sertoli, hay un retraso en la diferenciación de las células germinales que resulta en aumento del riesgo de formación de TCG y que puede deberse a diversas condiciones, no necesariamente relacionadas, como alteraciones genéticas y a exposición fetal masculina a ambientes estrogénicos (9).
Los estudios sobre el genoma de los TCG han evidenciado cambios cromosomales que incluyen copias adicionales de la totalidad o de parte de los cromosomas 1,2,7,8,12,14,15,17,21 y X y un número reducido de copias de la totalidad o de parte del los cromosomas 4,5,11,13 y 18 (12). Dentro de las alteraciones mayormente identificadas como causantes de una diferenciación anormal de las células germinales se encuentran:
- Isocromosoma del 12 p: Una sobre-expresión del brazo corto conocido como i(12p) que contiene los genes K RAS, BKAT1 y LDHB, que traducen proteínas de señalización intracelular que inducen la sobre-expresión de las células germinales, es común en más del 80% de los TCG, independiente de su origen histológico. No se encuentra presente en el estadio inicial del carcinoma in situ, pero sí en los estadios posteriores como carcinoma embrionario, coriocarcinoma, etc., lo que sugiere una alteración adquirida y su presencia de está relacionada con mayor capacidad invasora de las células que la expresan (11, 12-14).
- Alteración de "imprinting" genómico: Mecanismo por el cual el 1% de las células somáticas traducen solamente el alelo paterno, al producirse una interferencia en la activación del gen promotor en el alelo materno. En el caso de las células germinales, hay una alteración de la traducción del gen del IGF1 (Insulin Growth Factor), que normalmente se realiza de manera exclusiva en el alelo paterno para estas células (15).
- Mutación del gen KIT (RTKr): El gen KIT que codifica un receptor transmembranal de tirosin quinasa, se expresa en varios tipos celulares y regula la migración, proliferación y apoptosis de células germinales durante el desarrollo gonadal del feto. Es el gen mutado más conocido en cáncer, la substitución de pares de bases en el exón 17 codón 816 es la más conocida y se ha detectado en cerca del 8% de los TCG y en el 93% de los pacientes con TGC bilateral, por lo que algunos lo han sugerido como predictivo del desarrollo tumor contralateral (16). Se cree que la mutación ocurre muy tempranamente en la embriogénesis, antes de la división y migración a las gónadas de las células primordiales germinales. Las mutaciones son mucho más frecuente en TCG seminomatosos pero como la sobre-expresión del gen se ha observado tanto en siminomatosos como no seminomatosos, se sugiere que KIT es importante para la regulación y progresión del seminoma, sin que sea es el iniciador de la neoplasia (16).
- Complejo ciclina D2/Rb/EF2: La sobre-expresión de ciclina D-2 está relacionada con los casos de TCG de pobre pronóstico y se cree que alteraciones en gen CCND2, que codifica para ciclina D2, sea tal vez uno de los primeros eventos oncogénicos de estos tumores (13, 14).
- TP53: Se han observado anormalidades en la vía del gen supresor de tumores TP53, que codifica para p53 y otras proteínas involucradas en la apoptosis como Mdm2 y MdmX. Los niveles elevados de p53 a su vez activan p21, involucrada en el ciclo celular, permitiendo reparar los daños del ADN al bloquear la fase G1. p53 se sobre expresa en los casos de TCG resistentes al cisplatino, en contraste con aquellos sensibles que expresan el gen normal, pudiendo así realizar los procesos apoptóticos que induce el platino (11,13, 14).
- Por acción del cisplatino, se expresa p53, pero no p21, en cambio por acción de la radiación, p21 se expresa de manera dependiente de p53, lo que sugiere que el tipo de daño sufrido por el ADN, determina la acción de p53 sobre p21 (11).
- TPD52: En recientes estudios se ha encontrado sobre-expresión del gen de la proteína tumoral D52 (TPD52), ubicado en el cromosoma 21 y previamente relacionado con otros tipos de cáncer, en varios tipos de TGC, sobre todo en seminoma y en carcinoma embrionario, en contraste con teratomas, tumor saco vitelino y coriocarcinoma, que expresan una menor frecuencia de TPD52 y aunque su función sigue siendo desconocida, está asociada a cambios en el número de copias del ADN (11).
- Otras alteraciones: disminución de actividad del factor octamérico de transcripción, OCT3/4, específico para diagnóstico patológico; inactivación del gen Dead-end (Dnd1) y obre capacidad de reparación de nucleótidos (13).
Histología
Carcinoma in situ
Es llamado también neoplasia intratubular de células germinales y precede los TCG invasivos de testículo. Se localiza en la membrana basal de los túbulos seminíferos, en estrecha relación con las células de Sertoli en los testículos del adulto y a menudo presentes en el parénquima adyacente de los TCG. Es altamente quimio-sensible y radio-sensible, con una alta propensión a la apoptosis, que se maneja preferencialmente con dosis bajas de radioterapia (2,4,9). El promedio de tiempo para su paso a la forma invasora es de cinco años, presentándose con más frecuencia en el retroperitoneo y siendo rara la localización mediastinal (5,17).
Seminoma
Entre todos los TCG, es el más frecuente, presentándose principalmente en la cuarta década de vida (figura 2). Se trata de es un tumor blando, de textura regular y color gris rosado, histológicamente uniforme y con células del carcinoma in situ y similares a la célula germinal primitiva, con algunas células gigantes e infiltración linfocitaria (2,6). Se divide en clásico o puro (76%), anaplásico (10%), espermatocítico (9%) y trofoblástico (5%), siendo de menor agresividad el seminoma puro.
No seminomatosos
Estos se presentan con más frecuencia en la tercera década de vida y generalmente son mixtos, con más de un tipo celular (6).
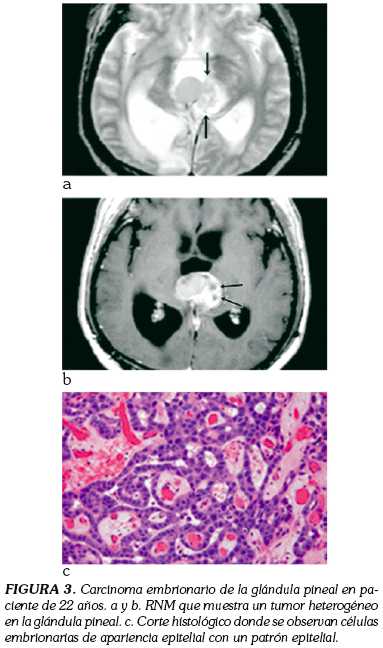
Carcinoma embrionario. Es el más frecuente, histológicamente se asemeja a un embrión primitivo, con células somáticas indiferenciadas, necrosis y hemorragia Coriocarcinoma. Se lo considera la variedad más agresiva, histológicamente tiene la presencia de citotrofoblasto y sincitiotrofoblasto, evolucionando rápidamente con metástasis sanguíneas y linfáticas (figura 4).
Tumor del saco vitelino. Derivado del seno endodérmico, es poco frecuente como tumor testicular puro y más corriente en tumores extragonadales.
Teratoma. Se compone de células somáticas de dos o tres capas germinales (ectodermo, mesodermo, endodermo). Cuando contiene elementos maduros bien diferenciados como cartílago, epitelio glandular o tejido nervioso se llama teratoma maduro que y cuando sus células son parcialmente diferenciadas con características embrionarias, se denomina teratoma inmaduro (figura 5). A pesar de su naturaleza benigna, tiende a crecer, a obstruir y a invadir estructuras adyacentes que sugieren resección, además de que un 3% al 6% pasa a malignidad (4,6).
Tumores germinales extragonadales
Más frecuentes en la línea media, corresponden del 1% al 4% de de los TCG, presentándose como masas retroperitoneales, mediastinales o pineales. El mediastino anterior es la localización más común, sobre todo de seminomas y carcinomas de células embrionarias, aunque también se pueden encontrar en escroto, tiroides, SNP y tejidos blandos de cabeza y cuello. Mientras que del 60% al 80% de los teratomas maduros son benignos, afectando por igual a ambos sexos, el 20% de los malignos es casi exclusivo de los hombres (17-19). Como siempre que se documente la presencia de un tumor germinal de mediastino o de retroperitoneo se deberá descartar la existencia de un tumor gonadal primitivo, su valoración inicial debe acompañarse de una ecografía testicular (17-19).
Progresión tumoral
Todas las células que van a derivar un TCG se expresan inicialmente como una neoplasia intratubular de células germinales no clasificado (ITGCnU), expresando marcadores celulares de membrana OCT3/OCT4, KIT y fosfatasa alcalina placentaria (2). La ITGCnU progresa a carcinoma in situ, seminomatoso o no seminomatoso, en un periodo aproximado de cinco a siete años. Como las características observadas en los diferentes TGC sugieren que las células del carcinoma in situ (CIS) tienen la capacidad de desarrollarse hacia diferentes tipos germinales y somáticos, estas podrían considerarse pluripotentes o verdaderamente totipotentes, que al sufrir diferentes eventos de reprogramación desarrollan TGC que no expresan los mismos genes embrionario, manifestándose en varios fenotipos (2) Los tumores seminomatosos tienen la importante característica clínica de poder diferenciarse a tumores no seminomatosos, condición que no ocurre a la inversa y que explica el por que pacientes con tumores seminomatosos con progresión de la enfermedad, pueden presentar un tumor no seminomatoso asociado (2,4,6,10).
Factores de riesgo
- Criptorquidia. El descenso anómalo testicular es uno de los factores de riesgo mejor establecidos, siendo más frecuente en el testículo intrabdominal que en inguinal, con un riesgo relativo de 2,5 a 14, especialmente con el seminoma, mientras que tan sólo el 2% de los testículos localizados en el área inguinal desarrolla TCG. Importante anotar que no hay cambio en el riesgo, después de realizada la cirugía para descender el testículo.
- Síndrome de Klinefelter. Caracterizado por el cariotipo 47, XXY, aumenta la incidencia de tumor germinal de localización mediastinal.
- Previo cáncer de testículo. El carcinoma in situ o neoplasia intratubular se identifica hasta en 5% en el testículo contralateral.
- Antecedentes familiares de cáncer de testículo. Se ha observado un mayor riesgo en los hombres que tienen algún familiar en primer grado de consanguinidad, con CA testicular.
- Factor de crecimiento de endotelio vascular (VEGF): Los testículos de la gran mayoría de pacientes con TCG evidencian incrementos en la expresión de VEGF en comparación con pacientes sanos, por lo que la expresión en suero de ligandos y receptores de VEGF tendría valor pronóstico (13).
- Factores de riesgo controversiales. Antecedente de trauma, orquitis secundaria a parotiditis, infertilidad y exposición de dietilestilbestrol, sin que se haya establecido una relación estadísticamente significativa. También se ha encontrado una mayor incidencia en pacientes VIH positivos (1,6).
Diseminación
Inicialmente, los TCG crecen localmente comprimiendo el tejido adyacente normal y las metástasis son secundarias a diseminación linfática hacia ganglios retroperitoneales, pulmonares, mediastinales y supraclaviculares. La diseminación sanguínea es más tardía, siendo el pulmón y el hígado los órganos más frecuentemente comprometidos (20,21). Estudios quirúrgicos han facilitado la identificación temprana de metástasis, al demostrar que los principales sitios de compromiso del TCG derecho unilateral son los ganglios linfáticos interaortocava, seguidos de los nodos precavos y pre-aórticos, mientras que para el izquierdo son los para-aórticos y pre-aórticos, seguidos de los interaortocava. La propagación contralateral es más común en los TGC derechos y usualmente asociada a enfermedad retroperitoneal de grandes dimensiones (4).
Manifestaciones clínicas
Los TCG cursan usualmente como una masa asintomática asociada a aumento del volumen testicular, de consistencia dura y de crecimiento lento, estando establecido que muchos de los pacientes hacen caso omiso de este "signo inaparente" y que incluso los médicos llegan a confundir la masa testicular con una epididimitis, o la enfermedad retroperitoneal con dolor lumbar y abdominal de otros orígenes, por lo que el diagnóstico diferencial incluye epididimitis, orquitis y patologías de los discos vertebrales (7). Se presenta dolor cuando se asocia a necrosis o a hemorragia y en la forma metastásica se asocia a dolor lumbar y abdominal, tos, hemoptisis y ginecomastia (1). Si bien esta presentación extragonadal -en retroperitoneo o mediastino- se da en una minoría de los pacientes, se ha propuesto también que ante la presencia de una masa supraclavicular, retroperitoneal o mediastinal en hombre jóvenes, se sospeche de TCG subyacente (7).
Diagnóstico
Como el cuadro inicial cursa asintomático, es importante generar una cultura de autoexamen testicular como método de screening, Una vez identificada una masa testicular, se deberá realizar una ecografía (figura 6) que permita detectar lesiones hipoecogénicas desde dos a tres mm, con una sensibilidad del 100% (6).
Aproximación inicial
Una vez sospechada la presencia de TCG y de encontrar hallazgos sugestivos en la ecografía testicular, se procederá a realizar los siguientes pasos (4,5 7,22):
1. Marcadores tumorales
2. Exámenes de extensión
a. Rx tórax
b. TAC abomino pélvico
c. TAC de tórax (justificada en los TCG no seminomatosos)
d. RNM cerebral: En coriocarcinomas, sobre todo pulmonares, y en la búsqueda de lugar oculto de la enfermedad (pacientes con marcadores elevados pero sin evidencia de metástasis).
3. Exploración quirúrgica y orquidectomía, siempre por vía inguinal.
4. Determinación del riesgo de recaída.
Marcadores tumorales
Las células germinales de los tumores de testículo producen glicoproteínas de origen embrionario que ayudan al diagnóstico, diferenciación y seguimiento postquirúrgico de la enfermedad, además de que determinan el riesgo de recaída de la enfermedad (4,6).
- Alfafetoproteína (αFP): Es un glicoproteína de alto peso molecular producida en hígado, saco vitelino e intestino fetales. Mientras que en el adulto sano sus niveles séricos se encuentran en niveles muy bajos (< 5-10 ng/ml), en los TCG, principalmente en el carcinoma embrionario, se eleva en un 72%. Es importante resaltar que nunca se eleve en el seminoma puro y que también se aumenta en el hepatocarcinoma.
- Gonadotrofina coriónica (βHCG): Esta glicoproteína de bajo peso molecular, compuesta por las subunidades alfa y beta, se produce normalmente en la placenta durante el embarazo, siendo sus valores normales menores a 10-15 ng/ml. Está aumentada en el 5% al 10% de los seminomas y en el 100% de los coriocarcinomas
- Deshidrogenasa láctica (LDH): Su elevación está en relación con el tamaño y la proliferación tumoral. Se eleva en el 60% de los TCG no seminomatosos y en el 80% de los seminomatosos.
En la tabla 1 se encuentra el porcentaje de positividad de los marcadores en cada uno de los TCG, que además de ayudar en el diagnóstico, determinan el riesgo de recaída, ya que la si la αFP, o la βHCG, o ambas, permanecen elevadas después del tratamiento, hay un riesgo de progresión del 70%, contrario a si se normalizan, en que el riesgo disminuye al 7% (6,20).
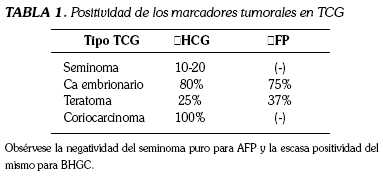
Obsérvese la negatividad del seminoma puro para AFP y la escasa positividad del mismo para BHGC.
Estadificación
La calificación TNM (T: tamaño, N: afectación o no de los linfáticos regionales y M: presencia o no de metástasis a distancia) para los TCG es la siguiente (4-6):
Tis Ca in situ.
T1 Tumor limitado al testículo, sin invasión linfovascular, con compromiso de la túnica albugínea, pero no de la túnica vaginal.
T2 Tumor limitado al testículo con invasión linfovascular, se extiende hasta la túnica vaginal.
T3 Tumor infiltra cordón espermático.
T4 Tumor infiltra el escroto.
N0 No metástasis retroperitoneales.
N1 Metástasis retroperitoneales < 2cm
N2 Metástasis retroperitoneales 2 - 5 cm
N3 Metástasis retroperitoneales > 5cm
M0 No enfermedad metastásica
M1 Enfermedad metastásica a distancia
Existe también una estadificación de acuerdo al nivel de los marcadores tumorales al diagnóstico, de la siguiente manera:
Sx: Marcadores no disponibles o no realizados
S0: Marcadores dentro de límites normales
S1: LDH menor de 1,5 veces lo normal, βHCG menor de 5000 mlu/ml o αFP > a 1000 ng/ml
S2: LDH entre 1,5 y 10 veces lo normal, βHCG entre 5000 y 50000mlu/ml o αFP entre 1000 y 10000ng/ml
S3: LDH mayor de 10 veces lo normal, βHCG mayor a 50000mlu/ml o αFP mayor a 10000 ng/ml
Estadios
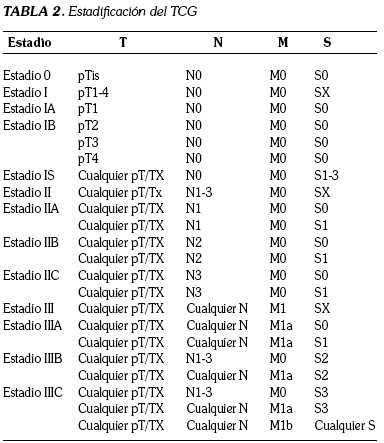
En la tabla 2 se muestra la clasificación de TNM, teniendo en cuenta la estadificación de los marcadores tumorales séricos previamente anotados (9):
Factores pronósticos
Para determinar la mejor opción de tratamiento, es de gran importancia conocer el riesgo de recaída que presenta el paciente desde su valoración inicial (5). De acuerdo con International Germ Cell Collaborative Group Prognostic Classification, que en 1997 propuso una nueva clasificación, basada en los hallazgos en una población de más 5000 pacientes, se han determinado los grupos de riesgo como bajo, medio y alto, con base en los niveles de marcadores tumorales prequirúrgicos, en la localización del tumor primario y en si hay o no metástasis viscerales no pulmonares, de la siguiente manera (23):
- Riesgo bajo (supervivencia del 91%): primario testicular o retroperitoneal y ausencia de metástasis visceral
- Riesgo intermedio (supervivencia del 79%): primario testicular o retroperitoneal y ausencia de metástasis visceral
- Riesgo alto (supervivencia del 48%): Primario mediastinal
αFP: <1000 UI/L
αFP: <1000 UI/L
βHCG: <5000 UI/L
LDH >1,5 veces lo normal
αFP: 1000–10000 UI/L
βHCG: 5000-50000 UI/L
LDH 1,5 a 10 veces lo normal
αFP: >10000 UI/L
βHCG: >50000 UI/L
LDH > 10 veces lo normal
Tratamiento
Los siguientes son algunos de los principios generales acerca del tratamiento de los TCG, que depende de la clasificación histológica y del estadiaje, resaltando que desde la introducción de la terapia basada en platino, ha mejorado el porcentaje de cura para los casos metastáticos, aunque para los casos de riesgo alto, es decir, aquellos con altos niveles de marcadores, metástasis no pulmonares y primario mediastinal no seminomatoso, todavía sigue siendo pobre la respuesta, incluso al aplicar altas dosis de quimioterapia (20,24,25). Para los seminomas, al ser tumores muy radiosensibles, el tratamiento de elección es la radioterapia, mientras que para los no seminomatosos, que en términos generales son radioresistentes, el tratamiento de elección es la orquidectomia, siempre por vía inguinal. Sin embargo, en los últimos años, el papel de la quimioterapia adyuvante viene siendo extensamente investigado, tanto para los seminomatosos como para los no seminomatosos, pareciendo ser un opción válida, que disminuiría los efectos adversos de otros enfoques, sin que la supervivencia se vea afectada si es bien realizada (22).
Establecer el estado I de la enfermedad, implica descartar por exámenes clínicos, bioquímicos, e imaginológicos, el compromiso fuera del testículo, en particular los ganglios retroperitoneales detectados con TAC abdominal, así como la persistencia de altos niveles de marcadores tumorales (21), ya que en la enfermedad mestastásica la respuesta a la quimioterapia es variable y dependiente del riesgo, como ya se explicó (20-22, 25-28).
Seminomatosos
Estadio I: En cerca del 70% de los pacientes con diagnóstico de seminoma puro, el cáncer se confina al testículo y su pronóstico es excelente, con una tasa de curación del 99%. Históricamente el manejo tradicional posterior a la orquidectomía ha sido la radioterapia adyuvante a nodos linfáticos retroperitoneales y pélvicos ipsilaterales (20-30 Gy) (5). Últimamente se ha propuesto el campo para-aórtico como el blanco estándar, con dosis bajas de 20Gy en diez fracciones diarias, tan efectivas como las antiguas de 30Gy en 15 diarias, aunque el seguimiento de dos a tres años para garantizar eficacia de este esquema, es muy corto para algunos. Úlceras, daño cardíaco y malignidades secundarias se han asociado a la radioterapia, pero las nuevas técnicas pueden reducir estos efectos a un futuro cercano (22).
El riesgo de recaída es menor al 5% después de radioterapia y se presenta especialmente en los tumores mayores de 4cm, por lo que algunos grupos proponen quimioterapia adyuvante basada en platinos para este subgrupo de pacientes, teniendo en cuenta que las células germinales son singularmente quimio-sensibles(20-22). Para evitar las altas toxicidades se ha propuesto como agente único el carboplatino, cuyos efectos secundarios son también menores que los de la radioterapia y con estudios que hasta la fecha muestran buenos resultados (22). En la segunda reunión del Grupo de Consenso Europeo para TCG (EGCCCG) se propone que tanto la quimioterapia con carboplatino como la radioterapia son buenas opciones, por lo que la decisión del tratamiento depende en parte de la experiencia del centro tratante, teniendo en cuenta las condiciones del paciente (7).
Es importante anotar que hay estudios de supervivencia en que se ha evidenciado que el tamaño del tumor primario y la infiltración del testículo son indicadores pronósticos independientes para metástasis ocultas, pero los pacientes que presentan estas dos condiciones, tienen riesgos de recaídas superiores al 32% (7,22). En un estudio reciente en pacientes en estado I (<4cm y sin infiltrado testicular) manejados con seguimiento y que hicieron recaída, se encontraron como factores de mal pronóstico la edad menor a 30 años y el incremento en los niveles de βCGH, pero hacen falta otros estudios que validen estos factores (22).
Estadio II: Los estadios IIA – IIB se manejan con dosis mayores de radioterapia (35-40 Gy) que las utilizadas para el estadio I, incluyendo ganglios paraaórticos e iliacos ipsilaterales. La tasa de supervivencia libre de recaída a cinco años es del 91% con ganglios menores de cinco cm y del 44% con ganglios mayores de 5cm. Por el alto riesgo de recaída, para el estadio IIC se considera, además de la radioterapia, realizar quimioterapia con bleomicina, etoposido y cisplatino (esquema BEP), cuyas dosis se observan en el anexo 1 el número de ciclos se determina según el riesgo, de modo que para el riesgo bajo son tres ciclos y para el riesgo intermedio cuatro ciclos (20,21).
En los reportes de la segunda reunión del EGCCCG también se establece que con las modernas técnicas de radiación se han incrementado los porcentajes de supervivencia, proponiendo 30 Gy para el estadio IIA y 36Gy para el estadio IIB, administradas homogéneamente en dosis de 2Gy en cinco fracciones por semana, con una supervivencia de seis años libre de recaídas del 95% para el IIA y del 89% para el IIB y una supervivencia global cercana al 100%, ordenando TAC abdominal y pélvico tres meses post-radiación para verificar el efecto del tratamiento (28). También dan la opción de tratamiento alternativo tres ciclos de quimioterapia con BEP o cuatro con etopósido (EP) para el estado IIB, en especial para pacientes con enfermedad retroperitoneal multinodal, a pesar de las toxicidades (28).
Estadio III: En este estadio la quimioterapia es altamente efectiva y los pacientes sin metástasis pulmonares y con pronóstico intermedio, tienen una tasa de respuesta global de 90% al esquema BEP, que se constituye en el estándar de tratamiento. El número de ciclos se determina, al igual que en el estadio II, según las consideraciones de riesgo. Cuando hay evidencia de masa residual, la FDG-PET (tomografía por emisión de positrones con fluordeoxiglucosa) puede determinar la viabilidad de la lesión y definir si se hace cirugía, o terapia de salvamento. Es importante tener en cuenta que una masa residual post-quimioterapia puede ser necrosis o fibrosis secundaria, o teratoma maduro o inmaduro y no necesariamente tumor viable (20,21,28).
No seminomatosos
Estadio I: El manejo estándar es la orquidectomía inguinal. En casos de ausencia de invasión vascular y no predominio de carcinoma embrionario, se recomienda observación, pero en presencia de alguno de estos factores, se debe hacer linfadenectomia retroperitoneal o quimioterapia con dos ciclos de BEP y una tasa de supervivencia global de 98%. Una ventaja de la linfadenectomía es que además de eliminar sitios de posterior recaída, evita la posterior vigilancia del retroperitoneo (21, 29). La infiltración venosa o linfática es el más importante indicador pronóstico de metástasis oculta (7,20,21,28) y mientras que en ausencia de tratamiento adicional a la cirugía el 48% de estos pacientes desarrolla metástasis (usualmente dentro del primer año de seguimiento), cuando son tratados sólo lo hacen del 14% al 22% (7,20). Las recaídas es entre el 40% y 50% en pacientes con invasión vascular, vs menos del 20% cuando no la hay (22). La tasa de proliferación y el porcentaje de carcinoma embrionario con relación al volumen total del tumor son también indicadores pronósticos, pero no aportan información pronóstica independiente de la infiltración venosa o linfática (7). En los casos de teratoma primario, que como se sabe es quimioresistente, la linfadenectomía retroperitoneal también puede ser una opción del tratamiento y aunque para algunos es un procedimiento que puede traer complicaciones, el uso de la técnica de Donohue, por un urólogo experto, la disección nerviosa es segura y se mantiene la función eyaculatoria (22).
La estrategia de vigilancia también es considerada y consiste, después de la orquidectomía inguinal, en evaluaciones mensuales de marcadores tumorales, radiografía de tórax y examen clínico y un TAC abdominal cuatrimestral, para en el segundo año pasar a controles bimensuales (22). En cuanto a la quimioterapia, esta es más usada en Europa que en Estados Unidos para el estado I del TCG no seminomatoso, siendo las toxicidades más comunes la ototoxicidad, las alteraciones hematológicas y nerviosas, posible deterioro cardiovascular tardío y el desarrollo de una segunda malignidad, por lo que son diversos los intentos de modificar el esquema BEP, encontrándose recientemente una propuesta de dos ciclos, reemplazando el cisplatino por carboplatino con la misma efectividad (22).
Estadio II: En presencia de ganglio retroperitoneal único menor de tres cm y marcadores normales, se recomienda realizar linfadenectomía retroperitoneal. Cuando los linfáticos retroperitoneales son mayores de tres cm, los marcadores tumorales elevados y el riesgo es bajo, se recomiendan tres ciclos de quimioterapia BEP (19,21). Los pacientes sin elevación en los marcadores, pero con varios ganglios retroperitoneales entre uno y dos cm son de especial cuidado, pues los nódulos bien pueden ser adenopatías benignas de gran tamaño, o también teratomas, o carcinomas embrionarios puros, o tumores mixtos. Si se trata de carcinoma embrionario, se pueden someter a quimioterapia inmediata, o después de un período de observación, pero si es teratoma o tumor mixto, se puede optar por una linfadenectomía retroperitoneal de los nódulos que de inmediato permite un resultado, o por un período de observación de seis semanas que permite establecer si la lesión disminuye, permanece estable o crece, que para los dos últimos casos sugeriría un teratoma o un tumor maligno indiferenciado, de acuerdo a si se incrementan o no los marcadores tumorales. Si no hay incremento la sospecha es teratoma y se recurre a cirugía, pero si hay incremento, se requiere de quimioterapia con BEP para enfermedad metastásica (28).
Estadio III: Con metástasis en ganglios linfáticos no regionales (mediastino, supraclavicular), o viscerales (pulmón, hueso, hígado y cerebro) y en riesgo bajo, se consideran tres ciclos de BEP. Si el riesgo es intermedio o alto, cuatro ciclos. La tasa de curación es del 70% y la tasa de supervivencia a dos años del 77%. Cuando hay contraindicación para bleomicina, se pueden dar cuatro ciclos de cisplatino y EP. La eficacia de BEP por cinco días con 100mg/m2 de EP y 20mg/m2 de cisplatino cada día, es equivalente a BEP con 165mg/m2 de EP durante tres días y 50mg/m2 de cisplatino durante dos días. Esto es de tener en cuenta por las toxicidades que se pueden presentar con BEP superior a tres ciclos, que incluyen ototoxicidad, neurotoxicida y Síndrome de Raynaud y que implicaría bajarlos a cuatro (28).
Un estudio reciente reporta buenos resultados con el uso de metrotexate, paclitaxel, ifosfamida y cisplatino (M-TIP) como primera línea de tratamiento en treinta pacientes de alto riesgo, teniendo en cuenta el sinergismo observado entre los tres últimos al administrarse simultáneamente, a la remisión durable inducida por el metrotexate, en algunos caso de Ca testicular y a que experimentalmente se ha observado sinergismo con paclitaxel, cuando el metrotexate se administra primero. En los pacientes sometidos a este esquema, la toxicidad más importante fue la neutropenia, seguida de fiebre, anemia y trombocitopenia, sin ningún caso de muerte asociada al tratamiento, pero al ser una serie pequeña, se requiere de más estudios que permitan sacar conclusiones acerca de la respuesta y supervivencia con este nuevo esquema (25).
Cuando los pacientes presentan metástasis cerebrales en el diagnóstico inicial, el tipo histológico predominante es carcinoma embrionario o el coriocarcinoma, con elevados niveles de βHCG, frecuentes metástasis pulmonares y una probabilidad de supervivencia a largo plazo del 30% al 40%, mientras que en aquellos que la desarrollan durante el tratamiento, o en la recurrencia después de la primera quimioterapia con cisplatino, es apenas del 2% al 5%, siendo dependiente de si es una masa solitaria o no y de si es coriocarcinoma, que en todos los casos es de pésimo pronóstico (28,30,31).
Hay reportes que muestran aumento en la supervivencia hasta de un 70% y 80% en pacientes de mal pronóstico con metástasis cerebral, aplicando altas dosis de quimioterapia (cisplatino y etopósido) y transplante autólogo de célula madre en pacientes con mal pronóstico y uno reciente en fase III en el que con altas dosis de quimioterapia iniciales vs. dosis estándar no se observaron diferencias significativas, por lo que se postula que las altas dosis de quimioterapia sólo se deberían considerar en pacientes con un exagerado mal pronóstico (30). Y aunque para este tipo de metástasis no hay criterios de tratamiento completamente definidos, hay predominio en los intentos de curación con dosis estándar de quimioterapia con cisplatino, acompañada de dosis de radioterapia craneal, que en unos estudios mejora el pronóstico y en otros por el contrario, no muestra ningún beneficio (28-31), con reportes incluso de alteraciones neurológicas persistentes como convulsiones, cefalea, hemiparesias, parestesias, confusión y diplopia, consecuencia de gliosis y leucoencefalopatía post-radiación (26). La cirugía también ha sido contemplada en casos de metástasis cerebral única de fácil acceso, seguida de radioterapia y quimioterapia (28,31).
Manejo de las masas residuales
Como ya se ha dicho, las masas residuales post-quimioterapia que ocurren en aproximadamente un 25% de los pacientes con TCG metastático que reciben quimioterapia, no necesariamente corresponden a tumor viable, pudiendo ser también teratomas sin diferenciación maligna, o fibrosis, o necrosis (25,32). Su extracción quirúrgica resulta esencial, para muchos grupos, con el fin de excluir actividad residual del tumor, para prevenir el síndrome del "growing teratoma", o una posterior diferenciación del teratoma hacia cáncer activo, lo cual determina el futuro manejo del paciente (20,25). Sin embargo, en el informe del consenso europeo de TCG del año 2008, se plantea que cuando se trata de un seminoma, las masas residuales post- quimioterapia o post-radioterapia, no necesariamente se deben resecar, pero si controlarse con imágenes y con marcadores tumorales (28). El uso de FDG-PET es opcional para lesiones menores de tres cm y recomendada para las mayores de tres cm. Si el FDG-PET es negativo, son varias las opciones de tratamiento, pero si es positivo a las cuatro o seis semanas después del día 21 de la última quimioterapia o radioterapia, es muy alta la posibilidad de que el tejido tumoral esté activo, recomendándose la resección para el estudio histológico, que finalmente sugiere el tratamiento a seguir: observación, cirugía, radiación o más quimioterapia. En los casos de incremento en los marcadores o de resección incompleta de un tumor viable, la recomendación es terapia de salvamento VIP (Vinblastina, Ifosfamida, Cisplatino) o TIP (Paclitaxel, Ifosfamida y Cisplatino) y sin es imposible el platino, con paclitaxel (28).
Cuando el tumor es no seminomatoso y hay masas residuales post-tratamiento, los métodos imaginológicos de predicción no son muy confiables, incluyendo el FDG-PET, por lo que si técnicamente es factible, se recomienda la resección de cualquier masa residual, así estén normales los marcadores tumorales. Si la resección fue completa y más del 10% de las células tumorales viables, quimioterapia de consolidación con dos ciclos adicionales de BEP, pero si fue incompleta la resección de un tumor activo, entonces terapia de salvamento VIP o TIP (28).
Tratamiento de la recidiva tumoral
El seguimiento de los pacientes con TCG durante los dos primeros años incluye examen físico completo, marcadores tumorales, Rx de tórax, mensual en el primero año y bimensual en el segundo y TAC abdominal y pélvico trimestral en el primero y cada cuatro meses en el segundo. En el tercer año los controles son trimestrales y en el cuarto semestrales y del quinto en adelante anuales, realizando los mismos exámenes (5,6,32) Las recaídas ocurren generalmente dentro de los dos años de tratamiento inicial y sólo en un 2% al 4% de los pacientes, se presentan más tarde, sobre todo cuando son tumores no seminomatosos. El promedio de aparición es de seis años, pero hay reportes hasta de 32 años (32). Para la recaída de un tumor primario de testículo que consigue remisión con BEP las indicaciones dependen del riesgo. Si éste es bajo o intermedio, están indicados cuatro ciclos de VIP o de TIP, pero si es alto, la recomendación es quimioterapia altas dosis + transplante de médula ósea como rescate (20,28).
Las recaídas por encima de los dos años son escasas, siendo pocas las series reportadas. El manejo de estos pacientes es difícil y en la literatura no se encuentra consenso al respecto (14,28,32,33). Las lesiones son más frecuentes en el retroperitoneo y las FP son el marcador predominante (32, 33). Algunos sugieren cirugía radical inmediata de todas las lesiones, independiente de los niveles de los marcadores y terapia de salvamento cuando no es factible la resección total, para posteriormente realizar una segunda cirugía, si hubo respuesta a la quimioterapia, la que en términos generales es muy pobre y no recomendada sobre la cirugía (14, 28,32,34,35).
Cuando los TGC son refrefactarios las opciones terapéuticas incluyen dosis convencionales de quimioterapia con cisplatino e ifosfamida en combinación con VEP o TIP, o quimioterapia altas dosis + transplante autólogo de médula ósea, o el uso de un régimen intensivo de drogas convencionales (14). Una segunda línea de terapia puede alcanzar remisión durable en el 25% al 50% de los casos y sólo una minoría logra curación con una tercera línea de tratamiento + transplante autólogo de médula ósea (14). La enfermedad es refractaria al cisplatino cuando hay progresión dentro de las cuatro semanas posteriores al término de quimioterapia basada en cisplatino y absolutamente refractaria, cuando la progresión se presenta durante la quimioterapia (14).
La terapia de rescate quirúrgico es importante en pacientes refractarios al platino, cuando la masa es completamente resecable y cuando la recaída es posterior a dos años (14) La resección puede hacerse entre cuatro y seis semanas después de normalizados los marcadores tumorales, siendo muy malo el pronóstico cuando después de una segunda o tercera línea de quimioterapia, las masas corresponden a tumor indiferenciado y como la quimioterapia post-operatoria no mejora la supervivencia, ésta no se recomienda (28).
En cuanto a los factores pronósticos para el TCG refractario no se ha llegado a un consenso, por los que son pacientes que requieren de un minucioso manejo y vigilancia. Dependiendo de los grupos se encuentran dentro de estos factores, el intervalo libre de progresión menor o mayor a dos años, niveles de marcadores tumorales, respuesta completa o incompleta a la quimioterapia, origen extragonadal y si hay o no metástasis pulmonares (14). La resistencia al cisplatino parece ser debida a la incapacidad de apoptosis celular (gen TP53) y a inhabilidad en la detención del ciclo celular en la fase G1-S (gen RB del retinoblatoma) por los que son estos dos puntos de estudio en busca de nuevas opciones terapéuticas (14).
Varias opciones quimioterapéuticas se han venido ensayando para los casos de TCG refractario a los platinos, dentro de ellos etopósido (VP-16) oral, paclitaxel con una modesta acción, gemcitabina conun toxicidad hematológica algo favorable, oxiliplatino, un derivado soluble enagua del cisplatino y con una menor toxicidad, administrados solos o en combinación, sin que haya resultados concluyentes (14).
Altas dosis de quimioterapia y rescate con trasplante de médula ósea
Este tratamiento se considera con intención curativa, en pacientes con TCG metastásico que progresa, luego de quimioterapia con base en cisplatino. Se utilizan altas dosis de carboplatino y etopósido, seguidas de rescate con trasplante autólogo de médula ósea, en uno o dos ciclos. Se ha observado una mejor respuesta cuando este protocolo se usa como segunda línea de tratamiento, con una supervivencia libre de enfermedad del 69,6% en segunda línea y del 44% en tercera línea. Con base en el riesgo determinado al momento del diagnóstico, la supervivencia libre de enfermedad es del 76% para el grupo de bajo riesgo, del 63% para el riesgo intermedio y del 50% para alto riesgo (5,6,20,24,28).
Anexo 1
Esquemas de quimioterapia
- BEP:
- TIP:
- VIP:
Cisplatino 20 mg/m² asociado a manitol
Etopósido 100 mg/m² de D1 al D5
Bleomicina 30 unidades IV días 2, 9 y 16
Repetir cada 3 semanas
Paclitaxel 250 mg/m² D1
Ifosfamida 1.200 mg/m² IV del D2 al D6
Cisplatino 20 mg/m² IV del D2 al D6
Repetir cada 3 semanas
Cisplatino 20 mg/m² D1 al D5
Ifosfamida 1.200 mg/m² IV del D1 al D5
Vinblastina 0,11 mg/kg IV el D1 y D2
Repetir cada 3 semanas
Referencias
1. De Vita L, Laurence T. Cancer: Principles and Practice of Oncology. 8 ed. Philadelphia: Lipincott Williams and Wilkins; 1998. [ Links ]
2. Kristensena DM, Sonnea SB, Ottesena AM, Perrett RM, Nielsena JE, Almstrupa K, et al. Origin of pluripotent germ cell tumours: The role of microenvironment during embryonic development. Mol Cel Endoc 2008; 288:111-18. [ Links ]
3. Walsh TJ, Davies BJ, Croughan MS, Carroll PR, Ture P. Racial differences among boys with testicular germ cell tumours in the United States. J of Urol 2008; 179:1961-65. [ Links ]
4. Carver BS, Sheinfeld J. Germ Cell Tumors of the Testis. Ann Surg Oncol 2008; 12(11): 871-880. [ Links ]
5. Plazas R, Avila A, Tumor de células germinales, Revista Colombiana de Cancerologia, 2002; 6(1): 33-46. [ Links ]
6. J Walter, L. Looijenga, Testicular Germ Cell tumours in a broader perspective. Nature Reviews 2005; 5: 210-222. [ Links ]
7. Krege S et al.European Consensus Conference on Diagnosis and Treatment of Germ Cell Cancer: A Report of the Second Meeting of the European Germ Cell Cancer Consensus Group (EGCCCG): Part I. European Urology. 2008; 53: 478-96. [ Links ]
8. K Molyneux , C Wylie. Primordial Germ Cell Migration. Int. J. Dev. Biol. 2004, 48: 537-39. [ Links ]
9. Hersmusa R, de Leeuwa BH, Wolffenbuttel KP, Dropc SL, Oosterhuisa JW, Coolsd M, et al. New insights into type II germ cell tumor pathogenesis based on studies of patients with various forms of disorders of sex development (DSD). Molec Cell Endoc 2008; 291:1-10. [ Links ]
10. Schneider DT, Schuster AE, Fritsch MK, Hu J, Olson T, Lauer S. Multipoint imprinting analysis indicates a common precursor in gonadal and nongonadal pediatric germ cells tumors. Cancer Res 2001; 6: 7268-76. [ Links ]
11. di Pietro A, de Vries EGE, Gietema JA, Spierings DCJ, de Jong S. Testicular germ cell tumours: The paradigm of chemo-sensitive solid tumours. Int. J. Bioch Cell Biol 2005; 37: 2437-56. [ Links ]
12. Alagaratnama S, Hardyd JR, A. Lothea RA, Skotheima RI, Byrned JA. TPD52, a candidate gene from genomic studies, is overexpressed in testicular germ cell tumours. Molec Cell Endoc 2008. In press [ Links ]
13. Horwich A, Shipley J. Testicular Germ Cell cancer. Lancet 2006; 367: 754-65. [ Links ]
14. Kondaguntaa GV, Sonpavdea G, Galskya MD, Fleminga MT, Hutsona TE, Sternbergb CN. Novel treatment options for refractory germ cell tumors. Update on Cancer Therapeutics 2008; 3: 89-96. [ Links ]
15. Ueno T, Tanaka Y. Sprectrum of the germ cell tumours: From head to toe. Radiographics 2004; 24: 387-404. [ Links ]
16. Coffey J, Linger R, Pugh J, Dudakia D, Sokal M,Easton DF, et al. KIT mutations occur predominantly in seminoma germ cell tumors and are not predictive of bilateral disease: Report of 220 tumors and review of literature. Genes, Chromosomes & Cancer 2008; 47: 34-42. [ Links ]
17. Daugaard G, von der Maase H, Olsen J, Rorth M, Skakkeback NE. Carcinoma -in situ- of the testis in patients with assumed extragonadal germ-cell tumours. Lancet 1987; 2: 528-30. [ Links ]
18. Scholz M, Zehender M, Thalmann GN, Borner M,Thonr H. Extragonadal retroperitoneal germ cell tumour: Evidence of origin in the testis. Ann Oncol 2002; 13: 121-4. [ Links ]
19. Bokemeyer C, Nichols CR, Droz JP, Schmoll HJ, Horwich A, Gerl A, et al. Extragonadal Germ Cell Tumors of the Mediastinum and Retroperitoneum: Results From an International Analysis. J Clin Oncol 2002; 20: 1864-73. [ Links ]
20. Einhorn LH, Williams SD, High-Dose Chemotherapy and Stem-Cell Rescue for Metastatic Germ-Cell Tumors. N Engl J Med 2007, 357: 340-348. [ Links ]
21. Schmoll HJ, Souchon R, Krege S, Albers P, Beyer J, Kollmaniisberger C, et al. European consensus on diagnosis and treatment of germ cell cancer: A report of the European germ Cell Cancer Consensus Group (EGCCCG). Ann Oncol 2004; 15: 1377-99. [ Links ]
22. Sava T, Consoli F, Santo A and Cetto GL. Adjuvant treatment in the management of testis-confinedgerm cell tumours after orchidectomy. BJU International 2007 101:155-59. [ Links ]
23. International Germ Cell Cancer Collaborative Group. International germ cell consensus classification: A prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997;15:594-603. [ Links ]
24. Droz JP, Kramar A, Biron P. Genito-Urinary Group of the French Federation of Cancer Centers (GETUG). Failure of high-dose cyclophosphamide and etoposide combined with double-dose cisplatin and bone marrow support in patients with high-volume metastatic nonseminomatous germ-cell tumors: Mature results of a randomized trial. European Urology 2007; 51(3): 739-48. [ Links ]
25. Pectasides D, Pectasides E, Papaxoinis G, Xiros N, Kamposioras K, Tountas N, et al. Methotrexate, paclitaxel, ifosfamide, and cisplatin in poor-risk nonseminomatous germ cell tumors. Urology Oncology: Seminars and Original Investigations. 2008. In press [ Links ]
26. Hartmann JT, Nichols CR, Droz JP. Prognostic variables for response and outcome in patients with extragonadal germ-cell tumors. Ann Oncol 2002; 13: 1017-28. [ Links ]
27. Hartmann JT, Einhorn L, Nichols CR, Droz JP, Horwich A, Gerl A, et al. Second-Line Chemotherapy in Patients With Relased Extragonadal Nonseminomatous Germ Cell Tumors: Results of an International Multicenter Analysis. J Clin Oncol 2001; 19: 1641-8. [ Links ]
28. Krege S et al.European Consensus Conference on Diagnosis and Treatment of Germ Cell Cancer: A Report of the Second Meeting of the European Germ Cell Cancer Consensus Group (EGCCCG): Part II. Europ Urol 2008 53(497-513) [ Links ]
29. Dash A, Carver BS, Stasi J, Bajorin DF, Motzer RJ, Bosl GJ and Sheinfeld J. The Indication for Postchemotherapy Lymph Node Dissection in Clinical Stage IS Nonseminomatous Germ Cell Tumor. Cancer 2008 112(4):800-5 [ Links ]
30. Oechslea K, Kollmannsbergerb C, Honeckera F, Boehlkea I, and Bokemeyera C.Cerebral metastases in non-seminomatous germ cell tumour patients undergoing primary high-dose chemotherapy. Euro J Cancer 2008 44:1663-9 [ Links ]
31. Doyle DM, and Einhorn LH. Delayed effects of whole brain radiotherapy in germ cell tumor patients with central nervous system metastases. Int J Rad Onc Bio. Phys 2008 70(5):1361-64 [ Links ]
32. Rutherford E, Ferguson JL, Geldart TR, Mead GM, Smart JM and Tung KT. Late relapse of metastatic non-seminomatous testicular germ cell tumours Clin Radiol 2006 61(11):907-15 [ Links ]
33. Ehrlich Y and Baniel J. Late Relapse of Testis Cáncer Urologic Clinics of North America 2007; 34(2): 253-8. [ Links ]
34. Richie J. Late relapse of metastatic testicular nonseminomatous germ cell cancer: surgery is needed for cure: Geldart TR, Gale J, McKendrick J, Kirby J, Mead G, Medical Oncology Unit, Southhampton University Hospitals NHS Trust, Southhampton, United Kingdom Urologic Oncology: Sem and Orig Invest 2007; 25(2):172-3. [ Links ]
35. Willis SF, Winkler M, Savage P, Seckl MJ and Christmas TJ. Repeat retroperitoneal lymph-node dissection after chemotherapy for metastatic testicular germ cell tumour BJU International 2007; 100:809-12. [ Links ]














