Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.17 no.1 Bogotá Jan./June 2009
ARTÍCULO DE REVISIÓN
WARFARINA: USO CONTEMPORÁNEO
WARFARIN: CURRENT USE
WARFARINA: USO CONTEMPORANEO
JAMES YURGAKYa* Y FRANCISCO RODRÍGUEZb
a Residente del Programa de Medicina Interna, Universidad Militar Nueva Granada.
b Médico Internista del Servicio de Medicina Interna del Hospital Militar Central.
* Correspondencia: jamesy7656@yahoo.es. Dirección postal: Servicio de Medicina Interna, Hospital Militar Central, Tr 3 No. 49-00, Bogotá, D.C.
Recibido: Mayo 13 de 2009. Aceptado: Junio 3 de 2009.
Resumen
La warfarina es uno de los medicamentos más prescritos en el mundo y cuando está bien indicada, el beneficio en la prevención de eventos trombóticos y en la reducción de la mortalidad está documentado, aunque aspectos relacionados con la seguridad y con una alta tasa de complicaciones ha limitado su uso en forma generalizada. En este artículo se revisan aspectos que generan dudas específicas en la práctica clínica relacionadas con la dosis, las indicaciones, el tratamiento y la prevención de complicaciones para la warfarina, además de que se promueve la búsqueda de nuevos medicamentos con un perfil de seguridad más favorable.
Palabras clave: warfarina, anticoagulantes, trombosis
Abstract
Warfarine is one of the most prescribed medicines in the world and when it is well indicated, it is documented the benefit in the prevention of thrombotics events and in the reduction of mortality, although aspects related to the security and with a high rate of complications has limited its use in a generalized manner . In this article we review aspects that generate specific doubts in the clinical practiced related to the dose, the indications, the treatment and the prevention of complications of warfarina, in addition to which we promote the search of new drugs with a more favourable security profile.
Key words: warfarin, anticoagulants, thrombosis
Resumo
A warfarina é um de medicinas, mas prescritas no mundo e quando bom indicada, no benefício na prevenção de eventos trombóticos e na redução da mortalidade está documentado, embora aspectos relacionado com a segurança e com uma taxa elevada das complicações limitaram seu uso generalizado. Neste artigo revisam-se aspectos que geram dúvidas especificas na pratica clinica relacionados com a dose, às indicações, o tratamento e à prevenção das complicações para o warfarina, além de que favorece a busca de novas medicinas com um perfil da segurança mas favorável.
Palavras-chave: warfarina, anticoagulantes, trombose
Introducción
La warfarina, usada para el tratamiento de fenómenos trombóticos desde 1960, es un derivado sintético de la cumarina que al antagonizar en forma competitiva la vitamina K e inhibir la síntesis de la enzima epóxido reductasa, lo hace también con los factores de coagulación dependientes de la vitamina K, entre ellos los factores II, VII, IX, y X. En la actualidad se dispone de preparaciones comerciales compuestas por mezclas racémicas de los isómeros R y S, éste último mucho más potente que el primero en su antagonismo con la vitamina K. El metabolismo de este medicamento, en su mayoría hepático, se realiza por el sistema enzimático CYP2C9, cuyas mutaciones específicas, al igual que las de la vitamina K epóxido reductasa (VKORC 1), son determinantes en la respuesta terapéutica a la warfarina (1-3).
La unión a proteínas (99%) constituye un determinante importante en las interacciones farmacológicas (3,4), debido a que sólo la fracción libre es biológicamente activa. Si un fármaco es capaz de ocupar la albúmina y desplazar el medicamento de la misma, potenciaría en forma considerable sus propiedades anticoagulantes , de igual manera que todos aquellos medicamentos con metabolismo dependiente del citocromo p450 tendrían efectos en la concentración plasmática de warfarina (tabla 1), por el incremento o disminución del metabolismo de la misma (4).
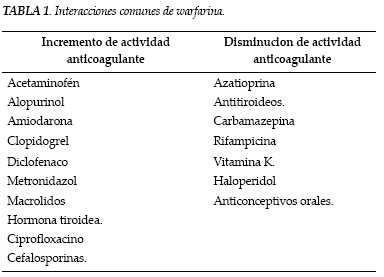
Las interacciones farmacológicas se han correlacionado con incremento de las tasas de sangrado, así como con dificultad para obtener valores terapéuticos de anticoagulación según sea el caso, a través de mecanismos que incluyen: disfunción plaquetaria (asa, clopidogrel), irritación gástrica directa (antiinflamatorios no esteroides, AINES), interferencia en el metabolismo (amiodarona, rifampicina), disminución síntesis de vitamina K (antibióticos), interferencia con metabolismo de vitamina K (acetaminofén). Dentro de los grupos de medicamentos usados frecuentemente debe resaltarse que los inhibidores de la ciclooxigenasa 2 (COX 2) selectivos, así como el pantoprazol se han relacionado con menores efectos adversos dentro del grupo de los AINES, e inhibidores de bomba de protones respectivamente (4).
Otro factor a tener en cuenta y que suele omitirse en la práctica clínica es la dieta del paciente, teniendo en cuenta que el consumo de determinadas cantidades de vitamina K puede generar variaciones semana a semana del INR. Se acepta que el consumo diario de la vitamina K debe ser entre 60 y 85 mcg día; alimentos como espinacas, lechugas y espárragos, tienen altos valores de esta vitamina, por lo que se debe orientar a los pacientes respecto al consumo adecuado de esos vegetales (4).
Mecanismo de acción
El efecto anticoagulante de la warfarina está determinado fundamentalmente por la inhibición de la carboxilación dependiente de vitamina K de los factores X, IX, VII, II en la porción N terminal de los mismos, generando productos inactivos que son incapaces de modificarse en presencia de calcio, para unirse al cofactor en la superficie de fosfolípidos. Además, interfiere con las propiedad biológicas de los anticoagulantes naturales, las proteína C Y S, confiriéndoles la capacidad de inducir fenómenos procoagulantes durante un periodo que oscila entre 36 y 48 horas después de la administración de la primera dosis, obligando así al uso concomitante de heparinas en pacientes con eventos trombóticos agudos (1, 4, 5).
Con una alta absorción por vía gastrointestinal (90 %), la warfarina tiene un pico de acción anticoagulante a los tres días de inicio del tratamiento, una vez se produzca el aclaramiento de los factores procoagulantes biológicamente activos, en especial de la protrombina, cuya vida media es larga, de aproximadamente 72 horas, si se la compara por ejemplo con el factor VII, cuya actividad se inhibe alrededor de las siete horas. Los rangos terapéuticos de INR (índice internacional normalizado) se obtienen cuando la actividad de los mencionados factores es inferior al 30%, razón por la cual en pacientes con fenómenos trombóticos agudos y en los de alto riesgo para eventos trombóticos se recomienda el inicio concomitante de heparina, hasta obtener un rango de anticoagulación adecuado según sea el caso en tratamiento (5). En la tabla 2 se muestra la vida media de los factores de coagulación sintetizados en el hígado (6).

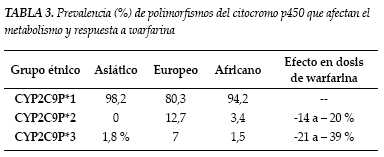
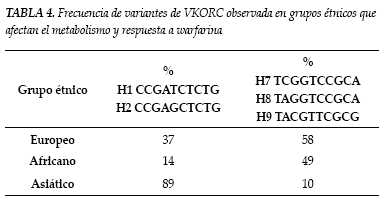
La variabilidad de la respuesta inicial del INR a la warfarina ha sido objeto de estudio documentándose que las mutaciones genéticas inciden notoriamente en ello (1-3). En primer lugar, la farmacocinética del medicamento se ve alterada por las mutaciones en el gen que codifica para la enzima hepática P4502C9 del citocromo, responsable de la oxidación del enatiómero S de la warfarina. El más estudiado de los alelos es 2C9*2 o 2C9*3 asociado a una imposibilidad de metabolizar la S-warfarina, pudiendo presentar un individuo, una o más combinaciones de estos polimorfismos (7). Otro importante determinante genético son las mutaciones en el gen que codifica para varias isoformas de la epóxido reductasa de la vitamina K (VKOR), situado en el brazo corto del cromosoma 16, específicamente el halotipo A/A, que lleva a la producción de enzimas con diferentes sensibilidades a la inhibición de warfarina, explicando la resistencia hereditaria observada en grupos familiares y que en determinados grupos étnicos haya diferencias en cuanto a la dosis de warfarina que se requiere para el mantenimiento de un INR terapéutico (tablas 3 y 4). Son mutaciones que se han correlacionado con valores más elevados de INR durante la primera semana de tratamiento, lo que supone un incremento en el riesgo de sangrado para estos individuos (1). También están reportados polimorfismos para el factor IX, que llevan a una reducción en su actividad y que alteran la farmacodinamia de la warfarina (1-3,7). Sin embargo y aunque cada vez se conoce más acerca de estas alteraciones genéticas, todavía no hay reportes que respalden que sea costo efectivo o de gran impacto clínico estandarizar estudios de tamizaje poblacional para detectar estas mutaciones, debido a que el impacto en las decisiones clínicas con esta información no ha disminuido la tasa de eventos adversos relacionados con el uso del medicamento (1-3).
Dosis inicial y monitorización
En la práctica diaria no existe completa claridad respecto a cual debe ser la dosis inicial de warfarina y a pesar de que las mutaciones genéticas se vienen estudiando ampliamente como determinantes de la respuesta inicial al medicamento, no se recomienda la detección temprana de las mismas, para decidir el inicio de tratamiento (1,7,8). Cuando se compara dosis de carga de cinco o diez mg, los resultados no han sido concluyentes respecto a la efectividad, ya que las complicaciones trombóticas y hemorrágicas pueden obedecer a la heterogenicidad de las poblaciones incluidas en los estudios (5,7-9). Por esta razón, la decisión de la mejor dosis inicial debe individualizarse de acuerdo con el contexto de cada paciente, aunque generalmente para pacientes ancianos, desnutridos, polimedicados, con falla cardiaca congestiva, disfunción hepática, déficit conocido de proteína C - S y alto riesgo de sangrado, se indica una dosis inicial de cinco mg, con titulación de acuerdo a los valores de INR, con el objeto de disminuir la tasa de complicaciones que se relacionan con el medicamento y de que se permita la suspensión de la heparina una vez se obtengan valores adecuados de INR durante 48 horas consecutivas (7,9,10). Para los pacientes sin déficit documentado de proteínas C y S y sin evento trombótico agudo (fibrilación auricular crónica), puede obviarse el inicio de heparina no fraccionada concomitante (9-11).
Riesgo de sangrado
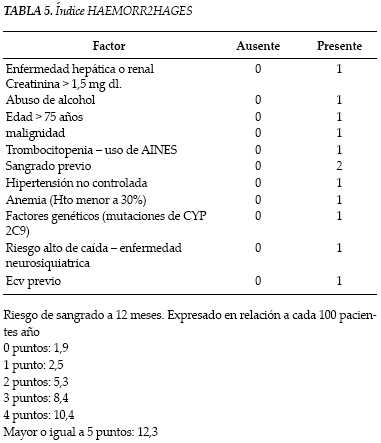
Las complicaciones hemorrágicas en pacientes que reciben tratamiento con warfarina son variables en intensidad, siendo los tractos gastrointestinal y urinario, junto con los tejidos blandos, los sitios afectados con más frecuencia. La mayor tasa de sangrado se encuentra alrededor de 2,2 por cada 100 pacientes/año, con sangrado del sistema nervioso central 0,5 por cada 100 pacientes/ año y sangrado que amenaza la vida del paciente 0,4 por cada 100 pacientes/año (12). Aunque la predicción de sangrado se ha correlacionado estrechamente con la intensidad de la anti-coagulación, múltiples factores del paciente, entre ellos la presencia o no de co-morbilidades, han sido claves como determinantes del riesgo de sangrado. Los índices de riesgo, diseñados para identificar la probabilidad de eventos hemorrágicos adversos en pacientes ambulatorios, son una herramienta que facilita la adopción de estrategias preventivas para disminuir la presencia de hemorragias serias, una vez determinada la indicación clara de terapia para anti coagulación con warfarina (12,13). El reciente índice de predicción de sangrado que incluye múltiples co-morbilidades y denominado HEMORR2HAGES (tabla 5), muestra ser superior a otros en la predicción de eventos adversos hemorrágicos en pacientes sometidos a anticoagulación crónica con derivados cumarinicos (4,7,13).
Rango de anticoagulación terapéutico
La indicación de warfarina para la prevención de las complicaciones trombóticas en diferentes entidades médicas y quirúrgicas ha sido ampliamente estudiada, con una reducción en la tasa de eventos adversos que justifica su uso. En general, los rangos de anticoagulación han sido bien estudiados y documentados, individualizándose para cada paciente y enfermedad a tratar, pero siempre manteniendo valores de INR que por medio de estudios han demostrado una buena relación riesgo- beneficio para los pacientes (tabla 6) (14).

El objetivo de anticoagulación se debe individualizar de acuerdo con la enfermedad en tratamiento y con las características propias del paciente, realizando siempre una valoración minuciosa del riesgo de eventos adversos para cada caso (13). Se han evaluado múltiples estrategias de anticoagulación en pacientes con tromboembolismo venoso, como regímenes de baja intensidad de anticoagulación definidos como rangos de INR de 1,5 a 2,0 que han resultado efectivos en la disminución de recurrencia a largo plazo para fenómenos tromboticos, comparándolos con placebo, con una tasa de eventos de 2,6 por 100 pacientes/año y 7,2 por 100 pacientes/año respectivamente, es decir, una reducción del 76% al 81% en la recurrencia de trombosis a favor de la warfarina (16,17). Al comparar baja intensidad de anticoagulación (INR 1,5-2,0) con rangos usuales (definidos como un INR de 2,0-3,0) no se encontraron diferencias significativas en la tasa de sangrado mayor a 1,1 por cada 100 pacientes/año vs. 0,9 % por cada 100 pacientes/año, pero se demostró si, que la obtención de un INR en rangos usuales es más efectiva para la prevención de fenómenos tromboembólicos venosos, con tasa de recurrencia de 1,9 por cada 100 pacientes/año para rango bajo y de 0,7 por cada 100 pacientes/año para régimen usual (17).
Los rangos supra-óptimos de anticoagulación (INR de 3,0- 4,0) no han mostrado eficacia superior para prevención de eventos trombóticos, pero si se han relacionado con más presencia de eventos adversos mayores en pacientes con reemplazos valvulares anticoagulados (18). La información disponible actual está a favor de rangos moderados de anticoagulación para casi todas las indicaciones de tratamiento con warfarina (14). Las recomendaciones para rangos de INR según la entidad patológica determinadas por el Consenso de Anticoagulación reportadas en el 2008 se resumen en la tabla 7 (14):

Situaciones especiales
Enfermedad renal crónica. Los pacientes que se encuentran en hemodiálisis experimentan un incremento notable de complicaciones hemorrágicas al recibir terapia con cumarínicos. En estudios comparativos de anticoagulación a dosis usuales vs baja intensidad se ha demostrado que hay incremento en la tasa de sangrados relacionado con la primera estrategia, documentándose una tasa de 0,1 a 0,54 eventos pacientes/año. Estos valores son dos veces mayores que las complicaciones de aquellos pacientes que reciben heparina de bajo peso molecular, razón por la que la mejor estrategia de anticoagulación para pacientes sometidos a hemodiálisis se debe sopesar siempre, teniendo en cuenta su predisposición a la presencia de eventos hemorrágicos (19-21).
Enfermedad arterial periferica. En la literatura actual se encuentran múltiples trabajos que evalúan en pacientes con enfermedad arterial periférica, la eficiencia de la warfarina vs el ácido acetil salicílico en la prevención de eventos isquémicos como infarto de miocardio, accidente cerebrovascular y muerte cardiovascular. La presencia de estos eventos en el grupo tratado con warfarina fue de 15,9% vs 17%, lo que demuestra que la tasa de los mismos no disminuye cuando se agrega warfarina al uso de ácido acetil salicílico y que por el contrario, la morbilidad se incrementa pues hay una mayor presencia de sangrados menores y mayores con una presentación de 4,0 % vs 1,2 % respectivamente (22-24).
Estenosis arterial intracraneana sintomática. La valoración de pacientes sintomáticos en enfermedad estenótica arterial intracraneana tratados con warfarina para INR en rangos usuales vs asa, sólo demostró que el uso de este cumarínico incrementó la presentación de sangrado mayor, sin disminuir la muerte cardiovascular, ni los eventos isquémicos cerebrales, ni la muerte súbita. (25-27).
Eventos trombóticos secundarios a neoplasia. Son muchos los pacientes con neoplasias activas que presentan trastornos de hipercoagulabilidad variables y que oscilan entre alteraciones en las pruebas de coagulación, hasta fenómenos embólicos masivos. En estudios como el CANTHANOX y CLOT (28,29) se comparó en pacientes con neoplasias activas, el uso de enoxaparina y daltaheparina vs warfarina en la prevención de eventos trombóticos, encontrando con claridad que las heparinas de bajo peso molecular resultaban superiores en cuanto a la prevención de trombosis, disminución de la mortalidad y complicaciones hemorrágicas, por lo que en la actualidad se acepta que los trastornos de hipercoagulabilidad asociados a neoplasias no se deben tratar con warfarina ni similares (30,31).
Síndrome antifosfolípidos. El rango de anticoagulación que se recomienda en este caso es de moderada intensidad con INR entre 2,0 y 3,0. En estudios controlados se evaluaron valores superiores, encontrando que no hay diferencias que justifiquen anticoagulación de alta intensidad con INR entre 3,1 a 4,0 (32,33). Como un porcentaje no despreciable de pacientes presenta retrombosis a pesar de estar anticoagulados, muchos clínicos prefieren el uso de heparina de bajo peso molecular para el tratamiento crónico de pacientes con síndrome antifosfolipidos; no obstante, todavía no hay información clara que permita la recomendación contundente de una estrategia sobre la otra (34, 35).
Fibrilación atrial. La fibrilación atrial (FA) es la alteración más frecuente del ritmo cardíaco (36). Se estima que una de cada cuatro personas de cuarenta años desarrollará FA a lo largo de su vida (36). En 2007 se diagnosticó FA a 6,3 millones de personas de Estados Unidos, Japón, Alemania, Italia, España, Francia y el Reino Unido. Debido al envejecimiento de la población, se espera que esta cifra se duplique en 30 años (37), razón por la que se le ha llamando la arritmia del siglo XXI.
La FA se relaciona con estados protrombóticos, con un riesgo 5 veces mayor para accidente cerebrovascular (ACV), independiente de si es paroxística o sostenida (36,37). El ACV cardioembólico se asocia con una mortalidad del 25% a los 30 días (39) y si está relacionado con FA, la mortalidad es de ~50% al cabo de un año. Hasta tres millones de personas sufren un ACV asociado a FA cada año en todo el mundo (36,37), siendo especialmente graves y discapacitantes y más de la mitad de los pacientes fallecen en un año (37). Más o menos dos terceras partes de los ACV debidos a FA pueden evitarse mediante el tratamiento anticoagulante adecuado (INR 2-3), recomendándose para los casos con más de un factor de riesgo moderado la anticoagulación con warfarina (39). Un meta-análisis de 29 estudios con un total de 28.044 pacientes mostró que la administración de dosis ajustadas de warfarina reduce los ACV isquémicos y la mortalidad total (36).
Falla cardiaca. Las causas de eventos trombóticos en estos pacientes incluyen estasis venosa en un ventrículo dilatado, formación de trombos intracavitarios y fibrilación auricular. Cada 5% que disminuye la fracción de eyección, se relaciona con un incremento para riesgo de enfermedad cardiovascular del 18% (40), sin estudios prospectivos controlados que permitan determinar cual es el beneficio real en pacientes anticoagulados con warfarina, en el contexto de falla cardiaca en ritmo sinusal (41,42). Estudios como el SOLV y SAVE (43,44) fueron incapaces de demostrar disminución de ACV en pacientes con disfunción ventricular izquierda tratados con warfarina, pero análisis retrospectivos del SOLV encontraron disminución de la mortalidad en pacientes tratados con cumarinicos, por lo que en la literatura sólo se apoya el uso de anticoagulación en pacientes con disfunción ventricular severa con fracción de eyección inferior al 30% y en aquellos con trombo intracavitario documentado, manteniendo valores de INR entre 2,0 y 3,0 (45,46).
Pacientes quirúrgicos. Para la mayoría de pacientes que van a ser sometidos a intervenciones quirúrgicas es apropiado suspender la warfarina cinco días previos al procedimiento. Según el riesgo de eventos trombóticos, se considerará el uso de heparina de bajo peso molecular subcutáneo en dosis que garanticen anticoagulación plena, sin embargo, algunos procedimientos menores como los de tipo dental, las terapias periodontales y las intervenciones dermatológicas menores, no requieren la suspensión de la warfarina (47).
Cuando se debe suspender la warfarina, el rango seguro de INR para cualquier procedimiento es menor a 1.5, teniendo en cuenta en el momento de retiro del medicamento aspectos como la duración de inmovilidad post-operatoria y los riesgos de eventos trombóticos. En pacientes con intervenciones quirúrgicas mayores que deben recibir anticoagulación a dosis terapéuticas, se prefiere la heparina no fraccionada porque es más fácil de revertir y porque su acción es mucho más corta si se la compara con heparinas de bajo peso molecular. En la tabla 8 se resume el enfoque general para los pacientes que se van a someter a intervenciones quirúrgicas.
Eventos adversos. El sangrado ha sido la complicación más temida en los pacientes sometidos a tratamientos de anticoagulación, sin embargo, la necrosis cutánea es resultado de un descenso en la actividad del la proteína C, la cual puede disminuir hasta en un 50 % durante las primeras 24 horas de tratamiento, presentándose en un porcentaje variable. Hay una fuerte asociación entre este fenómeno y el déficit innato o adquirido de proteína C, proteína S y la mutación del factor V de Leyden. El tratamiento de esta entidad consiste en el cese del medicamento, la administración de heparina no fraccionada en infusión continua para rangos de PTT de 1,5 veces y la consideración de concentrados de proteína C para los casos en que la extensión de la necrosis persista, a pesar de la suspensión de warfarina (48,49).
Tratamiento de sangrado
Las tasas de sangrado relacionadas con el uso de warfarina son elevadas, al punto de estar catalogada como un medicamento con alta tasa de eventos adversos (50,51). El grado de anticoagulación y los factores de riesgo de cada paciente son determinantes primordiales en la presencia o no de eventos hemorrágicos, siendo mayor de 5,0 el valor de INR que se relaciona con aumento de la tasa de sangrados. Las manifestaciones hemorrágicas del tracto gastrointestinal y genitourinario siempre deben generar la sospecha de enfermedad estructural, cuyo tratamiento está directamente relacionado con la presencia de sangrado activo, con la gravedad del mismo y con los valores del INR. Una mención aparte merecen los pacientes con prótesis valvulares sobre-anticoagulados moderadamente sin sangrado activo, en quienes la administración de vitamina K vs plasma fresco congelado no ha mostrado diferencias en cuanto a la efectividad de tratamiento, ni a los eventos adversos (52). En la tabla 9 se resumen las estrategias de tratamiento en pacientes sobre-anticoagulados, soportadas por la literatura actual (14).
*Sangrado menor: evento que no requiere valoración médica o estudios adicionales (4); *Sangrado mayor: se define como el que requiere tratamiento médico y/o transfusión de al menos dos unidades de glóbulos rojos empaquetados (4); *Sangrado que amenaza la vida: el que genera inestabilidad de signos vitales, secuelas neurológicas irreversibles y/o que requiera procedimientos quirúrgicos para control (4).
Conclusiones
A pesar de las complicaciones asociadas al uso de la warfarina y de que incluso llegue a ser llamada "un arma de doble filo" por estar entre los fármacos que mayores efectos adversos ocasionan, su prescripción sigue siendo elevada, tanto para pacientes hospitalizados como ambulatorios. Muchos de los resultados inesperados de su uso guardan relación directa con la presencia de uno o varios polimorfismos en los genes que codifican principalmente para las enzimas hepáticas que intervienen en su metabolismo y para la reductasa de la vitamina K, la cual antagoniza warfarina. Al desconocerse el perfil genético de las personas con las que se hacen la gran mayoría de estudios clínicos acerca de la efectividad y efectos colaterales del medicamento, se obvia el impacto de la variable genética, hecho que sumado a otros, impide llegar a conclusiones exactas cuando se analizan los resultados. De ahí que se requiera de controles periódicos del INR, observando y manteniendo sus rangos acorde con las guías.
Estos y otros vacíos metodológicos encontrados en varios de los estudios, obligan a tener mucha claridad en cuanto a las normas de manejo y al abordaje de las complicaciones para cada caso específico, resaltando que el objetivo los modelos y de las guías de manejo intentan contribuir a que en el momento de la toma de decisiones se establezcan beneficios y riesgos acerca de la anticoagulación, sin que estos lleguen a reemplazar el criterio clínico, ni a dejar de lado la importancia de las condiciones individuales y familiares de cada paciente.
Importante anotar que en los últimos años se vienen realizando ensayos con fármacos anti-trombina como el dabigatran y antifactor Xa, que según algunos podrían tener la misma eficacia pero con mayor seguridad, mejorando la calidad de vida y disminuyendo costos, al evitar el control periódico y crónico del INR (53).
Referencias
1. Genetic Determinants of Response to Warfarin during Initial AnticoagulationN Engl J Med 2008;358:999-1008. [ Links ]
2. Millican EA, Lenzini PA, Milligan PE, et al. Genetic-based dosing in orthopedic patients beginning warfarin therapy. Blood 2007;110:1511-5. [ Links ]
3. Pharmacogenetics-Based Coumarin Therapy Brian F Cage, Hematology 2006 105 : 467 [ Links ]
4. Warfarin Pharmacology, Clinical Management, and Evaluation of Hemorrhagic Risk for the Elderly Laurie G. Jacobs, MD Cardiol Clin 26 (2008) 157-167. [ Links ]
5. Antithrombotic therapy for venous thromboembolic disease Chest 2008;133;454-545.4. Kovacs MJ, Rodger M, Anderson DR, Morrow B, Kells G, Kovacs J, Boyle E, Wells PS. Comparison of 10-mg and 5-mg warfarin initiationnomograms together with low-molecular-weight heparin for outpatient treatment of acute venous thromboembolism. A randomized, doubleblind, controlled trial. Ann Intern Med 2003;138:714 -719. [ Links ]
6. Coagulopathy of acute liver failure , clin liver Dis (2009 ) 95-107. [ Links ]
7. Ansell J, Hirsh J, Hylek E, Jacobson A, Crowther M and Palareti G. Pharmacology and Management of the Vitamin K Antagonists. Chest 2008;133;160-198. [ Links ]
8. Crowther MA, Ginsberg JB, Kearon C, Harrison L, Johnson J, Massicotte MP, Hirsh J. A randomized trial comparing 5-mg and 10-mg warfarin loading doses. Arch Intern Med 1999;159:46-48. [ Links ]
9. Quiroz R, Gerhard-Herman M, Kosowsky JM, DeSantis SM, Kucher N, McKean SC, and Goldhaber SZ. Comparison of a Single End Point to Determine Optimal Initial Warfarin Dosing (5 mg Versus 10 mg) for Venous Thromboembolism. Am J Cardiol 2006;98:535-537. [ Links ]
10. Monkman K, Lazo-Langner A and Kovacs MJ. A 10 mg warfarin initiation nomogram is safe and effective in outpatients starting oral anticoagulant therapy for venous thromboembolism. Thrombosis Research 2009; 124: 275-280. [ Links ]
11. Schulman S. Care of Patients Receiving Long-Term Anticoagulant Therapy. N Engl J Med 2003;349:675-83. [ Links ]
12. Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk ofmajor bleeding in outpatients treated with warfarin. Am J Med 1998;105:91-9. St Jude. [ Links ]
13. Clinical classification schemes for predicting hemorrhage: Results from the National Registry of Atrial Fibrillation (NRAF) Am Heart J 2006;151:713- 9. [ Links ]
14. American College of Chest Physicians Evidence-Based Clinical Chest 2008;133;71-109. [ Links ]
15. Long-Term, Low-Intensity Warfarin Therapyfor the Prevention of Recurrent VenousThromboembolism N Engl J Med 2003;348:1425-34. [ Links ]
16. Comparison of Low-Intensity Warfarin Therapy with Conventional- Intensity Warfarin Therapy for Long-TermPrevention of Recurrent Venous Thromboembolism N Engl J Med 2003;349:631-9. [ Links ]
17. American College of Cardiology/American Heart Association.2006 Guidelines for the Management of Patients With Valvular Heart Disease Circulation 2006; 114:84-231. [ Links ]
18. Salem DN, Stein PD, Al-Ahmad A, et al. Antithrombotic therapy in valvular heart disease-native and prosthetic: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(suppl):457S-482S. [ Links ]
19. Warfarin Anticoagulation in Hemodialysis Patients: A Systematic Review of Bleeding Rates American Journal of Kidney Diseases, Vol 50, No 3 (September), 2007: pp 433-440. [ Links ]
20. Miller LM, Hopman WM, Garland JS, et al: Cardioprotective medication use in hemodialysis patients. Can J Cardiol22:755-760, 2006. [ Links ]
21. Brautbar N, Menz CL,Winston MA, et al: Retroperitoneal bleeding in hemodialysis patients. A cause for morbidity and mortality. JAMA 239:1530-1531, 1978. [ Links ]
22. Oral Anticoagulant and Antiplatelet Therapy and Peripheral Arterial Disease, N Engl J Med 2007;357:217-27. [ Links ]
23. Leng GC, Lee AJ, Fowkes FGR, et al. Incidence, natural history and cardiovascularevents in symptomatic and asymptomatic peripheral arterial disease in thegeneral population. Int J Epidemiol 1996;25:1172-81. [ Links ]
24. Efficacy of oral anticoagulants comparedwith aspirin after infrainguinal bypass surgery (the Dutch Bypass Oral Anticoagulants or Aspirin Study): a randomized trial. Lancet 2000;355:346-51. [Erratum, Lancet 2000;355:1104.] [ Links ]
25. Comparison of Warfarin and Aspirin for Symptomatic Intracranial Arterial StenosisN Engl J Med 2005;352:1305-16. [ Links ]
26. Chimowitz MI, Kokkinos J, Strong J, etal. The Warfarin-Aspirin Symptomatic IntracranialDisease Study. Neurology 1995;45:1488-93. [ Links ]
27. Millikan CH, Siekert RG, Shick RM. Studies in cerebrovascular disease. III. The use of anticoagulant drugs in the treatment of insufficiency or thrombosis within the basilar arterial system. Mayo Clin Proc 1955;30:116-26. [ Links ]
28. Meyer G, Marjanovic Z, Valcke J, Lorcerie B, Gruel Y, Solal-Celigny P, Le Maignan C, Extra JM, Cottu P, Farge D. Comparison of low-molecular-weight heparin and warfarin for the secondary prevention of venous thromboembolism in patients with cancer: a randomized controlled study. Arch Intern Med 2002 Aug 12-26;162(15):1729-35. [ Links ]
29. Lee AY; Levine MN; Baker RI; Bowden C; Kakkar AK; Prins M; Rickles FR; Julian JA; Haley S; Kovacs MJ; Gent MSO. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer . N Engl J Med 2003 Jul 10;349(2):146-53. [ Links ]
30. Luk C; Wells PS; Anderson D; Kovacs MJSO. Extended outpatient therapy with low molecular weight heparin for the treatment of recurrent venous thromboembolism despite warfarin therapy . Am J Med 2001 Sep;111(4):270-3. [ Links ]
31. AU - Lee AY; Rickles FR; Julian JA; Gent M; Baker RI; Bowden C; Kakkar AK; Prins M; Levine MNSO. Randomized comparison of low molecular weight heparin and coumarin derivatives on the survival of patients with cancer and venous thromboembolism. J Clin Oncol. 2005 Apr 1;23(10):2123-9. Epub 2005 Feb 7. [ Links ]
32. A Comparison of Two Intensities of Warfarin for the Prevention of Recurrent Thrombosis in Patients with the Antiphospholipid Antibody Syndrome , N Engl J Med 2003;349:1133-8. [ Links ]
33. Escudero A, Cuadrado MJ, Hughes GR. Bleeding and recurrent thrombosis in definite antiphospholipid syndrome: analysis of a series of 66 patients treated with oral anticoagulation to a target international normalized ratio of 3.5. Arch Intern Med 2002; 162:1164-9. [ Links ]
34. Treatment Options for Patients Who Have Antiphospholipid Syndromes,hemato onco clin N Am 22 (2008) 145-153. [ Links ]
35. Bick R, baker W. Antiphospholipid syndrome and thrombosis. Semin Thromb Hemost 1999;25:333. [ Links ]
36. Lloyd-Jones DM, et al. Decision Resources. Atrial Fibrillation Report. Dec 2008. Circulation 2004;110:1042-1046. [ Links ]
37. Fuster V, Rydén LE, Cannom DS, et al. ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients with Arial Fibrillation). J Am Coll Cardiol 2006;48:854-906. [Erratum, J Am Coll Cardiol 2007;50:562]. [ Links ]
38. Aguilar MI. Metaanalysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-67. [ Links ]
39. Birman-Deych E, Radford MJ, Nilasena DS, Gage BF. Use and effectiveness of warfarin in Medicare beneficiaries with atrial fibrillation. Stroke 2006;37:1070-4 [ Links ]
40. AU - Hatle L; Orjavik O; Storstein OSO. Chronic myocardial disease. I. Clinical picture related to long-term prognosis. Acta Med Scand 1976;199(5):399-405. [ Links ]
41. AU - Dunkman WB; Johnson GR; Carson PE; Bhat G; Farrell L; Cohn JN SO. Incidence of thromboembolic events in congestive heart failure. The V-HeFT VA Cooperative Studies Group. Circulation 1993 Jun;87(6 Suppl):VI94-101. [ Links ]
42. AU - Jafri SM; Mammen EF; Masura J; Goldstein SSO. Effects of warfarin on markers of hypercoagulability in patients with heart failure. Am Heart J 1997 Jul;134(1):27-36. [ Links ]
43. AU - Dries DL; Rosenberg YD; Waclawiw MA; Domanski MJ SO. Ejection fraction and risk of thromboembolic events in patients with systolic dysfunction and sinus rhythm: evidence for gender differences in the studies of left ventricular dysfunction trials. J Am Coll Cardiol 1997 Apr;29(5):1074-80 [ Links ]
44. AU - Loh E; Sutton MS; Wun CC; Rouleau JL; Flaker GC; Gottlieb SS; Lamas GA; Moye LA; Goldhaber SZ; Pfeffer MASO. Ventricular dysfunction and the risk of stroke after myocardial infarction. N Engl J Med 1997 Jan 23;336(4):251-7. [ Links ]
45. AU - Loh E; Sutton MS; Wun CC; Rouleau JL; Flaker GC; Gottlieb SS; Lamas GA; Moye LA; Goldhaber SZ; Pfeffer MASO Ventricular dysfunction and the risk of stroke after myocardial infarction. N Engl J Med 1997 Jan 23;336(4):251-7. [ Links ]
46. AU - Lip GY; Gibbs CR SO Anticoagulation for heart failure in sinus rhythm: a Cochrane systematic review. QJM 2002 Jul;95(7):451-9 [ Links ]
47. Ross I Baker, Paul B Coughlin, Alex S Gallus, Paul L Harper, Hatem H Salem and Erica M Wood. Warfarin reversal: consensus guidelines, on behalf of the Australasian Society of Thrombosis and Haemostasis. MJA 2004; 181: 492-497. [ Links ]
48. Schramm W; Spannagl M; Bauer KA; Rosenberg RD; Birkner B; Linnau Y; Schwarz HP. Treatment of coumarin-induced skin necrosis with a monoclonal antibody purified protein C concentrate. Arch Dermatol 1993 Jun;129(6):753-6. [ Links ]
49. Bauer, KA. Coumarin-induced skin necrosis. Arch Dermatol 1993; 129:766. [ Links ]
50. Atlas and Synopsis of Clinical Dermatology: Common and Serious Diseases, 4th edition. McGraw-Hill, New York 2001. Copyright © 2001 The McGraw-Hill Companies. [ Links ]
51. AU - Wysowski DK; Nourjah P; Swartz LSO. Bleeding complications with warfarin use: a prevalent adverse effect resulting in regulatory action. Arch Intern Med. 2007 Jul 9;167(13):1414-9. [ Links ]
52. Comparison of the Efficacy and Safety Profiles of Intravenous Vitamin K and Fresh Frozen Plasma as Treatment of Warfarin-Related Over-Anticoagulation in Patients With Mechanical Heart Valves Am J Cardiol 2006;97:409-411. [ Links ]
53. Connolly SJ, Ezekowitz MD, Yusuf S. Dabigatran versus warfarin in patients with atrial fibrillation N Engl J Med 2009;361. [ Links ]














