Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Med
versão impressa ISSN 0121-5256versão On-line ISSN 1909-7700
rev.fac.med v.17 n.1 Bogotá jan./jun. 2009
ARTÍCULO DE REVISIÓN
NEOCITOLISIS
NEOCYTOLYSIS
NEOCITOLISIS
FERNANDO PALOMINO Q.a*, LEONARDO BAUTISTA T.b Y MICHEL A. GARCÍA O.b
a Profesor Asistente, División de Fisiología, Facultad de Medicina. Universidad Nacional de Colombia, Bogotá, D.C, Colombia.
b Estudiantes de Medicina de la Universidad Nacional de Colombia, Bogotá, D.C, Colombia.
* Correspondencia: lfpalomino@clai.com. Dirección postal: División de Fisiología, Facultad de Medicina. Universidad Nacional de Colombia, Bogotá, D.C, Colombia.
Recibido: Octubre 20 de 2008. Aceptado: Marzo 4 de 2009.
Resumen
En la presente revisión se describe la neocitolisis, un proceso de hemólisis selectiva para eritrocitos jóvenes, evidenciada en pacientes con insuficiencia renal crónica al suspenderles el tratamiento con eritropoyetina recombinante y documentada igualmente en astronautas al entrar en contacto con la microgravedad y en personas aclimatadas a gran altitud, luego de descender a nivel del mar. Se discute también el modelo postulado hasta el momento para demostrar la hemólisis selectiva "in vivo", que permite establecer para la eritropoyetina la nueva función de factor trófico en la maduración plasmática eritroide y se comentan los escenarios clínicos y las aplicaciones hacia el futuro de este proceso.
Palabras clave: hemólisis, eritropoyetina
Abstract
The present revision describes Neocytolysis, a process of selective hemolysis of young erythrocytes, demonstrated in patients with chronic renal insufficiency when suspended from treatment with recombinant erythropoietin and documented, also, in astronauts when entering in contact with microgravity and in people acclimated to great altitude, when they descend to sea level. The model postulated until now to demonstrate selective hemolysis "in vivo" is also discussed, which allows to establish the new function of trophic factor for erythropoietin in the plasmatic erythroid maturation and comments are made on the clinical scenarios and the applications towards the future of this process.
Key words: hemolysis, erythropoietin
Resumo
Na presente revisão descreve a neocitolisis, um processo de hemólises seletivo para eritrócitos novos. Achada nos pacientes com insuficiência renal crônica ao suspender-lhes o tratamento com a eritropoyetina recombinante e evidenciado também nos astronautas ao entrar ao contato com a microgravedade e em pessoas aclimatadas a grande altitude, após descer ao nível do mar. Se discute também o modelo postulado atualmente para demonstrar a hemólises seletiva "in vivo" que permite estabelecer o novo papel da eritropoyetina de fator trófico na maduração plasmática eritroide. Finalmente se comenta os cenários clínicos e as aplicações no futuro deste processo.
Palavras-chave: hemólise, eritropoetina
Introducción
Desde los inicios de la terapéutica con eritropoyetina humana recombinante tipo β (rHuEPO-β) (1-4), para corregir la anemia observada en la insuficiencia renal crónica (IRC), secundaria a la disminución de la síntesis de eritropoyetina (EPO), se comenzó a notar que la supresión súbita de dicha citoquina se reflejaba en una rápida reinstauración del cuadro anémico, a una velocidad tal, que en su totalidad resultaba inexplicable por la sola disminución en la tasa de eritropoyesis (5-7). Este fenómeno, denominado neocitólisis, es debido a un proceso de hemolisis altamente selectiva para eritrocitos jóvenes o neocitos, cuya vida plasmática menor a diez días (8). El término fue acuñado en la década de los 90s por Alfrey y colaboradores, cuando observaron que los astronautas, a su regreso del espacio y durante los primeros ocho a diez días después del lanzamiento, presentaban una disminución en la masa celular eritrocitaria del 10% al 15% aproximadamente (8-10), definiendo esta condición como anemia del astronauta (11,12), la cual se había evidenciado previamente en 1967, durante la misión espacial Gemini V (13).
Por otra parte, desde hace más de un siglo es conocido que los individuos aclimatados a la altitud presentan una disminución rápida de varios parámetros hematimétricos (hematocrito, conteo eritrocitario total y hemoglobinemia) luego de descender a nivel del mar. Sin embargo, fue hasta 1932 que Hurtado postuló un mecanismo hemolítico para tal disminución, además de la reducción en la tasa de eritropoyesis; en la actualidad, ya se han mostrado las evidencias de neocitólisis en estas situaciones (16,17). Todos estos eventos han llevado al establecimiento del papel trófico de la EPO, que asegura la progresión del neocito a eritrocito en proceso de senescencia (10), teniendo también poder angiogénico y antiapoptótico, protagonistas en los procesos de isquemia e inflamación aguda (18-20 a nivel de células endoteliales (21), células de la retina (22), neuronas (23), células renales (24) y cardiomiocitos (25). Además, el concepto de neocitólisis ha facilitado la comprensión de los mecanismos hemolíticos que alteran el tiempo de vida del eritrocito en condiciones fisiológicas, ya que las explicaciones se limitaban a los procesos de condiciones patológicas como hemorragias y anemias hemolíticas congénitas o adquiridas, en las que la sobrevida eritrocitaria es menor a la vida media esperada para la edad (26).
Neocitolisis
La eritropoyesis es el proceso de producción de la línea eritrocitaria que genera glóbulos rojos maduros circulantes. Se inicia en la medula ósea, con la señal de diferenciación hacia línea roja por parte de la EPO, sobre una célula madre (27,28) convirtiéndola en unidad formadora de brotes eritroide (UFB-E), que enseguida continua su proceso de diferenciación hacia unidad formadora de colonias eritroide (UFC-E) y posteriormente a proeritroblasto, eritroblasto basófilo, eritroblasto policromatófilo (en este se inicia la síntesis de hemoglobina), eritroblasto ortocromático, y reticulocito, proceso que ocurre en aproximadamente seis días (29-31). Existen dos tipos de reticulocitos, el reticulocito intramedular que se genera al perder el eritroblasto ortocromático su núcleo, dejando apenas un tenue retículo de cromatina y que permanece de 24 a 48 horas dentro de la medula, sufriendo procesos de maduración. Eventualmente pasa de los sinusoides medulares al torrente sanguíneo, convirtiéndose así en reticulocito circulante, que demora de 24 a 72 horas en perder su remanente de cromatina (32-34). Se ha establecido que el número de reticulocitos circulantes a nivel sanguíneo depende de tres variables: la primera es la tasa de liberación de reticulocitos jóvenes desde la medula ósea, la segunda es la etapa de maduración en la que un reticulocito entra a la circulación periférica y la tercera es la velocidad de desaparición de la sustancia reticular (35).
El reticulocito circulante se convierte luego en neocito, que aproximadamente permanece en sangre diez días, transformándose luego en eritrocito maduro. Se define entonces, que la neocitólisis es la lisis de neocitos, tras un estimulo que genera una reducción súbita en los niveles plasmáticos de EPO, presentándose una caída en el conteo eritrocitario total, del hematocrito (Hcto) y de la hemoglobina (Hb), no explicable por la disminución en la tasa de eritropoyesis (figura 1).
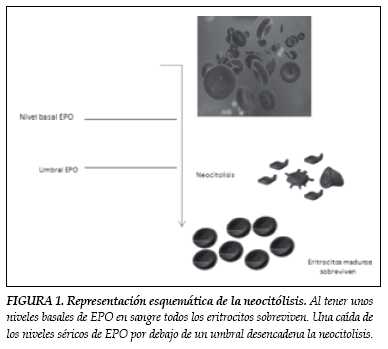
Neocitolisis en los pacientes renales
La insuficiencia renal crónica es el término (IRC) con el que se designa el estado "terminal" de una gran variedad de alteraciones que afectan el riñón. En dicho estado patológico los pacientes presentan disminución en la producción de EPO, generando lo que se conoce como anemia renal. Los estudios realizados en pacientes con IRC, en tratamiento de hemodiálisis y terapia con rHuEPO-β para controlar la anemia secundaria a la enfermedad, demuestran un patrón de hemólisis altamente selectivo para los eritrocitos más jóvenes, cuando los niveles de rHuEPO-β disminuyen por debajo de cierto umbral (36).
Para mirar la supervivencia de los eritrocitos en la población general, Rice y colaboradores realizaron una marcación eritrocitaria general con Cr51 en pacientes renales en terapia con rHuEPO-β, para posteriormente retirar súbitamente la administración de rHuEPO-β, observando que en los primeros nueve días posteriores al retiro de EPO, se generaba una curva que evidenciaba un patrón de hemólisis acelerada, dada por la diferencia entre la inclinación de la pendiente de los pacientes y la curva de supervivencia normal. Pasados los nueve, días la curva sufría un nuevo cambio, notándose que la inclinación de la misma parecía igualar la inclinación del patrón de referencia, observación consistente con neocitolisis (36). Para la marcación de las células rojas recién sintetizadas se administró un isotopo de C13-glicina y N15-glicina, a fin de obtener una evidencia más contundente sobre la selectividad de la hemólisis hacia eritrocitos jóvenes. Luego se determinó la relación de isótopos en materia fecal y sangre, evidenciándose en el día diez, posterior al retiro de la EPO, un incremento en la proporción del isótopo en la estercobilina, hecho altamente compatible con una hemólisis de neocitos (36). En otro estudio en modelo murino se pudo demostrar que cuando los animales se sometían a terapias intensas con rHuEPO-β y esta se suprimía de manera súbita, a los 25 días de cesar la terapia desarrollaban una anemia secundaria y transitoria, que reafirma el papel protagónico de la supresión de la EPO (37).
Neocitolisis en el descenso de las alturas
Los residentes de media y gran altitud (entre 1.500 m y 3.000 m y 3000 m o más, respectivamente) se enfrentan a una disminución en la disponibilidad de oxigeno, ya que la presión de aire disminuye conforme se incrementa la altura. Hasta el momento se han descrito tres patrones fisiológicos de respuesta en humanos a la hipoxia secundaria a este evento. En primer lugar están los habitantes de los Andes, que presentan eritrocitosis con hipoxemia arterial, esta es directamente proporcional al grado, duración y continuidad del estimulo anóxico (38). Además, cada eritrocito es más grande, contiene menos hemoglobina, menor contenido de oxigeno y es más resistente a la hemolisis, así su velocidad de destrucción sea mayor, comparada con un eritrocito a nivel del mar (todas las anteriores características de neocitos). En cuanto al conteo leucocitario y plaquetario no hay modificaciones comparado con los parámetros a nivel del mar. En otras palabras, los habitantes de los Andes presentan un estimulo positivo para la producción de EPO, que es traducido en la medula ósea como eritropoyesis (14, 15,39). Y son estos quienes durante un periodo corto de adaptación a la presión barométrica del mar, presentan con frecuencia una reducción en el contenido eritrocitario total y de hemoglobina, en otras palabras, neocitolisis (16,17).
Al descender al nivel del mar se ha constatado una disminución en el hematocrito, debido a que se aumenta la disponibilidad de oxigeno, siendo un estimulo negativo para la producción de EPO. Para confirmar si en este cambio ambiental existe neocitolisis, se realizó un estudio en Cerro de Pazco, (Perú-4300msnm) en nueve individuos con policitemia fisiológica de aclimatación a la altura. Alfrey y Rice emplearon glicina radiactiva incorporada a las células por una semana (10, 16). Esta técnica es más sensible dado que la glicina se une a células que tienen síntesis de proteínas, tales como reticulocitos. Luego de la marcación de cohortes jóvenes de eritrocitos se encontró que estos habían sido selectivamente bemolizados, con una caída de 10% en el conteo eritrocitario en seis de las nueve personas, pérdida que no puede explicarse por disminución en la eritropoyesis, ya que ésta no muestra alteraciones por lo menos durante seis días después del cambio altitudinal. Es decir, hubo una disminución de la hemoglobina (Hb) y el hematocrito que no debería presentarse en los primeros días, ya que los precursores más jóvenes aun están respondiendo a la secreción previa de EPO, sin cambios apreciables en los primeros seis s siete días en el conteo de reticulocitos (16).
Por otra parte, en tres individuos que recibieron rHuEPO-β diariamente durante el descenso, no se observó una caída en su masa eritrocitaria, pero si un incremento en los niveles de ferritina, sugiriendo de este modo un efecto antihemolítico de la EPO (10). Los niveles plasmáticos de EPO fueron potencialmente suprimidos luego del descenso (26,6~3,7 U arbitrarias en altitud Vs 5,6~0,4 U arbitrarias a nivel del mar) (17). En conclusión, se hizo evidente que la supresión de los niveles séricos de EPO en respuesta a un rápido cambio ambiental por si sola conllevaba al desencadenamiento de neocitólisis.
No obstante, el proceso de neocitolisis no ocurre en los otros dos patrones fisiológicos de respuesta a la hipoxia conocidos en humanos, evidenciados en los habitantes del Tíbet y de Etiopia. En los Sherpas -habitantes del Tíbetlas mediciones hematológicas demuestran un valor de hematocrito y hemoglobina estadísticamente significativos menores que los habitantes andinos, con una afinidad de oxigeno sanguíneo y forma o posición de la curva de equilibrio de oxigeno que no varían entre si y una presión parcial de oxigeno inspirado de aproximadamente el 60% para ambas poblaciones, lo que sugiere una adaptación genética (38, 40, 41,42). Por otra parte, en la región de Ambaras, Etiopía, se encontró que sus habitantes no presentaban eritrocitosis ni hipoxemia arterial, que su presión parcial de oxigeno inspirado era del 64%, la concentración de hemoglobina muy similar a la encontrada en los Sherpas, con una saturación de oxigeno del 95%, mientras que para los tibetanos era del 89% y para los habitantes de los Andes de 91% (43).
Es decir, que ni en los Sherpas, ni en los Etíopes existe una cohorte de neocitos tan amplia como la tienen los habitantes de los Andes, o los residentes a nivel del mar que viajan por pocos días a alturas intermedias o altas, quienes experimentan un proceso de aclimatación con una consecuente liberación inicial de EPO durante las primeras 19-40 horas de hipoxia y una posterior y progresiva caída de los niveles séricos para igualar los que se tenían a nivel del mar, aun encontrándose en las alturas y que posteriormente, al realizar un descenso a nivel del mar en un periodo corto de tiempo (44), en donde la cantidad de neocitos se ha aumentado debido al estimulo previo, presentan neocitólisis.
Es así como en la concepción clásica de la hematofisiología de la adaptación a cambios ambientales, en donde al censar un exceso de células rojas circulantes para un ambiente determinado dicho aumento se debía corregir para el nuevo ambiente en el que se encontrara el organismo, dando lugar a una reducción de la eritropoyesis debido a una caída en la concentración plasmática de EPO, el proceso de neocitolisis modifica el protagonismo de la disminución de la eritropoyesis, llegando a plantearse una función trófica (10) de la EPO, al asegurar la progresión en la maduración de neocitos a eritrocitos en proceso de senescencia (de 11 a 120 días).
Neocitolisis en el espacio (microgravedad)
Investigadores como Alfrey, Rice y colaboradores observaron que durante los vuelos espaciales, los astronautas presentaban una serie de cambios fisiológicos en múltiples sistemas. A nivel hematológico se destacaba una disminución del volumen plasmático durante las primeras horas en el espacio de alrededor del 20%, porque al entrar en microgravedad, las paredes de los vasos sanguíneos en las extremidades (vénulas y capilares) colapsan, debido a que el peso de la sangre en ese momento no consigue la fuerza necesaria para mantener las paredes vasculares permeables. De esa forma la sangre es redistribuida centralmente, en donde la ocupación sanguínea es menos dependiente de la gravedad, creándose una "hipervolemia virtual" con un ambiente normóxico, que llega a desencadenar una serie de procesos como aumento de la diuresis y trasudado hacia los tejidos, manifestados como edema facial y dorsal, que posteriormente genera hemoconcentración (aumento central del hematocrito) (45,46).
Empero el aumento del hematocrito que se esperaría, dada la pérdida de plasma, este incremento era menor y no correspondía con los resultados obtenidos, lo cual se explica por dos razones principalmente, una rápida disminución del conteo eritrocitario y una hemolisis selectiva de neocitos. Dentro de las observaciones hechas se encontró que la disminución del conteo eritrocitario total en los astronautas (hemoglobina y hematocrito) presentaba una caída más marcada al compararlos con la reducción habitual de la masa eritrocitaria sometida al marcaje con Cr51, razón por la cual un proceso hemolítico debía ser la respuesta a ésta disminución en la masa eritrocitaria, ya que el porcentaje de reducción celular era considerable para que ocurriera en un intervalo de tiempo tan pequeño. Como se mencionó anteriormente, el proceso de eritropoyesis tarda alrededor de nueve días y si se considera que un eritrocito en promedio vive alrededor de 120 días, trascurridos diez días la reducción seria únicamente del 8% aproximadamente y no del 10% al 15% como se observó. Al marcar los eritrocitos con Cr51 dos semanas antes del lanzamiento, con el fin de mirar la supervivencia celular y corroborar el proceso hemolítico, los hallazgos fueron los menos esperados, ya que aunque la curva de supervivencia dada por el Cr51 no tenía alteraciones, los parámetros hematimétricos seguían mostrando una disminución en la masa celular eritrocitaria.
Sin embargo, existía la posibilidad de otra hipótesis y es que la hemólisis fuera tan altamente selectiva, que destruyera los eritrocitos con una vida plasmática menor al tiempo de marcaje y al lanzamiento, o sea eritrocitos menores de doce días (10). "Esta interpretación también explica porque una disminución en la supervivencia de las células rojas fue observada en la misión Gemini V, cuando el marcaje con Cr51 fue aplicado a las células rojas solo siete días antes del lanzamiento"(13). A partir de lo anterior, fue que surgió la razón de la hemólisis selectiva de neocitos en la que los eritrocitos de mayor tamaño (el tamaño del eritrocito disminuye con la edad) eran los destruidos, afectando el cálculo del hematocrito (8,9). Un aumento central del hematocrito es un estímulo negativo para la secreción de EPO por parte del riñón, ya que los niveles séricos de esta caen en forma acelerada, lo cual es seguido de una disminución del hematocrito y de la masa eritrocitaria, evidenciada al regresar a la tierra, en donde se genera una redistribución del volumen plasmático y hay hemodilución (47,48,49). Se presenta en consecuencia un déficit de eritrocitos que conduce a hipoxia y al restablecimiento de la secreción de EPO, es decir, que una reducción en un momento específico de los niveles de EPO séricos desencadena la neocitólisis.
Neocitolisis: un modelo fisiológico
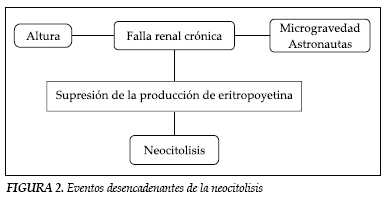
Se encuentran tres caminos clásicos que convergen en un mismo evento: la supresión de los niveles de EPO (figura 1). Por un lado está la hipervolemia virtual, que conlleva a un aumento central del hematocrito y a una hemoconcentración, causando una disminución de los niveles basales de EPO. El fenómeno de anemia del astronauta, que se hace evidente una vez se retorna a la tierra y el que los neocitos son rápidamente destruidos y el volumen sanguíneo redistribuido y el fenómeno de las personas aclimatadas a las alturas, quienes tienen un estimulo positivo para la secreción de EPO y que al descender a nivel del mar en un periodo corto de tiempo, experimentan de repente un aumento en la concentración de oxigeno libre, respondiendo con una disminución de EPO que conduce a neocitolisis.
Finalmente están los pacientes con IRC quienes reciben rHuEPO-β para controlar la anemia, pero que al suspender la dosificación de la misma experimentan también neocitolisis. Los tres eventos se representan en la figura 2.
Para determinar como la masa de células rojas aumentadas puede llegar a presentar neocitolisis junto con una supresión profunda de EPO, se han propuesto modelos en humanos que involucran administración de rHuEPO-β por periodos variables de tiempo para seguidamente estudiar la consecuencia de su retiro súbito. La neocitolisis posiblemente involucre un cambio en la interacción neocito-macrófago, siendo probable que estén involucradas moléculas de adhesión celular, importantes durante la maduración del progenitor eritroide y que persisten en algún grado en las células recién formadas (10). En algunas células endoteliales se han encontrado receptores de EPO, como son las células endoteliales esplénicas, ricas en estos receptores y las únicas reconocidas hasta el momento con la capacidad de responder al retiro de EPO, incrementando la permeabilidad, e interactuando con macrófagos que llevan a neocitolisis (figura 3) (10, 50,51).
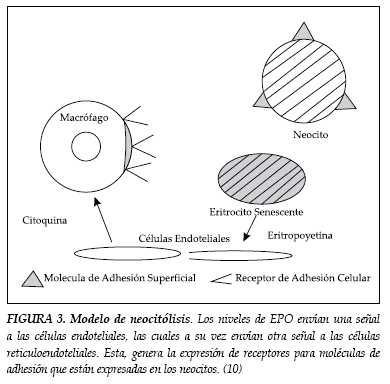
Otras moléculas que también han sido involucradas con neocitolisis son CD35, CD36, CD44 (HCAM), CD47, CD49e (VLA4), CD55 (DAF), Caderina, Factor de Von Willebran, Glicoforina A, ICAM 4, condroitin sulfato y fosfatidil serina. (12, 17,51). Finalmente, la neocitólisis pone en juego el tema de la existencia de factores de crecimiento tanto para producción como para la supervivencia de los eritrocitos, que podría implicar una variable de apoptosis en células anucleadas (10,36).
Aplicaciones clínicas y hacia el futuro
Se debe entender que la neocitólisis es un proceso que ocurre en diferentes escenarios, en donde el común denominador es la caída súbita de los niveles de EPO plasmático, con hemolisis selectiva de eritrocitos que tienen una vida plasmática menor de diez días y sin alteración franca de la eritropoyesis, todo esto con el fin de adaptarse rápidamente a unas nuevas condiciones ambientales. Puede jugar un rol en las enfermedades crónicas, incluyendo las enfermedades pulmonares obstructivas en las que uno de los tratamientos es la administración de oxigeno suplementario, lo que lleva a una reducción del conteo total eritrocitario, disminuyendo la frecuencia de síndromes de hiperviscosidad y de enfermedades tromboembólicas (46). También podría tener aplicación en malaria y en anemia de células falciformes, pues al administrar EPO suplementaria, se daría resistencia a los neocitos que se forman. Asimismo, este proceso podría estar involucrado en el dopaje que realizan algunos deportistas de alto rendimiento que buscan mejorar su desempeño mediante transfusiones antólogas, en quienes se ha visto un incremento de hemoglobina y hematocrito menor al esperado.
También ayuda a entender algunas enfermedades hematológicas y quizás, a encontrar el mecanismo de acción de algunos procesos como la deficiencia congénita de piruvato quinasa, en donde hay lisis selectiva de eritrocitos (8). Igualmente, el proceso de adaptación de la masa eritrocitaria en recién nacidos a término (16), en quienes hay una disminución franca de los parámetros hematimétricos pocos días después del nacimiento, al pasar de un ambiente hipóxico a uno normóxico, con una supresión súbita de los niveles de EPO en respuesta a este estimulo. Se debe considerar también para el manejo de las bolsas de sangre, como modificador de la vida eritrocitaria in vitro, modificando la terapéutica transfusional, porque al analizar cada una de las variables que hacen parte de los factores inductores de la neocitolisis, se tiene que al aumentar la hemoglobina y el hematocrito, se genera un estimulo negativo para la síntesis de EPO nativa, disminuyendo su concentración plasmática, lo que propicia un ambiente para el proceso de hemolisis selectiva (52).
Investigando acerca de nuevos productos de EPO y de vías de administración que puedan prevenir el estimulo de neocitolisis, se ha demostrado que la administración de EPO es más eficiente por vía subcutánea que por vía endovenosa, porque de esa forma se evitan fluctuaciones de concentración plasmática de la EPO y se mantiene un estado estacionario más prolongado en su rango terapéutico (51). Al evaluar la respuesta de la medula ósea se nota que disminuye la variabilidad de los valores de hemoglobina, concentrándose en rangos más estrechos (7,36), lo que permitiría concluir que el conocimiento de la neocitólisis por parte del clínico generaría una mayor comprensión de la fisiología hematológica y ampliaría el enfoque de manejo médico, pues la integraría dentro de las variables a corregir, o a inducir durante el tratamiento de las enfermedades, o de diferentes condiciones en las que se hace presente, o en donde su inductor (EPO ó rHuEPO-β) llegara a estar como línea terapéutica, así como condiciones externas en las que se llegara a alterar la concentración plasmática de EPO.
Referencias
1. Eschbach J.W, Egrie J.C, Downing M.R, Browne J.K, Adamson J.W. Correction of the anemia of end-stage renal disease with recombinant human erythropoietin. Results of a combined phase I and II clinical trial. N Engl J Med. 1987 Jan 8;316(2):73-8. [ Links ]
2. Eschbach J.W. The anemia of chronic renal failure: Pathophysiology and the effects of recombinant erythropoietin. Kidney International, Vol. 35 (1989), pp. 134148 [ Links ]
3. Eschbach JW, Adamson JW. Guidelines for recombinant human erythropoietin therapy. Am J Kidney Dis. 1989 Aug;14(2 Suppl 1):2-8. [ Links ]
4. Eschbach J.W, et al. Recombinant human erythropoietin in anemic patients with end-stage renal disease. Results of a phase III multicenter clinical trial. Ann Intern Med. 1989 Dec 15;111(12):992-1000. [ Links ]
5. Rice L, et al. Neocytolysis contributes to the anemia of renal disease. American Journal of Kidney Diseases, Volume 33, Issue 1, January 1999, Pages 59-62 [ Links ]
6. Means R.T. Neocytolysis: From outer space to the dialysis unit. American Journal of Kidney Diseases, Volume 33, Issue 1, January 1999, Pages 140-141 [ Links ]
7. Alfrey C.P, et al. Implications of Neocytolysis for optimal management of anaemia in chronic kidney disease. Nephron Clin Pract 2007;106:c149-c156 [ Links ]
8. Alfrey C.P,e t al. Neocytolysis: physiological down-regulator of redcell mass. Lancet 1997; 349: 1389–90 [ Links ]
9. Alfrey CP, Udden MM, Huntoon CL, Driscoll T. Destruction of newly released red blood cells in space flight. Med Sci Sports Exerc. 1996 Oct;28(10Suppl):S42-4. [ Links ]
10. RICE L, Alfrey CP: Modulation of red cell mass by Neocytolisis in space and on Earth. Pflügers Arch. - Eur J Physiol 2000, 441(2-3 Suppl): R91–R94 [ Links ]
11. Alfrey C.P, et al. Control of red blood cell mass in spaceflight. Journal of applied physiology. 1996, vol. 81, no1, pp. 98-104 [ Links ]
12. Rice L, Alfrey C. The Negative Regulation of Red Cell Mass by Neocytolysis: Physiologic and Pathophysiologic Manifestations. Cell Physiol Biochem 2005;15:245-250 [ Links ]
13. Fischer C, et al. Red Blood Cell Mass and Plasma Volume Changes in Manned Space Flight. JAMA. 1967;200(7):579-583. [ Links ]
14. Hurtado A. Studies at high altitude: Blood Observations on the Indian Natives of the Peruvian Andes. Amer. J. Physiol., 100: 487–505. [ Links ]
15. Hurtado A, et al. Influence of anoxemia on the hemopoietic activity. Arch Intern Med. 1945;75(5):284-323. [ Links ]
16. Rice L, et al. Neocytolysis on Descent from Altitude: A Newly Recognized Mechanism for the Control of Red Cell Mass. Ann Intern Med. 2001;134:652-656. [ Links ]
17. Risso A, et al. Red blood cell senescence and neocytolysis in humans after high altitude acclimatization. Blood Cells, Molecules, and Diseases 38 (2007) 83–92. [ Links ]
18. Rossert J, Eckardt KU. Erythropoietin receptors: their role beyond erythropoiesis. Nephrol Dial Transplant. 2005 Jun;20(6):1025-8. [ Links ]
19. Patel N, et al. Pretreatment with EPO reduces the injury and dysfunction caused by ischemia/reperfusion in the mouse kidney in vivo. Kidney International, Vol. 66 (2004), pp. 983–989. [ Links ]
20. Elliot J.M, et al. Erythropoietin mimics the acute phase response in critical illness. Critical Care 2003, 7:R35-R40 [ Links ]
21. Watanabe D, et al. Erythropoietin as a Retinal Angiogenic Factor in Proliferative Diabetic Retinopathy. N Engl J Med 2005;353:782-92. [ Links ]
22. Becerra S, et al. Erythropoietin an endogenous retinal survival factor. N Engl J Med, Vol. 347, No. 24 . December 12, 2002. [ Links ]
23. Ehrenreich H, et al. Erythropoietin Therapy for Acute Stroke Is Both Safe and Beneficial. Molecular Medicine 8(8): 495–505, 2002. [ Links ]
24. Kuriyam S, et al. Reversal of Anemia by Erythropoietin Therapy Retards the Progression of Chronic Renal Failure, Especially in Nondiabetic Patients. Nephron 1997;77:176-185 [ Links ]
25. Lappin T.R, Maxwell A.P, Johnston P.G. EPO's alter ego: erythropoietin has multiple actions. Stem Cells. 2002;20(6):485-92. [ Links ]
26. Nassar S, et al. Molecular defects of red blood cell membrane proteins among Egyptian children with hereditary spherocytosis. Lab Hematol 1998, 4: 269-275. [ Links ]
27. Bechensteen AG, Halvorsen S, Hågå P. Erythropoiesis during rapid growth. Role of erythropoietin and nutrition. Erythropoiesis during rapid growth. Role of erythropoietin and nutrition. Ann N Y Acad Sci. 1994 Apr 15;718:339-40. [ Links ]
28. Coleman D, et al. Rate of blood regeneration after blood loss. AMA Arch Intern Med. 1953;92(3):341-349. [ Links ]
29. Nijhof W. et al. Isolation and Characterization of the Erythroid Progenitor Cell: CFU-E. The journal of cell biology - volum 96 FEBRUARY 1983 386-392. [ Links ]
30. Nathan D.G, et al. The synthesis of heme and globin in the maturing human erythroid cell. J Clin Invest. 1961 June; 40(6): 940–946. [ Links ]
31. DESSYPRIS EN, Sawyer ST: Erythropoiesis. In: Wintrobe's Clinical Hematology. Volume 1. Part II. Section 2. The Erythocyte. 11th Ed. Philadelphia, PA: Lippincott Williams & Wilkins, 2004. p195-216. [ Links ]
32. Heath C, et al. The life of reticulocytes experiments on their maturation. Arch Intern Med. 1930;46(3):533-551. [ Links ]
33. Young LE, Lawrence JS. Maturation and destruction of transfused human reticulocytes. Evaluation of reticulocyte experiments for the measurement of hemoglobin metabolism. J Clin Invest. 1945 Jul;24(4):554–563. [ Links ]
34. Kendall R.G, Jeffries R, Cavill I, Norfolk D.R. Relationship between endogenous erythropoietin levels, reticulocyte count, and reticulocyte RNA distribution. A study of anemic patients with and without renal failure. Ann N Y Acad Sci. 1994 Apr 15;718:353-5. [ Links ]
35. Baldini M, et al. The Maturation Rate of Reticulocytes. Blood 1960 15: 614-629. [ Links ]
36. Rice L, et al. Neocytolysis contributes to the anemia of renal disease. American Journal of Kidney Diseases, Volume 33, Issue 1, January 1999, Pages 59-62 [ Links ]
37. Piron M, Loo M, Gothot A, Tassin F, Fillet G, Beguin Y. Cessation of intensive treatment with recombinant human erythropoietin is followed by secondary anemia. Blood. 2001 Jan 15;97(2):442-8. [ Links ]
38. Gonzales G, et al. Hemoglobina, Hematocrito y Adaptacion a la altura: su relación con los cambios hormonales y el periodo de residencia multigeneracional. Revista Med 15 (1): 80-93, 2007. [ Links ]
39. Rojas J. Aspectos fisiológicos en la adaptación a la hipoxia altitudinal. Acta Biológica Colombiana, Vol. 7 No. 2, 2002 [ Links ]
40. Winslow R.M, et al. Different hematologic responses to hypoxia in Sherpas and Quechua Indians. J Appl Physiol 66: 1561-1569, 1989; 8750-7587/89. [ Links ]
41. Beall C. Adaptations to altitude: A current assessment. Annual review of anthropology. 2001, vol. 30, pp. 423-456 [ Links ]
42. Adams WH, Strang LJ. Hemoglobin levels in persons of tibetan ancestry living at high altitude. Proc Soc Exp Biol Med. 1975 Sep;149(4):1036-9. [ Links ]
43. Beall C, et al. An Ethiopian pattern of human adaptation to high-altitude hypoxia. PNAS, December 24, 2002, vol. 99, no. 26, 17215–17218. [ Links ]
44. Abbrecht P.H, et al. Plasma erythropoietin in men and mice during acclimatization to different altitudes. J Appl Physiol 32: 54-58, 1972; 8750-7587/72. [ Links ]
45. Udden M.M, et al. Decreased production of red blood cells in human subjects exposed to microgravity. The Journal of laboratory and clinical medicine. 1995, vol. 125, no4, pp. 442-449. [ Links ]
46. Harris B, et al. Out of Thin Air: The Evolving Enigma of Erythropoietin and Neocytolysis. Annals of Internal Medicine. 17 April 2001. Volume 134 . Number 8. [ Links ]
47. Jennings RT, Sawin CF, Barratt MR: Chapter 28: Space Operations. In: Fundamentals of aerospace medicine. Third Edition. Philadelphia, PA: Lippincott Williams & Wilkins, 2002. p596-628. [ Links ]
48. BUCKEY JC: Chapter 7: Cardiovascular changes: Atrophy, arrhythmias, and orthostatic intolerance. In: Space Physiology. New York: Oxford university press, 2006. p139-168. [ Links ]
49. LEACH CS, Grigoriev AL, Natochin YV: Chapter 2: Short flights. In: Fluid and electrolyte regulation in spaceflight. Volume 94. San Diego, CA: American Astronautical society, 1998. p9-40. [ Links ]
50. Trial J, Rice L, Alfrey CP. Erythropoietin withdrawal alters interactions between young red blood cells, splenic endothelial cells, and macrophages: an in vitro model of neocytolysis. J Investig Med. 2001 Jul;49(4):335-45. [ Links ]
51. Trial J, et al. Erythropoietin withdrawal leads to the destruction of young red cells at the endothelial-macrophage interface. Current pharmaceutical design. 2004, vol. 10, no 2 (117 p.). [ Links ]
52. PEÑUELA O, Palomino F, Gomez L: Recombinant human erythropoietin beta improves storage lesion and decreases apoptosis-like indices on blood bank erythrocytes. Transfusion 2007, 47(3S Supplement): 85A-86. [ Links ]














