Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.17 no.2 Bogotá July/Dec. 2009
ARTÍCULO ORIGINAL
EVALUACIÓN DE LA BIOCOMPATIBILIDAD DE APATITA CARBONATADA DE SÍNTESIS SECA POR MEDIO DEL CULTIVO DE CÉLULAS OSTEOPROGENITORAS DE PORCINO
BIOCOMPATIBILITY EVALUATION OF CARBONATED APATITE OF DRY SYNTHESIS THROUGH PORCINE OSTEOPROGENITORS CULTURE
AVALIAÇÃO DA BIOCOMPATIBILIDADE DE APATITA CARBONATADA DE SÍNTESE SECA ATRAVÉS DE CULTURA DE CÉLULAS OSTEOPROGENITORAS DE SUÍNOS
CONSTANZA CARRETERO, BIÓLOGAa, CLAUDIA BERNAL, BACTERIÓLOGA, MARTHA LUCÍA TORRES, MICROBIÓLOGA, M.SC.a, K. JAMUNA THEVI, CIENCIA DE MATERIALES, M.SC.b, FADZIL AYAD ZAKARIA, CIENCIA DE MATERIALES, PH.D.b Y JOSÉ MIKÁN, BIÓLOGO, PH.D.a*
a Grupo Biotecnología en Salud, Laboratorio de Investigaciones, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia.
b Biomaterials Programme, Advanced Materials Research Centre (AMREC), SIRIM Berhad, Lot 34, Jalan Hi-Tech 2/3, Kulim Hi-Tech Park, 09000 Kulim, Kedah, Malaysia.
* Correspondencia: jose.mikan@unimilitar.edu.co. Dirección Postal: Tr. 3 #49-00, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia.
Recibido: Noviembre 5 de 2009. Aceptado: Diciembre 11 de 2009.
Resumen
El desarrollo de nuevos materiales para la regeneración ósea es un reto para las ciencias biomédicas, especialmente aquellos materiales sintéticos que simulan de la mejor manera los componentes del hueso natural. En este artículo se muestra los resultados de un trabajo en donde se evaluó la biocompatibilidad de la apatita carbonatada (CAp), preparada por reacción mecano-química de una mezcla de precursores en polvo, comprimida y luego horneada a altas temperaturas (llamada síntesis seca). Esta cerámica fue utilizada como sustrato en un cultivo de células osteoprogenitoras, las cuales se obtuvieron por medio de aspirados de la médula ósea de porcinos adultos, se aislaron por diluciones y se cultivaron en platos o sobre CAp con o sin la adición de factores de diferenciación osteogénica. Los cultivos se analizaron a diferentes tiempos por 45 días, periodo durante el cual se determinó el doblaje poblacional de las células y la capacidad osteoconductiva del biomaterial, a través de pruebas bioquímicas y moleculares. Como resultados de este trabajo se estableció un cultivo primario de osteoprogenitores de la médula ósea de porcino, para la evaluación in vitro de un material cerámico de síntesis por reacción del estado sólido, y se exploró el uso potencial del material como substituto del hueso natural, al analizar su capacidad osteoconductiva, por medio de microscopia óptica y electrónica y de la expresión de marcadores bioquímicos y moleculares, tales como la expresión de fosfatasa alcalina, deposición de calcio y acumulación de xilenol orange concomitante con la detección de Runx2, osteocalcina y osteopontina.
Palabras clave: biocerámicas, apatita carbonatada, células madre mesenquimales, médula ósea
Abstract
The development of new materials for bone regeneration constitutes a challenge for biomedical sciences, especially when it is desirable to design synthetic materials that simulate the most the composition of natural bone. In this work biocompatibility of carbonated apatite (CAp) was evaluated. CAp was prepared through mechano-chemical mixing, compression and sintered at high temperature (referred as dry synthesis) of powdered precursors. This ceramic was then used as a substrate for the culture of porcine osteogeprogenitors. Cells were obtained from the bone marrow of adult porcine just after sacrifice by series of dilutions. Cells were then cultured onto culture plates or onto CAp, with and without addition of known differentiation osteogenic factors. Cultures were carried out for 45 days during which the doubling time of the culture was determined as well as the osteoconductivty of CAp, by means of determining some biochemical and molecular markers. A primary culture of porcine bone marrow osteoprogenitor was established and was used for the in vitro evaluation of a ceramic material synthetised by solid state reaction. The potential use of the material as a substitute for natural bone implant was explored, by analysing its osteoconductive capacity, through light and electron microscopy and expression of biochemical and molecular markers, such as the expression of alkaline phosphatase, calcium deposition and xylenol orange accumulation, concomitant with detection of Runx2, osteocalcin and osteopontin.
Key words: bioceramics, carbonated apatite, mesenchymal stem cells, bone marrow
Resumo
O desenvolvimento de novos materiais para regeneração óssea é um desafio para as ciências biomédicas, especialmente as de materiais sintéticos que simulam da melhor maneira os componentes do osso natural. Neste artigo mostram-se os resultados de um trabalho que avaliou a biocompatibilidade de apatita carbonatada (Cap), preparada por reação mecanoquímica de uma mistura de pó precursor, comprimido e depois cozido em altas temperaturas (chamado de síntese seca). Esta cerâmica foi utilizada como substrato em uma cultura de células osteoprogenitoras, que foram obtidas por aspirado da medula óssea de suínos adultos, foram isoladas por diluição e cultivadas em placas ou no Cap com ou sem a adição de fatores de diferenciação osteogênica. As culturas foram analisadas em diferentes momentos, por 45 dias, período durante o qual se determinou a duplicação da população celular e a capacidade osteocondutora de biomaterial, através de testes bioquímicos e moleculares. Como resultado deste trabalho criou-se uma cultura primária de osteoprogenitoras da medula óssea de suínos, para avaliação in vitro de um material sintético cerâmico por reação de estado sólido, e foi explorado o potencial uso do material como um substituto para o osso natural, ao se analisar a capacidade osteocondutora, pela microscopia de luz e eletrônica e expressão de marcadores bioquímicos e moleculares, tais como a expressão de fosfatase alcalina, deposição de cálcio e acúmulo de laranja de xilenol concomitante com a detecção de Runx2, osteocalcina e osteopontin.
Palavras-chave: biocerâmica, apatita carbonatada, células-tronco mesenquimais, medula óssea
Introducción
Muchas lesiones o defectos encontrados por los especialistas de la salud, tanto en el área dental como en el área ortopédica, requieren el uso de injertos óseos. Las opciones actuales incluyen autoinjertos, aloinjertos y una variedad de dispositivos sintéticos (metales, cerámicas y polímeros). El uso de estos conlleva dificultades, tanto biológicas como metodológicas, con respecto a la reacción corporal y la asimilación del implante. Dada la importancia médica y el impacto económico de los dispositivos de uso biomédico, se viene ampliando la investigación para el desarrollo de nuevas técnicas y productos (1). El reto es generar bioactividad e integración ósea, seguido de reparación y regeneración del tejido circundante al implante de la forma más simple, sin generar reacciones de rechazo (2,3).
La hidroxiapatita es uno de los componentes cerámicos más utilizados en la fabricación de biomateriales en la actualidad. Sin embargo, aunque es osteoinductiva, su actividad biológica es dependiente del proceso de fabricación y de síntesis, los cuales pueden generar en algunas ocasiones, productos de baja biocompatibilidad con el tejido adyacente y pueden bloquear la capacidad osteoinductiva de las células residentes (4,5).
El uso de apatita carbonatada (CAp) ha mostrado ventajas frente a otras apatitas o fosfatos de calcio como un sustituto de hueso por su alta capacidad reabsorbible (6,7). Esta cerámica no se había podido sintetizar dado que el carbonato introducido en la hidroxiapatita suele perderse a más de 1.000 °C, temperatura promedio del horno durante la fase de "sintering" de una cerámica. Nuestro grupo sintetizó y patentó dos procedimientos para obtener CAp a través de la conocida reacción en soluciones acusas (de síntesis húmeda) y por reacción del estado sólido (síntesis seca) seguido del horneado a 1250 °C en atmósfera controlada. También se demostró la presencia del carbonato dentro del cristal de la cerámica (8,9), lo que puede ayudar a la infiltración de diferentes tipos celulares del tejido óseo, durante la evaluación de CAp de síntesis húmeda en cultivo de células (10). Otros trabajos han reportado que la presencia del carbonato en el cristal mejoraría la reactividad de los fosfatos de calcio en fluido simulado y también su actividad osteoinductiva y osteoconductiva, donde se ha resaltado principalmente su alta capacidad biodegradable, la cual es superior a la hidroxiapatita (5,11,12).
El uso de biomateriales junto con diferentes cultivos celulares es el modelo que se ha utilizado para verificar el éxito de los implantes. Los tipos celulares que se han ensayado han sido tan variados como los resultados obtenidos. Entre los tipos celulares más usados para el reemplazo óseo están las células provenientes de la médula ósea. Este grupo celular se caracteriza por contar con un porcentaje relativo de células madre mesenquimales (MSC: mesenchymal stem cell) (13), de las cuales en numerosos estudios se ha demostrado su pluripotencialidad y la capacidad de diferenciarse en diferentes tipos celulares como fibroblastos, células osteogénicas, células adipogénicas y/o células reticulares (4,13,14).
Materiales y métodos
Síntesis de apatita carbonatada
Se sintetizó apatita carbonatada por medio de reacción del estado sólido, como fue descrito previamente (8). En breve, los precursores químicos en polvo: Ca(PO4)2 (Fluka) y CaCO3 (Fluka) se mezclaron y reaccionaron en un dispositivo para moler, consistente en una jarra de teflón conteniendo esferas de alumina, girando sin fin sobre un aparato mecánico con poleas. Este "ball milling" se dejo trabajando por 24 h para que los polvos reaccionaran. Los productos de reacción fueron luego comprimidos en prensa isostática fria (AIP CP360) a 210MPa. Las muestras fueron luego horneadas ("sintering") en un horno de atmósfera controlada (Modutemp, Australia) hasta 1250°C por 1 h a una tasa de calentamiento de 5°C/min. El sintering continuó primero en aire por 1 h a 1250°C y luego se dejo enfriar en froma controlada, mientras se inyectó CO2 refrigerado a atmosferas determinadas, hasta alcanzar 500°C, para luego continuar las reducción de temperatura hasta la ambiental, en atmosfera de N². La fase cristalina de las muestras antes y despues del "sintering" fue caracterizada por difractometría de rayos X (XRD; Bruker, Germany). Se realizaron estudios de microscopía electrónica de barrido (SEM, Zeiss), espectroscopía infrarroja con transformación de Fourier (Perkin Elmer System 2000), análisis elemental por plasma acoplado inducido (ICP; Perkin Elmer Optima 2000DV) y análisis de CHNS con el uso del Elemental analyser FISON Model EA1108.
Obtención de células y caracterización del cultivo de la medula ósea
Se realizaron aspirados de medula ósea de la cresta iliaca de porcinos (recién sacrificados), de aproximadamente cinco meses de edad (Colaboración del Frigorífico San Martín, Bogotá, Colombia). La piel de la sección a tratar fue previamente desinfectada con alcohol antiséptico al 70%; se punzó con una aguja para aspirado medular de uso veterinario y se aspiró la médula con una jeringa veterinaria conteniendo Heparina (SIGMA- 250.0000 u) a una concentración de 1000 u/mL (15).
Las muestras se transportaron y se procesaron inmediatamente, midiendo el volumen recolectado y mezclándolo con medio de cultivo sin suplementos en una relación 2:1. En seguida se centrifugó a 1200 rpm durante 7 min, recuperando la interfase que se recolectó en un nuevo tubo y se centrifugó nuevamente. Esta segunda interfase y se suspendió 1:10 con medio 60% D-MEM 40% MCDB, suplementado con 10% SFB (suero fetal bovino) y antibiótico estreptomicina/penicilina 10mL/L y se sembró en placas de cultivo a una densidad entre 1x10³ a 1x105 células/cm². Tras subcultivos sucesivos, donde se redujo el SFB hasta 0,5-1%, se obtuvieron células fibroblastoides características que fueron críopreservadas (11).
Doblaje poblacional
Las células descongeladas se sembraron a una densidad de 2500 células/cm² en placas de 48 pozos con cuatro tratamientos distintos: (1) 60% D-MEM 40% MCDB (medio 60-40) y 2% SFB; (2) Medio 60-40 suplementado con 10% SFB e inductores de diferenciación (10-7 M Dex, 100 mM AsAp y 10 mM I-GliP); (3) y (4) la misma composición de los dos anteriores, respectivamente, pero sobre CAp de síntesis seca. Se realizaron siembras por triplicado para cada tratamiento y se incubaron en atmósfera húmeda con 5% de CO² a 37° C. Se realizó recuento celular de forma indirecta por medio de la detección de la actividad hexosaminidasa (16) en diferentes días de cultivo (0, 10, 20 y 35). El número de generaciones o doblaje poblacional (n) del cultivo, se expresó como n =3,32*log (NH/NI) en donde NI corresponde a la cantidad de células sembradas en tiempo 0 y NH es el recuento de células en los demás tiempos. Se determinó la tasa de multiplicación (r) que corresponde al número de generaciones por unidad de tiempo (17).
Diferenciación osteogénica
Se realizaron siembras en cuatro diferentes condiciones: Cultivo de células de médula ósea sobre placa de cultivo con medio más 2% SFB, cultivo de células de médula ósea sobre placa de cultivo con medio suplementado con 10% SFB e inductores de diferenciación (10-7 M Dex, 100 [M AsAp y 10 mM I-GliP), cultivo de células de médula ósea sobre CAp con medio más 2% SFB, cultivo de células de médula ósea sobre CAp con medio suplementado con 10% SFB e inductores de diferenciación (10-7 M Dex, 100 [M AsAp y 10 mM I-GliP).
Se realizaron siembras de 2.500 células/cm² en placas de 48 pozos, inoculando 0,5 mL de medio por pozo. Para el caso de los tratamientos con CAp se colocaron tres piezas (0.3 x 0.4 cm) por pozo, previamente reaccionadas en solución de fluido corporal simulado por ocho días (18). Se evaluó la morfología celular, los marcadores bioquímicos y los marcadores moleculares a los 0, 10, 20, 35 y 45 días. Se usaron células de segundo pase de médula ósea de adulto y los medios se cambiaron cada cuatro o cinco días.
Análisis de marcadores bioquímicos y moleculares
Pruebas Bioquímicas
La determinación cuantitativa de fosfatasa alcalina se realizó entre los días 0 y los 35, de acuerdo a Solchaga (19) y Jaiswal (14), y modificado por Díaz y col. (20). La determinación cualitativa de fosfatasa alcalina se realizó entre los días 0 y los 45, de acuerdo a Encina (21) y modificado por Díaz y col. (20). La determinación cuantitativa del calcio de la matriz extracellular se analizó entre los 0 y los 45 días, con el uso del método de Calcio-O-cresolftaleína complexona (22,23) considerando las modificaciones hechas por Díaz (20). La determinación cualitativa del calcio de la matriz extracelular se analizó entre los 0 y los 45 días. Los depósitos de calcio se determinaron por la técnica de von Kossa, descrita en Dragoo (24) y con las modificaciones hechas por Díaz y col. (20). La determinación cualitativa del calcio sobre CAp se realizó para los 35 y 45 días. Para observar los depósitos de calcio sobre la CAp se utilizó el reactivo fluorescente Xilenol Orange (SIGMA), un fluorocromo que forma un complejo con el calcio depositado, el cual emite un color naranja. Este se adicionó al medio de cultivo como solución [20 µM], y se dejó en reacción por 24 horas (25). La observación se realizó en el microscopio invertido con luz de fluorescencia (Lámpara HBO 50/AC).
La determinación cuantitativa de fosfatasa alcalina se realizó entre los días 0 y los 35, de acuerdo a Solchaga (19) y Jaiswal (14), y modificado por Díaz y col. (20). Entre los 0 y los 45 días se hizo: la determinación cualitativa de fosfatasa alcalina de acuerdo al método de Encina (21) y modificado por Díaz y col. (20), la determinación cuantitativa del calcio de la matriz extracellular por método de Calcio-O-cresolftaleína complexona (22,23) y modificado por Díaz y col. (20) y la determinación cualitativa del calcio de la matriz extracelular. Los depósitos de calcio se determinaron por la técnica de von Kossa, descrita en Dragoo (24) y modificada por Díaz y col. (20). La determinación cualitativa del calcio sobre CAp se realizó en los días 35 y 45. Para observar los depósitos de calcio sobre la CAp se utilizó el reactivo fluorescente Xilenol Orange (SIGMA), un fluorocromo que forma un complejo con el calcio depositado, el cual emite un color naranja. Este se adicionó al medio de cultivo como solución [20 µM], y se dejó en reacción por 24 horas (25). La observación se realizó en el microscopio invertido con luz de fluorescencia (Lámpara HBO 50/AC).
Pruebas Moleculares
Estas pruebas se realizaron en los días 0, 10, 20 y 35. El análisis se realizó por transcripción inversa seguida de PCR (RT-PCR). Se evaluó presencia de los transcritos de: Runx2, osteocalcina (OC) y osteopontina (OP), según la metodología empleada por Díaz (2006). Las secuencias usadas se muestran en la tabla 1.
La extracción de mARN a partir de los cultivos de células se hizo por el método de Trizol (Gibco-BRL Life Technologies cat No.15526). Para el RT se siguieron las recomendaciones del fabricante (INVITROGEN cat No. 18064-022) y los primers que se emplearon en la PCR fueron previamente diseñados y estandarizados por Díaz y col. (11,20). El control positivo de extracción del ARN y síntesis de cADN fue el gen de β-actina y como control positivo de la expresión de dichos genes se empleó una línea celular de osteoblastos humanos (CRL – 11372 de ATCC).
Microscopía electrónica de barrido sobre la CAp
Se tomaron imágenes de SEM del la superficie de CAp sin células para analizar el aspecto de los cristales depositados por reacción de fluido simulado y con células para ver la distribución de las células en el tiempo 0, y la formación y densidad de cristales de calcio a los 30 y 40 días. Para la preparación de muestras se realizó una deshidratación con acetona ascendente (30%, 50%, 70%, 90%, 100%) y se realizaron las observaciones en el microscopio electrónico de barrido XVP (eXtended Variable Pressure), (Zeiss EVO LS 10, Germany). Los depósitos de calcio se analizaron por espectrometría de rayos X (LEO 1525-12-95) (Díaz, 2007).
Análisis estadístico
Los análisis se hicieron empleando el programa R© versión 2.8.1 (B. D. Ripley and D. J. Murdoch, Boston, USA, 2005). Se realizaron análisis de varianza (ANOVA) y análisis de varianza para estructuras factoriales de los diferentes tratamientos para un intervalo de confianza 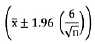 para una p= 0,05 y 1-alfa = 0,95.
para una p= 0,05 y 1-alfa = 0,95.
Resultados
Obtención y cultivo de células de medula ósea
Se obtuvieron células a partir de las siembras por dilución y cambio constante de medio. La mejor adherencia y proliferación se dio en las placas de 24 pozos, el día 14 de cultivo, cuando las células adherentes alcanzaban una confluencia de alrededor del 50%. Alrededor de los 20 días se alcanzó confluencia del 100%. Las células obtenidas presentaban la morfología fibroblastoide y tamaño de acuerdo a lo reportado para células mesenquimales (Figura 1a). Estas células se mantuvieron en medio de cultivo 60-40, suplementado con SFB al 1-2% (v/v) y antibiótico estreptomicina/penicilina.
Ensayo de doblaje poblacional
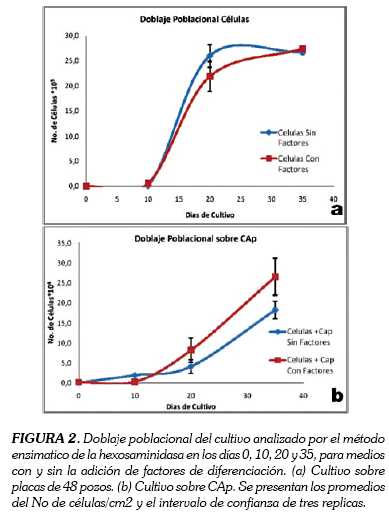
Los valores obtenidos de N acumulado para los cultivos sobre placa no se ven afectados por la adición de factores (sin factores: 21, 4 y con factores: 21, 6); mientras que los cultivos sobre CAp mostraron diferencias significativas cuando se compararon con los cultivos sobre placa. Se comprobó que esta diferencia se dio por la adsorción del p-nitrofenil liberado después de la reacción enzimática de la hexosaminidasa, y que al adsorberse a CAp, termina subvalorando la cantidad de células. Así mismo se observaron diferencias significativas entre los cultivos sobre CAp tratados con factores y los no tratados (sin factores: 19,6 y con factores: 12,7). La curva de doblaje poblacional de las células de médula ósea de porcinos adultos muestra que las células aumentan con los días de cultivo (n = 9,6 r = 0,02 a los 20 días de cultivo). Se observa que los cultivos sobre placa con y sin factores de diferenciación crecen exponencialmente, sin que se presenten diferencias entre ellos (Figura 2). En el caso de las células sembradas sobre CAp se observó que aumenta con los días de cultivo, pero a una tasa menor que los cultivos sobre placa (n = 8,3 r = 0,009 a los 20 días de cultivo).
Ensayo de diferenciación celular
Los cultivos iniciaron con una confluencia aproximada del 20% y con morfología celular de acuerdo lo descrito para células mesenquimales. A los diez días las diferencias entre los tratamientos empiezan a ser notorias: las células sin factores presentan una forma más alargada y fibroblastoide, mientras que las células con factores empiezan a adquirir forma cuboide. A los 20 días de cultivo todos los tratamientos presentan monocapa completa y en los cultivos con factores se pudo constatar el inicio de la formación de agregados celulares (nódulos) (Figura 1b). Como característica relevante, los cultivos sin factores sembrados sobre CAp muestran también de la formación de pequeños nódulos, los que no se observaron en los cultivos sobre placas (Figura 1c, 1d). A los 35 días de cultivo en adelante, las diferencias morfológicas anteriormente descritas se hicieron más evidentes.
Análisis de marcadores bioquímicos y moleculares
Fosfatasa alcalina
La actividad cuantitativa es mayor en cultivos con factores que en los cultivos sin factores. Aunque esta diferencia no resultó estadísticamente significativa para la comparación entre tratamientos, si resultó significativa entre tiempos, aumentando a medida que transcurrieron los días del ensayo. La determinación cualitativa por citoquímica mostró el color rojo característico para los tratamientos a partir de los diez días de cultivo, la cual se incrementa en intensidad hasta los 30 días (Figura 3a, 3b). A los 40 días la intensidad disminuye, siendo aparente solo en los nódulos.
Determinación de calcio en la matriz extracelular
Los análisis de cuantitativos y cualitativos (von Kossa) se realizaron solo en placa, dada la presencia de calcio en el material de CAp. De acuerdo con el análisis estadístico ANOVA se pudo constatar diferencias significativas entre los tratamientos. Se pudo determinar que la formación de matriz extracelular calcificada empieza entre los diez y los 20 días para los cultivos con factores y entre los 20 y los 35 días para los cultivos sin factores. Si bien los cultivos sin factores muestran concentraciones detectables de calcio, este es significativamente menor que en los cultivos con factores, lo que es más evidente en los tiempos más avanzados. Así mismo, la presencia de depósitos citoquímicos de calcio (precipitados de color negro) se observaron en los nódulos de los tratamientos con factores hacia los 20 días de cultivo. Los cultivos sin factores fueron positivos para precipitados de calcio a los 35 días de cultivo (Figura 3c y d). En general, los depósitos fueron mas claros y de mayor tamaño en los tratamientos con factores de diferenciación que en los de los cultivos sin factores en las placas.
La prueba con el cromóforo fluorescente xilenol orange para evidenciar cristales de calcio en la matriz sintetizada por las células y realizado a los 30 y 45 días de cultivo, mostró que la mineralización aumenta con el tiempo para los cultivos sobre placa y sobre CAp, tanto con factores como sin factores de diferenciación. Se observó mayor cantidad, tamaño y brillo de los focos de fluorescencia, con el aumento de los días de cultivo y la presencia de factores de diferenciación osteogénica (Figura 4).
RT-PCR
Se comprobó la presencia de transcritos de Runx2, OC y OP (Figura 5): Runx2 se detectó en todos los cultivos realizados. La expresión de OC se detectó en todos los tiempos y tratamientos excepto en el tiempo 0. OP se detectó en los cultivos con factores sobre placa a partir del tiempo 10, mientras que en los cultivos sin factores se no se detectó hasta el tiempo 20. Para los cultivos sobre CAp, la expresión de OP fue evidente en el cultivo sin factores del tiempo 10 y partir de allí en todos los tiempos y tratamientos.
Microscopía electrónica de barrido sobre CAp
La micrografías permitieron la comparación de la superficie de CAp de síntesis seca antes de reaccionar con SFB, donde se destacan los cristales con bordes angulados y las superficies lisas características de la cerámica después del horneado (Figura 6a, b). Por el contrario, el material reaccionado con SFB muestra una superficie de aspecto moteado (cristales amorfos), correspondientes a precipitados de fosfato de calcio sobre el material por efecto de la sobresaturación de sales en SFB en contacto con la cerámica (Figura 6c, d). Este material amorfo se constituye en una superficie apta para la adhesión celular, al ser reconocida por adhesinas de la membrana celular (26).
Se observó la adhesión y proliferación de las células sobre CAp con el transcurso del tiempo (Figura 7). Sin embargo, no fue posible determinar diferencias morfológicas entre las células en los cultivos tratados con factores de aquellos sin factores. Se confirmó que las células en suspensiones de baja concentración no se adhieren a CAp homogéneamente, si no en agrupaciones (Figura 7C) y van ocupando todo el área disponible a medida que proliferan, formando finalmente agrupaciones semejantes a nódulos. Se advirtió también la presencia de depósitos minerales tanto en cultivos sobre CAp sin factores como con factores de diferenciación, siendo de mayor tamaño para este ultimo. Se analizaron los depósitos partículados sobre la matriz (usualmente ubicados rodeando las células), por espectrometría de rayos X y se confirmó que la composición de esos depósitos es C, N, O y Ca, lo que es compatible con matriz extracelular calcificada propia del tejido óseo (Figura 8).
Discusión
Se realizó el aislamiento y cultivo de células de la médula ósea de adultos porcinos, las cuales, aunque están en bajas concentraciones dentro de un grupo celular heterogéneo, se adhieren y proliferan semejante a lo reportado en la literatura para células mesenquimales (27,28,29). Al inicio del cultivo la heterogeneidad morfológica es evidente, la cual disminuye notablemente con los subcultivos a baja concentración de SFB, predominando la morfología fibroblastoide. Esta morfología puede mantenerse siempre y cuando se mantengan bajas las concentraciones de SFB en los medios y las densidades de siembra y cultivo, lo que esta de acuerdo con la literatura (30,31,32). Dada la alta cantidad de volumen extraído y la baja proporción de células mesenquimales, el uso de la metodología de siembra por dilución, separando previamente los eritrocitos por centrifugación, resulta ser una metodología apropiada para obtener las células adherentes fibroblastiodes de la medula ósea de porcino. En este trabajo se planteó trabajar con densidades de siembra de células tan bajas como fuera posible, con la idea de establecer cultivos de clones por siembra en dilución (hasta 20 células /cm²), sobre cajas recubiertas con fibronectina y colágeno tipo I. Sin embargo, no se consiguió la obtención de dichos clones y se observó que la densidad mínima con la cual las células podían dividirse fue de 200 células/ cm², densidad a la cual no fue posible el aislamiento de clones viables. Al respecto se reporta en la literatura que la densidad de siembra es un factor crítico que influye en el potencial de proliferación (33). Jiang y col. (30) lograron clones de cultivos de medula de ósea fetales humanas a una densidad mínima de 32 cel/cm², en condiciones de cultivo similares a las que se utilizaron en este trabajo. Según lo descrito por Reyes (34), el éxito de clonación es de tan sólo 1%. Considerando el bajo número de pozos e intentos realizados en este trabajo, era de esperarse una probabilidad de éxito baja, pero se prevé que al aumentar el número de pozos e intentos podría tenerse éxito. El uso de clones es un exigencia, si se desea llegar a resultados mas claros respecto de la capacidad osteoinductora in vitro del material.
Por otro lado, se estableció que la determinación del número de células por actividad hexosaminidasa no es el método ideal a ser utilizado en el material de CAp, dado que el p-nitrofenol resultante de la reacción enzimática se adsorbe a la cerámica fuertemente y por lo tanto se termina subvalorando el número total de células. Dado que el método clásico de separación por tripsina también se dificulta en el material, se debe buscar un método alternativo de simple realización.
En este trabajo se observó que tanto los cultivos inducidos con factores sin diferenciación como los no inducidos, expresaron en algún grado cambios morfológicos y expresión de transcritos de genes específicos de la línea osteogénica. Una explicación muy plausible es la presencia de células tempranamente inducidas en osteogénesis, dentro del cultivo heterogéneo inicial. No obstante este resultado no permite determinar con claridad la capacidad osteoinductiva de CAp en el modelo in vitro, sí sugiere que este material tiene capacidad osteconductiva, puesto que se observó la adherencia, proliferación y posterior expresión de fenotipos y genes relacionados con la osteogenesis en los cultivos sobre CAp.
A este respecto, al final del periodo estudiado (45 días), los cultivos con factores de diferenciación mostraron una morfología totalmente distinta a la inicial, con formas cuboides bien definidas y agregados celulares similares a lo descrito en la literatura (35); mientras que los cultivos sin factores cambiaron su morfología fibroblastoide y mostraron la formación de algunos nódulos pequeños de mineralización. Así mismo, los resultados obtenidos en los ensayos con xilenol orange dan evidencia de la posible capacidad osteoconductiva de CAp, ya que los cultivos sobre el material (inducidos y no inducidos), presentan áreas de mineralización evidente, comparables con aquellas observadas en los cultivos con factores de inducción osteogénica sobre placas, no solo en microscopia de fluorescencia si no también en espectrometría de rayos X en los análisis de SEM.
En conclusión, se determinó la capacidad de propagación y diferenciación de las células extraídas de la médula ósea de porcinos establecidas en un cultivo primario, y su utilidad para evaluar in vitro un material cerámico de síntesis por reacción del estado sólido. Se exploró el uso potencial del material como posible implante, al analizar su capacidad osteoconductiva, por medio de microscopia óptica y electrónica y de la expresión de marcadores bioquímicos y moleculares. Se estableció el cultivo de células osteoprogenitoras de la médula ósea de porcino con el cual se evaluó la biocompatibildiad en términos de osteoconducción del material de CAp. Se propone continuar estudios con este modelo, con el fin de obtener cultivos clonales, que permitan obtener mejores resultados en términos de reducción de la variabilidad y la obtención de resultados más concluyentes respecto de la capacidad osteinductiva de CAp de síntesis seca.
Agradecimientos
Los autores quieren agradecer al Ministerio de Ciencias, Tecnología e Innovación de Malasia por el patrocinio de investigación IRPA 09 0101 0031 EA001 y a la Universidad Militar Nueva Granada por la financiación del proyecto Med 2005-001. A Melisa Barrios y Marién Villamil por su colaboración en los ensayos de conteo celular.
Referencias
1. Ringe J, Kaps C, Burmester G, Sitiinger M. Stem Cells for Regenerative Medicine: Advances in the Engineering of Tissues and Organs. Naturwissenschafen. 2002; 89:338-351. [ Links ]
2. Ozawa S, Kasugai S. Evaluation of Implant Materials (Hydroxyapatite, Glass Ceramics, Titanium) in Rat Bone Marrow Stromal Cell Culture. Biomaterials. 1996; 17: 23-29. [ Links ]
3. Kim HJ, Kim UJ, Kim HS, Li C, Wada M, Leisk GG, Kaplan D.L. Bone Tissue Engineering with Premineralized Silk Scaffolds. Bone. 2008; 42: 1226–1234. [ Links ]
4. Oreffo ROC, Driessens FCM, Planell JA, Triffitt JT. Growth and Differentiation of Human Bone Marrow Osteoprogenitors on Novel Calcium Phosphate Cements. Biomaterials. 1998; 19: 1845-1854. [ Links ]
5. Ducheyne, P, Qiu, Q. Bioactive Ceramics: the Effect of Surface Reactivity on Bone Formation and Bone Cell Function. Biomaterials. 1999; 20: 2287-2303. [ Links ]
6. Doi Y, Shibutani T, Moriwaki Y, Kajimoto T, Iwayama Y. Sintered Carbonate Apatites as Bioresorbable Bone Substitutes. Journal of Biomedical Materials Research. 1998; 39 (4): 603-610. [ Links ]
7. Langstaff S, Sayer M, Smith T J N, Pugh SM. Resorbable Bioceramics Based on Stabilized Calcium Phosphates. Part II: Evaluation of Biological Response. Biomaterials. 2001; 22: 135-150. [ Links ]
8. Zakaria, FA, Thevi KJ, Abu Bakar, SH, Hussin, ZH, Muhammad, S and Mikan-Venegas, JF. Preparation of Carbonated Apatite and its Evaluation. Proceedings of the Materials and Processes for Medical Devices Conference, 2005 November 14-16, Boston, Massachusetts, USA: ASM International. 2006. pg 43-47. [ Links ]
9. Zakaria FA, Marsad NH, Abdul-Manaf AY, Villamil M, Montes T, Carretero C, Mikan J. Characterisation of Carbonated Apatite for Possible Application in Biomedical Implants. Materials Research Innovations. 2009; 13(3):309-312. [ Links ]
10. Mikan J, Villamil M, Montes T, Carretero C, Bernal C, Torres ML, Zakaria FA. A Porcine Model for a Hybrid Material of Carbonated Apatite and Osteoprogenitor Cells. Materials Research Innovations. 2009; 13(3): 323-326. [ Links ]
11. Díaz LM, Villamil M, Bernal CL, Torres ML, Thevi JK, Zakaria FA, Mikan JF. Cultivo de Células de Linaje Osteogénico de Periostio de Porcino para la evaluación de un Biomaterial. Revista Med. 2007;15 (2): 192-206. [ Links ]
12. Habibovic P, De Groot K. Osteoinductive Biomaterials – Properties and Relevance in Bone Repair. Journal of tissue Engineering and Regenerative Medicine. 2007; 1: 25-32. [ Links ]
13. Ringe J, Kaps C, Schmitt B, Büscher K, Bartel J, Smolian H, Schultz O, Burmester G, Häupl T, Sittinger M. Porcine Mesenchymal Stem Cells Induction of Distinct Mesenchymal Cell Lineages. Cell Tissue Res. 2002; 307:321–327. [ Links ]
14. Jaiswal N, Haynesworth SE, Caplan AI, Bruder SP. Osteogenic Differentiation of Purified, Culture-Expanded Human Mesenchymal Stem Cells In Vitro. Journal of Celular Biochemitry. 1997; 64: 295-312. [ Links ]
15. D`ippolito G, Schiller C, Perez-Stable C, Balkan W, Roos B, Howard G. Cooperative Actions of Hepatocyte Growth Factor and 1,25-Dihydroxyvitamin D3 in Osteoblastic Differentiation of Human Vertebral Bone Marrow Stromal Cells. Bone. 2002; 31 (2): 269-275. [ Links ]
16. Merli A, Canessa A, Terragna A. Quantification of Toxoplasma-Induced Cytopathic Effect (CPE) In vitro by the Assessment of Cell Number Via the Endogenous Enzyme, Hesosaminidase. Journal of Microbiological Methods. 1987; 6: 327-332. [ Links ]
17. Davis JM. Basic Cell Culture: A Practical Approach. Oxford University Press. New York, United States. 1994; 301. [ Links ]
18. Oyane A, Onuma K, Ito A, Kim H, Kokubo T. and Nakamura T. J. Biomed. Mater. Res. A. 2003; 64A: 339–348. [ Links ]
19. Solchaga L.A, Cassiède P, Caplan A. Different Response to Osteo-Inductive Agente in Bone Marrow-and Periosteum-Derived Cell Preparations. Acta Orthopaedic Scandinavian. 1998; 69 (4): 426-432. [ Links ]
20. Díaz LM. Cultivo In Vitro De Células De Linaje Osteogénico Provenientes De Periostio De Porcino. Tesis de Grado. Bogotá. Universidad Militar Nueva Granada. Facultad de Ciencias, Facultad de Medicina. 2006. [ Links ]
21. Encina NR, Brillotte WG, Hofmann MC. Immunomagnetic Islation of Osteoprogenitors from Human Bone Marrow Stroma. Laboratory Investigation. 1999; 79 (4): 449-464. [ Links ]
22. Gitelman H. An Improved Automated Procedure for the Determination of Calcium in Biological Specimens. Analytics Biochemistry. 1967; 20: 521-531. [ Links ]
23. Gronthos S, Zannettino A, Graves S, Ohta S, Hay S, Simmons P. Differential Cell Surface Expression of the STOR-1 and Alkaline Phosphatase Antigens on Discrete-Developmental Stages in Primary Cultures of Human Bone Cells. Journal of Bone & Mineral Research. 1999; 14 (1): 47-56. [ Links ]
24. Dragoo JL, Lieberman JR, Lee R, Deugarte DA, Lee Y, Zuk PA, Hedrick MH, Benhaim P. Tissue-Engineered Bone from BMP-2–Transduced Stem Cells Derived from Human Fat. Plastic and Reconstructive Surgery. 2005; 115 (62): 1665-1673. [ Links ]
25. Wang YH, Liu Y, Maye P, Rowe DW. Examination of Mineralized Nodule Formation in Living Osteoblastic Cultures Using Fluorescent Dyes. Biotechnology Progress. 2006; 22: 1697-1701. [ Links ]
26. Anselme K. Osteoblast Adhesion on Biomaterials, Biomaterials. 2000; 21: 667-681. [ Links ]
27. Brustle KN, Jones RD. Learish. Embryonic Stem Cell-Derived Glial Precursors: a Source of Myelinating Transplants. Science. 1999; 285: 754-756. [ Links ]
28. Villa A, Rubio FJ, Navarro B, Bueno C, Martínez-Serrano A. Human neural stem cells in vitro. A focus on their isolation and perpetuation. Biomedicine and Pharmacotherapy. Review. 2001; 55 (2): 91-95. [ Links ]
29. Schmid R. Stem Cells: A Dramatic New Therapeutic Tool. Journal of Gastroenterology and Hepatology. 2002;17: 636-642. [ Links ]
30. Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Molecular Biology of the Cell. Fourth Edition. Garland Science. New York. USA. 2002; 1300-1311. [ Links ]
31. Jiang Y, Jahagirdar B, Reinhardt R, Schwartz R, Keene C, Ortiz-Gonzalez X, Reyes M, Lenvik T, Lund, Blackstad M, Du J, Aldrich S, Lisberg A, Low W, Largaespada D, Verfaillie C. Pluripotency of Mesenchymal Stem Cells Derived from Adult Marrow. Nature. 2002; 418: 41-49. [ Links ]
32. Jaquiéry C, Schaeren S, Farhadi J, Mainil-Varlet P, Kunz C, Zeilhofer H, Heberer M, Martin I. In Vitro Osteogenic Differentiation and In Vivo Bone-Forming Capacity of Human Isogenic Jaw Periosteal Cells and Bone Marrow Stromal Cells. Annals of Surgery. 2005; 242 (6): 859-868. [ Links ]
33. Pivoriunas A, Bernotienè E, Unguritè A, Valiunienè S, Drasutienè G, Venalis A. Isolation and Differentiation of mesenchymal stem-like cells from human umbilical cord vein endothelium and subendothelium. Biologija. 2006; 2: 99-103. [ Links ]
34. Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaille C. Purification and Ex vivo Expansion of Postnatal Human Marrow Mesodermal Progenitor Cells. Blood. 2001; 98 (9): 2615-2625. [ Links ]
35. Gilbert S. Developmental Biology. Fifth edition. Chapter 9. Sinauer Associates, Inc. Sunderland, Massachusetts. USA. 1997; 351-356. [ Links ]














