Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256On-line version ISSN 1909-7700
rev.fac.med vol.17 no.2 Bogotá July/Dec. 2009
PRÁCTICA CLÍNICA
TUMOR DE FRANTZ: REPORTE DE CASOS
FRANTZ' TUMOR: CASES REPORT
TUMOR DE FRANTZ: O RELATÓRIO DO CASOS
ANDREA TRÓCHEZ R., M.D.a*, RAFAEL R. PEÑA, M.D., CIRUJANO PEDIATRAb Y MARTÍN GÓMEZ T. M.D.,CIRUJANO PEDIATRAb, c
a Residente del programa de Cirugía Pediátrica de la Universidad Militar Nueva Granada.
b Servicio de Cirugía Pediátrica del Hospital Militar Central.
c Profesor de Cirugía Pediátrica de la Facultad de Medicina de la Universidad Militar Nueva Granada.
* Correspondencia: andreatrochezr@yahoo.com. Dirección postal: Tr. 3 # 49-00, Hospital Militar Central, Octavo piso central Departamento de Cirugía Pediátrica. Tel: 3486868 ext 5190 – 5191, Bogotá, D.C., Colombia
Recibido: Octubre 14 de 2009. Aceptado: Diciembre 9 de 2009.
Resumen
Los tumores pancreáticos de Frantz son una patología infrecuente, aún de patogénesis incierta, con una población blanco predominantemente de mujeres jóvenes. Su grado de malignidad es bajo y con la resección completa se tiene muy buena sobrevida. El propósito del presente artículo es analizar de forma retrospectiva dos casos que por sus dificultades diagnósticas aportan mucho acerca de la aproximación a esta patología, y de su importancia en el diagnóstico diferencial de las masas abdominales en niños, que de manejarse con los procedimientos quirúrgicos adecuados, permite a los pacientes una evolución y un pronóstico favorables.
Palabras clave: páncreas, tumores del páncreas
Abstract
Frantz pancreatic tumors are an infrequent pathology, histogenesis remain controversial, they occur predominantly in young women and because of their low-grade malignant potential, complete resection means good survival. The aim of this review is to present a retrospective analysis of two cases, which, because of their diagnostic difficulties can teach a lot in the evaluation process of this pathology and of its importance in the abdominal tumors differential diagnosis in children, which, when well managed with the adequate surgical method, allows the patients an excellent recovery and prognosis.
Key words: pancreas, pancreatic neoplasms
Resumo
Os tumors dos pancreáticos de Frantz é um pathology infrequënte, destilador do patogénesis incerto, com uma população branca predominantly de mulheres novas. Seu grau de malignidad é baixo e com resección completo o sobrelife muito bom é tido. A intenção do artigo atual é analisar dos casos retrospective do formulário dois que por suas dificuldades que você diagnostica contribua muito sobre a aproximação a este pathology, aquele ao punho próprio com os procedimentos cirúrgicos adaptados, permita aos pacientes uma evolução favorável e um prognosis.
Palavras-chave: Páncreas, neoplasias pancreáticas
Introducción
El tumor de Frantz es una neoplasia pancreática sólida pseudopapilar de baja incidencia, con no más de mil casos reportados hasta la fecha en la literatura. Representa menos del uno por ciento de los tumores de páncreas, siendo más frecuente en mujeres menores de veinte años, quienes con una resección quirúrgica completa, tienen una sobrevida del 90% a cinco años. Se considera de comportamiento benigno debido a su bajo poder metastático (alrededor del 15%), siendo infrecuente la afección ganglionar. Debido a su crecimiento insidioso sin mayor sintomatología, sin cambios metabólicos, ni elevación de biomarcadores, el diagnóstico de esta patología es difícil (1). En este artículo se presentan dos casos, el primero de ellos con un buen índice de sospecha y un tratamiento temprano y el segundo con dificultades diagnósticas, requirió de tres tiempos quirúrgicos para lograr el manejo definitivo; en la actualidad ambos con una evolución favorable.
Reporte de caso
Caso 1
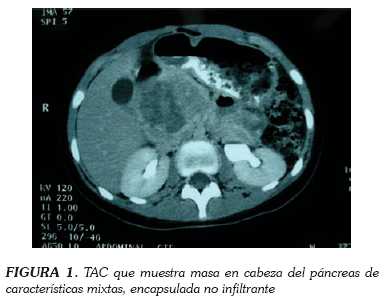
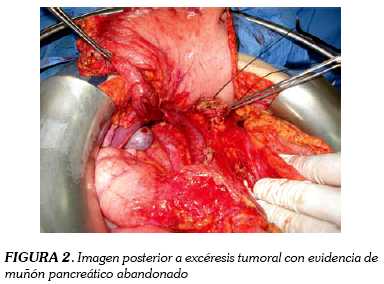
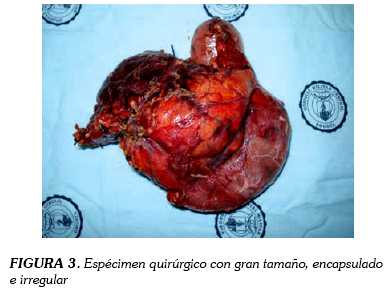
Mujer de catorce años sin antecedentes que consulta a urgencias por cuadro clínico recurrente de epigastralgia asociada a emesis. Se maneja de forma ambulatoria como una enfermedad ácido péptica pero por persistencia de los síntomas, reconsulta. Al examen físico se palpa masa en epigastrio no dolorosa que se interpreta como distensión de la vesícula biliar, por lo que se estudia con ecografía. Esta reporta masa pancreática bien definida, de características mixtas. Se solicita tomografía axial computarizada que define las características de la masa como de 7 x 10 cm dependiente de cabeza del páncreas, con bordes bien definidos, sin infiltración adyacente y con intima relación al duodeno (figura 1). Se programa para pancreatoduodenectomía tipo Whipple que se realiza sin complicaciones, con preservación del píloro y dejando el muñón pancreático abandonado (figuras 2 y 3). La paciente evoluciona lentamente con episodios de epigastralgia en el postoperatorio temprano, en relación a episodios de pancreatitis leve que responden al manejo médico. En controles postoperatorios la paciente no ha presentado recurrencias ni evidencia de metástasis estando actualmente con suplencia de enzimas pancreáticas sin necesidad de insulina.
Caso 2
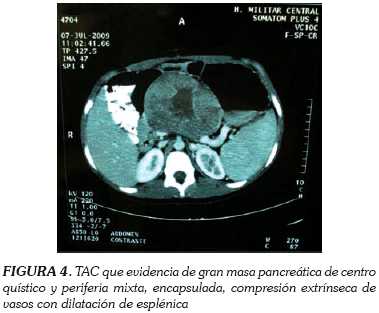
Paciente femenina de doce años con cuadro que inicia con epigastralgia, síndrome emético y masa epigástrica palpable, interpretada con estudios de imágenes como pseudo quiste pancreático. Se lleva a drenaje quirúrgico obteniéndose material hemático. Se encuentra en mejoría del cuadro dispéptico por tres años, luego por reinicio de los síntomas reconsulta y es remitida a la institución. Al examen físico, bajo la cicatriz quirúrgica previa, se palpa una masa de gran tamaño con leve dolor a palpación. Se toman biomarcadores encontrándose dentro de limites normales. Se evalúa con ecografía y TAC, que evidencian masa de páncreas con áreas hipodensas y otras de mayor densidad, en estrecha continuidad con los vasos mesentéricos y con compresión de la vena esplénica, con su consecuente dilatación (figura 4). Ante la duda diagnóstica se decide tomar biopsia abierta con trucut, que reporta tumor sólido pseudopapilar. Es llevada entonces a cirugía con plan de Whipple, pero en el acto quirúrgico se evidencia lesión de cola del páncreas por lo que se realiza pancreatectomía distal, confirmando patológicamente el diagnóstico inicial (figura 5). Presenta adecuada evolución postoperatoria sin dolor y sin signos de fístula pancreática, pero con cifras tensionales elevadas que inicialmente requirieron de infusión de nitroprusiato de sodio y luego manejo ambulatorio con antihipertensivos orales. Actualmente está sin suplencia de enzimas pancreáticas y sin insulina.
Discusión
El tumor de Frantz o tumor sólido pseudopapilar es una lesión pancreática infrecuente, formada por áreas sólidas, pseudoquistes y pseudopapilas, intercaladas con zonas de necrosis y hemorragia. Debe su nombre a V.K. Frantz, quien lo describió por primera vez en 1959 en el Atlas of Tumor Pathology, en un paciente al que decidió intervenir quirúrgicamente mediante una pancreatoduodenectomía y que falleció durante el procedimiento. Lo definió en ese momento como un tumor papilar del páncreas benigno o maligno (1). Pero luego, según las clasificaciones de neoplasias pancreaticas, su nomenclatura a cambiado varias veces a tumor sólido y quístico, a tumor papilar solido-quístico, a neoplasia epitelial papilar-quística, a neoplasia epitelial sólida y papilar, hasta la denominación actual recomendada por la Organización Mundial de la Salud (1996) de tumor sólido pseudopapilar (2).
Corresponde del 0,2% al 2,7% de los cánceres de páncreas y se presenta según frecuencia, en los siguientes segmentos pancreáticos: cabeza y cuello 34% al 35%, cuerpo 14,8% al 25%, cola 35,9% al 40% y proceso uncinado 0,43% (3,4). Su patogénesis aún no se encuentra clara del todo pero, de acuerdo con su patrón histológico, se cuenta con dos teorías sobre su origen: uno exocrino por sus papilas, ductos y acinos y otro endocrino por sus gránulos neurosecretores (5), teorías estas apoyadas por la evidencia de marcadores exocrinos de tripsina y quimiotripsina y endocrinos de sinaptofisina (6). Otras hipótesis afirman que estos tumores parten de células embrionarias pluripotenciales del páncreas, o del pool celular de las crestas ováricas que se encuentran adjuntas al tejido pancreático durante la embriogénesis (7). La evidencia inmunohistoquímica positiva para marcadores melanociticos, como la proteína S100, el melanoma negro humano 45 (HMB45) y el antígeno de melanoma reconocido por células T1 (MART1), junto con la presencia de gránulos de premelanosomas y melanosomas en las células tumorales por microscopía electrónica, sugieren que el origen tumoral puede ser neural (8).
Se cree que la aparición del tumor de Frantz se relaciona con alteraciones genéticas relacionadas con la vía del oncogen APC beta catenina, ya que la mayoría de los tumores presentan mutaciones del exon-3 de la beta catenina (9, 10). Esta mutación lleva al acumulo anormal de beta catenina que forma complejos grandes proteicos, junto con las ligandinas de ADN. Este complejo se fija a la región promotora de ciclina D1, encargada de regular la transición del ciclo celular de G1 a S y su sobreexpresión se encuentra comprobada en el tumor sólido pseudopapilar de páncreas (11). Los hallazgos de anormalidades cromosómicas, incluida la pérdida doble de cromosoma X, la trisomía 3 y la translocación desbalanceada 13–17, se asocia con comportamiento agresivo y posible potencial metastásico (8).
Son lesiones de crecimiento lento ya que duplican su tamaño en aproximadamente en 765 días (12) e inicialmente se organizan con una distribución radial de células a partir de tallos fibrovasculares, presentando posteriormente cambios degenerativos papilares de hemorragia y de necrosis que forman pseudoquistes (13). Los hallazgos histológicos patognomónicos son grupos de células neoplásicas papilares con centros vasculares y rodeados de un estroma mucinoso y una tercera capa de células monomórficas. La degeneración histológica se da con la vacuolización celular, formación de pseudopapilas, hemorragia, colecciones de macrófagos espumosos, bandas de colesterol, reacción a cuerpo extraño por células gigantes y fibrosis extensa con calcificaciones localizadas (14).
El tumor sólido pseudopapilar es más frecuente en el páncreas pero también se puede desarrollar a partir de tejido pancreático ectópico en mesocolon, retroperitoneo, epiplón e hígado, simulando lesiones metastásicas. La ocurrencia de tumores múltiples es muy rara (15). La presentación clínica más usual es de curso asintomático siendo así en el 15% de los pacientes, (10) con evidencia tardía de masa abdominal epigástrica palpable con o sin dolor y sin síntomas constitucionales asociados. Se puede acompañar de sintomatología obstructiva biliar o duodenal en el 4%, secundario a masas de gran tamaño (13). En casos excepcionales se puede presentar como abdomen agudo por la ruptura de la lesión (16). Se presenta con edad media de 23,9 años (6) y de forma más frecuente en mujeres adolescentes, aunque también se ha descrito en hombres, con una relación muy baja de 1:10 (3), considerándose que la incidencia de presentación masculina se encuentra en el rango de 3,9% a 6,6% (10). Son tumores generalmente benignos, siendo posible la degeneración a presentaciones más agresivas, por el desarrollo de lesiones metastásicas en el 1%. Los órganos blanco más frecuentes son el hígado, la porta, el bazo, los ganglios linfáticos, el epiplón, el duodeno, el colon, el pulmón y el retroperitoneo (3,17). También puede invadir el tejido pancreático sano y el tejido adiposo peripancreático (18).
Como para corroborar la impresión clínica no se cuenta con alteración de biomarcadores séricos que guíen el diagnóstico (4), la evaluación de la lesión pancreática depende fundamentalmente de los estudios imagenológicos. En la ecografía, la TAC y la RNM se identifica como una gran masa pancreática de entre 8 a 10 cm, bien definida, encapsulada, con aspecto mixto sólido-quístico según el grado de necrosis y hemorragia, con desplazamiento de estructuras cercanas, mas que su invasión (19,20). Se puede encontrar necrosis periférica y áreas resaltadas por el medio de contraste, indicando las áreas de hemorragia intratumoral. Sin embargo, el hallazgo radiológico que distingue el tumor sólido pseudopapilar de otros tumores pancreáticos es la cápsula fibrosa con contenido hemorrágico (19).
En la TAC las porciones sólidas del tumor son isoatenuantes con el páncreas, pero el contenido tumoral presenta una atenuación de 20 – 50 UH definiendo la presencia de detritos y sangre en el interior (19). Los septos y las calcificaciones solo se encuentran en un tercio de los tumores. El medio de contraste solo resalta los aspectos sólidos del tumor y en especial la cápsula. Algunas veces el tumor puede tener un crecimiento exofítico por lo que su origen pancreático puede no ser del todo claro (19). La RNM es mejor que la TAC en la diferenciación de dichas características tisulares: hemorragia, degeneración quística y la cápsula fibrosa que, en especial en fase T1, se observa como un anillo hiperintenso. Las porciones sólidas del tumor son iso o hipointensas con relación al páncreas en fase T1, e hiperintensas en T2. En las imágenes del T1, la mayoría de los tumores presentan focos hiperintensos que corresponden a las áreas de hemorragia, necrosis o detritos 19-21). El gadolinio realza la cápsula fibrosa, pero en imágenes tardías el contraste termina siendo menor que el de la glándula sana. Las imágenes en T1 con supresión grasa también son una gran ayuda para detectar los espacios de hemorragia intratumoral que caracterizan el tumor (21). La angiografía puede ayudar a delimitar la masa y su relación con las estructuras vasculares aledañas al desplazarlas, pero la característica principal tumoral es su conformación avascular o hipovascularizada (6,20).
Aún así, estos estudios son poco específicos, por lo que en algunos casos con pobre certeza diagnóstica, se puede utilizar punción con aguja fina guiada por ecoendoscopía o por TAC (10). Cuenta con sensibilidad de 94% comparada con el 69% y el 83% de TAC y RNM, respectivamente, incluso en lesiones de menos de tres cm. Esta biopsia ayuda en la diferenciación de otras neoplasias pancreáticas con similitudes radiológicas, pero con comportamiento biológico muy diferente como son los tumores pancreáticos endocrinos, el carcinoma de células acinares y el carcinoma mucinoso papilar. En el aspirado lo más frecuente es la presencia de células neoplásicas sueltas con fragmentos pseudopapilares, tallos fibrovasculares con células tumorales, globulos hialinos mucinosos inter o intracelulares y detritos (8). Las células suelen ser monomórficas, de bordes suaves, con escasa cantidad de citoplasma heterogéneo, núcleo redondeado con cromatina granular fina y un par de nucleolos. Se evidencian vacuolas intracitoplasmáticas infrecuentes en los tumores endocrinos pancreáticos (10). En las pruebas inmunohistoquímicas las células tumorales son positivas para CD-10, CD-56, vimentina, α-1-antiquimotripsina, fosfolipasa A2, enolasa y α-1- antitripsina, pudiendo mostrar también reactividad focal para citoqueratina y sinaptofisina y localización anormal nuclear de β–catenina (6,17). Se han identificado receptores para progesterona mientras los de estrógenos no se han encontrado (22).
Como diagnóstico diferencial se debe descartar pancreatoblastoma y adenoma microquístico, el primero se presenta en niños escolares y el segundo en adultos con hallazgos de hipervascularidad y calcificaciones centrales (17). En los niños, más que neoplasias pancreáticas, se debe descartar linfoma, neuroblastoma y leucemia. En adultos se deben tener en cuenta cualquier lesión quística pancreática como el tumor quístico mucinoso, el cistadenocarcinoma, el carcinoma de células acinares, el tumor de las células de los islotes y el adenocarcinoma ductal. El tratamiento de elección es la resección total de la lesión (19) incluyendo tumor, metástasis y recurrencia local, si se logra el pronóstico es bueno y la terapia adyuvante es innecesaria (23). Las cirugías usadas son: enucleación, resección local, pancreatectomía distal y pancreatoduodenectomía. No se encuentra diferencia del pronóstico entre las diferentes técnicas quirúrgicas, desde que la resección sea completa y el vaciamiento ganglionar es innecesario (13). En caso de tumores irresecables se puede realizar drenaje de la lesión y cistoenterostomía sumado a radioterapia coadyuvante, ya que el tumor es radiosensible. También hay un estudio que describe el uso de quimioterapia previa con destrucción intraoperatoria sonográfica de metástasis en tumores irresecables, con buenos resultados (24).
El pronóstico de la enfermedad es bueno por su baja tasa de malignización y poca probabilidad de recurrencia (alrededor del 6,6%). Además, incluso hablando de enfermedades metastáticas, las lesiones son de crecimiento lento por lo que la sobrevida a dos años es del 97% y a cinco años de más del 95%, incluso en patología diseminada (3,9). La mortalidad es del 1,5% aproximadamente, encontrándose como factores de mal pronóstico la invasión perineural o vascular, el alto grado de pleomorfismo celular, la rata mitótica elevada y la presencia de indicadores de comportamiento agresivo como el patrón de crecimiento difuso, la necrosis extensa y la atipia nuclear significativa.
De todo lo anterior se puede concluir que el tumor sólido pseudopapilar no es una lesión de fácil diagnóstico, empezando por su probable carácter asintomático derivado de su crecimiento lento, que aunque puede causar una alta sospecha, no cuenta con un método no invasivo de sensibilidad elevada. Es por ello que en casos de baja claridad diagnóstica se pueden realizar biopsias por punción que guíen el diagnóstico hacia la resección completa del tumor, que es el mejor método curativo para llegar a las bajas tasas de mortalidad y recurrencia esperadas.
Referencias
1. Frantz VK. Tumors of the pancreas. In: Rosai J, Sorbin L,eds. Atlas of Tumor Pathology, Section VII, fasc. 27 and 28. Washington, DC: Armed Forces Institute of Pathology, 1959: 32-33. [ Links ]
2. Klöppel G,e t al. Histological Typing of Tumours of the Exocrine Pancreas (WHO. World Health Organization. International Histological Classification of Tumours). Springer; 2nd edition (February 12, 2002). [ Links ]
3. Papavramidis T, et al. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literatura. J Am Coll Surg. 2005 Jun; 200(6):965-72. [ Links ]
4. Nadler E.P, et al. The Use of Endoscopic Ultrasound in the Diagnosis of Solid Pseudopapillary Tumors of the Pancreas in Children. Journal of Pediatric Surgery, Vol 37, No 9 (September), 2002: pp 1370-1373. [ Links ]
5. Kallichanda N et al Exp Mol Pathol 2006:81(2) 101-107. [ Links ]
6. Huang H.L, et al. Solid-pseudopapillary tumor of the pancreas: Clinical experience and literature review. World J Gastroenterol 2005;11(9):1403-1409. [ Links ]
7. Mao C, et al. Papillary cystic and solid tumors of the pancreas: a pancreatic embryonic tumor? Studies of three cases and cumulative review of the world's literature. Surgery 1995, vol. 118, no. 5, pp. 821-828. [ Links ]
8. Salla C, et al. Endoscopic ultrasound-guided fi ne-needle aspiration cytology diagnosis of solid pseudopapillary tumor of the pancreas: A case report and literature review. World J Gastroenterol 2007 October 14; 13(38): 5158-5163. [ Links ]
9. Tang L.H, et al. Clinically aggressive solid pseudopapillary tumors of the pancreas: a report of two cases with components of undifferentiated carcinoma and a comparative clinicopathologic analysis of 34 conventional cases. Am J Surg Pathol. 2005 Apr; 29(4):512-9. [ Links ]
10. Kemal M. Unusual cause of persistent abdominal pain in a young girl: solid-pseudopapillary tumour of the pancreas. Eur Radiol (2007) 17: 567–569. [ Links ]
11. Eder F, Schulz H, Rochen C, Lippert H. Solidpseudopapillary tumor of the pancreatic tail. World J Gastroenterol 2005; 11: 4117-4119. [ Links ]
12. Petrakis L, et al. Solid Pseudopapillary Neoplasm of the Pancreas: Report of a Case after a 10-Year Follow-Up and Review of the Literature. Pancreatology 2001;1:123-128. [ Links ]
13. Chung E, et al. Pancreatic Tumors in Children: Radiologic-Pathologic Correlation. RadioGraphics 2006; 26:1211–1238. [ Links ]
14. Hah J.O, et al. Preoperative chemotherapy and intraoperative radiofrequency ablation for unresectable solid pseudopapillary tumor of the pancreas. J Pediatr Hematol Oncol. 2007 Dec; 29(12):851-3. [ Links ]
15. Geers C, et al. Solid and Pseudopapillary Tumor of the PancreasReview and New Insights Into Pathogenesis. Am J Surg Pathol vol. 30, 1243 - 1249, 2006. [ Links ]
16. Asano T, et al. A 13-year-old girl with a Preoperatively Diagnosed Solid Cystic Tumor of the Pancreas. Journal of Nippon Medical School. Vol. 73 (2006) , No. 4 pp.231-234. [ Links ]
17. Adams A.L, et al. Solid pseudopapillary tumor of the pancreas: a review of salient clinical and pathologic features. Adv Anat Pathol. 2008 Jan; 15(1):39-45. [ Links ]
18. Hernandez J, et al. Solid Pseudopapillary Tumors of the Pancreas: Case Presentation and Review of the Literature. The American Surgeon, Volume 73, Number 3, March 2007 , pp. 290-293(4). [ Links ]
19. Francis W, et al. Solid-Pseudopapillary Tumors of the Pancreas: Case Report and Literature Review. Current surgery. Volume 63/Number 6. November/December 2006. [ Links ]
20. Cantisani V, et al. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients. AJR Am J Roentgenol. 2003 Aug;181(2):395-401. [ Links ]
21. Chun-Yi H, et al. Solid Pseudopapillary Tumor of the Pancreas: Report of 8 Cases in a Single Institution and Review of the Chinese Literature. Pancreatology 2006;6:291-296. [ Links ]
22. Adamthwaite J, et al. Solid Pseudopapillary Tumour of the Pancreas: Diverse Presentation, Outcome and Histology. JOP. J Pancreas 2006; 7(6):635-642. [ Links ]
23. Karatag O, et al. A case of solid pseudopapillary tumor of the pancreas. World J Gastroenterol 2006 October 14; 12(38): 6239-6243. [ Links ]
24. Shaikh S, et al. Three Cases of Unusual Solid Pseudopapillary Tumors. Can Radiology and Histology Aid Decision-Making?. JOP. J Pancreas 2008; 9(2):150-159. [ Links ]














