Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Med
versión impresa ISSN 0121-5256versión On-line ISSN 1909-7700
rev.fac.med v.19 n.1 Bogotá ene./jun. 2011
ARTÍCULO DE REVISIÓN
MÁS ALLÁ DEL MOLESTO RONQUIDO: SÍNDROME DE APNEA OBSTRUCTIVA DEL SUEÑO Y SU PELIGROSA ASOCIACIÓN CON EL SÍNDROME METABÓLICO
BEHIND BOTHERSOME SNORING: OBSTRUCTIVE SLEEP APNEA SYNDROME AND ITS DANGEROUS ASSOCIATION WITH METABOLIC SÍNDROME
ALÉM DO HUM IRRITANTE: SÍNDROME DA APNÉIA OBSTRUTIVA DO SONO E ASSOCIAÇÃO PERIGOSA COM SÍNDROME METABÓLICA
JAMES M. YURGAKY S. MD INTERNISTAa*, ALIRIO BASTIDAS MD. INTERNISTAb, JHON A. CONTA MD.c, JAIME A. MONTAÑA MD.c Y ANA MARÍA ARREDONDO G. MD.c
a Residente del programa de Endocrinología, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá., Colombia.
b Neumólogo y Epidemiólogo Hospital Militar de Bogotá, Colombia.
c Residente del programa de Medicina Interna, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia
* Correspondencia: JJames Yurgaky jamesy7656@yahoo.es. Dirección correspondencia: Tr. 3 No 49-00, Servicio de Endocrinología, Hospital Militar Central, Bogotá, Colombia. Teléfono: 4 34 48 42
Recibido: Mayo 15 de 2011. Aceptado: Diciembre Junio 15 de 2011.
Resumen
El síndrome de apnea hipoapnea obstructiva del sueño (SAHOS) es una enfermedad frecuente que afecta alrededor del 5 % de la población general y a casi la mitad de los pacientes obesos. La asociación de SAHOS con obesidad ha sido bien establecida desde que fue descrito por primera vez; durante los últimos años ha sido creciente la producción literaria que asocia la hipoxemia con un incremento de la enfermedad cardiovascular y metabólica, las cuales finalmente originan un mayor riesgo cardiovascular en los pacientes afectados no necesariamente obesos. Debido a la presencia de hipoxemia secundaria a la obstrucción mecánica del flujo aéreo que se encuentra en los pacientes afectados por el síndrome de apnea hipoapnea obstructiva del sueño, se desencadenan eventos fisiopatogénicos tales como la liberación de radicales libres, la disminución de la expresión de algunas enzimas importantes para el clivaje del colesterol y la producción de óxido nítrico y el aumento en la producción de mediadores inflamatorios que generan disrupción de vías metabólicas y endocrinológicas, lo cual ocasiona un incremento en el riesgo de sufrir diabetes mellitus, resistencia a la insulina, hipertensión arterial, obesidad y dislipidemia aterogénica.
Palabras clave: apnea del sueño obstructiva, Síndrome X metabólico, hipertensión
Abstract
Obstructive sleep apnea syndrome (OSAS) is a frequent disease that affects around 5% of the general population and almost half the obese patients. The association between OSAS and obesity has been well established since it was described for the first time. in the last few years a lot of literature has been issued that associates hypoxemia with the increase in cardiovascular and metabolic diseases which finally originates a major cardiovascular risk in patients not necessarily obese. Due to hypoxemia secondary to airflow mechanical obstruction present in OSAS patients, there are physiopathogenic events such as the liberation of free oxygen radicals, the decrease of the expression of some enzymes useful for cholesterol cleavage and nitric oxide production, and the increase in the production of inflammatory mediators that generates a disruption in metabolic and endocrine ways, which also increases the risk of diabetes mellitus, insulin resistance, arterial hypertension, obesity and atherogenic dyslipidemia.
Key words: Obstructive sleep apnea, metabolic syndrome X, hypertension
Resumo
O síndrome da apnéia obstrutiva do sono (SAOS) é uma doença comum que afeta cerca de 5% da população geral e quase a metade dos pacientes obesos; a associação de SAOS com a obesidade tem sido bem estabelecida desde que foi descrita pela primeira vez; a produção literária que associa a hipoxemia com um aumento da doença cardiovascular e metabólica nos últimos anos tem sido crescente, o que acabou por dar origem a um maior risco cardiovascular em pacientes afetados, não necessariamente obesos. Devido à presença de hipoxemia secundária à obstrução mecânica do fluxo de ar encontrado em pacientes afetados pela síndrome da apnéia hipopnéia obstrutiva do sono, se desencadena eventos fisiopatológicos, tais como radicais livres, diminuição da expressão de várias enzimas para a clivagem de colesterol e produção de óxido nítrico e aumento da produção de mediadores inflamatórios que produzem interrupção de vias metabólicas e endócrinas que resultam en um aumento deo risco de diabetes mellitus, resistência à insulina, hipertensão, obesidade e dislipidemia aterogênica.
Palavras-chave: apnéia do sono tipo obstrutiva, síndrome metabólica X, hipertensão.
Introducción
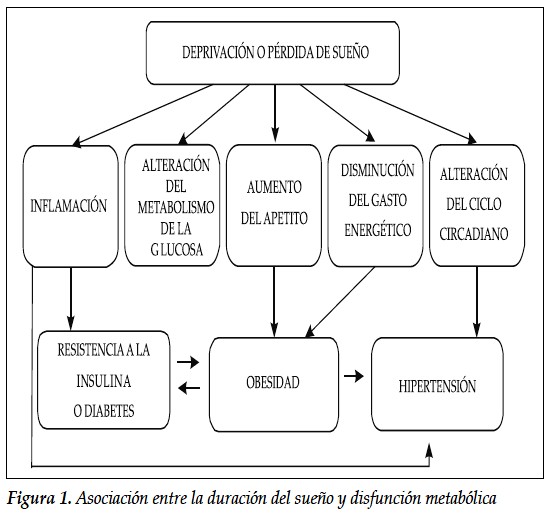
El sueño desde el principio de la humanidad fue concebido como un proceso netamente reparativo a través del cual el organismo restauraba el desgaste realizado durante las horas de vigilia; sin embargo, en la actualidad existe suficiente evidencia para afirmar que el sueño se relaciona estrechamente con el control de múltiples funciones endocrinológicas y metabólicas, tales como la liberación hormonal, el metabolismo de carbohidratos, el control del peso y del apetito (1).
La dinámica actual a la cual están sometidos los individuos en la sociedad moderna ha cambiado los patrones de sueño reportándose un descenso en el tiempo promedio diario, así como trastornos en la calidad de este; en la actualidad adultos y adolescentes duermen 1,5 a dos horas menos por noche si se compara con el siglo anterior y el 30 % de la población adulta reporta menos de seis horas de sueño por día (2). La deprivación crónica de sueño está relacionada en forma directa con estrés emocional y físico, ansiedad, riesgo cardiovascular, diabetes mellitus y obesidad (3).
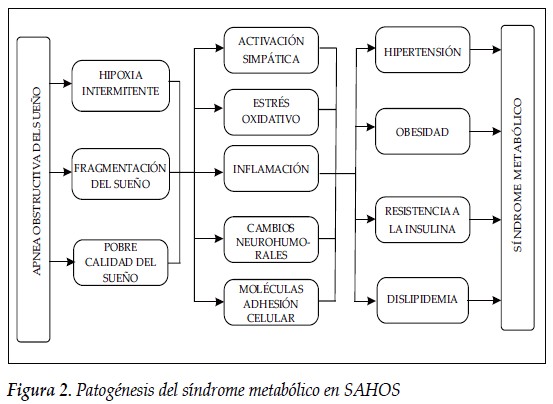
El síndrome de apnea obstructiva del sueño es un trastorno común con una prevalencia estimada en la población general del 4% y del 50 % en los pacientes obesos constituyéndose así en una epidemia mundial; se caracteriza por episodios repetitivos de colapso de la vía aérea durante el sueño, generando obstrucción al flujo de aire, de esta manera se genera un fenómeno de hipoxia y re oxigenación de forma intermitente que da como resultado una cascada de estrés oxidativo, activación simpática y disfunción endotelial, responsables del riesgo cardiometabólico aumentado en los pacientes que sufren esta enfermedad concediendo un Odds Ratio (OR) de hasta tres para eventos cardiovasculares fatales y no fatales comparado con la población general (4).
El SAHOS es también un factor de riesgo reconocido para síndrome metabólico, entidad caracterizada por la presencia de obesidad central, resistencia a la insulina, disfunción en el control de los carbohidratos, dislipidemia aterogénica e hipertensión arterial; tanto en pacientes obesos como no obesos confiere un riesgo hasta seis veces mayor si se compara con la población general y con una prevalencia que varía entre 30 y 50% según diferentes series; de esta manera son dos entidades que en forma conjunta incrementan el riesgo cardiovascular (5).
Sueño y regulación del sistema endocrinológico
El sueño de onda lenta o sueño profundo, se constituye como la fase del sueño más reparativa y ocurre normalmente durante las fases 3 y 4 del sueño REM (rapid eye movement); corresponde en su mayoría a las tres primeras horas de sueño y es durante esta fase del sueño donde ocurren importantes fenómenos fisiológicos, tales como incremento del tono vagal, reducción de la frecuencia cardiaca, disminución de la presión arterial y descenso de la actividad del sistema nervioso simpático (6). Por otro lado, en este mismo momento del sueño suceden fenómenos fisiológicos a nivel endocrino interesantes tales como la supresión del eje hipotálamo hipofisiario adrenocortical y el nadir de la secreción de la hormona de crecimiento y la prolactina (7). La interacción estricta de los fenómenos fisiológicos anteriormente mencionados conllevan a la regulación de la secreción de insulina y la consecuente tolerancia los carbohidratos, determinando de esta forma el balance establecido entre hormonas reguladoras y contra reguladoras (8).
Las hormonas involucradas en el control del apetito como la leptina, la cual es secretada por el adipocito y que se encarga principalmente de inducir la sensación de saciedad, y la ghrelina liberada específicamente por las células gástricas, y que tiene un efecto opuesto al de la leptina, también son moduladas en forma directa durante el sueño, observándose que los valores de estas dos hormonas son más altos durante la fase de sueño profundo comparados con los de la vigilia. (9)
La corta duración del sueño se encuentra asociada con un aumento del apetito y con un impacto negativo en la homeostasis de la glucosa, especialmente en aquellos sujetos que duermen menos de tres horas por día (10). El estudio titulado "The Sleep Heart Health Study" que incluyó alrededor de 1500 sujetos, demostró que dormir menos de seis horas por día o más de nueve, está relacionado con mayor riesgo de obesidad y Diabetes Mellitus (11); de esta manera durante los últimos años se ha establecido una relación causal entre los trastornos metabólicos y los disturbios del sueño, en un marco de fenómenos fisiopatológicos ampliamente conocidos (12).
Trastornos del sueño y dislipidemia La dislipidemia es un factor de riesgo cardiovascular mayor, el cual hace parte del síndrome metabólico, que en este contexto usualmente se caracteriza por elevación de triglicéridos, disminución de las lipoproteínas de alta densidad y elevación discreta de lipoproteínas de baja densidad (13). La asociación de hipercolesterolemia e hipertrigliceridemia con trastornos del sueño ha sido claramente documentada a través de estudios controlados, encontrándose una frecuencia de presentación aproximada del 61% y 53,3 % respectivamente en pacientes diagnosticados con SAHOS (14,15); el índice de desaturación encontrado en la polisomnografía de pacientes con SAHOS, es considerado un factor de riesgo independiente para la presencia de hipercolesterolemia e hipertrigliceridemia con un OR de 1,016 y 1,021 respectivamente. (15,16)
Los eventos fisiopatológicos que explican los trastornos de los lípidos en los pacientes con enfermedades del sueño han sido dilucidados durante los últimos años. Li y col. demostraron en modelos animales que la hipoxia intermitente induce hipertrigliceridemia mediante un aumento en la regulación de la síntesis de triglicéridos y fosfolípidos, así como hipercolesterolemia al inhibir la captación hepática de colesterol (17,18). La presencia de hipoxemia durante los periodos de apnea disminuye la actividad de la lipoptrotein lipasa, enzima localizada en el tejido endotelial y que juega un papel importante en la hidrólisis de quilomicrones, generándose de esta manera unas condiciones propicias para el asentamiento de arterioesclerosis (19). De acuerdo a la severidad de la hipoxemia se genera una disrupción en la peroxidación de lípidos que contribuye en forma directa a las anormalidades del metabolismo de las grasas observado en los pacientes con trastornos del sueño (20).
Los ciclos intermitentes de hipoxia y reoxigenación que resultan de los episodios de apnea, se encuentran implicados en el aumento de la regulación de la proteína denominada SREBP-1 (hepatic sterol regulatory element binding protein-1) en el hígado, un elemento transcriptor que controla la síntesis de los triglicéridos, de los ácidos grasos, de los ésteres de colesterol y de los fosfolípidos (20-22). La hipoxemia crónica intermitente tiene además la capacidad de inducir la transcripción de ARNm de genes controlados por la SREBP-1, como el denominado SCD-1(stearoyl coenzyme A desaturase-1) y la mtGPAT (mitocondrial glycerol-3-phosphate acyltransferase). Li y col. demostraron en modelos animales que la hipoxemia intermitente aumenta los valores hepáticos de ARNm de SREBP-1, así como las concentraciones séricas de colesterol total y de triglicéridos (23).
Los datos relacionados con la efectividad del tratamiento directo de la hipoxemia mediante el uso de CPAP, específicamente para mejorar la dislipidemia son inconsistentes; estudios controlados en pacientes tratados con CPAP durante un mes, han demostrado una reducción significativa de los valores de colesterol; no obstante, cuando se compararon los resultados en grupos con adecuada terapia contra aquellos en rangos subterapéuticos de tratamiento con CPAP, no se pudo demostrar diferencias estadísticamente significativas (24,25). Borgel y col. encontraron que la adherencia adecuada con valores terapéuticos de CPAP, estaba asociada con un incremento de lipoproteína de alta densidad en un 5,8%, con reducción marginal de colesterol, triglicéridos, lipoproteínas de baja densidad y apolipoproteina B (26,27).
Diabetes mellitus
El síndrome de apnea obstructiva del sueño es una entidad relacionada de forma directa con mayor riesgo de diabetes mellitus (29-32); En 1996 Stoohs y col. relacionaron la presencia de resistencia periférica a la insulina en pacientes con sahos y un índice de apnea (IHA) mayor de diez independiente de la presencia de obesidad (28); estos hallazgos iníciales motivaron de manera rápida la producción académica al respecto y se suscito un especial interés dirigido a esclarecer las bases fisiopatológicas que explican la asociación existente entre la hipoxemia, las anormalidades en el metabolismo de los carbohidratos y la sensibilidad a la insulina. En el año 2005 en Estados Unidos de América mediante una encuesta nacional, se estableció que uno de cada cuatro adultos sanos y uno de cada dos adultos obesos tienen riesgo aumentado de presentar sahos (33).
Reitchmuth y col. (34) en su trabajo titulado "la cohorte del sueño", establecieron que la presencia de un IHA mayor de quince confiere un OR de 2,3 para diabetes mellitus; por otro lado, el estudio de Lam y col. (35) ayudó a confirmar dicha asociación al demostrar que un IHA mayor a cinco comparado con un IHA menor a cinco confiere un OR de 2,14 para sufrir esta enfermedad. Las apreciaciones iniciales derivadas de estudios observacionales han sido reforzadas posteriormente con estudios clínicos; Meslier estudió 595 pacientes a quienes se les realizó la prueba de tolerancia oral a la glucosa a las dos horas y la polisomnografia, y encontró que 30,1% de los pacientes con SAHOS desarrollaban diabetes mellitus y en pacientes sin esta entidad solo la presentaban el 13,9% (36-42).
Los mecanismos fisiopatológicos que conducen a las manifestaciones sistémicas del SAHOS y al trastorno del metabolismo de los carbohidratos son multifactoriales, entre los cuales se han mencionado la actividad elevada del sistema nervioso simpático, la disregulación del sistema hipotálamo-hipófisiario y la disfunción endotelial secundaria al aumento del estrés oxidativo inducido por los periodos de apnea, por la hipoxia y por la fragmentación del sueño.
La hipoxia generada en los periodos de apnea, tiene como consecuencia la estimulación de quimiorreceptores generando la activación del sistema simpático, niveles bajos de leptina, niveles elevados de insulina en ayunas y resistencia periférica a la insulina (43-45). Los estudios experimentales de Oltmanns y col. (46) demostraron que las personas llevadas a periodos intermitentes de hipoxia con saturación de oxígeno menor a 75%, tienen mayor frecuencia cardiaca, niveles circulantes de epinefrina elevados y resistencia periférica a la insulina comparado con pacientes en condiciones de normoxemia.
El fenómeno cíclico de hipoxia y reoxigenación desencadena la activación de estrés oxidativo, produciendo un aumento significativo de especies reactivas de oxigeno circulantes tales como los radicales superóxido, peróxido de hidrogeno e hidroxilo; estos a su vez generan vías de señalización que generan procesos similares al fenómeno de isquemia-reperfusión, con peroxidación lipídica y proteica y disminución de la biodisponibilidad de óxido nítrico, propiciando de esta forma mayor grado de lesión endotelial y sistémica (46,47). Está plenamente demostrado que la hipoxia y la reperfusión cíclica favorecen un aumento de la regulación del factor transcripcional nuclear-kappa beta (NF-KB) y el factor inducible por hipoxia 1 (HIF-1), así como sobreexpresión de los factores transcripcionales GATA-4 y GATA-6, con la subsiguiente disminución de la sensibilidad periférica a la insulina (48,49); además, estudios in vitro han demostrado que los polimorfonucleares incrementan la expresión de las selectinas CD62 y CD15 ante la presencia de hipoxia intermitente, propiciando de esta manera un ambiente proinflamatorio que contribuye al daño endotelial y lesión celular.
La disminución de horas de sueño y la fragmentación del mismo, son dos factores asociados invariablemente con el riesgo aumentado de presentar diabetes mellitus y resistencia periférica a la insulina; Spiegel y col. demostraron una disminución en el aclaramiento de la glucosa y resistencia a la insulina en el 40% de sujetos que duermen menos de cinco horas diarias (50- 59). Las medidas terapéuticas para este grupo de pacientes incluyen la pérdida de peso, ejercicio regular y el uso de CPAP.
García y col. (60) analizaron un grupo de pacientes obesos con SAHOS, a quienes se les realizó una evaluación previa al tratamiento con CPAP de niveles de glucosa, insulina, ghrelina, leptina y resistina; se evaluaron nuevamente a los seis meses de tratamiento con C-PAP, encontrando un aumento en los niveles de insulina, disminución en los niveles de ghrelina en ayunas, sin cambio significativo en los niveles de leptina, adiponectina y resistina; se concluyó que el uso de CPAP aunque mejora la hipoxemia, no genera un impacto importante en la alteración metabólica presente y no es equiparable con los beneficios de la pérdida de peso corporal.
Hipertensión arterial y riesgo cardiovascular
Es clara la relación entre la obesidad con múltiples patologías como SAHOS e hipertensión arterial; de hecho se reconoce la asociación existente entre obesidad visceral y resistencia a la insulina, con la elevación de las cifras tensionales; adicionalmente la obesidad se ha relacionado en forma fuerte con la aparición de SAHOS. El SAHOS a su vez se relaciona con el desarrollo de hipertensión arterial o empeoramiento de la misma y con pobre control de las cifras tensionales. El sueño como tal tiene influencia directa sobre el control de las cifras tensionales, ya que se ha observado que individuos que duermen menos de cinco horas diarias tienen mayor riesgo de desarrollar hipertensión arterial (61- 63).
El SAHOS y la hipertensión arterial tienen una relación interdependiente, aproximadamente el 50% de los pacientes con SAHOS tienen hipertensión arterial, a su vez los pacientes hipertensos en un 30% pueden tener SAHOS no diagnosticado, el cual es responsable del pobre control con el tratamiento antihipertensivo, constituyéndose de esta manera en una de las causas de hipertensión resistente y secundaria que debe tenerse en cuenta en el estudio de este tipo de pacientes (62, 65, 66,71). El SAHOS por sí mismo, constituye un estado proinflamatorio y de hiperactividad adrenérgica que tiene múltiples consecuencias celulares, metabólicas y hemodinámicas, cuya vía final común es la elevación de la tensión arterial. Entre los mecanismos fisiopatológicos que explican estos eventos se encuentran: 1) mecanismos neurohormonales, 2) inflamación, estrés oxidativo y disfunción endotelial, 3) fenómenos hemodinámicos, 4) estado procoagulante (63, 64).
La hipoxemia generada por el SAHOS altera el sistema nervioso autónomo generando un estado de hiperactividad sobre el sistema nervioso simpático, reducción del tono vagal y disfunción de los barorreflejos, lo cual tiene como vía final común, la generación de vasoconstricción periférica con aumento de las cifras tensionales (62-64). Durante la hipoxemia se genera un estado de estrés oxidativo que a nivel endotelial es manifestado como un pobre balance en la relación óxido nítrico/endotelina, con una regulación a la baja de la óxido nítrico sintetasa y un aumento en la actividad de la endotelina; adicionalmente los múltiples factores asociados al SAHOS como la resistencia a la insulina pueden contribuir en dicho fenómeno.
Es importante mencionar que también puede experimentarse lesión endotelial por radicales libres de oxígeno en los estados de hiperventilación postapnea, los cuales generan pérdida de la regulación del tono vascular, dando como resultado final el incremento de la presión arterial. La hipoxemia también genera un estado proinflamatorio con incremento en los niveles de TNF-alfa e IL-6, los cuales son responsables de generar disfunción endotelial y activar sistemas neurohormonales como el sistema renina angiotensina aldosterona (62,64). La apnea genera una caída en la presión intratorácica (-80cm de agua) la cual genera múltiples fenómenos vasculares tales como, el incremento en la postcarga, aumento en la resistencia vascular sistémica, disfunción diastólica y finalmente remodelación cardiaca. Los fenómenos neurohormonales, metabólicos y celulares tienen una traducción hemodinámica: HIPERTENSION ARTERIAL. El SAHOS tiene influencia sobre el "dipping" nocturno de la tensión arterial, con pérdida del mismo. (62,69).
Finalmente existe un estado procoagulante con incremento en la activación plaquetaria, en los niveles de fibrinógeno y en la activación del factor VII que resulta en un incremento de la resistencia vascular sistémica (64). El uso del C-PAP que es la principal estrategia terapéutica del SAHOS puede tener impacto sobre la hipertensión arterial; se ha mostrado en varios estudios cómo su uso tiene impacto sobre las cifras tensionales, con una disminución en promedio de diez mmHg, valor que varía en las distintas series (67-70)
Obesidad
El SAHOS generalmente se encuentra asociado con varios factores de riesgo cardiovascular previamente mencionados, y es a su vez la causa y consecuencia de los mismos. La obesidad es el factor de riesgo más importante para el desarrollo de SAHOS, un 60 a 90% de los pacientes con este desorden presentan obesidad; a su vez, un 30 a 40% de los pacientes obesos pueden presentar SAHOS (73,74).
La obesidad influye mecánicamente en la función pulmonar predisponiendo a desordenes respiratorios del sueño tales como el síndrome de Pickwick, síndrome de hipo ventilación alveolar y SAHOS. El acúmulo de tejido adiposo a nivel de cuello y abdomen causa disminución en la luz de las vías respiratorias, alteración en la función de los músculos respiratorios de la vía aérea superior y restricción sobre la caja torácica, fenómenos que causan colapso de la vía aérea y disminución de los volúmenes pulmonares. A su vez el SAHOS genera un estado proinflamatorio secundario a la hipoxemia, que a nivel de tejido adiposo afecta la secreción de adipocitoquinas tales como la leptina, TNF-alfa e IL-6, las cuales tienen la potestad de estimular el centro hipotalámico del apetito, generando ganancia adicional de peso, incremento de la resistencia periférica a la insulina y trastornos en el metabolismo de los lípidos. (63, 72-75).
En conclusión, la coexistencia entre el síndrome metabólico y cada uno de sus componentes con el SAHOS esta adecuadamente documentado, generándose así una asociación extremadamente nociva que contribuye a la morbimortalidad cardiovascular de los pacientes con trastornos del sueño; por esta razón, el clínico debe estar siempre atento para identificar las diferentes alteraciones endocrinológicas, metabólicas y cardiovasculares, para poder ofrecer medidas de intervención terapéutica y preventivas encaminadas a propiciar la reducción ostensible del exceso de morbi-mortalidad observada en los pacientes con la peligrosa combinación SAHOS- síndrome metabólico.
Referencias
1. Van Cauter E, Spiegel K, Tasali E, Leproult R. Metabolic consequences of sleep and sleep loss. Sleep Med. 2008:9;23-8. [ Links ]
2. National Health Interview Survey. QuickStats: Percentage of Adults Who Reported an Average of <6 Hours of Sleep per 24-Hour Period, by Sex and Age Group - United States, 1985 and 2004. MMWR Morb Mortal Wkly Rep. 2005;54(37):933. [ Links ]
3. Copinschi G. Metabolic and endocrine effects of sleep deprivation. Essent Psychopharmacol. 2005;6(6):341. [ Links ]
4. Somers V K, White D P, Amin R, Abraham W T, Costa F, Culebras A, et al. Sleep apnea and cardiovascular disease. An American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular nursing. J Am Coll Cardiol. 2008;52(8):686. [ Links ]
5. González L M, Castaño J J, Herrera V, Jiménez A M, Lentijo P, Sierra A et al. Relación entre hipertensión arterial Sistémica y síndrome de apnea-hipopnea obstructiva del sueño y sus factores de riesgo asociados, en población hipertensa de un centro médico en Cali (Colombia) 2008.Arch Med. 2008;8(2):89. [ Links ]
6. Van Cauter E, Leproult R, Plat L. Age-related changes in slow wave sleep and REM sleep and relationship with growth hormone and cortisol levels in healthy men. J Am Med Assoc. 2000;284(7):861. [ Links ]
7. Van Cauter E, Holmback U, Knutson K, Leproult R, Miller A, Nedeltcheva A et al. Impact of sleep and sleep loss on neuroendocrine and metabolic function. Horm Res. 2007;67(1):2. [ Links ]
8. Buxton O et al. Sleep restriction for one week reduces insulin sensitivity measured using the euglycemic hyperinsulinemic clamp technique. Sleep. 2008;31:107. [ Links ]
9. Knutson KL, Van Cauter E. Associations between sleep loss and increased risk of obesity and diabetes. Ann NY Acad Sci. 2008;1129:287. [ Links ]
10. Gottlieb DJ, Punjabi NM, Newman AB, Resnick HE, Redline S, Baldwin C Met al. Association of sleep time with diabetes mellitus and impaired glucose tolerance. Arch Intern Med. 2005;165(8):863. [ Links ]
11. Ip M S, Lam K S, Ho C M, Tsang K W, Lam WK. Serumleptin and vascular risk factors in obstructive sleep apnea. Chest. 2000;118(3):580. [ Links ]
12. Coughlin SR, Mawdsley L, Mugarza J A, Wilding J P, Calverley P M. Cardiovascular and metabolic effects of CPAP in obese males with OSA. Eur Respir J. 2007;29(4):720. [ Links ]
13. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middleaged adults. N Engl J Med. 1993;328(17):1230. [ Links ]
14. Chou Y T et al. Hyperlipidaemia in patients with sleep-related breathing disorders: Prevalence & risk factors. Indian J Med Res. 2010;131:121. [ Links ]
15. Kiely JL, McNicholas WT. Cardiovascular risk factors in patients with obstructive sleep apnea syndrome. Eur Respir J. 2000;16(1):128. [ Links ]
16. Sharma SK, Kumpawat S, Goel A, Banga A, Ramakrishnan L, Chaturvedi P. Obesity, and not obstructive sleep apnea, is responsible for metabolic abnormalities in a cohort with sleep disordered breathing. Sleep Med. 2007;8(1):127. [ Links ]
17. Tan KC, Chow WS, Lam JC, Lam B, Wong WK, Tam S, et al. HDL dysfunction in obstructive sleep apnea. Atherosclerosis. 2006;184(2):377-82. [ Links ]
18. Li J, Thorne LN, Punjabi NM, Sun CK, Schwartz AR, Smith PL, et al. Intermittent hypoxia induces hyperlipidemia in lean mice. Circ Res. 2005;97(7):698. [ Links ]
19. Iesato K, Tatsumi K, Saibara T, Nakamura A, Terada J, Tada Y ,et al. Decreased lipoprotein lipase in obstructive sleep apnea syndrome. Circ J. 2007;71(8):1293. [ Links ]
20. Li J, Savransky V, Nanayakkara A, Smith PL, O'Donnell CP, Polotsky VY. Hyperlipidemia and lipid peroxidation are dependent on the severity of chronic intermittent hypoxia. J Appl Physiol. 2007;102(2):557. [ Links ]
21. Ericsson J, Jackson SM, Kim JB, Spiegelman BM, Edwards PA. Identification of glycerol-3-phosphate acyltransferase as an adipocytedetermination and differentiation factor 1- and sterol regulatory elementbindingprotein-responsive gene. J Biol Chem. 1997; 272(11):7298. [ Links ]
22. Ganesh BB, Wang P, Kim JH, Black TM, Lewin TM, Fiedorek FT Jr, Coleman RA. Rat sn-glycerol-3-phosphate acyltransferase: molecularcloning and characterization of the cDNA and expressed protein. BiochimBiophys Acta. 1999;1439(3):415. [ Links ]
23. Horton JD, Bashmakov Y, Shimomura I, Shimano H. Regulation of sterol regulatory element binding proteins in livers of fasted and refed mice. Proc Natl Acad Sci. 1998;95(11):5987. [ Links ]
24. Jianguo L. Effect of deficiency in SREBP cleavage-activating hypoxia protein on lipid metabolism during intermittent.Physiol Genomics. 2007;31(2):273. [ Links ]
25. Robinson G V, Pepperell J C, Segal H C, Davies R J, Stradling JR. Circulating cardiovascular risk factors in obstructive sleep apnoea: data from randomized controlled trials. Thorax. 2004;59(9):777. [ Links ]
26. Borgel J, Sanner BM, Bittlinsky A, Keskin F, Barlets NK, Buechner Net al. Obstructive sleep apnea and its therapy influence high-density lipoprotein cholesterol serum levels. Eur Respir J. 2006; 27(1):121. [ Links ]
27. Dorkova Z, Petrasova D, Molcanyiova A, Popovnakova M, Tkacova R. Effects of CPAP on cardiovascular risk profile in patients with severe obstructive sleep apnea and metabolic syndrome. Chest. 2008;134(4):686. [ Links ]
28. Stoohs R, Facchini F, Guilleminault C. Insulin resistance and sleepdisordered breathing in healthy humans. Am J RespCrit Care Med. 1996;154(1):170. [ Links ]
29. Elmasry A, Lindberg E, Berne C, et al. Sleep-disordered breathing and glucose metabolism in hypertensive men: a population-based study. J Intern Med. 2001;249(2):153. [ Links ]
30. Punjabi NM, Sorkin JD, Katzel LI, et al. Sleep-disordered breathing and insulin resistance in middle-aged and overweight men. Am J Respir Crit Care Med. 2002;165(5):677. [ Links ]
31. Ip S, Lam B, Ng M, et al. Obstructive sleep apnea isindependently associated with insulin resistance. Am J RespirCrit Care Med. 2002;165(5):670. [ Links ]
32. Punjabi NM, Shahar E, Redline S, et al. Sleep-disorderedbreathing, glucose intolerance, and insulin resistance: the SleepHeart Health Study. Am J Epidemiol. 2004;160(6):521. [ Links ]
33. Hiestand D M, Britz P, Goldman M et al. Prevalence of symptoms and risk of sleep apnea in the US population:results from the national sleep foundation sleep in America 2005 poll. Chest. 2006;130(3):780. [ Links ]
34. Reichmuth KJ, Austin D, Skatrud J B et al. Association of sleep apnea and type II diabetes: a population-based study. Am J Respir Crit Care Med. 2005;172(12):1590. [ Links ]
35. Lam JC, Lam B, Lam CL, et al. Obstructive sleep apnea and the metabolic syndrome in community-based Chinese adults in Hong Kong. Respir Med. 2006;100(6):980. [ Links ]
36. Foster GE, Kuna ST, Sanders MH et al. Sleep apnea in obese adults with type 2 diabetes: baseline results from sleep AHEAD study. Sleep. 2005;25:66 [ Links ]
37. Norton PG, Dunn EV. Snoring as a risk factor for disease: an epidemiological survey. BMJ. 1985;291(6496):630. [ Links ]
38. Grunstein R R, Stenlof K, Hedner J et al. Impact of obstructive sleep apnea and sleepiness on metabolic and cardiovascular risk factors in the Swedish Obese Subjects (SOS) Study. Int J Obes Relat Metab Disord. 1995;19(6):410. [ Links ]
39. Vgontzas AN, Papanicolaou DA, Bixler E O et al. Sleep apnea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance and hypercytokinemia. J Clin Endocrinol Metab. 2000;85(3):1151. [ Links ]
40. Tassone F, Lanfranco F, Gianotti L et al. Obstructive sleep apnea syndrome impairs insulin sensitivity independently of anthropometric variables. Clin Endocrinol. 2003;59(3):374. [ Links ]
41. Coughlin SR, Mawdsley L, Mugarza J A et al. Obstructive sleep apnoea is independently associated with an increased prevalence of metabolic syndrome. Eur Heart J. 2004;25(9):735. [ Links ]
42. McArdle N, Hillman D, Beilin L et al. Metabolic risk factors for vascular disease in obstructive sleep apnea: a matched controlledstudy. Am J Respir Crit Care Med. 2007;175(2):190. [ Links ]
43. Kono M, Tatsumi K, Saibara T et al. Obstructive sleep apnea syndrome is associated with some components of metabolic syndrome. Chest. 2007;131(5):1387. [ Links ]
44. Somers VK, Dyken ME, Clary M P et al. Sympathetic neural mechanisms in obstructive sleep apnea. J Clin Invest. 1995;96(4):1897. [ Links ]
45. Polotsky VY, Li J, Punjabi N M et al. Intermittent hypoxia increases insulin resistance in genetically obese mice. JPhysiol. 2003;552(1):253. [ Links ]
46. Oltmanns KM, Gehring H, Rudolf S, et al. Hypoxia causes glucose intolerance in humans. Am J Respir Crit Care Med. 2004;169(11):1231. [ Links ]
47. Lavie L. Obstructive sleep apnoea syndrome: an oxidative stress disorder. Sleep Med Rev. 2003;7(1):35. [ Links ]
48. Zhan G, Serrano F, Fenik P, et al. NADPH oxidase mediates hypersomnolence and brain oxidative injury in a murine model of sleep apnea. Am J RespirCrit Care Med. 2005;172(7):921. [ Links ]
49. Furukawa S, Fujita T, Shimabukuro M et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest. 2004;114(12):1752. [ Links ]
50. Laight DW, Desai KM, Gopaul N K et al. Pro-oxidant challenge in vivo provokes the onset of NIDDM in the insulin resistant obese Zucker rat. Br J Pharmacol. 1999;128(2):269. [ Links ]
51. Ayas N, White D, Al-Delaimy D, Manson J, Stampfer M, Speizer F et al. A prospective study of self-reported sleep duration and incident diabetes in women. Diabetes Care. 2003;26:380. [ Links ]
52. Mallon L, Broman JE, Hetta J. High incidence of diabetes inmen with sleep complaints or short sleep duration: a 12-yearfollow-up study of a middle-aged population. Diabetes Care. 2005;28:2762. [ Links ]
53. Kawakami N, Takatsuka N, Shimizu H. Sleep disturbance and onset of type 2 diabetes. Diabetes Care. 2004;27:282. [ Links ]
54. Nilsson P, Rööst M, Engström G, Hedblad B,Berglund G. Incidence of diabetes in middle-aged men is related to sleep disturbances. Diabetes Care. 2004;27:2464. [ Links ]
55. Björkelund C, Bondyr-Carlsson D, Lapidus L, Lissner L, Månsson J, Skoog I, et al. Sleep disturbances in midlife unrelated to 32-year diabetes incidence: the prospective population study of women in Gothenburg. Diabetes Care. 2005;28:2739. [ Links ]
56. Meisinger C, Heier M, Loewel H. Sleep disturbance as apredictor of type 2 diabetes mellitus in men and women from the general population. Diabetología. 2005;48:235. [ Links ]
57. Yaggi HK, Araujo AB, McKinlay JB. Sleep duration as a riskfactor for the development of type 2 diabetes. Diabetes Care. 2006;29:657. [ Links ]
58. Spiegel K, Leproult R, Van Cauter E. Impact of sleep debut on metabolic and endocrine function. Lancet. 1999;354:1435. [ Links ]
59. Lavie L, Lavie P. Molecular mechanisms of cardiovasculardisease in OSAHS: the oxidative stress link. EurRespir J. 2009;33:1467. [ Links ]
60. Garcia J, Sharafkhaneh H, Hirshkowitz M, Elkhatib R, Sharafkhaneh A. Weight and Metabolic Effects of CPAP in Obstructive Sleep Apnea patients with obesity. Respiratory Research. 2011;12:80. [ Links ]
61. Gottlieb DJ, Redline S, Nieto FJ, Baldwin CM, Newman AB, Resnick HE, Punjabi JM. Association of usual sleep duration with hypertension: the Sleep Heart Health Study. Sleep. 2006;29:1009. [ Links ]
62. Kapa S, SertKuniyoshi F, Somers V. Sleep Apnea and Hypertension: Interactions and Implications for Management. Hypertension. 2008;51:605. [ Links ]
63. KatsuYanai H, Tomono Y, Ito K, Furutani N, Yoshida H, Tada N. The underlying mechanisms for development of hypertension in the metabolic syndrome. Nutrition Journal.2008;7:10. [ Links ]
64. García-Río F, Arias M. Obstructive Sleep Apnea and Left Ventricular Systolic and Diastolic Dysfunction. Sleep Med Clin. 2007;2:565. [ Links ]
65. Jean-Louis G, Zizi F, Clark L,Clinton D. Brown, McFarlane S.Obstructive Sleep Apnea and Cardiovascular Disease: Role of the Metabolic Syndrome and Its Components, Journal ofClinical Sleep Medicine. 2008;4:3. [ Links ]
66. Young T, Peppard P, Palta M, Hla K, Finn L, Morgan B, et al. Population-based study of sleep-disordered breathing as a risk factor for hypertension. Arch Intern Med. 1997;157:1746. [ Links ]
67. Cantolla J, Aizpuru F, Montserrat JM, Ballester E, Terán- Santos J, Aguirregomoscorta JI et al. Continuous positive airway pressure as treatment for systemic hypertension in people with obstructive sleep apnoea: randomised controlled trial. BMJ. 2010;341:5991 [ Links ]
68. Kato M, Adachi T, Koshino Y, Somers VK. Obstructive sleep apnea and cardiovascular disease. Circ J. 2009;73:1363. [ Links ]
69. Kannan Ramar, Sean M. Caples. Cardiovascular Consequences of Obese and Non obese Obstructive Sleep Apnea. Med Clin N Am. 2010;9:465. [ Links ]
70. Daniel Norman; José S. Loredo; Richard A. Nelesen; Sonia Ancoli- Israel; Paul J. Mills; Michael G et al. Effects of Continuous Positive Airway Pressure Versus Supplemental Oxygen on 24-Hour Ambulatory Blood Pressure. Hypertension. 2006;47:840. [ Links ]
71. Norman, Loredo J, Nelesen R, Ancoli-Israel S, Mills P; Ziegler M et al. Effects of Continuous Positive Airway Pressure Versus Supplemental Oxygen on 24-Hour AmbulatoryBlood Pressure. Hypertension. 2006;47:840. [ Links ]
72. Chiong JR.Secondary hypertension: Current diagnosis and treatment. Intern J Cardio. 2008;124. [ Links ]
73. Klein S, Burke L, Bray G, Blair S, Allison D, Pi-Sunyer X et al. Clinical Implications of Obesity With Specific Focus on Cardiovascular Disease A Statement for Professionals From the American Heart AssociationCouncil on Nutrition, Physical Activity, and Metabolism. Circulation. 2004;110:2952 [ Links ]
74. Pillar G, Shehadeh N. Abdominal Fat and Sleep Apnea: The chicken or the egg? Diabetes Care. 2008;31(2):303. [ Links ]
75. Schwartz A, Patil S, Laffan A, Polotsky V, Schneider H, Smith P. Obesity and Obstructive Sleep Apnea Pathogenic Mechanisms and Therapeutic Approaches.Proc Am Thorac Soc. 2008;5:185. [ Links ]
76. Bazurto M, Meza E, Herrera K. Tratamiento de la apnea obstructiva delsueño con presión positiva. Perspectiva Neumológica. 2010;10:105. [ Links ]














