Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Med
Print version ISSN 0121-5256
rev.fac.med vol.20 no.2 Bogotá July/Dec. 2012
ARTÍCULO DE REVISIÓN
DIABETES GESTACIONAL Y COMPLICACIONES NEONATALES
GESTATIONAL DIABETES AND NEONATAL COMPLICATIONS
DIABETES GESTACIONAL E COMPLICAÇÕES NEONATAIS
JUAN ARIZMENDIa, VICENTE CARMONA PERTUZb, ALEJANDRO COLMENARESc, DIANA GÓMEZ HOYOSd, TATIANA PALOMOe
a Pediatra, Hospital Militar Central
b Perinatólogo, Hospital Militar Central
c Neonatólogo, Coordinador Unidad Recién Nacidos, Hospital Militar Central
d Neonatóloga, Coordinadora Unidad Recién nacidos, Hospital Universitario Clínica San Rafael
e Pediatra, Fellow primer año, Neonatología, Universidad Militar Nueva Granada
* Correspodencia: Correo electrónico: leonardoarevalo@tutopia.com Correo electrónico: sandra.pao.1@hotmail.com
Recibido: Noviembre 14 de 2012 Aceptado: Diciembre 18 de 2012
Resumen
La diabetes gestacional es un motivo de consulta frecuente en medicina materno-fetal; los casos vienen en aumento y por ende las complicaciones neonatales de los hijos de madres con diabetes gestacional, cada una de ellas es revisada con el fin de esclarecer la causa y el tratamiento.
Nuestro estudio es descriptivo y se consultaron las bases de datos: ScienceDirect, Ovid, Medline, Pubmed, LILACS. El objetivo es revisar la diabetes gestacional como entidad y describir las principales complicaciones neonatales.
Dentro del abordaje de una gestante con diagnóstico de diabetes mellitus debemos clasificar si es tipo 1 o tipo 2, establecer un objetivo claro en el valor de la glucometría y lo más importante un plan nutricional; cuando lo anterior no es posible las complicaciones neonatales se hacen inminentes y el riesgo de muerte in útero es mayor.
Durante la gestación la evaluación gineco-obstétrica nos ayuda a descartar malformaciones congénitas en el feto, y al nacer se evaluará la adaptación neonatal, para iniciar tratamiento temprano y disminuir la mortalidad en el recién nacido hijo de madre diabética.
Declaración de conflictos de interés: no existen conflictos de interés
Abstract
Gestational diabetes is a frequent complaint in maternal-fetal medicine; cases are on the rise and therefore neonatal complications in children of mothers with gestational diabetes, which will be reviewed in order to clarify the cause and treatment update.
Our study is descriptive and consulted the database: Science Direct, Ovid, Medline, PubMed, LILACS. The objective is to review the gestational diabetes as an entity and describe major neonatal complications.
Within the approach of a pregnant woman diagnosed with diabetes mellitus should classify whether type 1 or type 2, set a clear goal in the value of blood glucose and most importantly a nutrition plan, if the above is not possible neonatal complications are and the risk of imminent death in utero is higher.
During pregnancy, gynecological evaluation helps us discard obstrética congenital malformations in the fetus at birth and assess neonatal adaptation to initiate early treatment and reduce mortality in the newborn of a diabetic mother.
Resumo
A diabetes gestacional é um motivo de consulta frequente em medicina materno-fetal; os casos vêm em aumento e portanto as complicações neonatales dos filhos de mães com diabetes gestacional, as quais serão revisadas com o fim de esclarecer a causa e actualizar o tratamento.
Nosso estudo é descritivo e consultaram-se os bancos de dados: Science Direct, Ovid, Medline, Pubmed, LILACS. O objectivo é revisar a diabetes gestacional como entidade e descrever as principais complicações neonatales.
Dentro da abordagem de uma gestante com diagnóstico de diabetes mellitus devemos classificar se é tipo 1 ou tipo 2, estabelecer um objectivo claro no valor da glucometria e o mais importante um plano nutricional; quando o anterior não é possível as complicações neonatales se fazem iminentes e o risco de morte in útero é maior.
Durante a gestación a avaliação gineco-obstrética ajuda-nos a descartar malformaciones congénitas no feto e ao nascer avaliar-se-á a adaptação neonatal para iniciar tratamento temporão e diminuir a mortalidade no recém nascido filho de mãe diabética.
Diagnóstico prenatal y manejo de diabetes gestacional
La diabetes pregestacional cada vez es más frecuente debido a las altas cifras de sobrepeso y obesidad en todo el mundo, en los últimos años la prevalencia global de diabetes ha alcanzado proporciones epidémicas, se detectan 1,5 millones de nuevos casos de diabetes mellitus en un año. Esta epidemia afecta tanto a los países en vías de desarrollo como a los desarrollados, y se predice un mayor incremento para el año 2025. En los últimos 10 años se ha incrementado el número de mujeres con diabetes tipo 2 en edad reproductiva hasta en un 33% y el 70% de ellas en el rango de edad de 30 a 39 años (1-3).
El riesgo obstétrico es mayor en la diabetes mellitus gestacional por diferentes razones, entre ellas:
1. La mayoría de los embarazos en diabéticas no son planeados, por lo cual durante el primer periodo de embarazo pierden el control glicémico.
2. El embarazo en edad avanzada predispone a diabetes mellitus tipo 2 de novo, lo cual hace que el control glicémico no sea el adecuado durante la organogénesis.
3. En la diabética preconcepcional obtener un control glicémico óptimo no siempre es fácil.
La diabetes gestacional incrementa el riesgo de anomalías esqueléticas como el síndrome de regresión caudal, anomalías espinales y siringomielia; a nivel renal hidronefrosis, agenesia renal y quistes renales. Las malformaciones intestinales más comunes son: atresia del duodeno y el recto o en cualquier parte del tracto gastrointestinal (4-6).
El diagnóstico se realiza por medio de la prueba de tolerancia a la glucosa, la cual no debe ser mayor de 140 mg/dl, esta prueba tiene falsos negativos hasta en un 10% de los casos debido a emesis durante la prueba (7).
La diabetes gestacional altera diversos sistemas en el feto, el pobre control glicémico desde el inicio del embarazo afecta la organogénesis y el control tardío la composición corporal, incluyendo macrosomía y dificultad respiratoria (8).
El pobre control glicémico desde la primera cita prenatal y la diabetes gestacional complicada con nefropatía y retinopatía son los factores de riesgo más importantes para presentar complicaciones neonatales, con un riesgo relativo (RR) de 2,9 y 2,7 respectivamente, para necesidad de hospitalización al nacer, malformación congénita y muerte perinatal. Ser primigestante y fumadora se asocia con incremento en el riesgo de complicaciones perinatales, por lo cual este subgrupo de gestantes debe tener acceso a una consejería y un monitoreo intensivo materno fetal desde la primera cita (9).
Cuando el control glicémico no es el adecuado, constantemente se asocia con macrosomía con un OR de 2,73, pero una mejoría del control a la semana 28 tiene efectos favorables en el crecimiento del feto, incremento en la edad gestacional al nacer, peso adecuado al nacer y disminución de injuria al nacer (9,10).
El engrosamiento de la membrana del vello coriónico, puede incrementar la distancia de difusión de oxígeno entre la madre y el feto, pero la placenta compensa esta distancia aumentando el área total de la vellosidad coriónica. Pero en los casos de diabetes gestacional no controlada esta compensación no es suficiente, porque el flujo sanguíneo uterino hacia la placenta está disminuido, lo cual ocasiona alteración en el bienestar fetal.
En el control prenatal del primer trimestre el objetivo es verificar la viabilidad fetal, en el segundo se evalúa la integridad estructural, y para el tercer trimestre se debe conocer el crecimiento fetal y el bienestar del mismo. Durante la semana 32 de gestación se recomienda tomar "non-stress test" 2 veces por semana, y en caso de ser no reactivo se debe realizar "contraction stress test" (4,11).
La ecografía obstétrica es de gran ayuda para predecir complicaciones maternas como preeclampsia, fetales como muerte o stress, diagnóstico de malformaciones fetales, tiempo de terminación del embarazo, diagnóstico temprano de macrosomía, ayuda a mejorar los manejos neonatales y sirve de guía para planear la vía del parto y el momento del mismo (1,4).
Una ecografía realizada por experto tiene el 10% del peso real estimado en el 80% de los casos y del 20% en pacientes con valoración previa. La ecografía 3D es útil para evaluar con mayor exactitud el peso real estimado. Con respecto a la cantidad de líquido amniótico, normalmente, disminuye en la mitad de la gestación y en el tercer trimestre, pero en hijo de madre diabética no hay variación a lo largo de la gestación. Se recomienda una ecografía entre la semana 7 y 9 para evaluar viabilidad y edad gestacional, entre la semana 18 y 20 evaluación específica del corazón fetal con evaluación de las 4 cámaras y el tracto de salida; a las 28, 32 y 36 semanas se observa el crecimiento fetal y el volumen del líquido amniótico, después de la semana 38 se realiza prueba de bienestar fetal semanal (1).
El aporte materno de ácido araquidónico (AA) y ácido decohexanoico (DHA) en animales de experimentación durante la gestación y en el periodo de lactancia mejoraría el desarrollo neural del hipocampo del feto, disminuyendo los efectos adversos de la diabetes durante el embarazo (12).
Como medidas preventivas, para evitar complicaciones fetales, se debe tomar "non stress test" y perfil biofísico en gestantes diabéticas cercanas al término o las últimas semanas de embarazo. El doopler de arteria umbilical no ha mostrado ser útil en asegurar un bienestar fetal en la gestante diabética, a menos que curse con preeclampsia o retardo del crecimiento intrauterino, pues está claro que la asfixia no es secundaria a insuficiencia placentaria (13).
El embarazo en la paciente diabética ocasiona mayor resistencia a la insulina, lo cual incrementa la hiperglicemia gestacional y hace necesario el manejo con insulina, para mantener un adecuado control glicémico postprandial y así evitar las complicaciones fetales como aborto o macrosomía (14-16).
En las maternas con diabetes mellitus de "novo" se inicia dieta estricta baja en carbohidratos, en caso de continuar con intolerancia a la glucosa se adiciona insulina.
El manejo con insulina está indicado en pacientes con diabetes tipo 1 o tipo 2 que no se controlen con dieta. Las insulinas más utilizadas son las de acción rápida, entre ellas, la insulina lispro y la aspart. La insulina lispro (duración de 3-5 h) disminuye los niveles de hemoglobina glicosilada A1C en el preparto y es la que menos atraviesa la placenta. La insulina aspart es un análogo de la insulina de rápida acción, que ha sido estudiada y comparada con la insulina lispro en gestante diabética tipo 1, encontrándose mayor control postprandial y menor hipoglicemia nocturna. La insulina NPH es el análogo de insulina de acción intermedia, que se adiciona a la insulina de acción rápida durante el embarazo para mantener el requerimiento basal diario de insulina, porque los otros análogos de larga duración no han sido estudiados durante el embarazo.
La terapia con hipoglicemiantes orales, ha mostrado seguridad y efectividad en la gestante diabética durante el segundo y tercer trimestre, pero no son la primera opción porque atraviesan la placenta. El más estudiado es la metformina, que no ha mostrado diferencias en complicaciones perinatales cuando se compara con la insulina (16).
El tratamiento de la diabetes gestacional va unido a un plan nutricional y al compromiso del paciente de realizar monitoreo permanente de sus glucometrías. Uno de los objetivos del equipo médico es mejorar el estilo de vida de estas pacientes, y para ello se debe estar a la vanguardia de la tecnología, la cual cada día nos ofrece nuevas formas de manejo y monitoreo como las bombas de insulina.
Hasta el momento no se ha encontrado un solo mecanismo que explique las alteraciones en el feto y en el recién nacido hijo de madre diabética. Actualmente se cree en la hipótesis de que el feto de la madre con hiperglicemia desarrolla hiperplasia e hipertrofia de las células beta del páncreas y esto afecta diversos órganos in útero incluida la placenta (4, 17, 18).
En el feto, la insulina actúa como una hormona anabólica primaria de crecimiento fetal y desarrollo, ocasiona macrosomía y visceromegalia a nivel cardiaco y hepático. Cuando hay un exceso de sustrato (glucosa), se produce aumento de la síntesis grasa, y esta se deposita en los órganos antes mencionados, principalmente en el tercer trimestre (8,19,20).
Las primeras 7 semanas de gestación constituyen el periodo en que la hiperglicemia puede causar mayor teratogénesis. La incidencia de complicaciones es del 3,4% y 22,4% con hemoglobina glicosilada A1c menor a 8,5% y mayor de 8,5% respectivamente, niveles por encima de 10% se asocian a complicaciones neonatales (21-23).
La diabetes materna es un factor de riesgo independiente para muerte fetal, cerca de la mitad de las muertes fetales ocurre antes de la semana 30 de gestación, y la mayoría de estos fetos tienen restricción en el crecimiento asociado a preeclampsia y/o nefropatía diabética (13,21,23).
La mortalidad de la diabetes gestacional durante los últimos 25 años sigue siendo elevada aproximadamente 3 a 6 veces más que en el embarazo normal. El aumento de los números de casos de diabetes tipo 1 juvenil incrementa los casos de mortalidad en hijo de madre diabética. Del 30 al 40% de las muertes perinatales son debidas a malformaciones, 20 a 30% a prematurez y otro 20 a 30% a asfixia perinatal (20). La muerte fetal se produce por hiperglicemia e hiperinsulinemia fetal la cual aumenta el consumo de oxígeno ocasionando hipoxia fetal crónica y fallecimiento (21).
Las madres diabéticas suelen tener complicaciones durante el parto, como distocia de hombros, 3-4 veces más que los hijos con peso mayor de 4000 gramos de madres no diabéticas. Prever la distocia de hombros, no es fácil por ultrasonografía, se debe tener en cuenta la medición del perímetro abdominal, especialmente en el tercer trimestre del embarazo, lo cual ayuda a detectar el feto con macrosomía (13,24).
Las complicaciones más frecuentes del hijo de madre diabética, como macrosomía, hipertrofia miocárdica, hipoglicemia, alteraciones vasculares, malformaciones congénitas, se presentan en la diabética tipo 1 con niveles de eritropoyetina > 60 mU/ml en líquido amniótico. Sin embargo, faltan estudios con mayor población, que evalúen el beneficio clínico de medir la eritropoyetina en líquido amniótico (4,9,13,21,25).
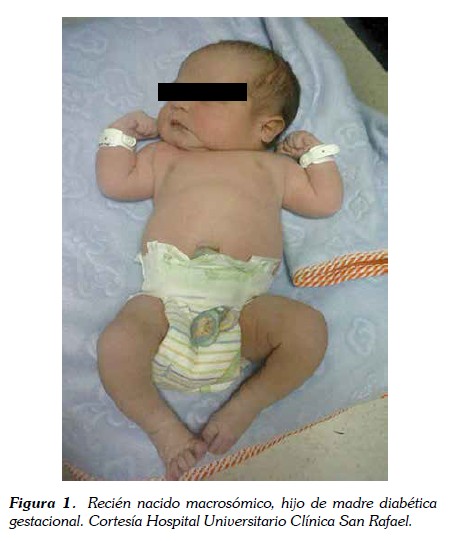
El peso al nacer es el resultado de la interacción entre madre, placenta y feto durante la vida intrauterina. La macrosomía y la visceromegalia selectiva son las características más frecuentes en la diabetes gestacional. La macrosomía se caracteriza por aumento del tejido graso, incremento de la masa muscular y organomegalia, sin incremento del tamaño de la masa cerebral (8,19,20) (ver figura 1). Uno de los marcadores séricos de macrosomía es la leptina, los niveles de leptina en sangre del cordón se encuentran aumentados en recién nacidos con peso grande para la edad gestacional, hijos de madre con diabetes gestacional e índice de masa corporal aumentado (26). No todos los hijos de madre diabética tienen peso grande para la edad gestacional, alrededor del 5% de los hijos de madre diabética presenta bajo peso para la edad gestacional, aún se desconoce la causa pero se están realizando estudios con el fin de encontrar otros factores asociados (24).
La hipoglicemia neonatal se ocasiona por la caída de los niveles plasmáticos de glucosa al nacer, lo cual disminuye los niveles de ácidos grasos libres, glicerol y betahidroxibutirato. Al iniciar aporte endovenoso de glucosa, aumenta la liberación de insulina y de péptido C, y si se compara la elevación de la insulina dos horas después del nacimiento en recién nacidos normales vs. hijos de madre diabética, se observa que los hijos de madre diabética tienen solo la mitad de su función hepática, esto se debe a la dependencia del páncreas materno in utero (13).
Las alteraciones en glucocorticoides plasmáticos y catecolaminas no son significativas en el hijo de madre diabética, Las somatomedinas, IGF-I e IGF II no están elevadas en sangre del cordón en estudios con animales de experimentación con hiperinsulinismo primario. En contraste, las catecolaminas en orina se encuentra disminuida, sobretodo en pacientes con baja concentración de glucosa plasmática y los niveles de glucagón plasmático se encuentran menos elevados comparado con los recién nacidos normales (27).
La trombosis venosa se presenta en el 16% de los casos en hijo de madre diabética, se asocia a polihidramnios, toxemia, trauma durante el parto, sepsis y cirugía, las venas más comprometidas son la adrenal y la renal (28).
La incidencia global de malformaciones congénitas en hijos de madres con diabetes mellitus insulinodependiente es de 6% a 13%, 2 a 4 veces mayor que en la población general. Las malformaciones más frecuentes comprometen corazón, sistema nervioso central, riñón y vías urinarias. El mecanismo teratogénico es desconocido, pero interviene la alta concentración de radicales libres, alteración en el metabolismo de las prostaglandinas, glicosilación de proteínas y múltiples mutaciones en el ADN (4, 27,29,30).
Proponemos una evaluación integral del hijo de madre diabética desde el inicio de la gestación (ver Tabla 1).
Complicaciones Neonatales
El género como predictor de riesgo
Uno de los predictores positivos de complicaciones neonatales del hijo de madre diabética, para recién nacido con peso grande para la edad gestacional, es el género masculino al igual que la diabetes tipo 1 y el embarazo múltiple (24,31). El sexo fetal tiene un impacto como predictor del peso al nacer, teniendo en cuenta el aumento progresivo de peso al nacer, la semana de parto, el tipo de diabetes y la macrosomía, con una única excepción en el feto masculino en el cual se encuentra una menor relación con el incremento de peso. La hipótesis propuesta para explicar lo anterior es la de la resistencia a la insulina, propuesta por Wilkin y Murphy en la cual se considera que las niñas tienen mayor resistencia a la insulina que los niños, tanto en la vida intrauterina como en la infancia y en la adolescencia con un mecanismo de base desconocido que puede ser secundario a un patrón de herencia ligada al sexo (24).
Función cardiorrespiratoria
Las anormalidades en la función cardiaca están presentes en el 30% de los hijos de madre diabética, e incluye la hipertrofia septal interventricular y la cardiomiopatía. Solo el 10% presentan falla cardiaca congestiva (4,19,27). La hipertrofia cardiaca, que se encuentra en el feto macrosómico, se asocia a falla cardiaca congestiva secundaria a hiperinsulinismo, por lo cual, una vez más es importante el adecuado control glicémico de la gestante diabética.
La hiperglicemia e hiperinsulinemia fetal crónica puede ocasionar almacenamiento de glucógeno en el septum interventricular. Las bases moleculares que sustentan la hipertrofia miocárdica e hipertrofia septal en algunos hijos de madre diabética son desconocidas, pero desde hace 2 años se ha propuesto que se debe a polimorfismos y alteración en las telomerasas que codifican para el miocardiocito, lo cual involucra los genes HOX, el factor de crecimiento epidérmico y la MAP quinasa (4,32). Durante el periodo neonatal el cuadro clínico es de obstrucción del flujo ventricular izquierdo y en el manejo se debe corregir la deshidratación y la hiperviscosidad con el fin de evitar que los síntomas se exacerben (33,34). El tratamiento depende del estado clínico del paciente, en caso de falla cardiaca congestiva se propone el uso de betabloqueadores, no se recomienda el manejo con inotrópicos como primera elección usualmente la lesión es transitoria y se puede resolver en semanas o meses (4,30).
El cierre del ductus arterioso y la caída de la presión arterial pulmonar son más tardíos en el hijo de madre diabética, sin encontrarse alteración en la función ventricular izquierda (35). El riesgo relativo para malformación cardiaca es de 12.9 en gestantes que requieren insulina, con un riesgo absoluto de 6.1 %. Las malformaciones cardiacas más frecuentes son: atresia pulmonar, dextrocardia, transposición de grandes vasos, defecto septal ventricular y ductus arterioso persistente en neonatos con peso mayor o igual a 2500 gramos (1).
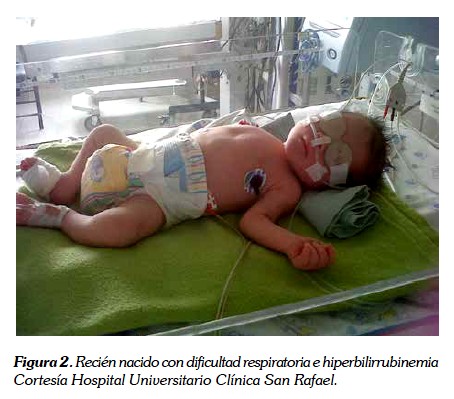
Con respecto al síndrome de dificultad respiratoria del recién nacido, los hijos de madre diabética tienen mayor riesgo de presentarlo porque la insulina interfiere en la unión de la colina a la lecitina a pesar de la presencia del cortisol, por lo cual la hiperinsulinemia altera la maduración pulmonar. El síndrome de dificultad respiratoria es secundario a la deficiencia de surfactante pulmonar y radiológicamente observamos pérdida de volumen y aparición de microatelectasias. Cabe resaltar que la síntesis de lecitina no está alterada en el hijo de madre diabética, pero la producción de fosfatidilglicerol es anormal. Sin embargo, la maduración pulmonar no se afecta en la gestante diabética con adecuado control glicémico (36). El tratamiento del recién nacido con dificultad respiratoria consiste en administrar oxígeno, aporte adecuado de líquidos y soporte ventilatorio cuando sea necesario (4,11) (ver figura 2).
La incidencia de asfixia perinatal es mayor en las gestantes diabéticas, con mayor frecuencia en gestantes con pobre control glicémico durante el tercer trimestre del embarazo, comparado con gestantes con buen control glicémico. Existen dos teorías sobre la causa de la hipoxia crónica en el hijo de madre diabética, la primera por hiperinsulinismo, en el cual aumenta la oxidación de glucosa ocasionando una disminución en el contenido arterial de oxígeno y la segunda por hiperglicemia persistente lo cual aumenta el consumo fetal de oxígeno (13,37). Madsen investigó la causa de la asfixia fetal en gestantes diabéticas y evaluó factores maternos, placentarios y fetales, dentro de los factores maternos más importantes encontró la hiperglicemia, la elevación de la hemoglobina glicosilada A1c y el tabaquismo.
En recién nacidos de madre diabética la concentración de eritropoyetina plasmática esta elevada y se observa aumento de los reticulocitos. En las autopsias de hijos de madre con diabetes mellitus se encuentra bajos depósitos de hierro a nivel hepático, cardiaco y cerebral, lo cual sugiere que un estado de hipoxia crónica fetal precede a la muerte neonatal (4,8). La eritropoyetina regula la producción de eritrocitos en fetos y en el adulto, no es almacenada ni atraviesa la placenta. En el feto a término la mayor síntesis de eritropoyetina ocurre en el riñón y durante la hipoxia se inicia la síntesis en otros tejidos. Experimentos en ratones y ovejas muestran que los niveles de eritropoyetina inician la elevación 2-3 horas después del inicio de la hipoxia aguda y la severidad de la hipoxia se correlaciona con el aumento de la eritropoyetina (4,13,37).
El feto se adapta a la hipoxia crónica con mecanismos hemodinámicos, uno de ellos la redistribución del gasto cardiaco para mejorar el flujo cerebral y cardiaco, además mejorando el transporte de oxígeno por medio del aumento de la síntesis de eritropoyetina (37).
Hipoglicemia Neonatal
La hiperglicemia materna resulta en hiperglicemia fetal, y al nacer con la interrupción de la glucosa se produce un aumento de secreción de insulina en el páncreas fetal, llevando a hipoglicemia neonatal. Niveles maternos de glicemia mayores de 125 mg/dl durante el parto, incrementan el riesgo de hipoglicemia en el recién nacido, la cual puede prolongarse hasta después de las 48 horas de vida. El hiperinsulinismo fetal suprime los niveles plasmáticos de ácidos grasos libres y/o disminuye la producción de glucosa hepática. Otro de los factores relacionados con hipoglicemia neonatal es el defecto en los mecanismos contrarregulatorios dados por las catecolaminas y el glucagón (8,29). El hijo de madre diabética con retardo del crecimiento intrauterino presenta hipoglicemia por disminución del glucógeno hepático más que por hiperinsulinismo (4).
Muchos recién nacidos hijos de madre diabética presentan hipoglicemia neonatal asintomática debido a que todavía tienen reservas cerebrales de glucógeno. Los signos y síntomas son inespecíficos: taquipnea, apnea, diaforesis, tremores, irritabilidad y convulsiones. Si los niveles de glucosa no son tan bajos (menores de 47 mg/dl) no se requiere manejo endovenoso, se debe iniciar aporte oral tan pronto como sea posible y preferiblemente con leche materna. El control estricto de la glicemia durante el embarazo y durante el parto minimiza el riesgo de hipoglicemia neonatal. Según la evolución clínica se inicia manejo endovenoso con dextrosa alcanzando flujo metabólico entre 8 a 11 mg/ kg/min y en caso de requerir flujos más altos se iniciará estudios complementarios y manejo de hipoglicemia neonatal persistente (38). La meta debe ser la prevención de la hipoglicemia neonatal, manteniendo adecuado control glicémico durante la gestación, con el fin de prevenir la hiperplasia de las células del islote pancreático (4,39).
Hipocalcemia e hipomagnesemia
Durante la gestación, las glándulas paratiroides se encuentran inactivas por el alto flujo de calcio proveniente de la madre, la hormona paratiroides y la vitamina D no cruzan la placenta en grandes cantidades. Con el nacimiento, el paso transplacentario de calcio a través de la placenta es interrumpido y se disminuyen los niveles de calcitonina, PTH y de 1,25 hidroxivitamina D con la consecuente disminución del calcio sérico, lo cual ocurre en las primeras 24 a 72 horas de vida.
Aproximadamente el 50% de los hijos de madre diabética insulino dependiente desarrollan hipocalcemia (calcio sérico menor de 7 mg/dl) durante los primeros 3 días de vida. La severidad de la hipocalcemia se correlaciona con el control glicémico de la materna con diabetes mellitus y se hace mayor cuando se asocia a asfixia perinatal. Se postula que una de las razones de la hipocalcemia es la relación bioquímica que se produce con la hiperfosfatemia, que usualmente está presente en las primeras 48 horas de vida (27).
La hipomagnesemia se define como concentración sérica de magnesio menor de 1,5 mg/dl. El 33% de los hijos de madre diabética tipo I presentan hipomagnesemia, la frecuencia y severidad de los síntomas se correlaciona con el estado materno, y es debido a la disminución de la acción paratiroidea o secundaria a hipomagnesemia materna, por diabetes mellitus de larga evolución con compromiso renal y aumento de la excreción de magnesio por orina. Los signos y síntomas de hipocalcemia e hipomagnesemia incluyen: tremores, diaforesis, taquipnea, irritabilidad y convulsiones. La presentación puede ser tardía hasta 24 a 72 horas después del inicio de la hipoglicemia.
Si el recién nacido se encuentra sintomático se inicia manejo con gluconato de calcio al 10% endovenoso, en infusión lenta y con precaución preferiblemente por acceso venoso central. La hipomagnesemia sintomática debe ser manejada con sulfato de magnesio al 5 % 2,5 ml/kg en infusión de una hora bajo monitoreo electrocardiográfico por riesgo de bloqueo, bradicardia refractaria e hipotensión (4,8).
Alteraciones hematológicas
Policitemia se define como hemoglobina mayor de 20 gr/dl y hematocrito mayor de 65%. Esta condición ocasiona hiperbilirubinemia en un 20 a 40% de los hijos de madre diabética. Los síntomas son secundarios a hiperviscosidad, incrementándose el riesgo de convulsiones, enterocolitis necrosante y trombosis venosa renal. Los hallazgos al examen físico son: tremores, convulsiones, taquipnea, priapismo y oliguria. Aún no se ha encontrado relación entre la policitemia y el control glicémico de la madre..
Otros tejidos vasculares también pueden estar comprometidos como el renal, el intestinal y el pulmonar. La trombosis venosa fetal es más común en el hijo de madre diabética presentando un cuadro clínico de hematuria, masa en flanco, trombocitopenia e hipertensión. A nivel intestinal pueden presentar intolerancia a la vía oral y enterocolitis necrosante. En el lecho vascular pulmonar se observa hipertensión pulmonar persistente, comprometiendo aún más el estado clínico del hijo de madre diabética con dificultad respiratoria.
En el hijo de madre diabética debemos medir el hematocrito y el recuento plaquetario en las primeras horas de vida, porque inicialmente disminuyen y al tercer día inicia el aumento; la trombocitopenia en un paciente con policitemia es un indicador de alteración microvascular significativa y de trombosis en cualquier lecho vascular.
El manejo de la policitemia depende del hematocrito y del inicio de síntomas, el paciente con hematocrito entre 65-70%, sin síntomas, puede iniciar manejo de hidratación con aporte de 100 ml/kg/día, y vigilar el hematocrito diario hasta resolución. La exanguinotransfusión parcial está indicada, si el paciente está sintomático, si el hematocrito va en ascenso o todo hematocrito mayor del 70% (4,8).
Deficiencia de hierro
El 65 al 95% de los hijos de madre diabética cursan con anormalidades en el metabolismo del hierro, baja concentración de ferritina y un aumento de la capacidad de unión del hierro, disminución de la saturación de la transferrina y un incremento en la concentración de protoporfirina libre del eritrocito lo cual indica una acelerada eritropoyesis; el grado de la alteración se correlaciona con el control glicémico materno y la hiperglicemia fetal.
La deficiencia de hierro ocasiona un alto riesgo en el neurodesarrollo y el comportamiento de los hijos de madre diabética, afecta la mielinización, el metabolismo energético cerebral y el de los neurotransmisores haciendo más vulnerable al cerebro neonatal al evento hipóxico-isquémico.. El tratamiento con hierro desde el momento del nacimiento, no está justificado, pues al nacer se presentan mecanismos fisiológico-regulatorios de redistribución del hierro (4).
Metabolismo de la bilirrubina
El hijo de madre diabética tiene un riesgo mayor de hiperbilirrubinemia por presentar mayor masa de células rojas, eritropoyesis inefectiva e inmadurez hepática para la conjugación y excreción de la bilirrubina (4).
La gran masa de células rojas provee el 30% de fuente para la producción de bilirrubina, pero existe una deficiente conjugación por inmadurez del sistema enzimático glucuronil-transferasa. Los precursores de células rojas quedan circulantes y son atrapados y removidos por el bazo, lo cual constituye una sobrecarga de bilirrubina a nivel hepático.
Función neurológica
El hijo de madre diabética está expuesto a cambios neurológicos tempranos, dados por asfixia perinatal, alteraciones metabólicas como hipoglicemia, hipocalcemia e hipomagnesemia y lesiones del plexo braquial (13).
Los signos clínicos tempranos de disfunción neurológica se observan en las primeras 24 horas de vida en pacientes con depresión neonatal, y en su mayoría presentan convulsiones, irritabilidad y tremores. Las alteraciones clínicas secundarias a hipoglicemia, hipocalcemia e hipomagnesemia presentan un pico entre las 24 a las 72 horas de vida, donde el tratamiento se debe hacer según las causas de base antes de iniciar manejo anticonvulsivante (4).
Las lesiones de nervios periféricos se asocian a macrosomía, y la causa es por compresión del cuello durante el parto entre las cuales se encuentran: parálisis de Erb (C5-C7), parálisis de Kumpkle (C7-C8), parálisis del nervio diafragmático (C3-C5) y daño del nervio laríngeo recurrente (T1-2) (13,40).
Secuelas a largo plazo en el hijo de madre diabética
Se han realizado estudios de seguimiento de hijos de madre diabética hasta los 7 años de edad, y las secuelas neurológicas dependen de la historia prenatal, perinatal y neonatal, dentro de los hallazgos se encuentran alteración en el desarrollo motor y cognitivo (10,27,41). La glicemia materna y el metabolismo lipídico influyen sobre el desarrollo comportamental en los niños, esto se correlaciona en el segundo y tercer trimestre con el intelecto de los hijos de madre diabética a los 11 años de edad.
Los hijos de madre diabética tienen un mayor riesgo de diabetes tipo 2 y de enfermedad coronaria en la edad adulta, encontrándose un aumento leve de los marcadores inflamatorios en el estado prediabético, en animales de experimentación. Si la madre tiene diabetes mellitus insulino-dependiente, el riesgo de transmisión es del 2%, si el padre tiene diabetes mellitus insulino-dependiente el riesgo es del 6%. La causa de la transmisión es poligénica, uno de los genes más encontrados es el de HLA-DQ en el cromosoma 6, pero se encuentran diversos genes en diferentes poblaciones. Ahora es posible identificar el riesgo desde el nacimiento con marcadores genéticos, los cuales son la base para futuras investigaciones.
Los niveles del perfil lipídico en el segundo y tercer trimestre del embarazo, en la gestante diabética, se correlaciona con el aumento de la presión arterial sistólica en la adolescencia, se desconoce los mecanismos exactos, pero se presume que hay una alteración del metabolismo fetal secundario a la alta concentración de ácidos grasos y de beta-hidroxibutirato en la madre diabética (42,43). En hijo de madre diabética se ha encontrado niveles elevados de LDL y bajos de HDL en sangre del cordón, ocasionando una mayor predisposición a enfermedad coronaria en la vida adulta (44).
La obesidad en la adolescencia de los hijos de madre diabética es de causa multifactorial, como factores intrauterinos, posnatales, genéticos, demográficos y estilo de vida (40,45).
Conclusiones
La revisión de la literatura confirma que los casos de diabetes gestacional siguen en aumento, con cifras alarmantes cada año, resaltando que es mayor el número de diabetes gestacional tipo 2, lo cual quiere decir, que podemos disminuir los casos solo con mejorar nuestros hábitos alimenticios desde la niñez.
A raíz del aumento de casos de diabetes gestacional, se ha estudiado más la diada madre-hijo, con el fin de encontrar el mayor beneficio para los dos y disminuir la morbimortalidad materna y perinatal. Para ello, se han logrado avances en la detección temprana de anomalías congénitas, como el uso de la ecografía 3D y el entrenamiento de los obstetras en medición de parámetros fetales, que sugieran alteración en el bienestar fetal. Además del seguimiento temprano de la gestante diabética, en la consulta de alto riesgo obstétrico, que busca acompañar a la materna y aclararle cuales son los riesgos durante su embarazo.
Con las insulinas de acción rápida asociadas a la NPH se logra mayor control glicémico durante los primeros trimestres como en el periodo preparto, logrando menores complicaciones neonatales como: hipoglicemia neonatal, dificultad respiratoria del recién nacido, macrosomía y malformaciones congénitas.
El reto para médicos, perinatólogos, obstetras, pediatras y neonatólogos dedicados al cuidado de las gestantes y del recién nacido, en unidades de alto riesgo, es lograr el control glicémico desde la concepción, y advertir a la materna todas las complicaciones fetales y neonatales secundarias al incumplimiento en el tratamiento.
Referencias
1. NizardJ, Ville Y. The fetus of a diabetic mother: sonographic evaluation. Seminars in Fetal & Neonatal Medicine. 2009; 14: 101-105. [ Links ]
2. Lapolla A, Dalfra M. Pregnancy complicated by type 2 diabetes: An emerging Problem. Diabetes Reseach and Clinical Practice. 2008; 80: 2-7. [ Links ]
3. Lucas MJ. Medical complications of pregnancy: diabetes complicating pregnancy. ObstetGynecolClin North Am. 2001; 28(3): 513-36. [ Links ]
4. Nold J, Georgieff M. Infants of diabetic mothers. PediatrClin N Am. 2004; 51: 619-637. [ Links ]
5. Adamowicz R, Lak-Olejnik B. Congenital malformation of newborns delivered by diabetic mothers. International Journal of Gynecology & Obstetrics. 2009; 107: S2 S413-S729. [ Links ]
6. Hod M, Merlob P. Prevalence of minor congenital anomalies in newborns of diabetic mothers. European Journal of Obstetrics & Gynecology and Reproductive Biology. 1992; 44 (2): 111-116. [ Links ]
7. Agarwal M.M, Punnose J. Gestational diabetes: problems associated with the oral glucose tolerance test. Diabetes Research and Clinical Practice. 2004; 63: 73-74. [ Links ]
8. Schwartz R, Teramo K. Effects of diabetic pregnancy on the fetus and newborn. Seminars in perinatology. 2000; 24(2): 120-135. [ Links ]
9. Va¨a¨ra¨sma¨ki M, Hartikainen A, Anttila M. Factors predicting peri- and neonatal outcome in diabetic pregnancy. Early Human Development. 2000; 59: 61-70. [ Links ]
10. Rizzo T, Dooley S. Prenatal and perinatal influences on long-term psychomotor development in offspring of diabetic mothers. Am J Obstet Gynecol. 1995; 173: 1753-B. [ Links ]
11. Persson B. Neonatal glucose metabolism in offspring of mothers with varying degrees of hyperglycemia during pregnancy. Seminars in Fetal & Neonatal Medicine. 2009; 14: 106-110. [ Links ]
12. Zhao J, del Bigio M. Maternal arachidonic acid supplementation improves neurodevelopment of offspring from healthy and diabetic rats. Prostaglandins, Leukotrienes and Essential Fatty Acids. 2009; 81: 349-356. [ Links ]
13. Teramo K. Obstetric problems in diabetic pregnancy. The role of fetalhipoxia. Best Practice & Research Clinical Endocrinology & Metabolism. 2010; 24: 663-671. [ Links ]
14. Chitayat L, Jovanovic L. Nesw modalities in the treatment of pregnancies complicated by diabetes: Drugs and devices. Seminars in Fetal & Neonatal Medicine. 2009; 14: 72-76. [ Links ]
15. Mecacci F, Carignani L. Maternal metabolic control and perinatal outcome in women with gestational diabetes treated with regular or lispro insulin: comparison with non-diabetic pregnant women. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2003; 111: 19-24. [ Links ]
16. Aydin Y, Berker D. Is insulin lispro safe in pregnant women: Does it cause any adverse outcomes on infants or mothers? Diabetes Research and Clinical Practice. 2008; 80: 444-448. [ Links ]
17. Eidelman A, Samueloff A. The pathophysiology of the fetus of the diabetic mother. Seminars in perinatology. 2002; 26 (3): 232-236. [ Links ]
18. Aarskog D. Cortisol production rate in newborn infants of diabetic mothers. The Journal of Pediatrics. 1963; 62 (6): 807-814. [ Links ]
19. Tyrala E. The infant of the diabetic mother. Obs and Gynecologyclin of North America. 1996; 23(1): 221-239. [ Links ]
20. Meur S, Mann N. Infant outcomes following diabetic pregnancies. Symposium: Neonatology, 2007 [ Links ]
21. Hare J. Birth defects in infants of diabetic mothers: a historical review. Insulin. 2009; (4): 169-176. [ Links ]
22. Lapolla A, Dalfra M. Can plasma glucose and HbA1c predict fetal growth in mothers with different glucose tolerance levels? Diabetes Research and Clinical Practice. 2007; 77: 465-470. [ Links ]
23. Kinsley B. Achieving better outcomes in pregnancies complicated by type 1 and type 2 diabetes mellitus. Clinical Therapeutics. 2007; 29: 153-160. [ Links ]
24. Sojo L, Garcia-Patterson A. Are birth weight predictors in diabetic pregnancy the same in boys and girls? European Journal of Obstetrics & Gynecology and Reproductive Biology. 2010; 153: 32-37. [ Links ]
25. Abdelgadir M, Elbagir M. Factors affecting perinatal morbidity and mortality in pregnancies complicated by diabetes mellitus in Sudan. Diabetes Research and Clinical Practice. 2003; 60: 41-47. [ Links ]
26. Gross G, Solenberger T. Leptin levels in newborns of diabetic or non-diabetic mothers. Am J Obstet Gynecol. 2007; 176(1): 16. [ Links ]
27. PlagemannA , Harder T. Alterations of hypothalamic catecholamines in the newborn offspring of gestational diabetic mother rats. Developmental Brain Research. 1998; 109: 201-209. [ Links ]
28. Oppenheimer E, Esterly J. Thrombosis in the newborn: Comparison between infants of diabetic and nondiabetic mothers. The Journal of Pediatrics. 1965; 67(4). 594-556. [ Links ]
29. Weintrob N, Kavp M. Short and long range complications in offspring of diabetic mothers. Journal of Diabetes and Its Complications. 1996; 10: 294-301. [ Links ]
30. Nasrat H, Salleh M. Outcome Of Pregnancy Of Diabetic Mothers. International Journal of Ginecology & Obstetrics. 1993; 43(1): 29-34. [ Links ]
31. Sojo L, Garcia-Patterson A. Are birth weight predictors in diabetic pregnancy the same in boys and girls? European Journal of Obstetrics & Gynecology and Reproductive Biology. 2010; 153: 32-37. [ Links ]
32. Mormile R, Vittori G. Is telomerase the final downstream effector of the escape of cardiomyocytes from the point-of-no-return of apoptosis in infants of diabetic mothers? Int J Cardiol. 2011; 378-379. [ Links ]
33. Rizzo G, Arduini D. Cardiac and venous blood flow in fetuses of insulin-dependent diabetic mothers: evidence of abnormal hemodynamics in early gestation. Am J Obstet Gynecol. 1995; 173: 1775-81. [ Links ]
34. Kero P, Jokinen E. Impaired left ventricular diastolic function in newborn infants of mothers with pregestational or gestational diabetes with good glycemic control. Early Human Development. 2004; 77: 13-22. [ Links ]
35. Kero P. Delayed postnatal adaptation of pulmonary hemodinamics in infants of diabetic mothers. J Pediatr. 1997; 131: 545-48. [ Links ]
36. Piazze J. Fetal lung maturity in pregnancies complicated by insulin-dependent and gestational diabetes: a matched cohort study. European Journal of Obstetrics & Gynecology and Reproductive Biology. 1999; 83: 145-150. [ Links ]
37. Schwartz R, Teramo K. Effects of diabetic pregnancy on the fetus and newborn. Seminars in Perinatology. 2000; 24(2): 120-135. [ Links ]
38. Hall R, Gay C. Prediction of neonatal hypoglycemia in infants of diabetic mothers by glucose dissaperence in the first hour of life. Early Human Development. 1983; 8(2): 113-117. [ Links ]
39. Stenninger E, Eriksson E. Monitoring of early postnatal glucose homeostasis and cerebral function in newborn infants of diabetic mothers. A pilot study Early Human Development. 2000; 62: 23-32. [ Links ]
40. Poston L. Maternal obesity, gestational weight gain and diets determinants of offspring long term health. Best Practice & Research Clinical Endocrinology & Metabolism. 2012; 26: 627-639. [ Links ]
41. Cole P, Yogman M. Behavior of diabetic mothers. Infant Behavior and Development. 1982; 5(2-4): 331-340. [ Links ]
42. Cho N, Silverman B. Correlation between intrauterine metabolic environment and blood pressure in adolescent offspring of diabetic mothers. The Journal of pediatrics. 2000; 136 (5): 587-592. [ Links ]
43. Evers IM, Valk HW, Visser GH. Risk of complications of pregnancy in women with type 1 diabetes: nationwide prospective study in the Netherlands. Br Med J. 2004; 328: 915. [ Links ]
44. Fordyce M, Duncan R. Cord blood serum in newborns of diabetic mothers. Journal of Chronic Diseases. 1983; 36(3): 263-268. [ Links ]
45. Catalano P, Thomas A RD. Increased fetal adiposity: A very sensitive marker of abnormal in utero development. Am J ObstetGynecol. 2003; 189:1698-704. [ Links ]
46. Adamowicz R, Lak-Olejnik B. Congenital malformation of newborns delivered by diabetic mothers. International Journal of Gynecology & Obstetrics. 2009; 107: S2 S413-S729. [ Links ]
47. Al Dabbous I, Owa J. Perinatal morbidity and mortality in offspring of diabetic mothers Inqatif , Saudi Arabia. European Journal Of Obstetrics And Gynecology And Reproductive Biology. 1996; 65: 165-169. [ Links ]
48. Fordyce M, Duncan R. Cord blood serum in newborns of diabetic mothers. Journal of Chronic Diseases. 1983; 36(3): 263-268. [ Links ]
49. Chitayat L, Jovanovic L. New modalities in the treatment of pregnancies complicated by diabetes: Drugs and devices. Seminars in Fetal & Neonatal Medicine. 2009; 14 72-76. [ Links ]
50. Wagner RK, Nielsen PE, Gonik B. Controversies in labor management: shoulder dystocia. Obstet Gynecol Clin North Am. 1999; 26(2): 371-83. [ Links ]













