Introducción
Las leishmaniosis son un grupo de enfermedades transmitidas al ser humano por la picadura de flebótomos hembras infectadas con el protozoo Leishmania. El tipo y la gravedad de las lesiones, las especies de Leishmania implicadas y la respuesta al tratamiento son muy variables 1-2. Aproximadamente, el 95% de leishmaniosis cutánea ocurre en las Américas, y Colombia está entre los seis países que más casos nuevos de leishmaniosis cutánea (LC) reporta al año a nivel mundial 1.
El diagnóstico tradicional de LC sigue teniendo el frotis directo, como método estándar de oro, cuyo resultado depende de la experticia del profesional que toma y lee las muestras, aspecto que incide notoriamente en la sensibilidad de este método. Además, hay que tener en cuenta que se deben tomar tres frotis por tres láminas portaobjetos, utilizando una hoja de bisturí 15 raspando de los bordes y el centro de la lesión. También es usado el aspirado que puede ser usado para detección de parásitos en lámina, su ADN o para cultivos, que, como lo señalan algunos autores, es altamente específico, poco sensible y de largo proceso, que requiere tanto personal como infraestructura especializada para tal fin 3-5.
La LC es una de las enfermedades que más disminuye el pie de fuerza de los hombres que conforman el Ejército Nacional de Colombia a consecuencia de su exposición por las operaciones de los uniformados en zonas endémicas, lo cual contribuye al aumento anual de la incidencia de la enfermedad. Por eso, se hace necesario explorar otros métodos para la toma de muestra fáciles, sensibles, no invasivos y que, además, el transporte de muestras desde los sitios de las operaciones militares.
En la literatura, es referenciado el uso de la impronta como método para la toma de muestra (figura 1). Consiste en la impresión de la lesión con sus microlíquidos en papel de filtro para el análisis molecular respectivo. Es un método no invasivo, con parámetros de validación, especificidad y sensibilidad, reportados para PCR del 100% 6. También es un método facilitador del diagnóstico molecular de la LC 7, que evita la necesidad de una cadena de frío para conservar las muestras. Es económico, requiere pequeños volúmenes de muestra y se necesitan conocimientos técnicos mínimos 8.
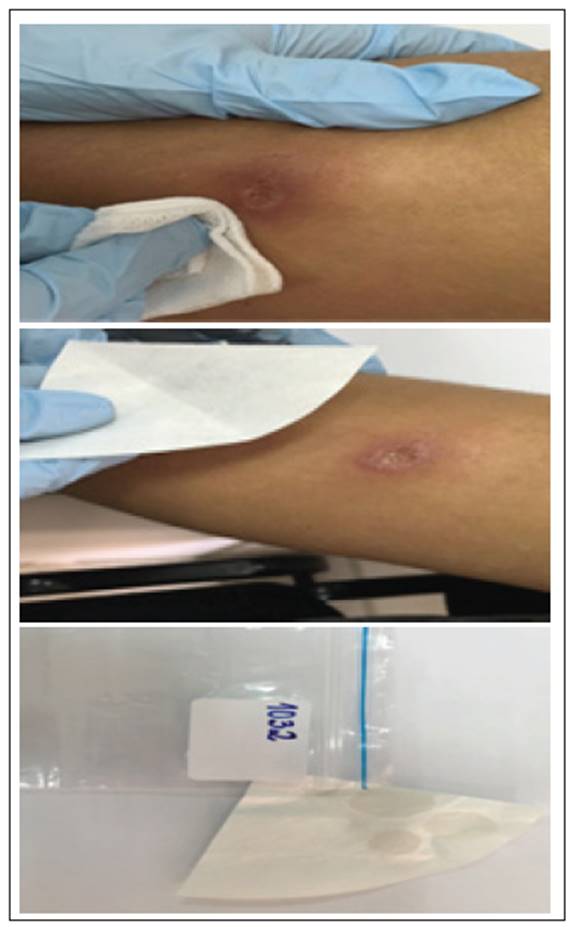
Fuente: Fotografía de los autores.
Figura 1 Protocolo adaptado de Boggild et al. 201015por el LRI DISAN para la toma de impronta de lesión de Leishmania. A. Limpieza y desinfección. B. Eliminación de la costra. C. Toma de la impronta. D. Secado al aire libre para su almacenamiento.
El uso del papel de filtro como método para la toma de muestra y posterior análisis molecular es potencialmente útil para el medio militar teniendo en cuenta los constantes desplazamientos del personal a zonas de alto riesgo, alejadas de los laboratorios con tecnología actualizada para el diagnóstico oportuno de LO.
Su utilización inició en el siglo pasado con las pruebas de sensibilidad a los antimicrobianos 9. Con el tiempo, se han venido utilizando en múltiples aspectos científicos con buenos resultados a través de la experiencia.
Generalmente la sangre es la muestra más común para recoger con papel de filtro, pero también se han hecho estudios con suero para detectar anticuerpos HAV con una sensibilidad y especificidad del 100% en comparación con el suero líquido 10.
También realizaron estudios con plasma y leche materna en comparación con el plasma líquido para el VIH por PCR cuantitativa, encontrando que el papel de filtro es un medio viable para la recogida de almacenamiento y envío de estas muestras y posterior seguimiento, así como una alternativa económica para controlar la carga viral, y que se ajusta a la escasa tecnología que existe en países en desarrollo 11.
El uso de papel de filtro fue evaluado con sangre y plasma midiendo la estabilidad del ARN del VIH con lo cual se concluye que a temperatura ambiente el ARN del virus fue estable durante más de un año 12.
Se han utilizado muestras de medula ósea, esputo, saliva, heces, etc. Casi cualquier muestra clínica puede ser almacenada en papel de filtro para el análisis posterior, y aunque la sangre total es la más conveniente y la más utilizada con papel de filtro, se está prestando cada vez más atención al diagnóstico de enfermedades infecciosas y desatendidas en lugares remotos utilizando microfluidos basados en la utilización del papel de filtro, lo que hace vislumbrar un futuro prometedor 13.
Sin embargo, se hace necesario una estandarización o consenso sobre la terminología y metodología para avanzar en el campo del diagnóstico a través del papel de filtro 14.
Materiales y métodos
Se tomaron 272 pacientes de las diferentes regiones del país acantonados en el centro de leishmaniosis de Bonza, el Batallón de Sanidad y el Fuerte de Tolemaida, entre otros, que tenían frotis positivo, y se seleccionaron bajo los siguientes criterios de inclusión: lesiones características de LC con mínimo 1, máximo 3 meses de evolución, que no estén localizadas en cara o genitales y sin tratamiento en los dos últimos meses.
Se tomaron las muestras de impronta de acuerdo con lo establecido por Boggild (2010), quien explica que después de eliminar la costra con una gasa húmeda con un papel filtro grado PCR se ejerce presión suave sobre la base de la úlcera hasta evidenciar el exudado de la lesión a través del papel filtro, se deja secar y se envía al laboratorio (figura 1).
Las muestras de aspirado fueron tomadas según el método estandarizado en el Laboratorio de Referencia e Investigación de Enfermedades Tropicales (LRI) de la Dirección de Sanidad Ejército (DISAN), seguido de la toma de impronta, en la misma lesión y bajo las mismas condiciones. Se limpia la lesión, se introduce 3 mm aguja de la jeringa (con aguja 30G x 8 mm o de 21G x 38/40 mm) con firmeza de forma tangencial, de modo que solo atraviese la dermis dentro de la lesión, se aspira suavemente con el émbolo de la jeringa y con la presión negativa se hacen movimientos circulares, junto con pequeños movimientos de entrada y salida del émbolo, sin soltar la aspiración, y el material obtenido es enviado al laboratorio.
La extracción de ADN se llevó a cabo a partir de 5-10 minicírculos de la impronta y 200 µL de aspirado mediante kit de extracción ISOLATE II Genomic DNA Kit (Bioline, London, LJK) y se cuantificó el ADN genómico mediante fluorometría, para verificar la viabilidad de la muestra. La amplificación del blanco molecular (120 pb de la región conservada de los minicírculos del cinetoplasto) se realizó utilizando los iniciadores OL1F (5' GGG GAG GGG CGT TCT GCG AA-3') y OL2R (5'CCG CCC CTA TTT TAC ACC AAC CCC-3') (1617), que anillan en los orígenes de replicación de las dos hebras de los minicírculos bajo las siguientes condiciones: 0,055 U/µL de Taq polimerasa Hot-start (Bioline UK), 5X de Buffer Taq polimerasa Hot-start (Bioline UK), 25 mM de MgCl2 (Bioline UK), 10 mM de dnTPs (SIGMA EU), 10 uM de iniciadores (IDT EU) y 5 µL de ADN sin diluir, para un volumen total de 20 µl. El perfil térmico consistió en una denaturación inicial: 94 °C por 4 min, seguido de 30 ciclos de denaturación a 94 °C por 30 s. Anillamiento a 55 °C por 30 s extensión a 72 °C por 30 s y una extensión final: 72 °C por 10 min. Técnica previamente estandarizada en el LRI-DISAN basada en la tesis de grado de Jojoa 18. Y el producto de la amplificación se visualizó mediante una electroforesis en gel de agarosa del 3,0% (figura 2). los resultados estadísticos fueron analizados haciendo uso del programa estadístico SPSS versión 19.
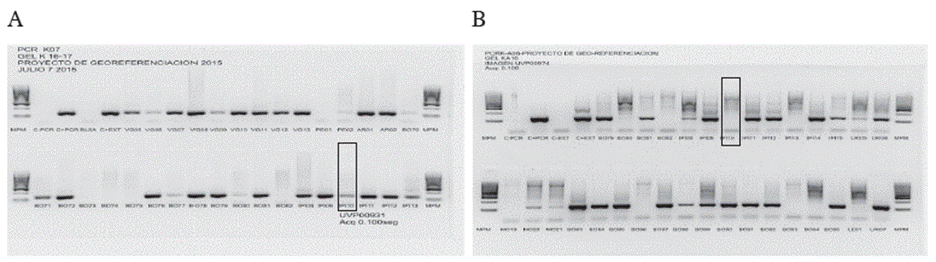
Fuente: Imágenes LRI-DISAN.
Figura 2 Imágenes de geles de agarosa al 3% que evidencia amplificación del blanco molecular CR-impronta (A) y aspirado (B). Los rectángulos corresponden a muestras de impronta y aspirado de un mismo paciente, en los que se evidencia que, mientras el aspirado arrojó un resultado negativo, la impronta permitió detectar ADN del parásito.
Resultados
El 90,07% (245/272) de las improntas arrojaron resultados positivos para la detección de ADN de parásitos de Leishmania; el 9,5% (26/272) de las muestras dieron resultados negativos. Y el 0,36% (1/272) de las improntas arrojaron un resultado no concluyente. Por su parte, el 86,3% (235/272) de los aspirados dieron positivo, y el 12,86% (35/272) dieron negativo para la detección del ADN del parásito y un 0,74% (2/272) resultado no concluyente (figura 3). La sensibilidad de la toma de muestra por impronta y el aspirado presentó valores del 90,07 y del 86,3%, respectivamente.
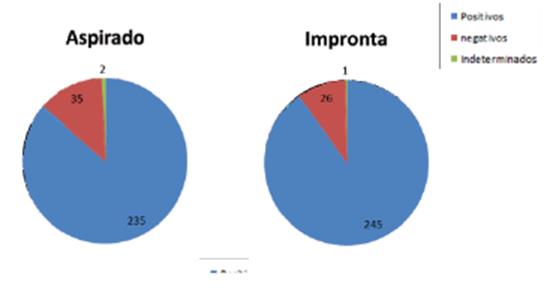
Fuente: Elaboración propia.
Figura 3 Comparación de resultados de la reacción en cadena de la polimerasa según el tipo de toma de muestra. La impronta versus aspirado la amplificación del kdNA a partir de muestras de impronta presentó mejores resultados al determinar el 90,07% de las muestras como positivas.
Discusión
La expansión de las operaciones militares en Colombia a zonas entre las que predominan las selvas tropicales donde se encuentran focos de transmisión aumenta los factores de riesgo de adquirir LC, lo que incrementa la incidencia de la enfermedad en esta población.
Así es que entre 2005 y 2010 ocurrieron más de 45 000 casos de LC en los soldados, como refiere la Organización Mundial de la Salud (OMS) 19. Y entre 2011 y 2015 se evidencia un incremento muy discreto pero constante según los datos obtenidos de bases de datos del Ejército.
Los datos del Instituto Nacional de Salud en Colombia indican que durante la década de 1990 se notificaban en promedio 6500 casos nuevos de leishmaniosis cada año, cifra que aumentó a un poco menos de 20 000 casos notificados en 2005. Durante los años siguientes el promedio de casos fue de 14 400, de los cuales el 98% correspondieron a la forma cutánea. En la última década, la mayor parte de los casos notificados al Sistema de Salud Pública (Sivigila) corresponden al régimen de excepción con un aporte oscilado entre el 50 y el 55% de los casos totales de país 24.
Por consiguiente, se hace necesario establecer métodos para toma de muestra o diagnósticos rápidos, simples, oportunos, eficientes y económicos, con una sensibilidad igual o mayor de los ya conocidos.
El LRI-DISAN pudo comprobar mediante los resultados de sensibilidad de la PCR con dos tomas de muestra diferente, impronta y aspirado, las ventajas del método de impronta descritas por Boggild et al. 6,15 que promete ser un método de fácil uso para toma de muestra en zonas apartadas, selváticas o endémicas, que finalmente se traduce en un diagnóstico rápido para un tratamiento eficaz y oportuno. De esta manera, se confirma lo referido por otros estudios de recoger y conservar en papel de filtro las muestras de LC para diagnóstico, afirmando que este método es conveniente para ser usado en condiciones de campo en países en desarrollo 20.
En 2014, Fadime y colaboradores realizaron estudios comparativos de la sensibilidad de los diferentes métodos de muestreo para diagnosticar LC mediante PCR convencional, que mostraron resultados para el frotis, el aspirado y la impronta del 60,6, el 49 y el 54,8%, respectivamente 21. En otros estudios, se han reportado sensibilidades para el cultivo del 62,8% y frotis del 74,4% 22, y con impronta para las úlceras infectadas secundariamente, la sensibilidad y especificidad fue del 100% 6.
Comparando estos valores con los obtenidos en el presente estudio, el 90,07% fueron positivos para impronta y el 86,3 % para aspirado, lo que muestra una mayor sensibilidad de la impronta con respecto al aspirado, que, aunque no es una diferencia muy marcada, el resultado sí concuerda con lo descrito en la literatura científica 21. Por lo que vale la pena optimizar el método probando una técnica de extracción más eficiente y un método de almacenamiento de los microcírculos de impronta que permitan aumentar la sensibilidad del método. No fue posible establecer la especificidad en este estudio porque se partió de la certeza de que el 100% de los pacientes participantes tenían un frotis positivo.
Las muestras negativas no fueron procesadas por ningún otro método, debido a que este estudio no influyó en el manejo o tratamiento de los pacientes, quienes debían cumplir con el criterio de inclusión de tener resultado positivo por frotis directo, y su resultado solo fue utilizado para los cálculos de sensibilidad respectivos.
Otra ventaja prometedora es en los casos en que las lesiones de LC pueden ser confundidas con otra clase de lesión dermatológica, en que se hace necesario realizar diagnósticos diferenciales, casos en que la impronta puede ser una toma de muestra, no invasiva, que se utilice con varios métodos diagnósticos y así se facilite la resolución favorable de la enfermedad.
El método de toma de muestra por impronta resultó ser efectivo para el diagnóstico de LC y es beneficioso para el Ejército Nacional, porque permite la toma de muestra en cualquier sitio de la geografía colombiana donde se encuentre el afectado y su conservación no exige mayores cuidados para su posterior procesamiento. Lo anterior influye directamente en los gastos de traslado e incapacidad del personal, oportunidad en el diagnóstico y pérdida del pie de fuerza, relacionados con el manejo actual de los pacientes, aclarando que esto no influye con la calidad y con el excelente Programa de Leishmaniasis con que se cuenta en el Ejército. Por tanto, la toma de muestra por impronta es una oportunidad de mejora en el diagnóstico, debido a que puede ser tomada por cualquier personal de salud sin un vasto conocimiento científico, posibilita el diagnóstico de leishmaniasis de forma oportuna para el suministro del tratamiento inmediato y de esta forma evitar posteriores complicaciones de la enfermedad. Por ende, amerita el ensayo del protocolo en tiempo real desde las diferentes zonas de operaciones del país.














