Introducción
El fenómeno de la glicosilación hace parte de los mecanismos de maduración postraduccionales de las proteínas, una secuencia metabólica donde participan gran variedad de agentes enzimáticos estratégicamente localizados en el lumen de retículo endoplásmico y complejo de Golgi, paso obligado de estas macromoléculas en los procesos de migración vesicular 1,2.
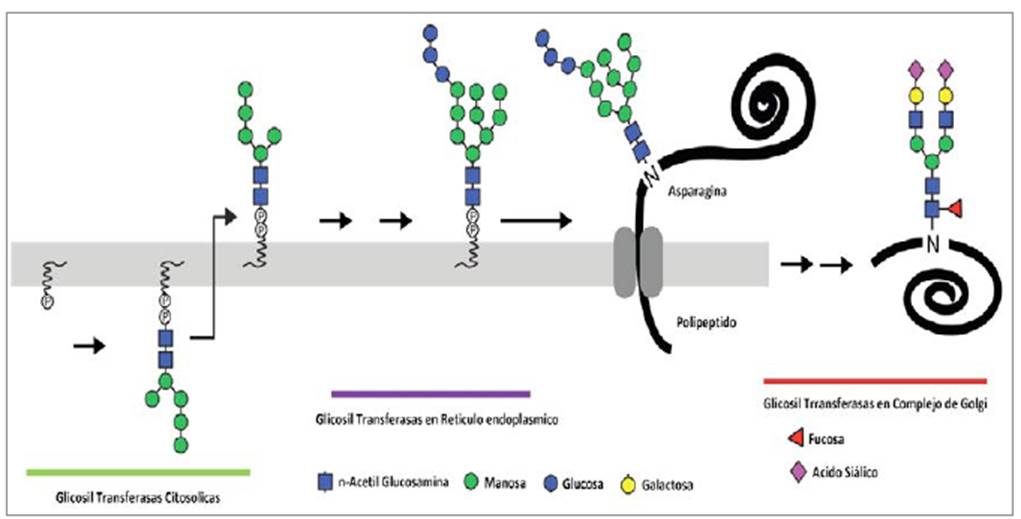
Cerca de 500 genes están relacionados con los procesos de glicosilación y aproximadamente el 50 % de nuestras proteínas se encuentran glicosiladas 3-5. Los azúcares unidos covalentemente a las proteínas son importantes para el control de calidad, la estructura, el plegamiento y la vida media, y hacen parte del sitio activo de estas o actúan como reguladores en la interacción glicoproteína ligando 4-6. Los azúcares son unidos mediante dos mecanismos: la O-glicosilación, que ocurre cuando los glicanos forman enlaces covalentes con el grupo hidroxilo de los residuos de serina, treonina o hidroxilisina de las proteínas, y la N-glicosilación, que se da por la unión covalente de los glicanos a la proteína a través del átomo de nitrógeno del amino de la asparagina que presenta como sitio de glicosilación. El proceso de glicosilación se produce en varias etapas: síntesis de dolicol, síntesis del oligo-sacárido central o núcleo unido al dolicol, transferencia del oligosacárido estándar a la asparagina de la proteína naciente y procesamiento de la cadena N-glicano. Las dos primeras etapas se dan en el citosol y la última se realiza en el lumen del retículo endoplasmático y las cisternas del aparato de Golgi (ver figura 1) 2,6,7. Los glucoconjugados son importantes en el metabolismo de proteínas, ya que cumplen funciones de reconocimiento, adhesión, migración celular, resistencia a las proteasas, mecanismos de defensa y antigenicidad; de ahí que la deficiencia de enzimas implicadas en la síntesis de estos compuestos causen diversas enfermedades multisistémicas agrupadas en los defectos congénitos de glicosilación (CDG) 8,9.
Fuente: elaboración propia, a partir de 10
Figura 1 Mecanismo de N-glicosilación. Proceso general y monosacáridos implicados.
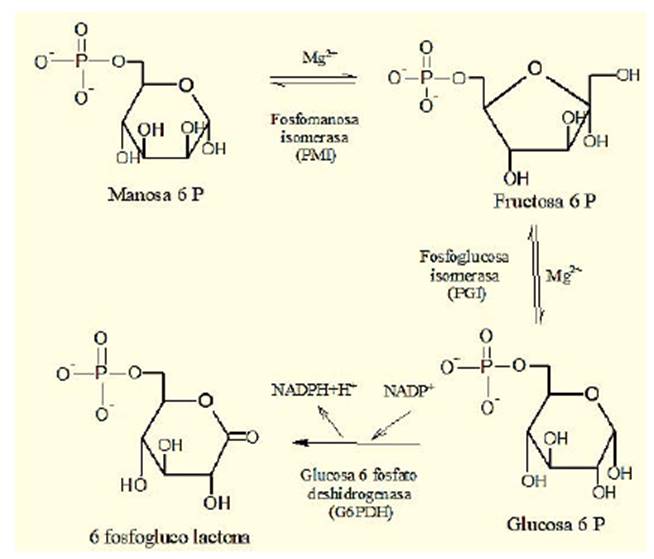
Dentro de la secuencia catalítica descrita anteriormente y como protagonista de los defectos de la glicosilación, se encuentra incluida la enzima citosólica fosfomanosa isomerasa humana (E. C. 5. 3. 1. 8), que cataliza la interconversión de fructosa-6-fosfato a manosa-6-fosfato, codificada por el gen MPi, que se localiza en el cromosoma 15 (q21.1) y transcribe una proteína de 440 aminoácidos con un único sitio activo que liga como cofactor un ion Zn2+ 11,12. Se han descrito 18 mutaciones (OMIM # 602579) en el gen que afectan la actividad catalítica de la enzima y están relacionadas con cambios puntuales de aminoácidos o aparición de codones de parada prematuros; también, se han descrito deleciones e inserciones que alteran factores de transcripción relacionados con este gen 13-17. La deficiencia de la fosfomanosa isomerasa (PMI) se conoce como desorden de glicosilación tipo Ib (CDG-Ib), que es heredado de forma autosómica recesiva y se caracteriza por complicaciones clínicas en el hígado y el intestino, principalmente 18. Los primeros síntomas se manifiestan a los tres meses de vida, los niños presentan diarrea y vómito, con frecuencia acompañados de hepatomegalia debida a fibrosis hepática 19. En algunos casos se observa hipoalbuminemia, que en ocasiones conduce a un retraso en la curva ponderal de crecimiento 8. Los pacientes pueden cursar con hipoglucemia por hiperinsulinismo, coagulopatías (hemiplejía, accidente cerebral, trombo cardíaco y flebitis) por niveles anormalmente bajos de los factores de coagulación y anticoagulación. A nivel intestinal, se presenta enteropatía con perdida proteica, atrofia de vellosidad yeyunal y cólica como enteropatía exudativa 8,9,17,20.
El diagnóstico en la primera infancia es ideal, porque la deficiencia de fosfomanosa isomerasa es el único de los defectos de glicosilación con un tratamiento eficaz, que consiste en la administración de manosa oral; este producto es deficiente en la reacción catalizada por esta enzima 21. La manosa exógena suplementada es fosforilada a manosa-6-fosfato por medio de una hexocinasa a expensas de ATP, contrarrestando el defecto enzimático y normalizando la concentración de este compuesto que es uno de los sustratos principales en la N-glicosilación de proteínas 9,22. Es importante mencionar que se ha demostrado que la terapia con manosa mejora la condición general de los síntomas digestivos reportados en todos los pacientes 18,23-25. La hipoglucemia y el vómito se estabilizan en pocas semanas, el estado general de los pacientes mejora rápido y la diarrea se normaliza después del primer año de tratamiento; sin embargo, en algunos casos, la hepatomegalia puede persistir 14,24. También se ha sugerido que en caso de presentarse compromiso de enteropatía con pérdida proteica los pacientes pueden ser tratados con heparina (7500 Ul/día) 26.
En Colombia, no se han realizado estudios enzimáticos para la identificación de pacientes con CDG Ib y en la actualidad no existen reportes de este desorden por parte del Ministerio de Salud y Protección Social. Por lo cual el propósito de este estudio fue desarrollar un método microespectrofotométrico para su diagnóstico.
Metodología
Las enzimas, los inhibidores de proteasas y los reactivos fueron obtenidos de SIGMA: PGI (P9544), G6PDH (G6378), leupeptina (L2884), antipaína (Sigma-10791), manosa-6-fosfato (M3655), HEPES (Sigma-H3375), DTT (10197777001), MgCl2 (M8266) y NADP+ (N0505); el KCl fue provisto por MERK (4936).
Para este estudio fueron analizadas 32 muestras de sangre completa en estado preprandial, 22 de niños (9 de género femenino y 11 masculino) y 10 de adultos (5 de género femenino y 5 masculino), con edades de 0,6 a 27 años. Las muestras fueron fenotípicamente normales y donadas mediante consentimiento informado.
Para el ensayo enzimático se recolectaron 5 ml de sangre venosa en tubos heparinizados. La separación leucocitaria se realizó por el método modificado de Shapira et al.27 y los extractos celulares fueron almacenados a -20° C en 600 µL de agua ultrapura hasta su uso. Los leucocitos aislados fueron llevados a lisis bajo baño de hielo en un sonicador ultrasonic Cell Disrruption W-220 y congelados a -20° C hasta su uso. Se cuantificó el contenido de proteínas totales por el método de Folin-Lowry, modificado por Ayala 28, utilizando una curva de calibración de albúmina sérica bovina (BSA) con valores de 25-200 mg/dL. La concentración de proteínas en los lisados fue ajustada a una conentración final de 40 µg/50 µL con buffer de lisis, el cual contenía 20 mM HEPES pH 7,1, 25 mM KCl, 1 mM DTT, 10 µg/mL leupeptina y 10 µg/mL antipaína.
Estandarización de la actividad enzimática de la fosfomanosa isomerasa
Las 32 muestras fueron valoradas por triplicado en el equipo Varios Kan Flash, que fue programado por medio del software SkanIt 2.4.5, con el cual realizó un método cinético y fotométrico de manera simultánea. Para la determinación de la actividad específica las enzimas auxiliares (PGI y G6PDH) fueron disueltas y cuantificadas por el método de ácido bicinconínico (BOA). Para la medición de la actividad enzimática se modificó el método de de Van Schaftingen y Jaeken (29) de la siguiente manera: se llevaron a cabo dos ensayos en los que se probaron dos concentraciones de enzimas auxiliares y de sustrato. Para la medición de la velocidad del ensayo 1 y 2 se adicionó mediante inyector a cada pozo 50 µL del lisado ajustado a 40 µg de proteína en un volumen final de 300 µL; para el ensayo 1 se agregaron 200 µL de buffer de reacción que contenía 100 mM HEPES pH 7,1, 12 mM MgCl2, 0,72 mM de NADP+, 0,72 U de PGI y 0,72 U de g6pdh; para el ensayo 2 se adicionaron los mismos componentes a las mismas concentraciones, excepto para las enzimas auxiliares (PGI y G6PDH) en las que se utilizó 1,2 U. La mezcla de reacción se mantuvo con hielo durante la dispensación y agitada a 300 rpm por 5 segundos. La reacción fue iniciada para el ensayo 1 y 2 por la adición de 50 µL de manosa-6-fosfato 6 mM y 36 mM, respectivamente. Para el blanco de reactivos se adicionaron todos los componentes excepto el sustrato, que fue reemplazado por 50 µL de buffer de lisis. La reacción se dejó estabilizar por siete minutos antes de iniciar la lectura. Las muestras se incubaron a 37° C y la actividad fue leída a 340 nm, y así se determinó el aumento de la concentración de NADPH+H+ por cada minuto durante dos horas. Adicionalmente, se corrió una curva de calibración de NADPH+H+ con concentraciones de 0,075 mM. 0,15 mM y 0,3 mM.
Ensayo de actividad enzimática contra el tiempo
Para determinar el tiempo óptimo de lectura de la reacción de actividad enzimática se procesaron tres secuencias de análisis a partir de un lisado de leucocitos (varón, edad: 5 años) haciendo un registro espectral de 10 horas, bajo las condiciones del ensayo 2.
Ensayo de estabilidad del buffer de reacción
Se determinó la estabilidad de las enzimas dentro del buffer de reacción (sin NADP+) mediante dos ensayos de actividad enzimática; el primer día de preparada la mezcla de reacción y 58 días después, el NADP+ fue adicionado a la mezcla de reacción antes de iniciar el ensayo. Se tomaron las mismas concentraciones de proteína, buffer de reacción (enzimas auxiliares y cofactores) y de sustrato descrito en el ensayo 2. Para esto se analizaron cinco muestras por triplicado tomadas al azar (3 niñas con edades 2,1, 13,4 y 9,5 años, un niño de 0,6 años y una mujer de 27 años).
Cuantificación de la actividad enzimática de la fosfomanosa isomerasa
La actividad enzimática específica de la enzima fue calculada en nmol/h. mg de proteína y nmol/min. mg de proteína, mediante una reacción acoplada en la cual el sustrato manosa-6-P en presencia de fosfomanosa isomerasa y el ión Mg2+ es transformado a fructosa-6-P, que a su vez se isomeriza mediante la acción catalítica de la fosfoglucosa isomerasa en presencia de Mg2+ a glucosa-6-P; esta, al mismo tiempo, por la acción de la glucosa 6 fosfato deshidrogenasa y la coenzima NADP+, produce 6-fosfogluco- lactona más NADPH+H+ (figura 2).
Análisis estadístico de la actividad enzimática de la fosfomanosa isomerasa
Para validar los resultados de actividad se utilizó el programa XLSTAT de Microsoft Excel, se hizo un análisis estadístico descriptivo en el que se estimó el coeficiente de variación, la desviación estándar, media, mediana, entre otros. Además, se determinaron los valores atípicos por medio de la prueba de Dixon, teniendo como criterio de significancia 1 SD. Se llevaron a cabo pruebas de distribución normal con el test de Kolmogorov-Smirnov por género y edad, considerando que no es significante cuando el p-valor es > α 0,05. Para determinar si la actividad enzimática estaba influenciada por la edad, el grupo control fue clasificado en tres grupos 0-4, 5-12 y 13-27 años, y se utilizó una prueba de Anova como test de normalidad, el Test de Breush-Pagan (heterocedasticidad) y de Durbin (independencia). Finalmente, se estableció un intervalo de actividad enzimática por medio del Test t de Student y se determinó el valor de referencia por medio de los fractiles 0,025 y 0,975, bajo un intervalo de confianza del 95 %.
Resultados
En los lisados de leucocitos se obtuvieron valores de proteínas en un rango de 89,7-342,8 mg/dl para las muestras n.° 28 y 13 de género femenino y masculino que tenían 22 y 8,2 años, respectivamente, al ser interpoladas en una curva de calibración de BSA que presentó una absortividad de 0,0041 L/ mg.cm y valores de coeficiente de correlación de 0,9916 e intercepto de 0,0429.
Ensayo de actividad enzimática de la fosfomanosa isomerasa frente a dos concentraciones de sustrato y enzimas
Al comparar por triplicado la actividad enzimática de cinco muestras utilizando una concentración final de sustrato de 0,6 mM (man-6-P) con 0,6 U de las enzimas auxiliares con respecto a la actividad enzimática de estas mismas muestras y empleando una concentración final de sustrato 6 mM y de enzimas auxiliares de 1 U, se encontró para este último un aumento en la actividad enzimática específica del 43 al 68 %, bajo estas últimas condiciones (tabla 1).
Tabla 1 Comparación de la actividad enzimática (AEz) de la fosfomanosa isomerasa empleando dos concentraciones de PGI, G6PDH y del sustrato M6P
| Ensayo 1: 0,6 U PGI y G6PDH; 0,6 mM Man-6-P | Ensayo 2 : 1 U PGI y G6PDH; 6 mM Man-6-P | * | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N.°muestra | Edad (años) | G | Ab | nmol/h. mg p. | nmol/min. mgp. | Ab | nmol/h.mg p. | nmol/min.mg p. | % AEz específica | |
| 3 | 12,3 | M | 0,054 | 190 | 3 | 0,171 | 600 | 10 | 68 | |
| 4 | 11,8 | F | 0,232 | 813 | 14 | 0,446 | 1565 | 26 | 48 | |
| 5 | 2,1 | F | 0,344 | 1207 | 20 | 0,827 | 2901 | 48 | 58 | |
| 6 | 0,6 | M | 0,308 | 1081 | 18 | 0,689 | 2416 | 40 | 55 | |
| 9 | 2,6 | M | 0,214 | 752 | 13 | 0,377 | 1323 | 22 | 43 | |
* Porcentaje de aumento de la actividad enzimática entre los ensayos.
Fuente: elaboración propia.
Por lo anterior, el protocolo para la medición de la actividad enzimática en nuestro estudio consistió en 50 µL del lisado ajustado previamente a 40 µg de proteína con buffer de lisis, 200 µL de buffer de reacción que contenía 100 mM HEPES pH 7,1, 11,9 mM MgCl2, 0,72 mM de NADP+, y 1,2 U de las enzimas auxiliares fosfoglucoisomerasa (PGI), glucosa 6 fosfato deshidrogenasa (G6PDH) y 50 µL de manosa-6-P 36 mM. Para este ensayo la actividad enzimática de la PMI mediante la reacción de acople (figura 2) presentó un rango de absorbancias de 0,135-0,868, una vez corregida la muestra contra su respectivo blanco, lo cual permitió calcular la actividad enzimática específica de la enzima en nmol/h. mg de proteína.
Curva de calibración de NADPH+H+
La curva de calibración de NADPH+H+ corregida por mínimos cuadrados obtuvo un coeficiente de extinción de 6,413 L/mmol.cm para esta coenzima, con un valor de intercepto de 0,0006 y una correlación de 0,999.
Ensayo de actividad enzimática contra el tiempo
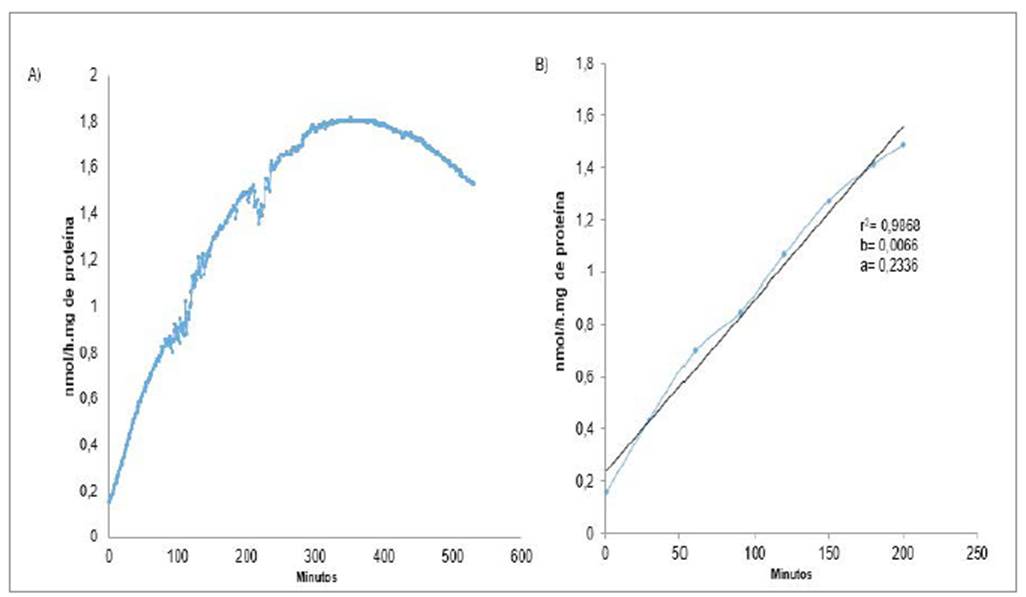
El seguimiento de la actividad enzimática durante diez horas (ensayos n=3) permitió determinar que la aparición del producto es lineal hasta 3,3 horas (r2= 0,9868) (figura 3B). Lo anterior sugiere que se pueden realizar lecturas en este intervalo, teniendo en cuenta que los valores de absorbancia se hallaron por arriba de 0,135 una vez corregida la muestra con su respectivo blanco. Por lo tanto, todas las muestras en nuestro ensayo fueron leídas a las dos horas. Se presentaron pequeñas variaciones de actividad a los 89 minutos y 234 minutos (figura 3A).
Ensayo de estabilidad del buffer de reacción
El ensayo de estabilidad de las enzimas auxiliares en el buffer de reacción (conteniendo las enzimas PGI y G6PDH, MgCl2 en HEPES 100 mM pH 7,1) mostró que solo había una disminución entre el 11 y el 27 % en la actividad enzimática específica después de transcurridos 58 días en las cinco muestras analizadas (tabla 2).
Tabla 2 Estabilidad del buffer de reacción
| Ensayo de actividad enzimática | |||||
|---|---|---|---|---|---|
| Ensayo día 1 | Ensayo día 58 | * | |||
| No | nmol/h. mg prot. | nmol/min. mg prot. | nmol/h. mg prot. | nmol/min. Mg prot. | % actividad enzimática específica |
| 5 | 2901 | 48 | 2343 | 39 | 19 |
| 6 | 2416 | 40 | 1790 | 30 | 26 |
| 8 | 553 | 9 | 452 | 8 | 18 |
| 18 | 551 | 9 | 492 | 8 | 11 |
| 25 | 567 | 9 | 415 | 7 | 27 |
* Porcentaje de disminución de la actividad enzimática entre los ensayos.
Fuente: elaboración propia.
Análisis estadístico de la actividad enzimática específica encontrada para fosfomanosa isomerasa
Se determinaron tres valores atípicos, con actividades enzimáticas específicas de 2901, 2799 y 3045 nmol/h.mg de proteína, que pertenecían a dos controles de género femenino y uno de género masculino, con edades de 2,1 años, 20 años y 5 años, respectivamente (figura 4).
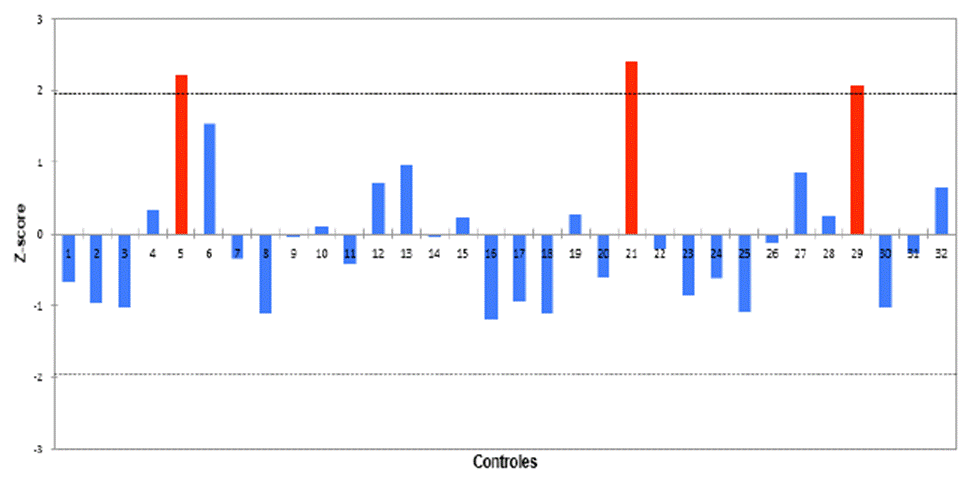
Nota: para establecer los valores que se encontraban fuera del rango del límite superior e inferior de actividad enzimática se utilizó el test de Dixon (barras de color rojo). Fuente: elaboración propia.
Figura 4 Distribución de valores de actividad enzimática y valores atípicos.
Se observó una distribución normal para la población de controles, que se analizó al obtener un p-valor 0,649 bajo un nivel de significancia a 0,05, y un p-valor de 0.699 determinado por la densidad de kernel por medio de la prueba de Kolmogorov-Smirnov (tabla 3). La distribución de los datos de actividad enzimática permitió calcular una actividad media 1330 nmol/h. mg de proteína con una SD de ± 714,5 nmol/h.mg de proteína y un coeficiente de variación de 0,53 (tabla 3).
Tabla 3 Análisis estadístico: muestra de controles sanos estudiados
| Análisis descriptivo | nmol/h. mg de proteína | |
|---|---|---|
| Media | 1330,26 | |
| Error típico | 126,30 | |
| Mediana | 1219,70 | |
| Desviación estándar | 714,44 | |
| Varianza de la muestra | 510420,16 | |
| Coeficiente de variación | 0,53 | |
| Curtosis | 0,30 | |
| Coeficiente de asimetría | 0,96 | |
| Mínimo | 473,31 | |
| Máximo | 3044,81 | |
| Análisis de normalidad | ||
| Test de normalidad | α | P-valor |
| Kolmogorov-Smirnov | 0,05 | 0,699 |
Fuente: elaboración propia.
El análisis estadístico y descriptivo de cajas para la muestra estudiada (n=32) determinó que el 25 % de los valores de actividad enzimática es ≥ 710 nmol/ h. mg de proteína y el 75 % de las muestras presentó valores de actividad ≤ 1618 nmol/h. mg de proteína. Asimismo, se halló una media de actividad enzimática de 1330 nmol/h. mg de proteína, y se encontraron dos valores atípicos de actividad enzimática de 3045 y 473 nmol/h. mg de proteína, que correspondían a controles de género masculino con edades de 2,3 y 5,3 años (figura 5A).
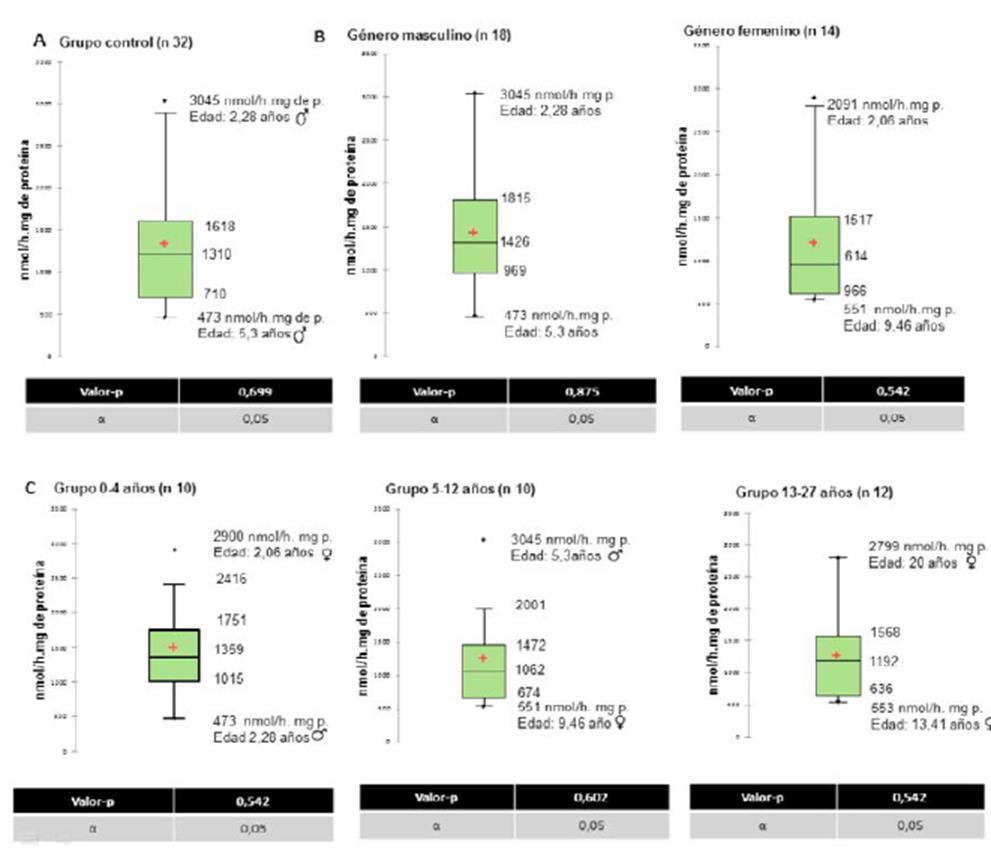
Fuente: elaboración propia.
Figura 5 Análisis por diagrama de cajas: a. controles analizados (total); b. grupo control por género, c. grupo control clasificado en tres rangos de edad (0-4, 5-12, 13-27 años).
Se observó al comparar el subgrupo de género masculino (n= 18) con respecto al femenino (n= 14) una mayor actividad enzimática específica en relación con la media calculada 1426 y 1206 nmol/h. mg de proteína, respectivamente. Además, se observaron dos valores atípicos de actividad enzimática para el género masculino 473, 3044 nmol/h. mg de proteína que correspondían cada uno a dos muestras de 2,3 y 5,3 años de edad. Para el género femenino se hallaron dos valores aberrantes en la actividad enzimática, 551 y 2901 nmol/h. mg de proteína, que correspondían a muestras de 2,1 y 9,5 años, respectivamente (figura 5B).
En los tres grupos analizados por edad se encontraron valores atípicos por medio del análisis de cajas y una actividad media de 1499 (0-4 años), 1246 (5-12 años) 1259 nmol/h. mg proteína (13-27 años) (figura 5C).
Análisis estadístico de controles por género y edad
Se encontró que la actividad enzimática no está influenciada por el género, porque se presentó una distribución normal con relación a la media de actividad para ambos grupos, al aplicar las pruebas estadísticas de Kolmogorov-Smirnov y el test bilateral. De igual forma el análisis de varianza entre los géneros mediante la prueba F de Fisher determinó que la actividad enzimática de la PMI no se encuentra influenciada por este (tabla 4).
Tabla 4 Análisis estadístico por edad y género para la PMI
| Género | Edad | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Femenino (n 14) | Masculino (n 18) | 0-4 años (n 10) | 5-12 años (n 10) | 13-27 años (n 12) | |||||||
| Test de normalidad | α | p-valor | α | p-valor | α | p-valor | α | p-valor | α | p-valor | |
| Kolmogorov- Smirnov | 0,05 | 0,542 | 0,05 | 0,875 | 0,05 | 0,817 | 0,05 | 0,602 | 0,05 | 0,908 | |
| Actividad Media (nmol/h.mg de proteína) | 1206,21 | 1426,66 | 1498 | 1247 | 1259 | ||||||
Fuente: elaboración propia.
Las actividades enzimáticas de los diferentes grupos de edad mostraron una distribución normal, y entre estos se observó, mediante análisis Anova, que no hay diferencias significativas (tabla 4).
Finalmente, lo anterior se corroboró mediante tres análisis estadísticos que demostraron que la actividad enzimática no estaba afectada por la edad: Durbin-Watson halló un p-valor < 0,001, White determinó un p-valor de 0,558 y Breusch-Pagan encontró un p-valor 0,332, todos bajo un nivel de significancia a 0,05.
Discusión
Estandarización del método para la determinación de la actividad enzimática
Los resultados de actividad enzimática en las muestras 3, 4, 5, 6 y 9, analizadas con las condiciones del ensayo 2, establecieron un mayor rango de absorbancia de 0,171-0,827, con lo que se obtuvo un intervalo de 600-2901 nmol/h. mg de proteína, en comparación con el ensayo 1 (al emplear como concentración final de sustrato 0,6 mM y de enzimas auxiliares 0,6 U), en este último se consiguió un menor rango de absorbancia (0,054-0,344), una vez corregidas las muestras contra su respectivo blanco; por lo tanto, se hallaron valores inferiores de producción de la coenzima NADPH+H+ y de actividad enzimática: 190-1207 nmol/h. mg de proteína. El aumento de actividad enzimática específica del 43 al 68 % en las cinco muestras analizadas al azar bajo las condiciones del ensayo 2 permitió establecer que la concentración del sustrato para la determinación de la actividad enzimática debería realizarse a una concentración final 6 mM, es decir, bajo condiciones saturantes (10 X) y con un aumento de la concentración de las enzimas auxiliares PGI y G6PDH a 1 U de concentración final, respectivamente. Estos resultados concuerdan con Bisswanager 30, el cual ha descrito que la velocidad de una enzima es directamente proporcional al grado de saturación y que cuando se emplea 10 veces la concentración del sustrato con respecto al Km se encuentra un 9 % de sitios libres y 91 % de saturación; también menciona que la reacción puede ser regulada en su velocidad al aumentar la concentración de las enzimas. Esto se observó al obtener un incremento en la aparición de NADPH+H+ que se reflejó en mayores valores de absorbancia para las muestras analizadas (rango de absorbancia 0,135-0,868 para las 32 muestras). Por lo anterior, el método microespectrofométrico se trabajó en condiciones saturantes de sustrato, ya que no se vio ningún tipo de inhibición por este para la enzima PMI.
Curva de calibración de NADPH+H+
La pequeña diferencia del coeficiente de extinción del NADPH+H+ para nuestro ensayo (6,41 L/mmol. cm) con relación al valor reportado 6,22 L/nmol. cm se explica gracias a que nuestro estándar fue disuelto en buffer HEPES 100 mM pH 7,1 y no en Tris-HCl 0,1 M pH 7,3-8,0 31.
Ensayo de actividad enzimática contra el tiempo
Los resultados observados en las curvas de progreso de formación del producto contra el tiempo están relacionados con el comportamiento enzimático descrito por diferentes autores hablan de una región lineal y una no lineal, y que el tiempo óptimo de lectura abarca una franja de 3 horas 20 minutos.
Siguiendo entonces las condiciones experimentales descritas, se dejaron como punto de lectura estándar 120 minutos (2 horas), tiempo que describe la fracción lineal de la pendiente de progreso, recomendada para producir una señal directa en la conversión de sustrato a producto. Gracias a esto se obtuvieron valores de absorbancia (≥ 0.135) en la determinación de la velocidad de la PMI que garantizan un menor porcentaje de error en la determinación de la actividad enzimática. Ligeras desviaciones de absorbancia pueden registrarse (minuto 89 y 234) por alteraciones de voltaje que ofrecen inestabilidad espectrofotométrica.
Después de los 300 min se observó una velocidad asintótica, que puede ser explicada por la saturación de los centros activos de la enzima con el sustrato; también se halló una disminución en la actividad después del minuto 400. Este comportamiento se puede presentar por influencias desestabilizantes en la estructura de la proteína, que pueden ser por causa de un decrecimiento del sustrato, disminución de la coenzima en su estado oxidado, inhibición de la actividad de la enzima o por cambios drásticos del pH generado por la producción de NADPH+H+; esta última puede afectar la estructura terciaría de la enzima de una forma irreversible.
Otro factor que posiblemente afecta la actividad enzimática es el tipo de buffer; sin embargo, en el experimento la temperatura utilizada fue constante (37°C) y como sistema amortiguador se usó HEPES, que tiene una capacidad débil para complejar iones. Con lo anterior se logró que estos en la mezcla de reacción enzimática (MgCl2) estuvieran a disposición como cofactor para la glucosa 6 fosfato deshidrogenasa y para la fosfomanosa isomerasa, aunque la última usa Zn++ como cofactor 30
Ensayo de estabilidad del buffer de reacción
La causa de la disminución de la actividad enzimática después de los 58 días (tabla 3) se explica por procesos de óxido-reducción, que produce desestabilización de la estructura terciaría por cambios de pH de la PGI y G6PDH 30). No obstante, las enzimas mostraron un alto grado de estabilidad en comparación con otros estudios, los cuales sugieren que la PMI disminuye drásticamente su actividad y que los ensayos se deben realizar de forma inmediata, una vez resuspendidas las enzimas PGI y g6pdh en agua. La preservación de un 73 % de actividad podría explicarse gracias a que estas no fueron solubilizadas en agua, sino en buffer HEPES 100 mM pH 7,1 lo que permitió conservar su actividad por un tiempo más prolongado.
Análisis estadístico de la actividad enzimática específica de la fosfomanosa isomerasa en la muestra de controles estudiada
Las medidas de dispersión aplicadas a la población estudiada (SD y varianza) ofrecen una marcada desviación del valor medio de actividad enzimática encontrada. Esta es una circunstancia habitual en pequeños muestreos que no abarcan todos los grupos etarios, hallazgo que muestra una franca corrección a medida que se incluyan nuevos controles de la población en estudio.
Otro hallazgo relevante a esta primera aproximación a los valores de referencia para la fosfomanosa isomerasa se relaciona con los valores atípicos encontrados en términos de sobreexpresión de actividad, un fenómeno que puede ser explicado, primero, por los polimorfismos hallados en los genes de la enzima que pueden causar este comportamiento y, segundo, por al uso de sustratos artificiales, como se ha descrito anteriormente para la enfermedad de Niemann Pick A/B o en los ensayos in vitro para hexosaminidasas Totales 32,33.
Finalmente, respecto a factores como edad o género, estos no mostraron una diferencia significativa, lo cual es consistente con otros análisis relacionados con enzimas de expresión leucocitaria realizados en nuestra población, donde el único grupo que mostró una discrepancia importante de actividad se encontraba en el periodo neonatal (≤ 3 semanas de vida), grupo etario no incluido en el presente estudio 34.
Intervalo y valor de referencia de actividad enzimática de la fosfomanosa isomerasa
Los resultados del valor de referencia encontrados en la presente investigación muestran un valor más bajo de actividad enzimática (9,2 nmol/min. mg de proteína) con respecto al límite inferior y más alto (40,3 nmol/min. mg de proteína) con respecto al estudio realizado en Múnich por Niehues et al.35, quienes reportaron un valor de referencia para la enzima PMI de 16,6-20,04 nmol/min. mg de proteína con una actividad media de 18,1 nmol/min. mg de proteína al analizar una muestra de leucocitos de 12 controles. Esta diferencia en la actividad enzimática específica con relación a otras investigaciones se puede explicar porque las unidades de enzima empleada en nuestro ensayo fueron iguales para las enzimas auxiliares (1U) y la incubación se realizó a 37 °C, lo cual disminuye la energía de activación de las enzimas, y permite una mayor velocidad de reacción y, por tanto, aparición del producto, en comparación con lo empleado por 35, que utilizaron 100 mU para la PGI y 500 mU para la G6PDH, y llevaron a cabo la incubación del ensayo a temperatura ambiente.
Sin embargo, el comportamiento del ensayo está en concordancia con el valor de referencia (558-2416 nmol/h.mg de proteína) y con los valores hallados en el intervalo de confianza (10731588 nmol/h.mg de proteína) con respecto a los reportados por De Koning et al.36 en Holanda: 860-1800 nmol/h. mg de proteína. Estos autores analizaron un grupo control de 15 individuos. En comparación con nuestro estudio, el valor de actividad del límite superior fue mucho más alto (2416 nmol/h. mg de proteína), porque se trabajó con concentraciones saturantes de sustrato, aproximadamente diez veces más para lograr una mayor velocidad de la enzima; por lo tanto, concentraciones altas de sustrato influencian la actividad de la enzima e incrementan su actividad 30. No obstante, es conveniente documentar al respecto que un valor mayor de actividad enzimática en la muestra de estudio también puede presentarse por aspectos relacionados con la población en seguimiento, un fenómeno que se ha reportado en otros ensayos que muestran que los valores de referencia no se solapan con los reportados por la literatura. Por ejemplo, se tienen los hallazgos respecto a la valoración de la enzima galactosa 1-fosfato uridil transferasa en una muestra de 162 niños lactantes, conseguidos por Ayala et al.37 biotinidasa y a-amilasa en una muestra de 106 niños colombianos 38.
Otro aspecto para resaltar en la data enzimática obtenida es el valor de límite inferior (551 nmol/h. mg de proteína) que, en contraste con los estudios de 36, aparentemente no permitiría la detección de portadores, dado que en dicho estudio se informan actividades para PMI de 610 y 710 nmol/h.mg de proteína (madre/padre respectivamente y portadores). Esta situación se puede explicar en términos de las diferentes poblaciones en estudio y por el número mayor de muestras de origen pediátrico incluidas en el presente protocolo (50 % del total).
Sin embargo, centrados en la población afectada, el valor de actividad media encontrado (1330 nmol/h. mg de proteína) permite realizar el diagnóstico de la deficiencia de la fosfomanosa isomerasa, porque al ser contrastados con los valores de actividad de los pacientes con CDG-Ib (120-180 nmol/ h. mg de proteína) publicados por 35 y 36 se encuentran actividades específicas inferiores a 9,02 %-13,53 %.
Finalmente, esta investigación constituye una de las primeras herramientas de laboratorio en la aproximación de los defectos de la glicosilación en Colombia, que facilitará el diagnóstico de forma temprana en pacientes deficientes de la PMI, lo cual permitirá cambiar el curso natural de la enfermedad y así evitar las serias complicaciones de individuos afectados, que no han recibido el beneficio de un dictamen correcto y oportuno. La anterior reflexión va unida, igualmente, al hecho de que siendo una microtécnica podrá ser aplicada como prueba neonatal, incluso dada la facilidad en el tratamiento y el bajo costo al poder suplementar bajo orientación médica manosa de forma oral, lo que sin duda mejora la calidad de vida de los pacientes y su entorno familiar 14,18.