Introducción
Desde la época antigua el ser humano ha padecido diversas enfermedades causadas por agentes infecciosos microscópicos llamados virus, es decir "toxina" o "veneno" 1,2. Los virus son básicamente una cápside proteica con su material genético dentro de ella; son demasiado pequeños para ser percibidos por los microscopios convencionales y no pueden reproducirse por sí mismos, por lo que necesitan de una célula para su replicación. Pueden infectar animales, vegetales, hongos o bacterias 3,4.
A lo largo de las últimas décadas, algunas enfermedades crónicas padecidas por la humanidad son generadas por virus, por ejemplo, el síndrome de inmunodeficiencia adquirido (sida), enfermedad en la cual el sistema de defensa es atacado por el virus de inmunodeficiencia humana (vm), además de la hepatitis y la rabia, ente otras. Estas patologías, además, son de gran importancia por sus graves consecuencias sociales, psicológicas y económicas a nivel mundial 5,6.
Otras enfermedades causadas por los virus son las fiebres hemorrágicas, un grupo de enfermedades causadas por cuatro familias de virus, entre las que se encuentran los virus del Ébola y el Marburg; el virus de la fiebre de Lassa y el virus de la fiebre amarilla 7-9. Algunas de estas fiebres hemorrágicas causan síntomas leves, pero otras, como las causadas por los virus Ébola y Marburg, causan complicaciones graves en la salud e incluso pueden causar la muerte 8-10.
En los últimos años, el aumento de contagios por algunos virus específicos ha captado la atención de varios centros de salud y grupos de investigación del mundo, particularmente, en América. Entre los principales virus que han causado estos recientes episodios se encuentran los virus del Ébola, el Zika y el chikunguña 11,12. Por ejemplo, el último y más importante brote de Ébola se presentó en África Occidental en 2014, donde se registraron más de 1000 defunciones; en 2019, se presentaron algunos casos en Europa y en el primer semestre de 2019 se han reportado algunos brotes en el Congo, por lo que se mantiene la alerta mundial. Respecto al virus chikunguña (VCHIK), llegó desde África a América a finales de 2013 10,11. De igual manera, al virus del Zika (ZIKV), también proveniente del África, llegó entre 2015 y 2016 al continente americano y su incidencia alcanzó niveles pandémicos 10-12.
A partir de este contexto, en este documento se presenta una revisión de los padecimientos producidos por los contagios por ZIKV y VCHIK en la población de América del Sur y, centralmente, en Colombia. Asimismo, se realiza una contextualización general de los virus estudiados, la presentación de algunas estadísticas en el periodo del brote y alcance de sus efectos en la población Colombiana, así como las características más importantes de aquellos virus.
Metodología
Para la investigación, se siguió una metodología general que abarca los siguientes pasos: (a) definición del tema, (b) elaboración de un plan de trabajo, (c) búsqueda bibliográfica, (d) análisis y selección de los documentos, (e) enriquecimiento de la documentación mediante discusión y conceso de los autores, (f) análisis de los documentos, (g) síntesis de la información y (h) redacción del artículo de revisión.
Para la búsqueda bibliográfica, se utilizaron varias fuentes documentales. Se realizó una búsqueda bibliográfica en junio de 2018, en los buscadores especializados: Sciencedirect, Nature Publishing Group, Pubmed, Scopus y NCBI, entre otros; y se consultaron artículos relevantes del tema de las últimas dos décadas. Así como diversas publicaciones científicas de Argentina, Colombia y Brasil. Asimismo, se analizaron los reportes de prensa más representativos de índole nacional e internacional, dado que estos medios de comunicación son las principales fuentes de información de la población. Los registros obtenidos oscilaron entre 150 y 200, tras la combinación de las diferentes palabras clave. En general, se revisaron 88 publicaciones de artículos científicos y de prensa, así como comunicaciones y carteles oficiales de la Organización Mundial de la Salud (OMS). También, se analizaron algunos estudios recientes, publicados por grupos de investigación de estados Unidos y Europa en microbiología clínica. Finalmente, para la edición de los archivos PDB e imágenes se emplearon los programas Maestro, Schrõdinger, LLC, New York, NY, 2018 y Chimera 1.13.1, 2019.
El análisis de los documentos llevó a cabo de acuerdo con las siguientes etapas: inicialmente, las fuentes se clasificaron con base en su contenido y se evaluaron, las secciones de resumen y conclusiones de cada artículo (primera evaluación). Posteriormente, se seleccionó y extrajo la información más relevante o sobresaliente, con la finalidad de retirar la irrelevante y reducir el volumen del material de análisis. La etapa final de esta fase fue verificar los datos en extractos individuales (segunda evaluación). La síntesis del documento se basó, nuevamente, en una serie de subetapas: se ordenó y combinó la información extraída dentro de cada epígrafe; luego, se realizó una evaluación comparativa de los diferentes extractos o datos (tercera evaluación). Acto seguido, se condensó la información en una estructura y forma más accesible y de acuerdo con los objetivos y las fuentes. Por último, se llevó a cabo la escritura del documento.
Es importante mencionar que las revisiones bibliográficas de este tipo presentan algunas limitaciones y sesgos, por la forma como se construyen. Un limitante principal es la pérdida de información generalizada, debida principalmente a dos factores: la búsqueda bibliográfica y a la selección de documentos. En el primer caso, es posible que no se haya considerado información relevante en diferentes artículos, debido a que dichos artículos contienen información valiosa para la revisión pero que no se consideró, por estar publicada en revistas no incluidas en las bases de datos consultadas. El segundo factor que limita los trabajos de este tipo es la selección de documentos, que se debe principalmente a la formación de los autores, ya que esto, naturalmente, dará el enfoque general del trabajo. Este aspecto, además de limitar el trabajo, es también responsable de las limitaciones y sesgos en este tipo de trabajos.
Con respecto al sesgo en este tipo de trabajos, es necesario considerar que en el proceso existe un criterio subjetivo ineludible. Por ello, como se mencionó, los documentos se seleccionaron considerando las secciones de resumen y conclusiones.
En este punto, debido a la formación en ciencia (bioquímica) de los autores, es inevitable que un mayor enfoque hacia la información que involucre datos y características más cercanos a esta ciencia. Esto podría haberse traducido en que se hubiera dejado de lado el tema netamente médico, al menos un poco. Lo anterior puede plantearse como un aspecto no necesariamente negativo, pero es necesario tener en cuenta que la información recopilada puede analizarse desde diferentes consideraciones, dependiendo de quien realice el análisis.
Análisis y discusión
Epidemiología y análisis histórico de los virus
Dentro de la clasificación de los virus, los del grupo Arbovirus (del inglés arthropod-borne viruses, es decir virus llevados por artrópodos) son trasmitidos por artrópodos, principalmente, mosquitos. Estos virus afectan diferentes zonas del mundo, especialmente, las ubicadas en zonas tropicales. Además, estos virus han llamado la atención recientemente, debido al incremento en el número de consultas médicas, generado a causa de diversas afecciones en salud en pobladores de países de América del Sur como Brasil, Colombia, Perú, Ecuador y Venezuela, con síntomas similares a los producidos por la infección con el virus del dengue 13-15. En la actualidad, se sabe con seguridad que tales afecciones son producidas por los virus ZIKV y VCHIK. El primero produce una fiebre denominada fiebre del Zika, enfermedad del Zika o, simplemente, zika; mientras el segundo produce una enfermedad que recibe el nombre de artritis epidémica chikunguña o fiebre de chikunguña 16,17.
El ZIKV es un virus emergente de la familia flavi-viridae, una familia de virus que se propagan principalmente por vectores artrópodos, especialmente garrapatas y mosquitos 18. Estos virus contienen un genoma ARN monocatenario de carácter positivo, por lo que se incluyen en el Grupo iv de la Clasificación de Baltimore. El genoma no es segmentado, es decir, es lineal, con una extensión de 9,6 a 12,3 kilobases. Las partículas virales son esféricas, con un diámetro aproximado de 40-60 nm y presentan una envoltura vírica (Figura 1a), donde se aprecia la terminal 5' que presentan un cap del nucleótido metilato (Figura 1b). Entre las principales enfermedades infecciosas producidas por esta familia viral se incluyen: encefalitis, dengue, meningoencefalitis, fiebre amarilla y hepatitis C 18.
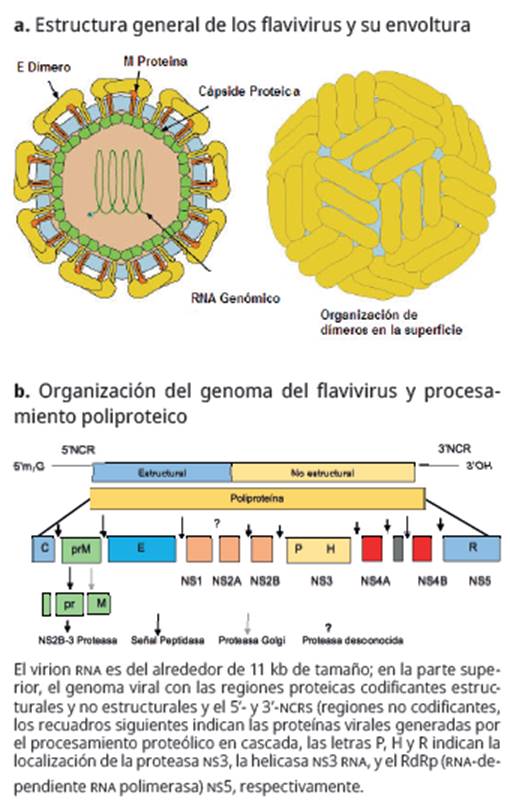
Fuente: tomado y editado por autores de Zhang et al. Nat Struct Biol. 2003; 10(11):907-12.
Figura 1 Estructura, organización del genoma y procesamiento poliproteico de los flavivirus.
Por su parte, el zikv (Figura 2), trasmitido principalmente por el mosquito Aedes aegypti19,20-22, fue aislado por primera vez en 1947, en Uganda, desde especies de monos macacos Rhesus, durante un estudio de fiebre amarilla en el bosque tropical de Zika (ecosistema ubicado en Entebbe a 23 kilómetros de Kampala, capital de Uganda); es un lugar con exuberante vegetación que alberga todo tipo de animales y plantas, entre ellos, cuarenta especies de mosquitos 23,24.
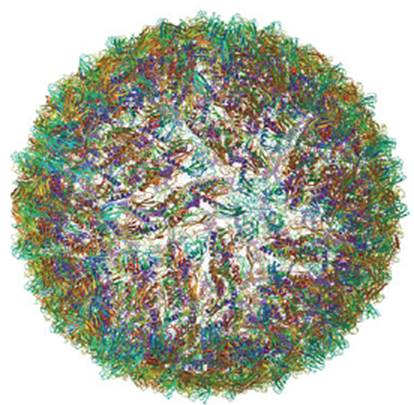
Fuente: tomado de Protein Data Bank y Kostyuchenko et al. Nature. 2016; 533(7603):425-8. 22-23.
Figura 2 Cryo-EM. Estructura del virus del Zika [ZIKV].
En 1948, el virus fue aislado de un grupo de mosquitos de la familia Aedes africanus, presentes en la misma región del bosque 25. Posteriormente en Nigeria, entre 1968 y 1975, el virus fue aislado y reportado en seres humanos, cuando pudo comprobarse que los individuos que habitaban esta región presentaban anticuerpos específicos para este virus. Después de aislar el virus en Nigeria, subsecuentemente, se realizaron más aislamientos de cepas del virus en mosquitos de Aedes spp., en bosques cercanos al bosque Zika, situados en África y Malasia 24-26.
En 1977, el científico investigador Olson reportó siete personas en Indonesia, con la infección del Zika durante un estudio serológico. Después, se realizaron estudios serológicos que evidenciaron infecciones de Zika en pacientes humanos, en Egipto, Nigeria, Uganda, India, Malasia, Indonesia, Pakistán, Tailandia, el norte de Vietnam y Filipinas. Ello demostró que, para 1980, el virus ya presentaba una amplia ocurrencia alrededor del mundo 26,27.
En abril de 2007, en el estado de Yap, Estados Federados de Micronesia, Oceanía, se detectó una epidemia de fiebre y erupción cutánea asociada presumiblemente con el virus del dengue (DENV), por lo que se llevaron muestras de pacientes afectados en esta epidemia al Laboratorio de Diagnóstico de Arbovirus, en los Centros para el Control y la Prevención de Enfermedades (CDC, Fort Collins, EE. UU.). Después de hacer los estudios serológicos pertinentes, se confirmó que la infección en el estado de Yap fue generada por el virus Zika y no por el virus del dengue, como se pensaba inicialmente 28-31. Este reporte demostró la primera evidencia del virus Zika fuera de África y Asia. Después de la notificación de los primeros reportes del virus, se han presentado otros brotes de Zika en islas del Océano Pacífico, desde 2007 29-31.
Durante 2014, el virus se introdujo en la Isla de Pascua, Chile, y, a comienzos de 2015, el ministerio de salud de Brasil y el instituto Evandro Chagas confirmaron dieciséis casos positivos en Brasil 27-29. A finales de 2015, en Brasil se estimó entre 0,4 y 1,3 millones de casos de infección del virus, lo que lo hace el país más afectado de América del Sur por este virus 27-30. En marzo de 2016, el virus se había extendido activamente por lo menos a 33 países, principalmente, en América y también a África y Oceanía 21. Después, la expansión del virus continuó hacia América Central y la totalidad de América del Sur.
En cuanto al virus chikunguña, la sintomatolo-gía que lo acompaña fue descrita, por primera, vez en 1779. Entonces, fue caracterizado como una variante del virus del dengue, pero fue solo hasta inicios del siglo veinte, cuando fue reconocido como un virus diferente 32. Los brotes de chikunguña se reportaron por primera vez a mediados de 1952, en Tanzania, África, desde donde se dispersó hacia el continente asiático, luego a Europa y, posteriormente, al continente americano. A pesar de todo, el lugar exacto de origen del virus es incierto 33,34.
Dada la rápida dispersión del virus y la ausencia de un tratamiento efectivo contra él, el chikunguña ha adoptado un carácter de importancia médica mundial 34,35. El VCHIK (Figura 3) fue reconocido rápidamente como un virus diferente, puesto que su principal síntoma consiste en un fuerte dolor de articulaciones, de ahí su nombre, derivado de un término del idioma macondo (un idioma bantú del sur de Tanzania y norte de Mozambique), que se refiere a los procesos de "secarse", "encorvarse" o "retorcerse" 34,35.
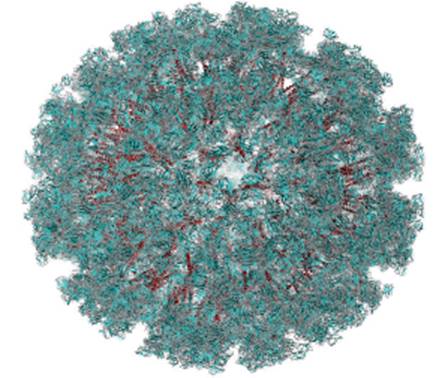
Fuente: tomado Protein Data Bank y Sun et al. Elife. 2013; 2:e00435. 35,36.
Figura 3 Estructura del virus Chikunguña.
Una vez identificado el virus y parte de su ciclo de vida, fue posible reconocer sus primeros brotes fuera del continente africano 37-40. Durante el periodo de 1960-1980, se presentaron fuertes brotes de la epidemia en países asiáticos, principalmente en Camboya e India 39-41. Hasta el momento, estudios filogenéticos han demostrado que durante los primeros años de la epidemia (1958-1973), el VCHIK proveniente de África había mutado para formar una nueva cepa 42-44. Tanto la cepa africana como la asiática permanecieron restringidas a estos dos continentes hasta 2004, cuando se presentaron brotes en islas del Índico, que permitieron la dispersión posterior del virus al contiene americano 45,16.
Recientemente, se han desarrollado algunos estudios para determinar la causa por la cual el virus amplió su rango de infección. Entre los resultados, se determinó una mutación presente en la glicoproteína E1 del virus, en la cual, el aminoácido codificante 226 (círculo verde de la Figura 4a) cambió su posición 46-47, ya que la glicoproteína E1 es la que permite la infección de las células del mosquito. El cambio de aminoácidos ALA por VAL en esta proteína permitió la infección de un nuevo vector (en este caso, una nueva especie de mosquito). Así, el moquito Aedes albopictus se convirtió en el principal vector del chikunguña en zonas tropicales y templadas, debido a su capacidad de tolerar cambios bruscos de temperatura 44-46.
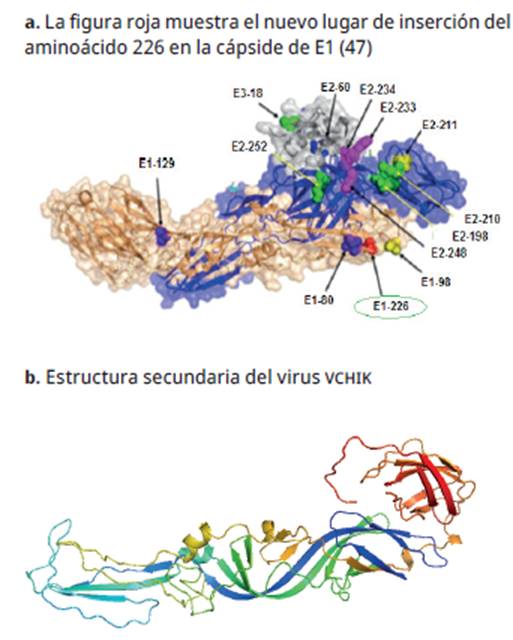
Fuente: tomada y adaptada de Protein Data Bank y Fox et al. Cell. 2015; 163(5):1095-107. 47,48.
Figura 4 Glicoproteína E1 del virus del chikunguña.
Este cambio estructural de la proteína determinó la dispersión del virus a nivel global 44-47. En la actualidad, el chikunguña representa una problemática que va más allá del sistema de salud público, debido a la ausencia de un tratamiento eficiente para el virus, lo que ha llevado a los centros asistenciales a almacenar medicamentos únicamente para el tratamiento de los síntomas, acciones insuficientes durante un brote 49-51.
Por otro lado, se considera que los países americanos son más vulnerables a brotes continuos de la epidemia, debido a que aún no se ha generado un sistema inmune grupal, es decir, las personas son más fáciles de vulnerar por la infección, puesto que aún no han desarrollado acciones inmunes resistentes al virus, contrario a lo que ya sucede, por ejemplo, en el continente africano 49-51.
Manifestaciones clínicas de las fiebres del Zika y el chikunguña
En general, los síntomas de la fiebre del Zika constituyen aumentos considerables en la temperatura corporal, dolores articulares crónicos, cefaleas, debilidad general y dolor muscular 26. En el inicio la enfermedad, la infección aparece relativamente leve, limitada y no es letal; además no presenta síntomas en el 80 % de los casos. Pero, en algunos casos, los síntomas inician entre 2 y 7 días después de la picadura del mosquito, cuando ya se evidencia dolor de cabeza, conjuntivitis, dolor de estómago, mareos y fiebre; a los cuales siguen las complicaciones más importantes: malestar general, anorexia, eflorescencia o erupciones maculopapulares y un pronunciado dolor articular 28,29,51.
El verdadero potencial de la enfermedad es aún desconocido, sin embargo, durante la pasada epidemia en Polinesia Francesa, se reportaron cerca de 73 casos del síndrome de Guillain-Barré y otros padecimientos neurológicos. Se sospecha que estos síntomas son complicaciones de la infección, pero esta relación aún se encuentra en investigación 28,52.
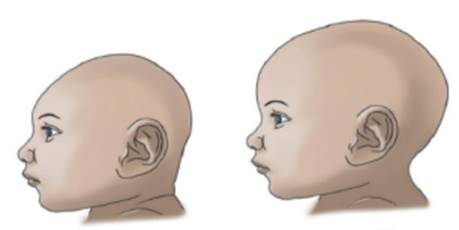
Actualmente, la preocupación más importante en el cuadro clínico de esta infección es debido a que se presume el virus ZIKV está asociado con el aumento de la incidencia de microcefalia en neonatos de mujeres que hayan contraído el virus durante el embarazo. En esta afección, la cabeza de los niños es más pequeña, comparada con la de otros de su misma edad y sexo (Figura 5), lo que puede afectar el desarrollo de las funciones motrices y del habla, además de implicar hiperactividad y retraso mental, en numerosas ocasiones 26,53,54.
La sintomatología de la fiebre chikunguña se caracteriza por la aparición inmediata de fiebre, a veces de más de 40 °C. A esta fiebre le sigue un eritema, acompañado de dolores articulares. Otros signos frecuentes son los dolores musculares y de cabeza, las náuseas, el cansancio y erupciones cutáneas. El virus puede causar una enfermedad aguda, subaguda o crónica. El período de incubación del virus de chikunguña varía entre uno y doce días. La infección puede ser asintomática, pero, por lo general, entre 75 % y 95 % de los infectados desarrollan síntomas. Otros síntomas reportados en pacientes han sido fatiga, rash (eflorescencia), problemas digestivos y conjuntivitis 32,33,55-58.
Durante la reciente epidemia de 2015, se observó que la fiebre de chikunguña se manifiesta en varias fases. Dentro de la fase aguda, se identificaron dos etapas: una viral, durante los primeros 5-7 días, seguida de una etapa de convalecencia de aproximadamente 10 días, en los cuales los síntomas empeoran, pero el virus aún no puede detectarse en la sangre 56-59. Luego, se manifiesta la fiebre con inicio de la viremia, cuando el nivel de virus VCHIK en la sangre se correlaciona con la intensidad de los síntomas. Cuando la in-munoglobulina m y los anticuerpos aparecen en la sangre, la viremia empieza a disminuir, pero el dolor de cabeza, insomnio y cansancio extremo se manifiestan. Seguido de la fiebre, se presenta un fuerte dolor de articulaciones y rigidez que puede persistir semanas o incluso meses. Aquel dolor puede ser debilitante y a menudo resulta casi en la inmovilidad total de las articulaciones afectadas. Se presenta en más de una articulación, en la mayoría de los casos, y puede ocurrir en el 87-98 % de los afectados 55-60.
Las articulaciones más afectadas son las de brazos y piernas. El dolor se produce con mayor frecuencia en articulaciones periféricas, como las muñecas, tobillos, así como en otras articulaciones mayores como hombros, codos y rodillas. El dolor también puede presentarse en músculos y ligamentos 59,61. La mayoría de los pacientes se recupera completamente, pero en algunos casos los dolores articulares pueden durar meses o años.
Adicionalmente, se han descrito casos ocasionales con complicaciones oculares, neurológicas y cardíacas y también con molestias gastrointestinales. Las complicaciones graves no son frecuentes, pero, en personas mayores, la enfermedad puede conllevar a la muerte.
A menudo los pacientes solo tienen síntomas leves y la infección puede pasar inadvertida o diagnosticarse erróneamente como dengue, particularmente, en zonas donde este último es frecuente. Asimismo, las personas con enfermedades como presión arterial alta, diabetes o enfermedades del corazón presentan mayor riesgo y complicaciones 56,60.
La causa de pacientes con síntomas crónicos prolongados en el tiempo aún no tiene una justificación exacta, ya que los resultados para las pruebas autoinmunes o reumatoides resultan negativos en ellos 33,56,60. En estos pacientes, el antígeno vírico se ha podido encontrar en biopsias musculares en personas infectadas, luego de varios meses de contagio; adicionalmente, el antígeno viral y el virus se han encontrado en macrófagos de la articulación sinovial, en personas que han experimentado episodios de recaídas hasta 18 meses después de la infección, por lo que puede inferirse que el virus conlleva a infecciones persistentes en humanos 34,36,52-58.
Organismos causantes de la trasmisión y expansión de los virus
Ha sido posible identificar que tanto la fiebre del Zika como la del chikunguña son trasmitidas por picaduras de mosquitos, específicamente del género Aedes38. Este género de mosquitos culícidos (culicidae: familia de dípteros nematóceros conocidos coloquialmente como mosquitos) es frecuente en todo el mundo y, especialmente, en áreas tropicales y subtropicales, con condiciones geográficas particulares, como suelos inundables con grandes reservorios de aguas estancadas 38-40. El nombre procede de aquel género proviene del griego aédés, es decir, "odioso". Transmiten, diversas enfermedades, como la fiebre amarilla, el dengue y la dirofilariasis, entre otras 42,43. Además, en Polinesia, el Aedes polynesiensis trasmite la filariasis linfática, producida por Brugia y otros nemátodos 47,48,50.
Los mosquitos Aedes, usualmente, exhiben bandas negras y blancas en cuerpo y patas, pero también pueden presentar otras coloraciones. Algunos científicos sostienen que parte de las especies debieran trasladarse al género Stegomyia, al haber elevado este subgénero al rango de género, pero aún se reconoce con su clasificación clásica 46. El género Aedes incluye varios subgéneros, como Aegypti, Aedimorphus, Fredwardsius y Stegomyia48-50.
En el ser humano, la infección surge como resultado de las picaduras por mosquitos hembra infectados al succionar la sangre de otras personas infectadas 40-42. El virus infecta el intestino medio del mosquito y luego se extiende hasta las glándulas salivales, en un período de 8-12 días. Tras este período de incubación, el mosquito puede transmitir el virus a las personas, al picarlas con fines exploratorios, defensivos o alimentarios. Los mosquitos suelen picar durante toda la mañana e inicios de la tarde y actuar tanto en el interior como afuera de las viviendas 50,52,61.
De acuerdo con la OMS, este insecto utiliza como criadero espacios pequeños que pueden naturales o artificiales. Depositan sus huevos en recipientes que contienen agua que, en un par de días, se convierten en larvas, las cuales crecen hasta convertirse en zancudos adultos. Por eso, se aconseja suprimir posibles criaderos en agua estancada en viviendas o cerca de ellas; adicionalmente, se recomienda utilizar insecticidas y repelentes sobre la piel y la ropa 52,60-62.
Se ha determinado que el mosquito puede picar a las personas sin ser percibido, porque se acerca silenciosamente y pica, principalmente, en codos y tobillos. Este comportamiento se concluyó de acuerdo con una investigación del Centro para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos. Por último, usualmente, los mosquitos prefieren picar a los humanos, aunque en ocasiones también atacan a diferentes animales domésticos, principalmente, a los perros 60-62.
En lo que respecta a la trasmisión del virus ZIKV, además de la mencionada picadura del mosquito y la transmisión sexual, se han observado formas alternativas de transmisión, entre las que se destacan las transmisiones por transfusiones y trasplantes, así como la transmisión congénita y durante el parto 64-66.
Diagnóstico de los virus en los humanos
El primer aspecto que debe considerarse para llevar a cabo el diagnóstico es preguntar a la persona posiblemente infectada si ha visitado áreas donde se haya reportado transmisión dentro de los últimos 15 días previos al inicio de los síntomas 46,51. En el laboratorio, el diagnóstico del virus del Zika se realiza durante la etapa aguda de la enfermedad, por medio de un equipo de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR, por sus siglas en inglés), empleando muestras de suero 62-67. Sin embargo, el virus también puede ser detectado en muestras de orina y saliva. Para las muestras de suero se emplea detección molecular (RT-PCR); estas deben ser tomadas dentro de los primeros 6 días después de iniciada la sintomatología.
La detección de inmunoglobulina IgM mediante la técnica ELISA para el virus ZIKV debe realizarse en muestras de suero tomadas a partir del cuarto día de evidencia de síntomas 29,38,41. Los resultados positivos de las muestras requieren ser confirmados mediante la prueba de neutralización en cultivos celulares bajo agarosa. Esta última sólo puede ser realizada en laboratorios especializados que trabajan con cultivos celulares. En esta prueba, se requieren dos muestras: una obtenida el cuarto día y otra obtenida 15 días después de la primera. En términos generales los resultados de infecciones por flavivirus pueden ser de análisis complejo, ya que pueden presentarse cruces serológicos de otros virus, como el del dengue 53-56,63,64.
Por su parte, el diagnóstico del chikunguña es similar al del virus del Zika: se emplean diversos criterios analíticos realizados en laboratorio y se basa en la detección directa o indirecta del virus con alguna de las siguientes pruebas: aislamiento viral, detección de RNA viral por medio de la técnica de RT-PCR, detección de anticuerpos IgM en muestra de suero, recolectada durante la fase aguda o subaguda, por medio de la técnica ELISA 51-53.
Brote epidemiológico y situación actual de los virus
El virus del Zika ha afectado gravemente algunas poblaciones de Colombia 67,68. Hasta junio de 2016, se habían reportado cerca de casos 50 000 de infectados por el virus, de los cuales 9000 fueron mujeres embarazadas, según informes del Instituto Nacional de Salud [INS] 65,66. La presencia del virus se mantenía en 282 municipios del país, hacia finales de 2016, y la mayoría de afectados eran mujeres (67,4 %), con mayor incidencia en personas entre los 25 y 29 años [14,1 %] 75,76.
Según reportes de 2016, a partir del ingreso a la fase endémica, desde la semana epidemiológica 29 hasta la semana epidemiológica 37 de 2016 (mediados de septiembre), fueron notificados cerca de 3020 casos de enfermedad por virus Zika; los cuales, sumados con los que se notificaron hasta el cierre de la fase epidémica en la semana epidemiológica 28 de 2016, sumaron un total de 8826 casos confirmados y 95 129 sospechosos; de estos, 91 383 proceden de 507 municipios donde se confirmaron casos por laboratorio y 3746, de 283 municipios donde no se habían confirmado casos hasta esa fecha.
En la semana epidemiológica 37 de 2016, se registraron 405 casos, 99 de esa semana y 306 de semanas epidemiológicas anteriores, notificados de manera tardía. Se reportaron 405 casos sospechosos (de municipios con y sin casos confirmados por laboratorio); sumando los casos confirmados y sospechosos, los departamentos que concentraron cerca del 60,0 % del total de los casos notificados fueron Valle del Cauca, Norte de Santander, Santander, Tolima y Huila 68-73.
Asimismo, en Colombia, el Ministerio de Salud vinculó al ZIKV como responsable de la muerte de 3 enfermos de Guillain-Barré 69. Además, se reportaron más de 800 000 infectados por el virus en 2016, y medio millar de casos de microcefalia, similares a los casos de Brasil, país más afectado con más de un millón y medio de casos 68-73. Se cree que el virus se expandirá por todo el continente americano, en Perú, Ecuador y Venezuela, exceptuando Canadá y Chile, según declaraciones de la OMS 73-76.
Con respecto al VCHIK, el INS indicaba alrededor de 60 muertes causadas por el virus en Colombia entre 2014 y 2015 68-73,76-78. Además se reportó que la tasa de letalidad corresponde a 0,014 %, ya que un total de 450 000 personas padecieron la enfermedad durante este periodo 71,73. El INS informó, además, que el mayor número de muertes por este virus se dio en Norte de Santander (12 casos), seguido por el Tolima (9 casos), mismo número registrado en Cundinamarca 71,73. De acuerdo con el organismo especializado, seis de los fallecidos estuvieron aquejados simultáneamente con dengue 73. Además, se resaltó la importancia de que el personal de salud no deje de inspeccionar el dengue, aún en la presencia de chikunguña, dada su importancia en morbilidad y mortalidad.
Vacunas contra los virus Zika y chikunguña
Existen vacunas eficaces contra diversos Flavivirus, por ejemplo, contra los virus que producen la fiebre amarilla o la encefalitis (la japonesa y la transmitida por garrapatas). Estas vacunas fueron desarrollas hacia 1930. Por su parte, el dengue también cuenta con una vacuna, desarrollada recientemente en 2016, denominada engvaxia, fármaco que es producido por la farmacéutica francesa Sanofi Pasteur.
Sin embargo, no existe todavía una vacuna comercial efectiva contra los virus del Zika y chikunguña; no obstante, diversos estudios arrojan resultados prometedores, según afirma el doctor Anthony Fauci, director del Instituto Nacional de Alergia y Enfermedades Infecciosas de Estados Unidos. La demora para su obtención se debe a que el proceso para desarrollar una vacuna certificada y llevarla a producción es aún bastante complejo, dado que realizar los estudios en animales, realizar ensayos clínicos y obtener la licencia de aplicación comercial en humanos tarda de 10 a 12 años, por lo menos.
A pesar de lo anterior, algunos centros de investigación aseguran haber obtenido una vacuna efectiva contra el VCHIK, como el grupo de investigación de la University of Texas Medical Branch (EE. UU.), en convenio con universidades de Brasil, que ha experimentado con animales y que, en la última etapa de sus investigaciones, ha realizado pruebas en humanos con buenos resultados contra este virus: la vacuna probada generó una adecuada respuesta inmune en los 25 voluntarios que participaron en las pruebas, sin que sufrir efectos secundarios graves 78,80. La molécula experimental utilizada es una "vacuna recombinante de virus vivo atenuado", creada a través de la modificación genética del VCHIK. La cepa en la cual se desarrolló la vacuna es diferente, comparada con el virus natural, en dos aspectos: por un lado, no puede causar la enfermedad y, por otro, tampoco infecta a los mosquitos transmisores, característica importante para asegurar que la vacuna no inicie una nueva transmisión en zonas que presentan casos reportados 53,78,80. En cambio, genera una respuesta inmune para proteger contra futuras infecciones.
Asimismo, en México también especialistas del centro de investigaciones regionales Hyedo Noguchi de la Universidad Autónoma de Yucatán están llevando a cabo estudios para encontrar una vacuna efectiva contra este virus 77. Asimismo, el Consejo Superior de Investigaciones Científicas (CSIC) de España afirmó haber desarrollado una vacuna contra el virus del chikunguña, transmitido por el mosquito tigre, es decir, el Aedes albo-pictus80,81. De forma paralela, en el Centro de Biotecnología del CSIC también se ha desarrollado un prototipo de vacuna probado con éxito en animales (ratones y monos) y que protege frente a la infección. Este último producto está preparado para avanzar ahora hacia los ensayos clínicos en seres humanos 78,80-81.
En cuanto a la vacuna para prevenir la fiebre del Zika, el Instituto Nacional de la Salud (NIH, por sus siglas en inglés) de Estados Unidos afirmó, en marzo de 2016, que la vacuna podría estar lista en septiembre de ese mismo año, sin embargo, esto no sucedió debido a la complejidad del virus 82,84. Se ha reportado que próximamente va a tenerse lista una vacuna para probarla en humanos, pero aún sin disponibilidad para distribución y comercialización 83. La vacuna desarrolla por el NIH es la que se encuentra en etapas más avanzadas y que cuenta con mayor efectividad en comparación con otras que están desarrollándose, según reportes científicos.
Sin embargo, hay otras vacunas con resultados prometedores como la desarrollada por Sanofi, quien anunció que en la primavera de 2017 empezaron ensayos preclínicos de un producto farmacéutico, en el que estaba involucrado cerca de un centenar de investigadores. A pesar de ello, en aquella fase sólo se llevaron a cabo pruebas en animales, pero ya estaban proyectando pruebas también en humanos 82,84.
Otras dos vacunas en proceso de desarrollo son la de la compañía de india Bharat Biotech, con sede en Hyderabad, y la de la farmacéutica estadounidense Inovio. El investigador Fauci ha afirmado que el producto que ellos han desarrollado estaría enfocado para aplicarse en mujeres embarazadas, debido al vínculo con los casos de microcefalia y síndrome de Guillain-Barré asociados al Zika, como asegura la OMS. Por ello, la producción de esta vacuna para este público específico involucraría un proceso más complejo, teniendo en cuenta los riesgos para el feto 82,84. El doctor Fauci ha afirmado que, si los resultados de los estudios de la fase I de la vacuna son efectivos, podría inferirse que la vacuna estaría lista para ser distribuida en los próximos años (2020).
Al respecto, es de anotar que es de vital importancia desarrollar la vacuna en este plazo, ya que se ha comprobado ampliamente la relación de la infección con el desarrollo de microcefalia, además de posibles daños cognitivos 82-86. Es este aspecto, en efecto, se tienen resultados de un estudio mediante análisis de células madre humanas, en el que se ha comprobado que el virus de Zika infecta selectivamente células pertenecientes a la corteza cerebral, las hace más propensas a morir y les reduce su capacidad de reproducción 82,84.
Prevención contra la infección de los virus
A nivel general, donde hay presencia de los mosquitos vectores de estos virus, se recomienda a la comunidad usar mosquiteras en las ventanas mientras se duerme, para evitar la entrada de los insectos y, con ello, prevenir el contagio de los virus mediante picaduras 79,81,82. Asimismo, es aconsejable no mantener las ventanas abiertas, además de eliminar el agua estancada, como en los jardines, dado que el mosquito vive y se reproduce en esos ambientes 53,78,80. También es aconsejable que las personas vistan ropa blanca o muy clara, con manga larga, siempre que se pueda y usar repelente de insectos 73,81).
Debido a la falta de tratamiento y una vacuna efectiva contra los virus, es necesario frenar su expansión, erradicando la presencia del mosquito transmisor. Un método para lograrlo es evitar que el insecto se reproduzca o hacer que muera antes de que llegue a transmitir la enfermedad 86. Para ello, pueden emplearse mosquitos genéticamente modificados (sistema que aún está evaluándose, pero que la OMS ha respaldado ampliamente), puesto que el virus se ha expandido por todo el continente americano y se cree que puede afectar a alrededor de cinco millones de personas 86-88.
Conclusión
Es indispensable conocer de forma adecuada las diferencias entre las fiebres producidas por los virus del dengue, Zika y chikunguña, debido a que presentan sintomatología similar que puede causar confusión, en cuanto a prevención y tratamiento en las zonas más afectadas. Por tanto, es necesario desarrollar una prueba diferencial rápida y oportuna para identificar el virus causante de la fiebre y empezar el tratamiento lo antes posible. Asimismo, es necesario atacar la reproducción de los mosquitos portadores de estos virus y tomar en cuenta todos los protocolos de seguridad establecidos por la OMS y el INS.
Actualmente, se ha dado por superado el pico epidémico del virus Zika, registrado en Colombia durante el año 2015 e inicios de 2016. Sin embargo, en algunas regiones del territorio del país, sigue presentándose circulación activa del virus y departamentos como Meta, Quindío y Valle del Cauca siguen en la etapa de transmisión activa. En cuanto al chikunguña, en Colombia y América del Sur, el brote ya se detuvo, pero es importante no disminuir las precauciones en el control de los brotes de este virus.
Se reconoce que además de las picaduras de mosquitos, el virus Zika puede propagarse con la transmisión por vía sexual, por transfusiones de sangre, trasplantes, transmisión congénita y durante el parto. Esto torna más complejo prevenirlo y tratarlo, sumado al hecho de que el virus está asociado con el aumento de la incidencia de microcefalia, lo que lo hace más peligroso para las poblaciones donde se han presentado brotes. Por ello, es sumamente necesario su control, eliminación y erradicación definitiva.
Aunque existen vacunas efectivas contra muchos Flavivirus, actualmente, no se cuenta con una vacuna eficaz contra los virus del chikunguña y el Zika. Sin embargo, recientemente, se han logrado grandes avances; además, hay varios grupos de investigación y farmacéuticas de diferentes países buscando tratamientos y vacunas efectivas para ambos virus. Algunos de estos afirman que podría contarse con una vacuna efectiva hacia 2020.
Finalmente, es de gran importancia, continuar las investigaciones para ampliar el conocimiento sobre el comportamiento y las características biológicas de los virus y lograr el desarrollo efectivo de vacunas y tratamientos, a fin de evitar su propagación.