Introducción
Las geohelmintiasis o helmintiasis transmitidas por el suelo (HTS) son un problema de salud pública que afecta principalmente a los escolares, preescolares y mujeres gestantes de las poblaciones vulnerables con deficiente acceso a saneamiento básico y agua apta para el consumo humano. Se ha estimado que a escala mundial 1500 millones de personas presentan infección por algún geohelminto 1.
Si bien una estrategia recomendada por la Organización Mundial de la Salud (OMS) para el control integrado de estas helmintiasis es la quimioterapia preventiva antihelmíntica (o administración masiva de antihelmínticos) con una periodicidad establecida, se ha reportado evidencia de la reducción de la eficacia de algunos fármacos antihelmínticos como el albendazol y se menciona la posible aparición de resistencia a estos medicamentos 2,3, en particular, en las áreas geográficas donde se han implementado y evaluado programas de control de las geohelmintiasis desde hace varios años. Por tanto, se justifica continuar con la investigación y el desarrollo de nuevos antihelmínticos.
Metodología
Se realizó una revisión narrativa mediante la búsqueda de artículos en las bases de datos Medline, Scielo, ScienceDirect y en la biblioteca Cochrane. La selección de los artículos se hizo en función de los siguientes criterios de inclusión: 1) estudios publicados desde 2013 hasta 2020 (consultados en julio de 2021); 2) todos los diseños metodológicos desde investigaciones in silico, in vitro, in vivo e investigación clínica; 3) publicaciones en español e inglés; y 4) las palabras clave utilizadas para la búsqueda fueron escogidas por la metodología Decs: Trichuris, Ascaris, Necator, Ancylostoma, helmintiasis, antihelmínticos, descubrimiento de fármacos, desarrollo de medicamentos, diana o blanco. Finalmente, se tomaron 28 referencias bibliográficas que cumplían con los criterios de búsqueda formulados y que permitieron establecer una narrativa con respecto a los principales avances o novedades sobre el uso, descubrimiento y desarrollo de medicamentos antihelmínticos.
Resultados
Mecanismos de acción de antihelmínticos
El grupo de fármacos de elección (benzimidazoles) en el tratamiento y control de las geohelmintiasis actúa por unión a la β-tubulina, que es una de las unidades constitutivas de los microtúbulos de este parásito, inhibe su polimerización y altera la absorción de glucosa. Estos son componentes fundamentales del citoesqueleto eucariota por lo cual la desestabilización de su ensamblaje provoca alteraciones fisiológicas en los parásitos, desde la división celular hasta el transporte interno de macromoléculas 4.
Por otro lado, la ivermectina perteneciente al grupo de las lactonas macrocíclicas se utiliza en el tratamiento de la estrongiloidiasis. Los fármacos de este grupo actúan como moduladores alostéricos de los canales de cloruro abiertos por glutamato, cuyo efecto es la hiperpolarización de las células nerviosas y musculares postsinápticas lo que induce a una parálisis de la locomoción y del bombeo faríngeo del parásito 4. Otra opción de tratamiento en el caso de infecciones por geohelmintos es el pamoato de pirantel, que inhibe la colinesterasa y produce una activación continua de los receptores nicotínicos del parásito, un bloqueo neuromuscular y una parálisis espástica, que promueven la eliminación del helminto intestinal 5.
Reducción de la eficacia
Aunque desde 1997 se ha reportado la disminución de la eficacia y posible aparición de resistencia a antihelmínticos (es reportada particularmente para el parásito Trichuris trichiura), las fallas metodológicas, pruebas no concluyentes y variedad de metodologías e indicadores considerados en estos estudios llevaron a confusión sobre los resultados de la eficacia de este grupo de fármacos 6. Es por eso que en 2013 la OMS publicó el Manual de evaluación de la eficacia de los antihelmínticos contra las esquistosomiasis y geohelmintiasis 7; y desde entonces se condujeron al menos veinte ensayos para evaluar la eficacia de los medicamentos recomendados para el tratamiento de las helmintiasis, especialmente en las áreas geográficas donde los programas de quimioterapia preventiva han tenido cobertura durante más de cinco años 8. Los resultados de estos estudios y las revisiones que abordan la eficacia de antihelmínticos concuerdan con que la eficacia de los fármacos de mayor uso en quimioterapia preventiva, como albendazol y mebendazol, ha disminuido con el tiempo 9. Además, se ha hecho evidente que los resultados de eficacia de los fármacos varían ampliamente respecto a cada especie de geohelminto, es decir, para Ascaris lumbricoides una tasa de curación del 95,7 % con albendazol y 96,2 % con mebendazol, mientras para Trichuris trichiura la eficacia de los fármacos disponibles es del 30,7 % y 42,1 %, en tasa de curación con albendazol y mebendazol, respectivamente 8,9, resultados que confirman la necesidad de buscar nuevos fármacos antihelmínticos y combinaciones de estos que puedan minimizar el riesgo de resistencia.
Además, en 2020 se sugirió un estudio de vigilancia mundial, para evaluar la eficacia de los fármacos antihelmínticos y la posible aparición de resistencia a estos en los programas de control de geohelmintiasis en Bangladesh, Camboya, Laos, Vietnam, Ghana, Ruanda, Senegal y Nicaragua, debido a la preocupación latente de no contar con un sistema de vigilancia actualizado en el mundo 10.
Resistencia a antihelmínticos
Cuando hay exposición repetida a los antihelmínticos se define un proceso de resistencia como la capacidad del parásito de sobrevivir a dosis normales de uso del fármaco que matarían parásitos de la misma especie y estadio 11. Se ha documentado que esta resistencia puede deberse a variantes genéticas que se transmiten a la descendencia, por medio de polimorfismos en nucleótidos específicos (SNP, por sus siglas en inglés). Ejemplo de esto es la variación en el gen de β-tubulina, que genera resistencia ante benzimidazoles (figura 1).
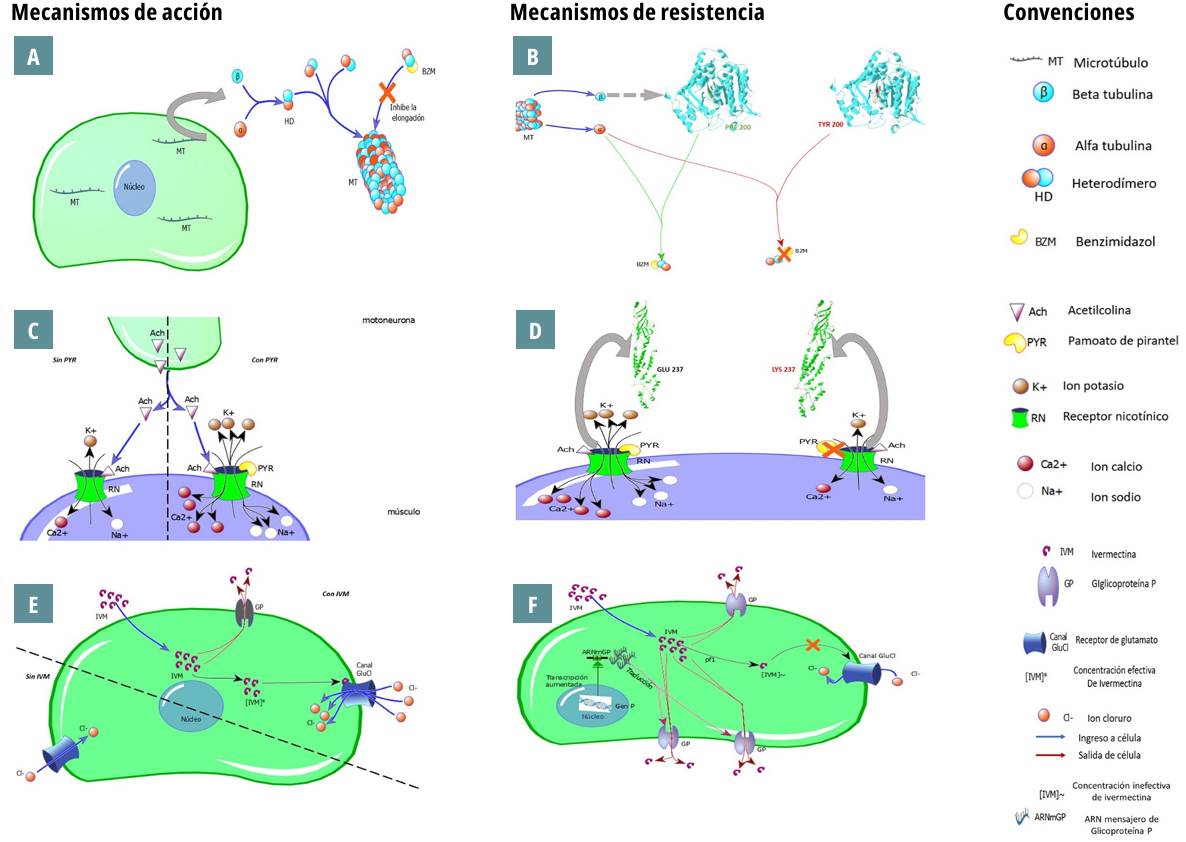
Fuente: elaboración propia empleando la herramienta 13.
Figura 1. Los diagramas A y B muestran los mecanismos de acción y de resistencia de los fármacos del grupo de los benzimidazoles respectivamente. En A se observa el efecto que estas moléculas producen en la inhibición de la elongación de los microtúbulos. En B se ilustra el presunto mecanismo de resistencia descrito para esta clase de fármacos a partir del cambio del aminoácido de la posición 200 de la unidad de β-tubulina, que impide la unión del benzimidazol al dímero de tubulina y por tanto se evita su acción antihelmíntica permitiendo que continúe la formación de los microtúbulos celulares. C y D son los diagramas de mecanismo de acción y posible mecanismo de resistencia de las tetrahidropirimidinas como el pirantel. Mientras que en C se observa la unión del pirantel al receptor nicotínico de la neurona postsináptica para promover su despolarización, en D se describe el supuesto cambio del aminoácido 237 de dicho receptor, lo cual impide la unión del fármaco y por tanto no se logra su acción nematicida. Finalmente, E esquematiza el mecanismo de acción las lactonas macrocíclicas como la ivermectina, que debe alcanzar una concentración efectiva dentro de la célula para generar un efecto sobre el canal de cloruro sensible a glutamato y promover la hiperpolarización de la placa neuromuscular del parásito. En F se evidencia que uno de los posibles mecanismos de resistencia ante este grupo de fármacos es una alteración genética que conduzca a la sobreproducción de glicoproteína P, la cual funciona como bomba de expulsión de la ivermectina y por tanto no favorece su acción.
En estudios de resistencia a antihelmínticos de uso veterinario se sugieren también mecanismos diferentes ante las tetrahidropirimidinas como el pirantel por medio de cambios estructurales en el receptor nicotínico o mecanismos de mutación en el gen de la glicoproteína P que promueven una rápida expulsión de las lactonas macrocíclicas y disminuyen la eficacia de fármacos como la ivermectina 11,12. Ya se ha evidenciado el desarrollo de resistencia a fármacos antihelmínticos de uso veterinario, por lo que es indispensable evaluar la ocurrencia de este fenómeno en el ámbito humano, debido a que se ha reportado la disminución de eficacia en diferentes regiones del mundo.
Desde la última década del siglo pasado se discute la necesidad de atender al desarrollo de resistencia que ya se identificaba en ovinos; situación que diferentes expertos consideraban podía ser similar en humanos y que, por tanto, constituye un problema de salud pública en la actualidad. Geerts y Gryseels 3 señalaron el cómo los métodos analíticos de los años dosmil no garantizaban sensibilidad suficiente como para establecer de forma contundente el desarrollo de resistencia y, sin embargo, presentaron en su trabajo una recopilación de estudios que dan cuenta de la disminución de eficacia de benzimidazoles, ivermectina y praziquantel en poblaciones humanas de África, Brasil y Egipto. La sola sospecha de resistencia a los benzimidazoles es un signo de alarma para buscar nuevas opciones que aseguren eficacia en los programas de control de las geohelmintiasis, pero que también garanticen una respuesta adecuada a su tratamiento 3.
Brecha en el desarrollo farmacológico
El desarrollo de medicamentos para enfermedades infecciosas desatendidas (EID) se ve limitado por los altos costos que acarrean para la industria farmacéutica la investigación y el desarrollo de fármacos que representan un bajo atractivo comercial, puesto que ya existen tratamientos disponibles para las geohelmintiasis, además de que estas enfermedades se asocian principalmente a condiciones de pobreza y saneamiento básico deficiente.
Sin embargo, en la actualidad los avances técnicos y científicos introducen modelos más eficientes para la innovación farmacéutica en estas enfermedades. Ejemplo de ello son los grandes adelantos en genómica, el uso de técnicas de cribado de alta eficiencia para el descubrimiento de moléculas con potencial farmacológico, la ciencia abierta que favorece el intercambio de información sobre lo investigado en este tema, etc. Todas estas herramientas favorecen un estudio más completo de los modelos parasitarios responsables de las geohelmintiasis.
Además, son un camino para entender los mecanismos de acción de los antihelmínticos existentes, evaluar los posibles medios de resistencia que desarrollan los parásitos y hacer una búsqueda orientada de otros blancos terapéuticos a partir del estudio molecular detallado de los geohelmintos y su relación con el hospedero.
Transversal a la investigación de nuevos fármacos antihelmínticos hay que destacar la importancia de la disponibilidad e intercambio constante de información entre la academia y la industria para contribuir al desarrollo de tratamientos ante las denominadas enfermedades desatendidas, evitando obstáculos usuales de la competencia en investigación y producción. En ese sentido, la Plataforma de eliminación de helmintos (HELP, por sus siglas en inglés) conformada por instituciones sin ánimo de lucro, universidades y compañías farmacéuticas, interesadas en reducir e incluso eliminar estas parasitosis, según lo establecido por la OMS 14, cumple un rol crucial como propulsora en la producción de nuevos antihelmínticos a partir de la consolidación de la información y de las investigaciones disponibles hasta el momento, cerrando esa brecha intangible entre academia e industria farmacéutica.
El descubrimiento y desarrollo de fármacos implica diferentes etapas de investigación que requieren una inversión de tiempo y dinero para garantizar la obtención final de medicamentos eficaces, seguros y de calidad para el individuo que lo requiere. La investigación parte de comprender la patogenia, en este caso, conocer los mecanismos por los cuales el helminto logra establecerse en un organismo; y de esta forma identificar dianas terapéuticas y analizar su funcionamiento para eliminar los parásitos y prevenir la morbilidad asociada a ellos. Tradicionalmente se ha impulsado el descubrimiento de fármacos desde extractos naturales y a partir de allí el diseño y evaluación de las moléculas en diversas formulaciones hasta alcanzar la seguridad y eficacia requeridas. Debido a los altos costos y a la gran probabilidad de fallo que se asocia a ese desarrollo tradicional de medicamentos, la industria farmacéutica busca innovar en metodologías y tecnologías para la investigación y así acelerar el descubrimiento y garantizar un óptimo desarrollo de medicamentos. En el caso de las EID, como las geohelmintiasis, también ha sido relevante el fortalecimiento de técnicas de alto rendimiento, los avances en genómica y la divulgación científica. A continuación, se presentan los avances en la identificación de dianas terapéuticas y en el desarrollo de fármacos antihelmínticos desde las diferentes etapas en que se encontraban estos al momento de la publicación (tabla 1).
Tabla 1 Consolidado de dianas terapéuticas o fármacos en investigación para el tratamiento de las geohelmintiasis
| Geohelmintos* | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Etapa de investigación | Ascaris lumbricoides | Trichuris trichiura | Ancylostoma duodenale | Necator americanus | Strongyloides stercoralis | |||||
| Diana o fármaco | Ref. | Diana o fármaco | Ref. | Diana o fármaco | Ref. | Diana o fármaco | Ref. | Diana fármaco | Ref. | |
| In silico | 23 | Peroxirredoxina (AceParx-1) | 17 | Glutatión-s- transferasa 3 | 18 | |||||
| β Anhidrasa carbónica (AIBCA) | 24 | -- | -- | Receptor de acetilcolina acr-16 | 22 | Secuencias de microARN | 21 | -- | -- | |
| Receptor de acetilcolina ACR-16 | 22 | |||||||||
| Ciencias ómicas | Inhibidores tisulares de metaloproteasas (TIMPS) | 26 | Perhexilina | 27 | Perhexilina | 27 | Inhibidores tisulares de metaloproteasas (TIMPS) | 26 | ||
| Perhexilina | 27 | |||||||||
| Perhexilina | 27 | GenesSNR-3y LPP-1 | 32 | Genoma | 28 | |||||
| Proteínas intestinales | 35 | Base de datos proteómica | 36 | Gen de inhibición plaquetaria Ace-HPI | 33 | Proteoma de productos excretores/ secretores | 29 | |||
| Base de datos proteómica | 36 | Base de datos proteómica | 36 | |||||||
| In vitro | Transcinamal-dehído | 38 | Receptor x retinoide | 37 | Receptor nicotínico Aca- ACR-16 | 41 | ||||
| Receptor nicotínico ASU-ACR-16 | 39 | Transcinamal-dehído | 38 | HTS de compuestos químicos nematicidas | 42 | Derivados del 1-metil-1H-pirazol-5-carboxamida | 43 | -- | ||
| (S)-5-etinil-anabasina | 40 | |||||||||
| In vivo | Emodepsidey su producto pf1022a | 44 | Inhibidores de la catepsina K: odanacatiby K11777 | 46 | ||||||
| -- | -- | Fármacos tipo dihidrobenz[e] [1,4]oxazepina- 2(3H)-ona | 45 | Butaconazol, tadalafil y torin-1 | 48 | Hemoglobinasa aspártica-1 (APR-1) | 47 | -- | -- | |
| Butaconazol, tadalafiloy torin-1 | 48 | Econazol, sulconazol, pararrosanilina y cetilpiridinio | 49 | |||||||
| Investigación clínica | -- | -- | -- | -- | -- | -- | -- | -- | Moxidectina | 50 |
Aproximación experimental, diana o fármaco en estudio, geohelminto asociado a la infección humana (*estudiado directamente o en otros modelos parasitarios relacionados filogenéticamente), y referencias bibliográficas.
Fuente: elaboración propia.
Estudios in silico
El modelado computacional (o in silico) es el proceso por el cual, a partir de algoritmos, se desarrolla un modelo informático para realizar experimentos controlados 15. Esta estrategia se ha integrado al proceso de descubrimiento y desarrollo de fármacos ya que contribuye con el análisis eficiente de información de los modelos experimentales, la comprensión de mecanismos de acción a partir de la generación y testeo de múltiples hipótesis, el diseño ideal de estructuras químicas, entre otras 16.
El uso de estas técnicas para el desarrollo de antihelmínticos no ha sido la excepción. En 2013, por ejemplo, Nguyen et al. 17 publicaron un análisis estructural, biofísico y bioquímico de una peroxirredoxina (AcePrax-1) de A. ceylanicum. Estas enzimas proporcionan protección antioxidante al parásito además de tener funciones como chaperonas y moléculas de señalización. Este grupo de investigación evaluó su expresión, excreción/secreción y su conformación estructural en presencia de inhibidores de tipo Conoidin. Su análisis valida la AcePrax-1 como diana farmacológica en las infecciones por Ancylostoma y además propone el uso de Conoidin A como sonda química para evaluarla.
En este mismo año Kelleher et al. 18 presentaron la estructura de la glutatión-s-transferasa 3, puesto que en un trabajo previo 19 ya habían resuelto la estructura de las primeras dos transferasas de esta clase. Este grupo de enzimas es el principal sistema de desintoxicación y defensa ante el estrés oxidativo del Necator americanus. Este trabajo describe su expresión, purificación, cristalización y evaluación por rayos x para definir la estructura de la Na-GST-3, demostrando con estas técnicas que, en comparación con las estructuras previas, esta tiene un sitio de unión más grande, lo cual implica mayor posibilidad de interacción entre este y los principios activos. Los resultados de este trabajo forman parte de los esfuerzos por investigar proteínas de fases adultas de N. americanus para el desarrollo de vacunas recombinantes 20, así como nuevas dianas terapéuticas para la búsqueda de antihelmínticos con mecanismos de acción alternativos. En 2016 Kulkarni y Mittal 21 identificaron tres secuencias de microARN de N. americanus (miR-8308, miR-1175-3p miR-254). Estas secuencias de ARN no codificante regulan la expresión génica después de la transcripción y su identificación permite comprender mejor la biología de la enfermedad.
Los modelos parasitarios A. ceylanicum y N. americanus fueron utilizados en 2020 para estudiar el receptor ionotrópico de acetilcolina (ACR-16) debido al mecanismo de acción que tienen algunos antihelmínticos sobre canales iónico-colinérgicos 22. En este estudio se evaluó la farmacodinámica de antihelmínticos sobre ambas especies y, debido a la diferencia en sensibilidad de la respuesta, se utilizó un modelo de homología in silico para investigar los posibles cambios estructurales que explican estas en la unión del agonista. Los resultados demuestran la importancia de identificar estructuralmente los sitios del parásito asociados al mecanismo de acción antihelmíntica, pues aún en especies estrechamente relacionadas, se puede observar un espectro funcional diferencial; además, sugieren mecanismos explicativos para este.
En el campo de los estudios computacionales también se ha evaluado el modelo Ascaris lumbricoides. En 2015 Zolfaghari Emameh et al. 23 identificaron una β-anhidrasa carbónica (AIBCA) a partir de datos de secuenciación proteica y herramientas bioinformáticas como NCBI BLAST, InterPro, CATH/Gene3D y MetaCyc para definir la estructura de la AIBCA y su homología con proteínas de esta clase en otros nemátodos. En este estudio también se produjo AIBCA de forma recombinante para evaluar su cinética y desde el modelado computacional se evaluaron sus posibles roles en vías biológicas fundamentales para el parásito. En 2019 24 se publica la secuencia, análisis fisicoquímico, caracterización funcional y estructura 3D a partir de simulaciones de dinámica molecular de esta diana terapéutica. Los resultados estructurales expuestos son útiles para el diseño de fármacos antihelmínticos, especialmente desde esta diana terapéutica ausente en vertebrados.
Ciencias ómicas
El avance de las ciencias ómicas en la última década ha favorecido ampliamente el estudio de los helmintos. Estas herramientas experimentales permiten la investigación específica de los modelos parasitarios asociados a las geohelmintiasis y son una ventaja real ante la ausencia de recursos ómicos ya que el investigador debía recurrir a organismos modelo de vida libre debido a las dificultades implícitas para la obtención de los geohelmintos vivos en cantidades suficientes para su estudio o a replicar el ciclo de vida en ensayos in vitro25. Por eso, el respaldo ómico en la evaluación biológica de los geohelmintos estimula el progreso en la comprensión amplia de su fisiopatología y permite identificar dianas terapéuticas que antes del boom genómico pasaban inadvertidas en la evaluación de modelos homólogos.
Los inhibidores tisulares de metaloproteasas (TIMP, por sus siglas en inglés) son un ejemplo de objetivos farmacológicos de los cuales se carecía de información en modelos parasitarios humanos que habían sido caracterizados solo en algunos estudios para ancylostomas caninos. En 2013, gracias a las tecnologías de manipulación de genes se realizó una investigación de TIMP en Necator americanus, Ascaris suum, Clonorchis sinensis y Opisthorchis viverrini, entre otros 26. A partir de este estudio se identificaron 15 secuencias homologas de TIMP, se predijeron seis estructuras secundarias y se analizó su relación filogenética y la expresión de los genes codificadores de estas metaloproteasas en diferentes fases del desarrollo del Necator americanus y otros parásitos. Este trabajo es una primera aproximación a la descripción de esta familia proteica que participa en la remodelación de tejidos y otros procesos celulares, pero hace falta investigación funcional y estructural más detallada para entender su rol y su relevancia en la patología que ocasionan.
La disponibilidad de información ómica permite la identificación de mayor variedad de dianas terapéuticas basadas en los mecanismos moleculares de patogenicidad. En 2013 Taylor et al. 27 realizaron cribados quimiogenómicos de compuestos similares a fármacos existentes que fueran dirigidos a proteínas y reacciones clave en el desarrollo de diez especies de nematodos diferentes. Este estudio, basado en perfiles de expresión génica y evaluación in vitro de compuestos similares a fármacos sobre el nematodo C. elegans, condujo a la identificación de la perhexilina como una molécula antihelmíntica de amplio espectro, y ofreció un listado de dianas farmacológicas y compuestos similares a fármacos prioritarios para el descubrimiento de nuevos antihelmínticos.
En 2014 se informó la secuencia y ensamblaje del genoma de N. americanus28. Su análisis bioinformático permitió a Tang et al. identificar grupos moleculares involucrados en la invasión y en funciones de alimentación. El acceso al genoma del parásito marca una diferencia fundamental, pues por lo general los análisis moleculares para la identificación de blancos terapéuticos se desarrollan con la información de modelos nematodos de vida libre. Por tanto, contar con este genoma abre las puertas para entender los mecanismos moleculares reales para las infecciones ocasionadas por N. americanus. En este trabajo también se establecieron grupos moleculares específicos de Necator americanus, sugiriendo posibles objetivos de intervención farmacológica y moléculas de alto potencial diagnóstico. Otro gran avance respecto a este modelo parasitario consistió en la descripción del proteoma de productos secretores y excretores (es, por sus siglas en inglés) 29, mejorando la anotación preexistente del genoma e identificando las familias proteicas más abundantes del N. americanus. Logan et al. evaluaron las funciones de cada una de estas superfamilias y la expresión de cuatro de las proteínas SCP/TAPS para comprobar su grado de inmunogenicidad, y su potencial uso en diagnóstico o en elaboración de vacunas. Sin embargo, gran parte de las proteínas identificadas tienen funciones desconocidas por lo que aún queda mucho por investigar.
A. ceylanicum o A. caninum también son de alta relevancia en diferentes regiones, y debido a la capacidad de cultivar y obtener muestras de estas dos especies en modelos in vivo para ensayos de laboratorio, son las que se utilizan para modelar la biología y patogenicidad de los Ancylostomas 30. Así, a partir de muestras de A. ceylanicum evaluadas in vivo en hámsteres dorados, se pudo obtener una secuencia inicial de 313 Mb del genoma y caracterizar el transcriptoma de esta especie e identificar genes relevantes para los procesos de infección por Ancylostoma tanto en ensayos m vitro como en pruebas in vivo31. En 2015 Gao et al. identificaron dos genes que estarían relacionados con vías de desarrollo del parásito (SNR-3 y LPP-1) y que son diana del factor de transcripción DAF-16 que media diferentes vías en el nematodo C. elegans; posteriormente se determinaron sus patrones de expresión mediante ensayos in vitro y PCR cuantitativa en tiempo real para establecer que en la etapa L4 del parásito tienen un rol más importante 32.
Huang et al. 33 estudiaron el inhibidor plaquetario de A. ceylanicum asumiendo su relación con la manifestación de hemorragia intestinal causada por uncinarias, previamente vinculada con el inhibidor plaquetario (HPI) aislado de la especie homologa A. caninum. Por medio de técnicas bioquímicas y moleculares demostraron la expresión diferencial de este gen en todos los estadios del nematodo, que es mayor en fase adulta; determinaron su localización en esófago y glándulas cefálicas y estudiaron su actividad anticoagulante. Las evidencias señalan al gen Ace-HPI como una diana farmacológica importante para el desarrollo de fármacos y vacunas.
Para Ascaris lumbricoides se emplea, por lo general, el modelo porcino en investigación in vitro34. Ejemplo de ello es un análisis funcional y filogenético de proteínas intestinales de A. suum35 debido a su importancia en procesos de supervivencia del parásito como la digestión y absorción de nutrientes. Tras la obtención de las muestras intestinales del parásito e identificación de más de mil proteínas se desarrolló un análisis multiómico para analizar la conservación de estas proteínas respecto a otras especies de nematodos, hospedadores animales y humanos. Los resultados señalan proteínas intestinales altamente conservadas en nematodos, con funciones relevantes en la homeostasis de los parásitos. En 2015 Wang et al. 36 establecieron una base de datos proteómica a partir del análisis funcional de las secuencias de ARN obtenidas del material intestinal de Haemonchus contortus, Trichuris suisy Ascaris suum.
Estudios in vitro
En cuanto a la evaluación de fármacos antihelmínticos en 2014, sobre el modelo de trichuriasis, se estableció un estudio de motilidad y viabilidad del parásito con respecto a un antagonista del receptor X retinoide 37. Hurst et al. evaluaron la importancia de ese receptor en el desarrollo del Trichuris muris, a partir de pruebas in vitro y un análisis bioinformático del genoma que respalda los resultados obtenidos. Esta investigación pone de manifiesto una nueva diana farmacológica.
En 2015 se identificó el potencial antihelmíntico del extracto de canela a partir de ensayos in vitro de inhibición de la migración y la motilidad de los parásitos Ascaris suum y Trichuris suis38. Williams et al. concluyeron que el transcinamal-dehído es el componente del extracto de canela responsable de la actividad antihelmíntica.
También para A. suum se propiciaron estudios basados en el receptor nicotínico acr-16, que contaron con información referente a la identificación, a la localización y a la respuesta a agonistas de este receptor para Ascaris 39. Zheng et al. 40 evidenciaron los sitios de acoplamiento molecular para este receptor, evaluaron la expresión del Asu-acr-16 en Xenopus laevis y realizaron una caracterización farmacológica in vitro de derivados nicotínicos como la anabasina: mostraron que la (S)-5-etinil-anabasina es un compuesto líder por su potencia inhibitoria respecto a los otros derivados evaluados.
Posteriormente se realizó la caracterización de este mismo receptor en Ancylostoma caninum 41. Choudhary et al. compararon este receptor respecto a la información disponible de la misma diana en A. suum. Además, evaluaron la potencia de una serie de agonistas nicotínicos para establecer la sensibilidad del receptor y comprobaron que la 3-bromo cisteína fue el agonista de mayor potencia, y que ninguno de los fármacos colinomiméticos disponibles en la actualidad tiene efecto sobre Aca-ACR-16. En este estudio también se evaluaron antagonistas del receptor nicotínico resaltando la d-tubocurarina y la dihidro-β-eritroidina como inhibidores totales.
A partir de cribados de alto rendimiento Abrióla et al. 42 condujeron un ensayo de toxicidad de compuestos químicos para la larva L1 del A. ceylanicum, e identificaron más de 800 compuestos que inhiben la eclosión de esta especie. Se perfiló la búsqueda limitando los resultados a 59 compuestos con una actividad de al menos el 90 % respecto a fármacos comerciales y de alta selectividad por el parásito.
En 2019 se realizó un estudio de actividad, diseño basado en la relación estructura-actividad (SAR, por sus siglas en inglés), y selectividad in vitro de compuestos derivados del 1-metil-lH-pirazol-5-carboxamida 43. El interés en estos compuestos partió de información previa sobre la presencia de este grupo farmacóforo en dos compuestos capaces de inhibir la motilidad y desarrollo del parásito Haemonchus contortus, que guarda relación filogenética con la uncinaria N. americanus que infecta humanos. En este estudio, Le et al. examinaron los análogos SAR, cuyos resultados condujeron a dos análogos con actividad inhibitoria del desarrollo del parásito, evaluada también contra otras especies como A. ceylanicum y T. muris.
Estudios in vivo
En 2014 se evaluaron las propiedades antihelmínticas de ciclooctadepsipéptidos y aminofenilamidinas en el modelo trichuriasis murina 44. Ambos grupos de fármacos han demostrado su actividad antihelmíntica a partir de mecanismos de acción totalmente diferentes. Kulke et al. evaluaron la eficacia in vivo del amidantel, amidantel desacilado y tribendimidina (aminofenilamidinas), así como el emodepside y su producto natural de fermentación PF1022A (ciclooctadepsipéptidos) contra todos los estadios de Trichuris muris. Se demostró la relevancia de las moléculas tipo ciclooctadepsipéptidos en unidosis como tratamiento contra la trichuriasis.
También sobre esta especie de helmintos en 2017, Partridge et al. 45 realizaron una serie de pruebas ex vivo e in vivo de fármacos tipo dihidrobenz[e][1,4]oxazepina-2(3H)-ona, que fueron identificados en el cribado de una biblioteca de moléculas por ser compuestos capaces de ocasionar parálisis del parásito. En ensayos de motilidad se evaluó la actividad ex vivo de algunas moléculas hit del grupo y se encontró una relación dosis-respuesta; y finalmente se analizó la viabilidad de infección in vivo que demostró reducir la infectividad y abrió la puerta a su uso como un control ambiental.
Por otro lado, en relación con modelos de uncinarias encontramos un estudio que evaluó el odanacatib (un inhibidor de catepsina K que estaba en fase clínica para otro uso), junto con otro inhibidor de la proteasa catepsina cisterna (K11777), demostrando su actividad ante la infección por A. ceylanicum46. Vermeire et al. concluyeron que las propiedades farmacocinéticas del odanacatib eran las responsables del efecto inhibitorio contra la proteasa catepsina, mientras que la otra molécula evaluada demostró una potencia del 96 % contra la actividad de esta proteasa.
El desarrollo de pruebas en modelos animales permite la confirmación de dianas terapéuticas identificadas previamente. Ese es el caso de la hemoglobinasa aspártica-1 (APR-1) identificada por aproximaciones moleculares como diana viable para el N. americanus, y en 2018 fue evaluada por Bouchery et al. 47 en un modelo murino infectado con Nippostrongylus brasiliensis. Este estudio describe la vía de alimentación sanguínea que tiene el N. brasiliensis y cómo este factor es indispensable para el crecimiento del parásito. Además, se describe cómo la inmunización con la hemoglobinasa del N. americanus puede inhibir el desarrollo de este parásito, así como la relevancia de las quinolonas para bloquear la vía de alimentación sanguínea. Estos resultados se ven comprometidos por la distancia filogenética entre las uncinarias humanas y el modelo utilizado.
En 2019 se identificaron inhibidores enzimáticos de moléculas pequeñas a partir de una aproximación genómica, el posterior ensayo fenotípico in vitro de los compuestos hit y por último la evaluación in vivo de la eficacia de los compuestos líderes 48. Tyagi et al. realizaron el cribado de compuestos basados en las reacciones determinantes del metabolismo de 17 especies de nematodos que condujo a la identificación de tres compuestos que tuvieron un impacto significativo sobre la fecundidad del parásito: butaconazol, tadalafilo y torin-1.
En ese mismo año Elfawal et al.49 evaluaron el efecto en la motilidad y morfología de los fármacos sobre A. ceylanicum y C. elegans; posteriormente los resultados se analizaron a partir de herramientas quimioinformáticas contra T. muris. Con estas pruebas se reconocieron 19 fármacos con actividad antihelmíntica de amplio espectro, entre los cuales se seleccionaron cuatro compuestos para realizar pruebas in vivo: el nitrato de econazol, el nitrato de sulconazol, el clorhidrato de pararrosanilina y el clorhidrato de cetilpiridinio. Este estudio resaltó la actividad de la pararrosanilina sobre la fecundidad del parásito.
Investigación clínica
La moxidectina se identificó como un fármaco en evaluación clínica de fase 2. Hofmann et al. 50 evaluaron la eficacia y seguridad de dosis ascendentes, desde los 2 mg hasta 12 mg de este fármaco, en pacientes infectados por Strongyloides stercoralis en cuatro pueblos de Laos. Concluyeron que la dosis recomendada para realizar las evaluaciones clínicas posteriores en el tratamiento de estrongiloidiasis era de 8 mg, tanto por su perfil de seguridad y eficacia contra la especie responsable de esta infección, como porque es la dosis indicada también para el tratamiento de la oncocercosis. La moxidectina sería la única alternativa ante el tratamiento actual de la estrongiloidiasis, que es la ivermectina.
Conclusiones
El avance de la ciencia en técnicas de genómica y proteómica ha favorecido ampliamente el estudio selectivo, diferencial y complementario de los modelos parasitarios, abriendo la puerta a una comprensión más cercana de los mecanismos de interacción parásito-hospedero y permitiendo establecer dianas terapéuticas alternativas. Existen al menos siete candidatos a fármacos antihelmínticos que estarían ya en fase de investigación in vivo y se resalta la moxidectina como única molécula en fase de investigación clínica como alternativa para el tratamiento de la estrongiloidiasis.














