Introducción
La proteinosis alveolar pulmonar (PAP) es una patología rara descrita por Rosen, Castleman y Liebow en 1958, caracterizada por una obstrucción alveolar debido al acúmulo de surfactante pulmonar en el espacio alveolar. Su prevalencia oscila entre 3,7 y 40 casos por millón de habitantes 1.
Fisiopatología
El surfactante pulmonar es una sustancia tensoactiva producida y secretada por el neumocito tipo II, que previene el colapso alveolar y defiende al huésped de patógenos microbianos; el macrófago alveolar se encarga de su eliminación para lo que requiere la presencia del factor estimulante de colonias de granulocitos (GM-CSF) 2.
La enfermedad tiene lugar debido a la formación de anticuerpos antiGM-CSF que se unen con alta afinidad al GM-CSF, bloquean su efecto biológico y dan lugar a macrófagos alveolares disfuncionales, que producen acúmulo de surfactante y desechos celulares dentro del alvéolo 2.
Se conocen tres formas de PAP: la autoinmune que representa el 90 % de los casos y es ocasionada por anticuerpos antiGM-CSF. La secundaria que representa el 4 % de los casos y se origina por efectos tóxicos en los macrófagos producidos por toxinas, exposición ambiental a sílice, cemento, aluminio, talco, trastornos hematológicos, fármacos inmunosupresores e infecciones crónicas 2. Por último, la causa hereditaria que representa el 1 % de las ocurrencias, se presenta por mutaciones en la subunidad alfa o beta del receptor GM-CSF, mutación en SLC7A7, las proteínas B y C y el casete 3 de unión a ATP que son responsables de la regulación del surfactante pulmonar 3.
Manifestaciones clínicas
La PAP es más frecuente en adultos entre 20 y 50 años; sin embargo, puede afectar individuos de cualquier edad, con una relación hombre mujer de 2.6:1 y un predominio en pacientes fumadores en el 70 % de los casos 3,4. La presentación clínica de la PAP es inespecífica y altamente variable de acuerdo con estudios realizados en diferentes países (tabla 1) 5,6,7.
Tabla 1. Presentación clínica en pacientes con PAP 10
| Síntomas | Frecuencia (% de pacientes) | ||
|---|---|---|---|
| Disnea | 52 | 94 | 67 |
| Tos | 23 | 66 | 31 |
| Fiebre | 1 | 0 | 11 |
| Fatiga | 0 | 49 | 0 |
| Pérdida de peso | 0,4 | 43 | 0 |
| Asintomático | 31 | 0 | 5 |
| Estudio | Inoue5 | Bonella 6 | Campo 7 |
Fuente: elaboración propia.
Los pacientes con proteinosis alveolar tienen riesgo aumentado de presentar infecciones oportunistas por nocardia (43 %), mycobacterias (37 %) y hongos (20 %) 8.
El pronóstico de la enfermedad es impredecible. La supervivencia de la PAP autoinmune es del 95 % a 5 años cuando se da manejo con lavado pulmonar total 3. Por su parte, los pacientes con PAP secundaria tienen un tiempo de supervivencia de menos de 15 meses y la causa de muerte se da principalmente por las enfermedades hematológicas subyacentes (33 %), infecciones (25 %), insuficiencia respiratoria y complicaciones hemorrágicas. Hoy en día se sabe que la remisión espontánea ocurre en menos del 10 % de los pacientes 9.
Diagnóstico
Debido a que la presentación clínica de la PAP es inespecífica, el diagnóstico requiere una historia clínica compatible, hallazgos radiológicos típicos, citología de lavado broncoalveolar o biomarcadores 10.
Los hallazgos imagenológicos son sugestivos, pero no son diagnósticos por sí solos: en la radiografía de tórax es característico encontrar opacidades alveolares bilaterales de distribución perihiliar sin broncograma aéreo o “patrón en alas de murciélago”; por otro lado, en la tomografía computarizada (TAC) se espera encontrar el signo del “empedrado” que consiste en un engrosamiento interlobulillar asociado a opacidades difusas en vidrio esmerilado 9,11.
El patrón restrictivo en la espirometría es el más común en estos casos; sin embargo, no es necesario para el diagnóstico de PAP. Usualmente no se requieren biopsias para el diagnóstico, pero podrían llegar a ser útiles 10.
Con frecuencia el diagnóstico definitivo se establece con el lavado broncoalveolar en el cual se observa líquido de aspecto lechoso y opaco característico del PAP junto con un examen citológico que evidencia macrófagos grandes, espumosos, con material amorfo que tiñe PAS positivo, con predominio de linfocitos 10.
Recientemente se han venido desarrollando pruebas de anticuerpos IgG antiGM-CSF que se han descrito con sensibilidad y especificidad cercana al 100 % para el diagnóstico de PAP. Esta prueba se realiza mediante Elisa o mediante aglutinación con látex 10. Un nivel de anticuerpos antiGM-CSF de 2,8 microgramos/ml o más es anormal y es compatible con la PAP 12.
Tratamiento
El tratamiento se realiza dependiendo de la gravedad de los síntomas. A los pacientes con disnea leve o asintomáticos se les brinda cuidado de soporte y monitorización de las pruebas de función pulmonar 2.
Para los pacientes con disnea en reposo, PaO2 menor de 65 mmHg, gradiente alveolo arterial en reposo mayor de 40 mmHg o desaturaciones de oxígeno en la prueba de caminata de 6 minutos está indicado el lavado pulmonar total, procedimiento que se realiza bajo anestesia general con tubo endotraqueal de doble lumen. Se considera que este es el tratamiento de elección como primera línea 10.
Existen terapias alternativas de segunda línea como:
Se ha encontrado que la mejoría después de las inyecciones de GM-CSF es más lenta con respecto al lavado pulmonar estándar, por lo que es una terapia en desuso y en la actualidad es vista como una terapia alternativa 2.
La plasmaféresis y el rituximab son terapias alternativas para la PAP refractaria al lavado pulmonar completo 10. Por otro lado, la única terapia probada para la PAP secundaria es el tratamiento de la enfermedad subyacente. También se ha descrito el trasplante alogénico de células madre hematopoyéticas; no obstante, hay pocos estudios que evidencien resolución completa de la PAP secundaria después del trasplante 13.
Por su parte la PAP congénita se puede beneficiar del lavado pulmonar, aunque este no es curativo. Se han realizado estudios con terapia génica en animales y trasplantes de macrófagos pulmonares que dan como resultado la completa resolución de la PAP, pero esta terapia conlleva a riesgos potenciales de enfermedad injerto contra huésped e infecciones oportunistas 14.
La utilización de corticoides puede empeorar el cuadro clínico; por esta razón se debe evitar su uso, en razón a que estimulan aún más la producción de surfactante pulmonar, favorecen su acumulación y aumentan el riesgo de infecciones pulmonares 10.
Reporte de caso
Paciente masculino de 32 años de edad residente en Bogotá, desempleado hace dos años con antecedente de neumopatía crónica sin etiología clara con requerimiento de oxígeno suplementario a bajo flujo hace dos meses. Niega tabaquismo, quien consulta al servicio de urgencias por exacerbación del cuadro hace cinco días consistente en tos sin expectoración, disnea progresiva en el momento clase funcional III/IV asociada a pérdida de peso de 2 kg en los últimos dos meses, sensación de escalofríos, dolor en hemitórax izquierdo no irradiado de intensidad 7/10. Al examen físico de ingreso, paciente con murmullo vesicular disminuido con predominio en hemitórax derecho y crépitos finos en ambas bases pulmonares, afebril, desaturado al ambiente, con acropaquia, sin signos de dificultad respiratoria.
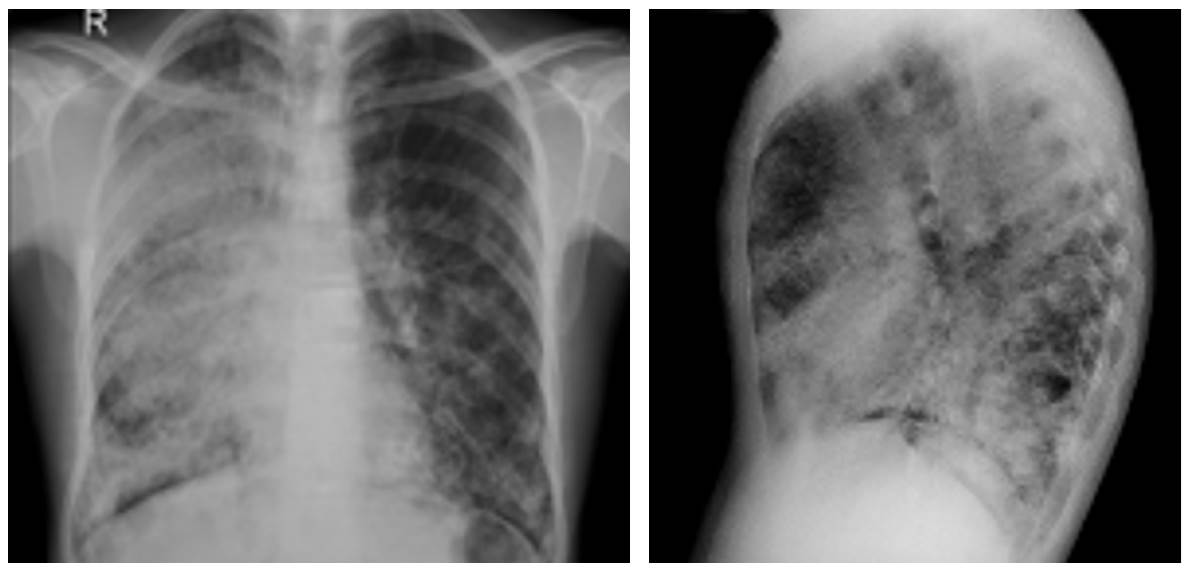
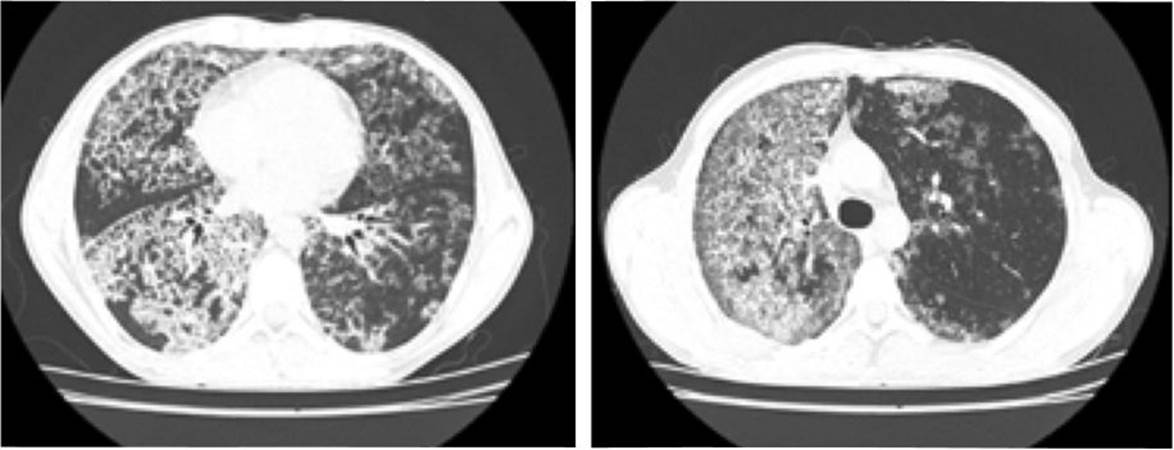
Al ingreso se solicita hemograma con leucocitos: 6300 x 103 mm3, #neutrófilos: 4020, #linfocitos: 1600, hemoglobina: 17,9 g/dl, hematocrito: 53,2 %, plaquetas: 315.000 mm3, radiografía de tórax con evidencia de zonas en vidrio esmerilado generalizadas con predominio en hemitórax derecho (figura 1) por lo cual se solicita tac que evidencia múltiples áreas parcheadas de distribución generalizada de mayor compromiso apical derecho en relación con áreas de vidrio esmerilado asociado a engrosamiento del intersticio interlobulillar que genera patrón en “empedrado” (figura 2).
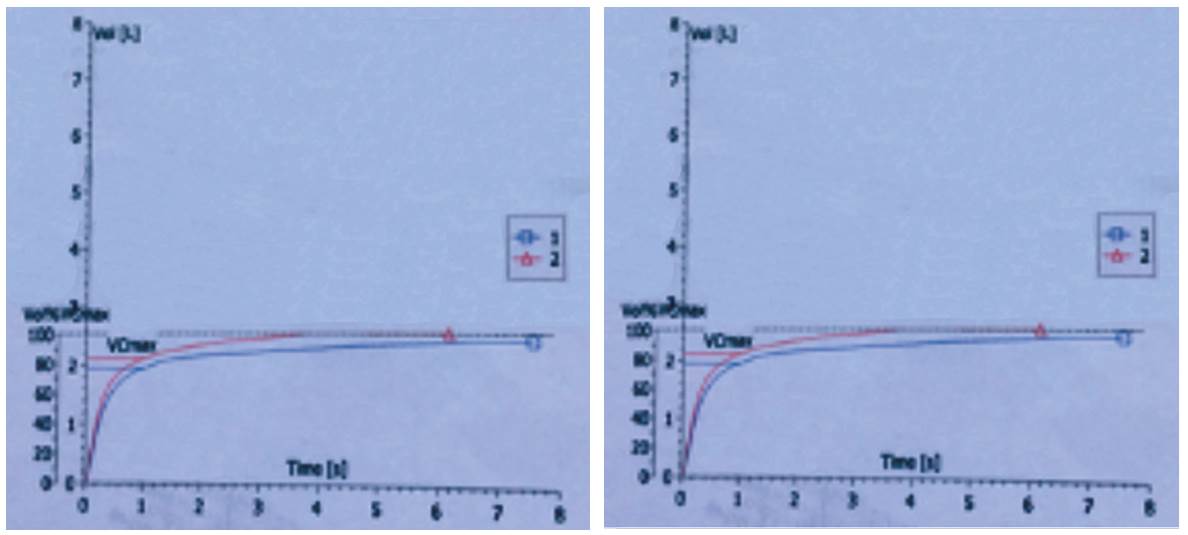
Se inició manejo con salbutamol 50 microgramos 4 puff cada seis horas, bromuro de ipratropio 2 puff cada seis horas, prednisona 20 mg vo día sin mejoría de la oxigenación, por lo que se solicitan paraclínicos para estudio de neumopatía crónica (ANAS, p y C ANCAS, factor reumatoideo, VIH, baciloscopias seriadas) cuyos resultados son negativos. Se solicita espirometría (figura 3) con CVF 2400 mi (50,8 %), VEF1: 1950 mi (49,3 %), VEF1/CVF: 80,9 % interpretada como alteración ventilatoria restrictiva moderada sin respuesta al broncodilatador. Ecocardiograma transtorácico con función sistólica biventricular conservada (FEVI 65 %), insuficiencia tricuspídea leve, signos indirectos de hipertensión pulmonar PSAP: 34 mmHg.
De acuerdo con los resultados paraclínicos quienes sospechan proteinosis alveolar solicitan valoración por neumología por lo cual consideran pertinente la realización de fibrobroncoscopia con lavado broncoalveolar. En la citología evidencian macrófagos, células escamosas y polimorfonucleares sobre un fondo proteináceo junto con cambios por mala preservación, coloraciones especiales: Diff Quick, Ziehl Neelsen, Grocott, PAS positivo. Finalmente, en virtud del contexto de un paciente joven con disnea, deterioro progresivo de la clase funcional sin enfermedad cardiovascular, junto con TAC de tórax con certeza de patrón en “empedrado” y lavado broncoalveolar con presencia de macrófagos con tinción PAS positivo, se realiza el diagnóstico de proteinosis alveolar. Por esta razón se instaura tratamiento con lavados broncoalveolares totales con posterior mejoría de oxigenación, pero con persistencia de requerimiento de oxígeno a bajo flujo por las noches. Al paciente se le da egreso con bromuro de ipratropio 2 puff cada ocho horas y seguimiento ambulatorio por neumología para evaluar progresión de la enfermedad.
Discusión
Se considera que el paciente presentó una PAP probablemente de etiología autoinmune (responsable del 90 % de los casos) debido a que el debut fue en la edad adulta y la ausencia de antecedentes exposicionales, infecciosos o hematológicos hacen menos probable una etiología congénita o secundaria 2. La ausencia de antecedente tabáquico contrasta con lo descrito en la literatura debido a que este se encuentra presente en el 70 % de los pacientes con PAP 4,15. Nuestro paciente debutó con una disnea leve de dos meses de evolución con requerimiento de oxígeno suplementario a bajo flujo asociado a pérdida de peso y acropaquias. El hemograma inicial evidenció una poliglobulia secundaria a hipoxemia de larga data, que posteriormente se exacerba presentando tos sin expectoración y dolor torácico, lo cual concuerda con la clínica característica de la PAP 5,6,7. La TAC con patrón en “empedrado” y la espirometría con patrón restrictivo son pruebas inespecíficas para el diagnóstico, pero fueron de gran utilidad a la hora de establecer la sospecha clínica inicial de PAP 9,10,11, posteriormente confirmada mediante lavado broncoalveolar que evidenciaron macrófagos con material amorfo PAS positivo, tal como está descrito en la literatura 10.
Vale la pena destacar que, dentro de la conducta inicial al ingreso del paciente, la administración de corticoides como la prednisona pudo haber empeorado el cuadro clínico porque estimula la producción de surfactante pulmonar y aumenta el riesgo de infecciones pulmonares concomitantes 10. Una vez confirmado el diagnóstico de PAP se estableció manejo de primera línea con lavado broncoalveolar total presentando buena evolución clínica sin requerimiento del uso de terapias alternativas.
Conclusiones
La PAP es una condición poco frecuente; sin embargo, es de vital importancia incluirla como diagnóstico diferencial en todo paciente con disnea, tos sin expectoración, tac con patrón en “empedrado” y espirometría con patrón restrictivo. Teniendo en cuenta la rareza de esta enfermedad es importante descartar previamente patología reumatológica o infecciosa como SARS-CoV-2. Es indiscutible la indudable escasez de estudios que involucren a pacientes con PAP, por lo cual la epidemiología de la enfermedad en Colombia aún es desconocida.