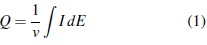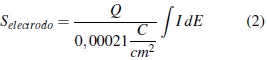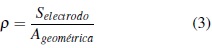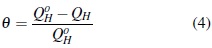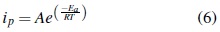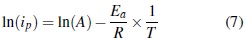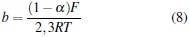Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia en Desarrollo
Print version ISSN 0121-7488
Ciencia en Desarrollo vol.4 no.2 Tunja July/Dec. 2013
Síntesis y caracterización voltamperométrica de electrodos platinados dopados con cerio, empleados para la degradación de 4-clorofenol
Synthesis and Voltammetric Characterization of Plated Electrodes Doped with Cerium, Used for Degradation of 4-Chlorophenol
Wilquin Farid Peña Scarpettaa,*
Jhonny Fernando Villard Gutiérreza
Alfonso Enrique Ramíreza
Evgenii Nikolaevish Kolosovb
a Docente Departamento de Química de la Universidad del Cauca, Popayán, Colombia.
* Correo electrónico: wilquin.farid@gmail.com.
b Docente, Universidad Amistad de los Pueblos de Rusia, Orjenikidse, Moscú, Rusia.
Recepción: 23-jul-12 Aceptación: 15-oct-12
Resumen
Este trabajo se fundamenta en la elaboración de catalizadores platinados (Pt/Ti) y platinados dopados (Ce/Pt/Ti), que se crean por regla general basándose en la formación de una película que actúa como recubrimiento sobre una superficie conductora (titanio), por el método de electrodeposición en régimen galvanostático. Sobre los electrodos sintetizados, y con base en la reacción de electrooxidación del 4clorofenol, se evaluaron parámetros como la influencia del tiempo durante la electrodeposición y su incidencia en la magnitud de las irregularidades superficiales, y el factor de recubrimiento de los electrodos en el sistema reaccionante; así como parámetros que describen el comportamiento electroquímico de los electrodos.
Palabras clave: 4-Clorofenol, electrodeposición, caracterización de electrodes.
Abstract
This work is founded on preparation of platinum catalysts (Pt/Ti) and platinum-doped systems (Ce/Pt/Ti), which are generally obtained by formation of a film that acts as a coating on a conductive surface (titanium) by electro-deposition method under galvanostatic regime. On synthesized electrodes, and based on the reaction of electro-oxidation of 4-chlorophenol, we evaluated parameters such as the influence of time during the electro-oxidation and its effect on the magnitude of the surface irregularities and the covering factor of the electrodes in the reaction system; likewise, the parameters that describe the electrochemical behavior of the electrodes.
Keywords: 4-Chlorophenol, Electrodeposition, Electrode characterization.
1. Introducción
Los plaguicidas organoclorados (OC) se encuentran ampliamente distribuidos en ambientes terrestres y acuáticos, debido a que en las últimas dos décadas han sido utilizados indiscriminadamente para combatir plagas en la industria, la agricultura, e incluso durante las campañas de salud donde son aplicados para contrarrestar enfermedades como la malaria. Sus propiedades fisicoquímicas los hacen muy resistentes a la degradación biológica, por lo que permanecen durante largos periodos en el medio ambiente. Por causa de su espectro de distribución y difícil biodegradación, estos contaminantes representan una seria amenaza para la salud pública y para la mayoría de las formas de vida, pues son compuestos altamente tóxicos que inducen mutagénesis (alteración del ADN o de los cromosomas), teratogénesis (malformaciones en el embrión) y alteraciones sobre una gran variedad de funciones metabólicas y de reproducción[1]. Además, estos agentes químicos son también liposolubles, lo que significa que tienen tendencia a concentrarse en los tejidos adiposos de los seres vivos a lo largo de su vida. Los efectos bioacumulativos de estos compuestos se manifiestan, generalmente, al incrementar su concentración conforme se asciende en la cadena trófica o alimentaria [2].
Los problemas medioambientales que generan los compuestos organoclorados, tales como el 4clorofenol, hacen imperante el desarrollo de métodos de remediación medioambiental, que disminuyan el efecto contaminante causado por la deposición de estas sustancias en el entorno. Dentro de la gran gama de métodos estudiados recientemente, se ha elegido la degradación electroquímica, ya que es un método que garantiza la remoción selectiva de los átomos de cloro a partir de la estructura del compuesto organoclorado a través de un proceso catódico, seguido de la posterior oxidación de dichos compuestos, que se da gracias a un proceso anódico, lo cual conduce a la obtención de compuestos altamente oxidadostales como ácido acético, ácido oxálico, formaldehido, ácido fórmico y en su mayoría dióxido de carbono [3, 4].
El electrodo que interviene en una reacción electrocatalítica suele encontrarse recubierto por átomos o moléculas adsorbidas o electroadsorbidas, a través de procesos de síntesis de películas de diferente grosor, formadas por un compuesto químico (metal, sal, óxido o polímero). Desde este punto de vista, pueden distinguirse dos tipos principales de electrocatalizadores: 1) los que están constituidos por una fase conductora, cuya superficie esté modificada por especies adsorbidas o electroadsorbidas hasta formar una monocapa que constituye, en algunos casos, una fase bidimensional. En este caso, la interfase puede constituirse como fase conductora/adsorbato/electrolito. Esto sucede, por ejemplo, con los metales nobles y sus aleaciones, metales implantados y los electrodos recubiertos con otros metales depositados a subpotenciales; y 2) aquellos formados por una fase conductora recubierta por verdaderas fases tridimensionales, como son los que constituyen interfaces metal/óxido/electrolito. En ambos tipos de electrocatalizadores, la interfase adquiere una configuración compleja y su utilidad práctica depende de la conductividad electrónica del electrocatalizador, su estabilidad a la corrosión y su actividad superficial, definida ya sea en términos físicos, por la densidad de estados superficiales, o en términos químicos, por los correspondientes procesos de adsorción [5]. Ejemplos de estos sistemas son los electrodos de platino platinado (Pt/Pt), titanio platinado (Pt/Ti), titanio platinado dopado con plomo (PbO2-Pt/Ti), etc., donde se utiliza una lámina conductora de platino o titanio, la cuales manifiestan diferentes conductividades eléctricas, siendo mayor la del platino. Según los reportes realizados por Gutiérrez y Kolosov [6], los electrodos de platino platinado y titanio platinado degradan completamente la molécula de 2,4-diclorofenoxiacetato de sodio hacia moléculas de mayor grado de oxidación y alcanzan porcentajes de remoción de carbono orgánico total del 30%, durante un periodo de reacción de ocho horas en ambos casos. Teniendo en cuenta que el platino es mejor conductor, se esperaría que el electrodo de platino platinado manifestara mayor electroactividad, pero las electroactividades de los dos electrodos se igualan, ya que al depositar platino en la matriz de titanio no se alcanza un estado de equilibrio entre las dos fases. Esto revela una estrecha relación entre la actividad electrocatalítica y la posibilidad de contar con un exceso de energía libre superficial, como consecuencia de configuraciones metaestables; situación que se relaciona con el comportamiento dinámico de la superficie electrocatalítica [5, 7].
El uso de electrocatalizadores se presenta como una alternativa para la limpieza y degradación de las sustancias orgánicas que contaminan el agua. Si bien el Ti/Pt y el Pt son materiales que se han trabajado comúnmente, suelen inactivarse en el proceso de oxidación. Tanto el Ti/Pt como el Pt pueden presuponer un efecto de envenenamiento por monóxido de carbono y la formación de compuestos poliméricos en su superficie, pero su dopaje podría evitar su inactivación, lo que los convertiría en electrocatalizadores muy llamativos para el empleo en la descontaminación del agua [6].
Los sistemas electroquímicos se pueden evaluar a través de mediciones realizadas utilizando técnicas potenciodinámicas, donde se obtiene como respuesta una corriente originada al variar el potencial en función del tiempo, o sea, que de esta manera se valoran parámetros que definen las características de un electrodo [8]. A través de la técnica de voltamperometría cíclica aplicada a los electrodos preparados utilizando como electrolito soporte una solución 0,5 M de ácido sulfúrico, se estudiaron parámetros como la influencia del tiempo durante la electrodeposición y su incidencia en la magnitud de las irregularidades superficiales y el factor de recubrimiento de los electrodos en el sistema reaccionante; así como parámetros que describen el comportamiento electro-químico de los electrodos, como el coeficiente de transferencia de carga, la energía aparente de activación, la corriente de intercambio y su influencia en la actividad electrocatalítica; todo esto para la reacción de electrooxidación del 4-clorofenol.
2. Sección experimental
2.1. Síntesis de electrodos de titanio platinizado
Los electrocatalizadores soportados (Pt/Ti) se elaboraron utilizando láminas de titanio (Goodfellow, diametro: 0,5 mm, 99,6%) con un área geométrica aproximada de 4 cm2, que fue limpiada previamente por abrasión física con una lija número 360, y abrasión química sumergiendo las láminas lijadas en una solución de ácido oxálico (Carlo Erba, 98,5%), y calentada a punto de ebullición hasta obtener una solución de color café que corresponde a la formación de oxalato de titanio. El recubrimiento se efectuó a régimen galvanostático aplicando una densidad de corriente de 0,3 mA/cm2 en una solución 0,01M de K2PtCl6 (Acrosorganics, 40% Pt) con intervalos de tiempo que varían entre una y doce horas. Posteriormente se realizaron curvas potenciodinámicas para determinar parámetros electrocatalíticos como área específica y coeficiente de rugosidad, y frente a estos resultados se determinó el tiempo de electrodeposición mediante el cual se obtienen mejores resultados.
Antes de su caracterización, estos electrodos fueron estabilizados haciendo curvas voltamperométricas en un intervalo de potencial de 0 a 1,5 V durante una hora, a una velocidad de barrido de 20 mV/s.
2.2. Dopaje de los electrodos de titanio platinizado
El dopaje de los electrodos se efectuó a régimen galvanostático, aplicando una densidad de corriente de 0,8 mA/cm2, y utilizando electrodos Pt/Ti recién preparados y una solución 0.01M de Ce(NO3)3· 6H2O (Merck, 99%), en intervalos de tiempo que varían de diez a setenta segundos.
Para seleccionar el electrodo dopado con mejor electroactividad, se realizaron curvas potenciodinámicas con soluciones de electrolito soporte (H2SO4 0.5M) y 4-clorofenol 0.01M (Merkc, 98%).
2.3. Estudio de los parámetros electroquímicos
El estudio del comportamiento electrocatalítico de los electrodos se llevó a cabo por voltamperometría cíclica y usando una solución 0,5M de H2SO4 (Suprapure Merck, 96%), una celda convencional de tres electrodos de 40 mL a temperatura ambiente, junto con un Potenciostato-Galvanostato EL-02,06 Ressiskogo; el sistema fue desgasificado aplicando un flujo continuo de nitrógeno gaseoso. Como electrodos de trabajo se utilizaron los electrocatalizadores Pt/Ti y Ce/Pt/Ti; el electrodo de referencia fue de plata-cloruro de plata (ESR-10101, de fabricación rusa) y como electrodo auxiliar se usaron láminas de grafito o platino. A través de la toma de curvas voltamperométricas se determinaron las mejores propiedades de los sistemas catalíticos preparados, dentro de los cuales son de particular interés la medición del área superficial, el coeficiente de rugosidad, el grado de adsorción de las sustancias en la superficie del electrodo, la energía aparente de activación y finalmente los parámetros de interés desde el punto de vista cinético, tales como: potencial de estado estacionario, corriente de intercambio y coeficiente de transferencia de carga. Todo esto, por medio de la variación de algunos parámetros, como la concentración del 4-clorofenol, temperatura y potencial aplicado. Las medidas potenciométricas consistieron en el registro de las curvas I-E, en un intervalo dado de potenciales, con una velocidad de barrido de 20 mV/s.
3. Resultados y discusión
3.1. Síntesis y caracterización de electrodos platinizados y platinizados dopados con cerio
Para el platinado de las láminas de titanio, se escogió el método de síntesis por electrodeposición utilizando sales de platino disueltas en un medio acuoso bajo régimen galvanostático, ya que este permite localizar las partículas catalíticas en la superficie del electrodo soporte, lo más próximo posible a la solución electrolítica, además no requiere tratamientos de calentamiento (oxidativo y/o reductivo), pues no necesita o involucra solventes o reactivos orgánicos, como sucede con la mayoría de los métodos de síntesis químicos, situación que lo convierte en un proceso limpio. Este es un proceso sencillo y muy reproducible, de mucho interés para el desarrollo industrial. Este método también hace posible el control de la composición atómica del catalizador y permite preparar catalizadores mono, bi o incluso trimetálicos. Para la síntesis de electrodos platinados, se aplican frecuentemente densidades de corriente de 20 mA/cm2 entre dos electrodos, donde una sal metálica, como el hexacloroplatinato de potasio, es reducida en el electrodo de trabajo y dicho metal se deposita directamente formando partículas nanométricas [9].
En este trabajo, se aplicó una densidad de corriente de 0,3 mA/cm2, a fin de optimizar el proceso de electrodeposición, ya que si se utilizan densidades de corriente bajas, se tiene un buen control sobre la velocidad de nucleación de las partículas, el tamaño de partícula y, por lo tanto, sobre la magnitud de irregularidades superficiales en el electrodo. Cuando se usan densidades de corriente tan altas como 20 mA/cm2, no solo se dificulta controlar la velocidad de nucleación de las partículas, sino que se da una pérdida del platino en solución por precipitación de micropartículas de platino cerovalente, que disminuye la efectividad del proceso. Se ha establecido que la principal limitación de este método consiste en el bajo rendimiento farádico para la electrodeposición de metal en el soporte del electrodo, por lo que se requieren largos tiempos para obtener buenos resultados. Por ejemplo, para preparar un electrodo de carbono platinado, solo se alcanza un rendimiento farádico del 10% [9]. Hay que resaltar que al utilizar una densidad de corriente tan baja, incrementa el rendimiento farádico, que para este caso fue del 34%.
El dopaje de los electrodos platinizados se realizó aplicando una densidad de corriente de 0,8 mA/cm2, la cual es mayor que la utilizada para la platinación. Para este caso es necesario emplear una densidad de corriente mayor, a fin de garantizar la deposición preferente de cerio cerovalente en la superficie del electrodo. Se debe tener en cuenta que el cerio metálico reacciona de forma espontánea y en ocasiones violenta, cuando entra en contacto con el agua, puesto que forma óxido de cerio (IV) e hidrógeno gaseoso, y disminuye la eficiencia en el dopaje. Por esta razón, cuando se aplica una densidad de corriente menor a la mencionada, no se logra obtener electrodos dopados con buenas electroactividades.
3.2. Medición del área superficial por voltamperometría cíclica
La voltamperometría cíclica es una técnica que ha sido extensamente utilizada para determinar el área superficial (como área superficial electroquímicamente activa) de electrocatalizadores, que tienen la facultad de sufrir adsorción-desorción de hidrógeno en medio ácido, particularmente, los metales del grupo del platino. A partir de los estudios efectuados con anterioridad, se ha concluido que la voltamperometría cíclica es un buen método para obtener información sobre el área superficial de los electrodos, pero debe prestarse especial atención a los procesos de estabilización de los electrocatalizadores. Hay que tener en cuenta que la presencia de un flujo de gas inerte en la celda electroquímica afecta los procesos de adsorción-desorción de hidrógeno, teniendo así una marcada influencia en los resultados voltamperométricos [10].
El área de los electrodos Pt/Ti y Ce/Pt/Ti se determinó mediante la integración de la corriente de desorción de hidrógeno en soluciones de ácido sulfúrico, considerando que la capacidad de la doble capa eléctrica no varía con el potencial y que sobre la superficie del electrocatalizador se adsorbe un átomo de hidrógeno por cada átomo de platino presente en la superficie, formando de esta manera una monocapa de hidrógeno en un rango de potenciales que va desde 0,09 hasta 0.4 V.
En este rango de potenciales, se obtienen dos picos cuya área es proporcional a la carga coulómbica intercambiada para la adsorción de hidrógeno, la cual se puede calcular de la siguiente manera:
Donde se asume que por cada átomo de platino en la superficie del electrodo, se adsorbe un átomo de hidrógeno, Q representa la cantidad de carga requerida para la desorción de una monocapa de hidrógeno, v hace referencia a la velocidad de barrido de potencial en milivoltios por segundo, dE e I son concordantes con el cambio de potencial en el intervalo de 0,09 a 04 voltios y la corriente de celda respectivamente [11, 10].
Relacionando la carga medida por voltamperometría cíclica con la carga teórica requerida para formar una monocapa de hidrógeno sobre un centímetro cuadrado de platino (0,0021 C/cm2), es posible determinar el área electroactiva de un electrodo.
Para comparar la actividad catalítica de diferentes electrodos, es necesario establecer una relación entre el área electroactiva y el área geométrica del electrodo en cuestión, calculando así, el coeficiente de rugosidad [12, 13].
Se debe prestar especial atención a la contribución de carga de la doble capa eléctrica, por lo que es necesario restarla de la carga obtenida a partir del pico de desorción de hidrógeno.
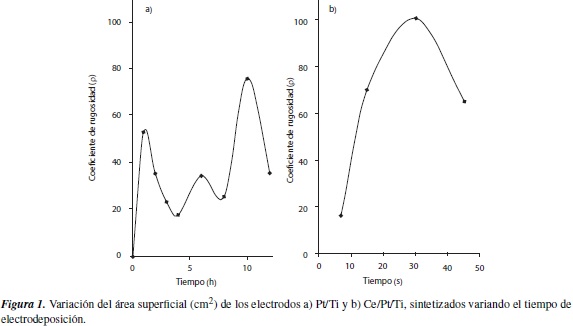
En la figura 1a, se observa que los electrodos sometidos al proceso de electrodeposición galvanostática durante diez horas, manifiestan un mayor coeficiente de rugosidad, el cual presenta un valor de 76. Hay que resaltar que a medida que avanza el proceso de electrodeposición, muestra un comportamiento particular, dado por procesos de formación de partículas de platino en la superficie del soporte, del cual depende el grado de irregularidades superficiales.
En el gráfico se pueden encontrar tres máximos de área para los electrodos obtenidos después de realizar la electrodeposición por dos, seis y diez horas, que se relacionan con los procesos de formación de partículas superficiales estables; y una caída drástica del valor de área entre una y tres horas, y a ocho horas, que corresponde a un proceso de crecimiento de las partículas formadas y como consecuencia de ello, una homogeneización de la estructura superficial. A partir del gráfico, se puede intuir que los puntos del proceso en que se alcanza cada máximo de área superficial electroactiva, corresponden a un alto grado de irregularidades superficiales con la posterior formación de una monocapa en forma bidimensional epitaxial. Sobre este depósito, se da inicio a la segunda o tercera monocapa, constituyendo sobre estas, núcleos tridimensionales que al crecer dan lugar a una respuesta electroquímica similar a la del Pt policristalino.
Un método de gran utilidad para modificar las propiedades superficies de los electrodos, es la inserción de dopantes, los cuales son impurezas que son depositadas de manera controlada en su superficie. Cuando los electrodos se preparan a través de métodos de electrodeposición, el control en la inserción de dichas impurezas se logra mediante la aplicación de densidades de corriente bajas, tiempos regulados y soluciones que contienen bajas concentraciones del dopante que se va a electrodepositar.
Cuando la superficie del electrocatalizador platinado se modifica adicionando dopantes, se busca alterar el sobrepotencial de desprendimiento de oxígeno. Dicho proceso de evolución sufre un desplazamiento de potencial, por lo que es posible incrementar la eficiencia en la producción de moléculas con alta capacidad oxidante, derivadas de la hidrólisis del agua, como son los radicales hidroxilo.
En la figura 1b, se observa un máximo en la curva, correspondiente a un coeficiente de rugosidad de 101, siendo este el mejor resultado para los electrodos Ce/Pt/Ti preparados.
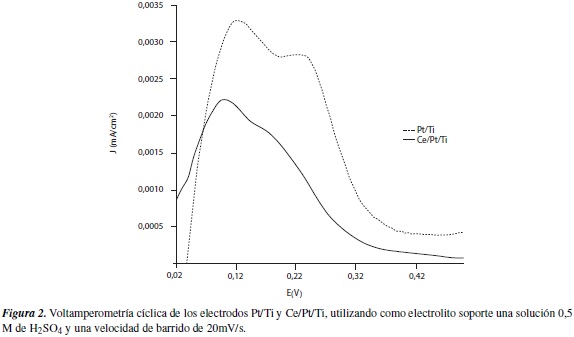
A partir de los resultados obtenidos, se puede determinar que la presencia de cerio como dopante superficial, favorece la formación de una estructura cristalina bien definida para las partículas de platino (figura 2), ya que estas manifiestan una mejor resolución de las señales de corriente correspondientes a las caras cristalinas con mayor electroactividad —el pico que se presenta en el potencial más negativo, se ha asociado con la adsorción de cristales de Pt(100), y el pico en el potencial más positivo, con adsorción Pt(111) [11]—, además favorece el incremento en la cantidad de irregularidades superficiales, lo que se contrasta con el aumento del valor del coeficiente de rugosidad.
Todo lo anterior conduce a concluir que desde el punto de vista del estudio del área superficial electroactiva, el cerio actúa como un dopante promotor, ya que disminuye el efecto de la sinterización de las partículas de platino durante el proceso de estabilización del electrodo, incrementando así el coeficiente de rugosidad del mismo.
3.3. Actividad electrocatalítica
La síntesis de electrodos platinados es de gran utilidad, puesto que marca una pauta en la investigación de procesos electrocatalíticos. En estudios anteriores se ha reconocido que el platino manifiesta buenas características en aplicaciones como la oxidación de sustancias orgánicas en diversas reacciones promovidas por sistemas enmarcados en la catálisis heterogénea. Pero debe tenerse en cuenta que la presencia de ciertas sustancias en un sistema reaccionante, con frecuencia en cantidades absolutamente insignificantes, es capaz de disminuir o extinguir por completo la actividad del catalizador. Típicos venenos de algunos catalizadores basados en metales del grupo del platino, son compuestos de azufre (H2S, CS2, tiofeno, mercaptanos, etc.), el ácido clorhídrico y algunos de sus productos, el monóxido de carbono, los halógenos libres, el mercurio y sus sales, los compuestos de fósforo, arsénico, plomo y otros[14]; por lo que, en la actualidad, la investigación en este campo ha dirigido su atención hacia el desarrollo de electrodos dopados que manifiesten mayor resistencia a los efectos de envenenamiento descritos anteriormente. Por esta razón, se da inicio al estudio de la actividad electrocatalítica de electrocatalizadores de titanio platinado y de titanio platinado modificado a través de la inserción del cerio como dopante, frente a la electrooxidación de 4-clorofenol.
El método utilizado para modificar las propiedades de las superficies de los electrodos platinados, es la inserción de cerio, que actúa como una impureza que es depositada de manera controlada en su superficie. En este caso, los electrodos son preparados a través del método de electrodeposición, en el cual, el control en la inserción de cerio se realiza teniendo en cuenta la necesidad de aplicar densidades de corriente bajas, regular el tiempo de la deposición y la concentración del dopante que se va a electrodepositar.
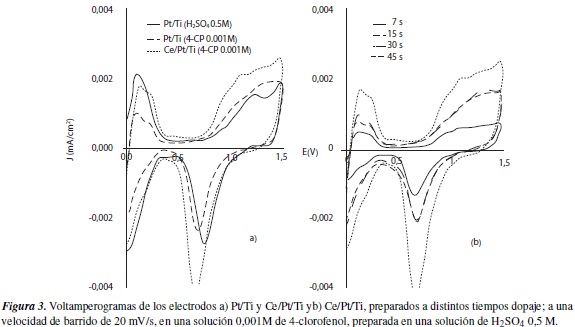
En la figura 3a se toma como punto de partida para el análisis de la actividad catalítica del electrodo, frente a la oxidación de la molécula orgánica, donde se observa claramente que a través de la inserción de cerio como dopante, no solo se promueve el incremento de las irregularidades superficiales, aumentando así su coeficiente de rugosidad, sino que también se amplía el valor de corriente entre los potenciales correspondientes a los procesos oxidativos (0,6 a 1,5 V). Cuando la superficie del electrocatalizador se modifica adicionando cerio, también se logra modificar el potencial de estado estacionario correspondiente a la reacción electroquímica y, como consecuencia, el potencial de inicio de la reacción hacia valores más negativos. Estos potenciales de estado estacionario se desplazan desde 0,807 V para el electrodo Pt/Ti, hasta 0,658 V, para el electrodo Ce/Pt/Ti.
La disminución del potencial de equilibrio se relaciona con el incremento de la eficiencia de potencial para la oxidación de la sustancia orgánica y, como consecuencia, se logra mejorar la actividad de los electrocatalizadores, los cuales pueden actuar a potenciales más bajos. Por otra parte, el incremento de la corriente para la oxidación del 4-clorofenol, es consecuente con el aumento de la eficiencia farádica, la cual está vinculada con la habilidad del electro-catalizador para oxidar, o no hacerlo, las sustancias orgánicas completamente hasta dióxido de carbono, es decir, está relacionada con la selectividad del catalizador [12].
Se debe recordar, que la actividad de un electrocatalizador no solo depende del tipo, sino también de la cantidad de dopante que hace parte de su estructura, y del método de dopaje. Para esto, se evaluó la respuesta de los electrodos de titanio platinado (Pt/Ti) y titanio platinado dopado con cerio (Ce/Pt/Ti), en la electrooxidación del 4-clorofenol, a través de voltamperometría cíclica. En la figura 3b, se puede observar que el tiempo óptimo de dopaje es de treinta segundos, pues el voltamperograma obtenido con este electrodo es el que manifiesta la mayor corriente de oxidación (ip), lo que contrasta con el hecho de que a mayor corriente, habrá mayor actividad por parte del electrocatalizador.
Hay que resaltar que el método de dopaje empleado consiste en la deposición electroquímica de cerio en los espacios intersticiales presentes en la capa de platino, formada a través del paso de corriente (catódica) por una lámina de titanio, sobre la cual se reduce el platino presente en la solución. Este tipo de interacción favorece no solo el incremento de irregularidades superficiales, sino que también genera un mecanismo de interacción bifuncional, aumentando así la actividad electrocatalítica de los electrodos.
De acuerdo con los reportes realizados por Kong Jiang-Tao et al. [15], la actividad electrocatalítica de los electrodos platinados dopados con cerio se incrementa por la capacidad que tienen estos elementos para realizar transferencia directa de electrones, lo que facilita la destrucción del 4-clorofenol. En este caso, la presencia de electrones en el nivel 4f, refuerza su electroactividad superficial, debido, principalmente, a que los electrones del orbital 4f pueden migrar a los orbitales 5d desocupados, convirtiéndose en electrones de valencia y, como resultado, se amplía el coeficiente de transferencia electrónica y la densidad de estados superficiales, actuando así como un dopante promotor modificador.
3.4. Isotermas de adsorción
Los materiales que se utilizan en electrocatálisis están definidos por las superficies que los delimitan. Esto se puede afirmar teniendo en cuenta que el sistema consiste en una reacción química heterogénea, donde se producen fenómenos de difusión continua molecular o convectiva de las sustancias reaccionantes hacia la superficie en la que transcurre la reacción y la ininterrumpida difusión inversa de los productos de la reacción. Cuando dos fases se ponen en contacto, se origina la interfase, caracterizada idealmente por un plano de separación entre ellas (plano interfacial). La interfase es un sistema fisicoquímico que alcanza su equilibrio a presión y temperatura constantes, minimizando el cambio de energía libre asociado con su formación. Esto implica una adecuación de la estructura superficial a la condición de mínimo en el cambio de energía libre correspondiente. Por ejemplo, en la interfase adsorbente/adsorbato, las moléculas del adsorbato tienden a saturar los enlaces residuales de la superficie, para lo cual su concentración en el plano del adsorbato aumenta con respecto a su concentración en la fase de la cual proviene. Este aumento de la concentración de las moléculas del adsorbato en la superficie del adsorbente, constituye la adsorción. En los procesos de adsorción electroquímica, el comportamiento del sistema suele corresponder al de monocapas localizadas [5].
En los procesos de electroquímica, el modelo más utilizado es el de Langmuir. Sin embargo, dada la complejidad de estos procesos, es necesario tomar en cuenta la heterogeneidad superficial y las interacciones laterales. En estos casos, el modelo puede requerir de dos sitios adyacentes para la adsorción de una especie o de una disociación previa del adsorbato [5].
Para lograr una correcta aplicación de las isotermas de adsorción, se debe considerar la estructura electrodo/solución; así, se observa de inmediato que la adsorción, tanto de iones como de moléculas neutras en la superficie del electrodo, depende de la carga acumulada sobre el mismo, es decir, es una función del potencial aplicado a la interfase. En consecuencia, desde el punto de vista de los fenómenos de adsorción, el campo eléctrico actúa en este caso como término energético adicional, favoreciendo o impidiendo la adsorción de las diferentes especies en fase líquida [5].
La fracción del electrodo recubierta con la sustancia orgánica, se calcula con la siguiente ecuación:
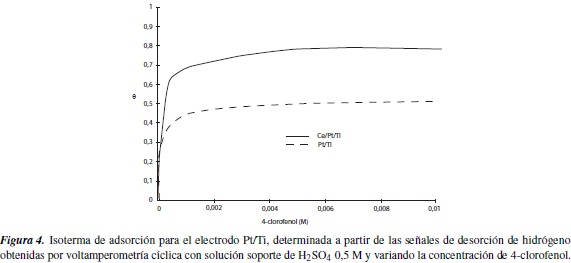
Donde QoH y QH son las cargas integradas de los datos obtenidos de la voltamperometría cíclica en la zona de desorción de hidrógeno, en ausencia y presencia de 4-clorofenol respectivamente[13]. A partir de los valores de θ para diferentes concentraciones de 4-clorofenol a temperatura constante, se construyeron las isotermas mostradas en la figura 4.
Al observar las isotermas para los dos electrodos, se encuentra que la pendiente de la curva disminuye de forma drástica alrededor de una concentración de 0,001 M de 4-clorofenol, lo que indica que este valor se ubica en el estado de transición, donde la velocidad total del proceso está determinada tanto por difusión como por transferencia de carga. A partir de este dato, se establece que la cinética macroscópica observada de la reacción electroquímica, estará subordinada a las ecuaciones que pueden obtenerse teniendo en cuenta sólo los procesos de difusión, y no reflejará, por lo tanto, la velocidad verdadera de la reacción electroquímica en la superficie del electrodo. Si la concentración de la sustancia orgánica es inferior a 0,001 M, la velocidad del proceso total estará determinada por la de reacción electroquímica. En este caso, el proceso cae en la zona cinética y se describe por la ecuación cinética de la reacción que transcurre en la superficie del catalizador [14].
Tomando como punto de referencia una concentración de 4-clorofenol 0,001M, se encuentran valores del factor de recubrimiento de 0,409 y 0,646 para los electrodos de titanio platinizado y titanio platinizado dopado con cerio respectivamente. Y con base en los resultados obtenidos, se puede concluir que la velocidad de adsorción es directamente proporcional a la concentración del analito en la solución y a la superficie libre del sólido; igualmente se puede establecer que cuanto mayor sea el valor de θ, mayor será la eficiencia cinética del catalizador, siendo esta mayor para el electrodo dopado con cerio.
3.5. Energía aparente de activación
Es un hecho experimental que la mayoría de las constantes de velocidad de muchas reacciones en fase líquida se relacionan con la temperatura: casi siempre, el Lnk es lineal con el recíproco de la temperatura (1/T). Arrhenius fue el primero en reconocer la generalidad de este comportamiento y propuso que la constante de velocidad puede ser expresada como:
Donde T es la temperatura absoluta dada en Kelvin, R representa la constante universal de los gases (8,3143 J/Kmol) y Ea está dada en unidades de energía. El factor exponencial es reminiscente de la probabilidad al usar energía térmica para superar la barrera energética Ea, este factor se conoce como energía de activación del sistema y está dada en KJ/mol. Si el exponencial expresa la probabilidad de superar la barrera energética, entonces "A"; debe estar relacionado con la frecuencia de intentos por superarla; así "A"; se conoce como factor de frecuencia [16].
Los cálculos de la energía aparente de activación se hicieron a través de las consideraciones de Arrhenius, teniendo en cuenta que existe una proporcionalidad directa entre la medida de la corriente de la celda y la constante de velocidad de la reacción. Así, la ecuación utilizada para calcular la energía aparente de activación, se describe como sigue:
Aplicando las propiedades de los logaritmos, encontramos que:
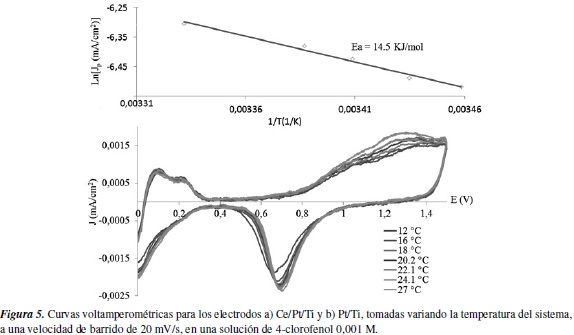
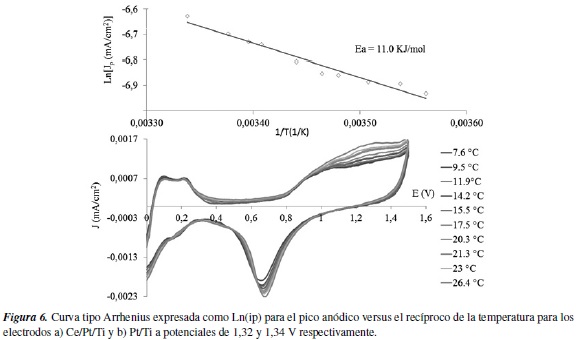
Los valores de la energía aparente de activación encontrada para la electrooxidación del 4-clorofenol con los electrodos Ce/Pt/Ti y Pt/Ti, fue de 11,1 y 14,5 KJ/mol respectivamente. La disminución del valor de energía aparente de activación muestra que la inserción del cerio como dopante superficial, tiene un efecto positivo, ya que la barrera energética que se debe superar cuando se utiliza el electrodo dopado es menor que cuando se utiliza el electrodo platinizado sin dopaje.
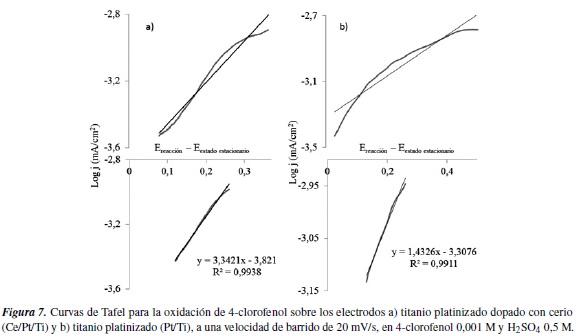
3.6. Curvas de Tafel
Para evaluar las propiedades del electrodo frente a los parámetros cinéticos de las reacciones electroquímicas, en los cuales dichos electrodos están involucrados, es conveniente examinar su comportamiento frente a las curvas de Tafel; es decir, estableciendo una asociación lineal entre el potencial aplicado a la interfase electrodo/electrolito y el logaritmo de la densidad de corriente referida a la unidad de área real del electrodo. Las correspondientes representaciones de Tafel, en una amplia región de potenciales, muestran pendientes definidas, y para cada electrodo en un electrolito dado, la densidad de corriente de intercambio es función de las propiedades del sustrato [5]. Es importante reconocer que a partir de las pendientes de las curvas de Tafel, es posible obtener valores relacionados con la electroactividad del electrodo, como el coeficiente de transferencia de carga y la corriente de intercambio, además nos dan una idea de la velocidad y el grado de irreversibilidad del proceso.
A partir de los datos conseguidos, se obtuvieron las curvas mostradas para los electrodos Pt/Ti y Ce/Pt/Ti para la oxidación de 4-clorofenol. En la figura 7 se muestran las curvas de Tafel en la parte a), y la sección lineal junto con la ecuación correspondiente a cada recta en la b) de las figuras respectivamente.
Debe tenerse en cuenta que la curva corresponde a un proceso anódico, por lo que la pendiente de su sección lineal se calcula según la siguiente ecuación [16]:
De donde se puede obtener el valor del coeficiente de transferencia de carga (α), dado que se conoce el valor de la pendiente, a partir de la linealización de la curva, y F representa la constante de Faraday (96485,3 C/mol). Mediante este proceso también se obtiene el valor de la corriente de intercambio (i0), cuando se extrapolan los segmentos lineales hasta alcanzar el eje cartesiano correspondiente a la ordenada.
La parte de la reacción que está controlada por la transferencia electrónica, coincide con la sección lineal de la curva de Tafel, la cual se encuentra en un rango de sobrepotenciales calculados a partir de la sustracción entre el potencial aplicado y el potencial de estado estacionario, referente a la interacción dada entre el electrodo y la solución reaccionante.
Según los estudios realizados [11], la sección lineal generalmente se da a sobrepotenciales mayores a 0,1 V cuando el control de la reacción se da por transferencia electrónica.
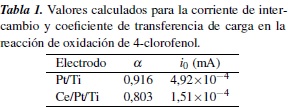
Los valores del coeficiente de transferencia de carga (α), que se obtienen aplicando las ecuaciones anteriormente descritas, se muestran en la tabla 1. Vale resaltar que la magnitud de α es útil para determinar el carácter de reversibilidad de las reacciones de oxidación del 4-clorofenol con cada uno de los electrodos, donde se encuentra que el electrodo de titanio platinizado manifiesta una constante de transferencia de carga mayor que el electrodo dopado con cerio, lo que es congruente con el desplazamiento del potencial de equilibrio y demuestra una mayor irreversibilidad del sistema, cuando se utiliza el electrodo platinizado sin dopar.
También se encuentra que los valores en la corriente de intercambio para las reacciones con los dos electrodos tienen magnitudes muy similares, siendo menor para el electrodo de titanio platinizado dopado con cerio, lo que indica que la velocidad de la reacción bajo condiciones limitadas por transferencia de carga es mayor, si se utiliza este electrodo, puesto que la magnitud de dicho parámetro (según las consideraciones de Butler-Volmer) es inversamente proporcional a la constante estándar de velocidad electroquímica para el proceso.
4. Conclusiones
Con la adición del cerio como dopante se logra modificar la estructura de la superficie del electro-catalizador, gracias a que este influye en las propiedades estructurales tales como la cristalinidad y el grado de irregularidades superficiales; adicional-mente, el hecho de presentar un par redox +3y +4, ayuda en dicho proceso.
De acuerdo con los parámetros medidos, el cerio actúa como un dopante promotor modificador, ya que no solo tiene una fuerte incidencia en las propiedades estructurales, sino que modifica el comportamiento electroquímico del electrodo, pues disminuye el valor del potencial de equilibrio para la electrooxidación del 4-clorofenol y también disminuye el valor del coeficiente de transferencia de carga, respecto al electrodo que no ha sufrido proceso alguno de dopaje.
Cuando se utiliza un electrodo dopado con cerio, se encuentra que la reacción de oxidación de la sustancia orgánica en cuestión manifiesta una mayor velocidad y carácter reversible en el sistema, comparado con el electrodo Pt/Ti.
Agradecimientos
Este trabajo se realizó gracias a los aportes financieros otorgados por la Vicerrectoría de Investigaciones de la Universidad del Cauca, al grupo de investigación en catálisis con el proyecto ID 3603 y a la asesoría prestada por los doctores Jhonny Fernando Vilard Gutiérrez, Alfonso Enrique Ramírez y Evgenii Nikolaevish Kolosov, quienes participaron activamente durante el desarrollo del proyecto investigativo.
Referencias
[1] L. Calva y M. Torres, "Plaguicidas organoclorados", Departamento de Hidrobiología, D.C.B.S. U A M-I, vol. 30, pp. 35-46, 1995. [ Links ]
[2] B. Padilla, F. Díez y S. Ordóñez, "Tratamiento de efluentes acuosos contaminados con compuestos organoclorados", Ingeniería del agua, vol. 12, 2005. [ Links ]
[3] H. Wang, J. Wang, "Comparative study on electrochemical degradation of 2,4-dichlorophenol by different Pd/C gas-diffusion cathodes", Applied Catalysis B: Environmental, vol. 89, pp. 111-117, 2009. [ Links ]
[4] Y. Wang, Z. Shen, Y. Li y J. Niu, "Electrochemical properties of the erbium-chitosanfluorine-modified PbO2 electrode for the degradation of 2,4-dichlorophenol in aqueous solution", Chemosphere, vol. 79, pp. 987-996, 2010. [ Links ]
[5] A. Arvia y M. Giordano, "Introducción a la electrocatálisis", en E. Chesneau Ed. Washington: Secretaría General de la Organización de los Estados Americanos, 1983. [ Links ]
[6] J. Gutiérrez y E. Kolosov, "Intermediarios electrooxidación de 2,4-D y Na 2,4-D en los ánodos de platinado de Pt/Ti, Pt (Pb)/Ti, Pt(Pb)/Pt", Izvestia Universidad Estatal del Suroeste, vol. 32, pp. 55-65, 2011. [ Links ]
[7] L. Ciriaco, C. Anjo, J. Correja, M. Pacheco y A. López, "Electrochemical degradation of ibuprofen on Ti/Pt/PbO2 and Si/BDD electrodes", Electrochimica Acta, vol. 54, pp. 1464-1472, 2008. [ Links ]
[8] N. Vante (2003). Electroquímica y electrocatálisis. En Materiales: aspectos fundamentales y aplicaciones. 1ª ed. Buenos aires, Argentina: e-libro.net, [En línea] Disponible en: http://www.e-libro.net. [ Links ]
[9] C. Coutanceau, S. Brimaud, C. Lamy, J.M. Léger, L. Dubau, S. Rousseau y F. Vigier, "Review of different methods for developing nanoelectrocatalysts for the oxidation of organic compounds", Electrochimica Acta, vol. 53, pp. 6865-6880, 2008. [ Links ]
[10] A. Pozio, M. De Francesco, A. Cemmi, F. Cardellini y L. Giorgi, "Comparison of high superface Pt/C catalysts by cyclic voltammetry", Journal of powder sources, vol. 105, pp. 13-19, 2002. [ Links ]
[11] B. Hoyos, C. Sánchez y J. González, "Caracterización de catalizadores de Pt-Ru/C por electro-desorción de hidrógeno", Red Alyc, vol. 71, 29-34, 2004. [ Links ]
[12] C. Coutanceau, S. Brimaud, J.M. L'eger, S. Rousseau y F. Vigier, "Review of different methods for developing nanoelectrocatalysts for the oxidation of organic compounds", Electrochimica Acta, vol 53, pp. 6865-6880, 2000. [ Links ]
[13] B. Hoyos, J. González y C. Sánchez, "Evaluación de mezclas Pt-Ru/C como catalizadores de la electro-oxidación de etanol", Red de Revistas Científicas de América Latina y el Caribe, España y Portugal, vol. 24, pp. 60-66, 2004. [ Links ]
[14] Y. Gerasimov. (1977). Curso de física química. Tomo II. 4ª ed. Moscú: Mir. [En línea]. Disponible en: http://www.freelibros.org/quimica/curso-de-quimica-fisica-tomo-2.html. [ Links ]
[15] J. Kong, S. Shi, L. Kong, X. Zhu y J. Ni, "Preparation and characterization of PbO2 electrodes doped with different rare earth oxides", Electrochimica Acta, vol. 53, pp. 2048-2054, 2007. [ Links ]
[16] A. Bard y L. Faulkner, Electrochemical methods: fundamentals and applications. New York: J. W. Sons, Ed., 2001, pp. [ Links ]