Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia en Desarrollo
Print version ISSN 0121-7488
Ciencia en Desarrollo vol.4 no.2 Tunja July/Dec. 2013
Caracterización de la comunidad de Macrófitas acuáticas en lagunas del Páramo de La Rusia (Boyacá-Colombia)
Characterization of the Community of Aquatic Macrophytes in Lakes of La Rusia Paramo (Boyacá-Colombia)
Carolina Ramos Montañoa*
Nancy Milena Cárdenas-Avellab
Yimy Herrera Martínezc
a MSc. Docente Escuela de Ciencias Biológicas, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá.
* Correo electrónico: carolina.ramos@uptc.edu.co.
b Bióloga, Grupo de Investigación Manejo Integrado de Ecosistemas y Biodiversidad XIUA, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá.
c MSc(c) PhD, Docente Escuela de Ciencias Biológicas, Facultad de Ciencias Básicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá.
Recepción: 08-jul-12 Aceptación: 15-oct-12
Resumen
Las macrófitas acuáticas son uno de los componentes más importantes de los ecosistemas lacustres, responsables de la productividad primaria, de suministrar nichos para otros niveles tróficos, reciclar los nutrientes y estabilizar sedimentos. La investigación con relación a las macrófitas acuáticas en lagunas neotropicales de alta montaña, es escasa y necesaria para llegar a una mayor comprensión del funcionamiento de estos ecosistemas. En las lagunas Cristalina, Media y Pozo en el páramo de La Rusia (Boyacá, Colombia), entre 3.720 y 3.792 msnm, se hizo la caracterización de las comunidades de macrófitas acuáticas, usando cuadrantes de 0.25 m. para evaluar la frecuencia y la cobertura. También se determinó la distribución por hábitos de crecimiento. Las frecuencias por especie fueron usadas como estimadores de abundancia para calcular el índice de diversidad de Shannon, (H) el índice de dominancia de Simpson (D), y los índices de similitud de Jaccard y Bray-Curtis. En total se registraron 17 especies de macrófitas acuáticas, de las cuales sólo Callitriche heterophylla, Isoetes palmeri, Ranunculus flagelliformis, Juncus sp. y Elatine minima estaban presentes en las tres lagunas. La laguna Media presentó la mayor diversidad (13 especies, H = 2,053, D = 0,184). Aunque todas las lagunas muestran una transparencia Secchi similar, y la distancia entre ellas es reducida, se encontraron diferencias en la diversidad, distribución de hábitos y cobertura de macrófitas, lo cual sugiere que existen factores ambientales distintos a la luz, posiblemente los nutrientes o la geomorfología, que marcan diferencias entre las lagunas. Se analizan los resultados con base en los antecedentes de investigaciones similares en otros países andinos.
Palabras clave: Macrófitas acuáticas, cobertura, sumergidas, flotantes, emergentes, diversidad, lagunas altoandinas.
Abstract
The aquatic macrophytes are one of the most important components of lacustrine ecosystems. They are in charge of the primary productivity, the availability of niches for other trophic levels, the nutrient cycling and the stabilizing of sediments. Research in relation of aquatic macrophytes in neotropical lakes of high Andean mountains is scarse and necessary to approach a better comprehension of the functioning of these ecosystems. We made the characterization the community of aquatic macrophytes in the lakes Cristalina, Media and Pozo, in La Rusia Paramo (Boyacá-Colombia), between 3.720 and 3.792 m. alt., using 0.25 m. quadrants to evaluate the frequency and cover. Besides it was evaluated the distribution of different growth habits. Frequencies per species were used like abundance estimators to calculate the Shannon diversity index (H), the Simpson dominance index (D), and the similarity indices of Jaccard and Bray-Curtis. Overall, it was collected 17 species of aquatic macrophytes, from which only Callitriche heterophylla, Isoetes palmeri, Ranunculus flagelliformis, Juncus sp. and Elatine minima were common to all lakes. The Media lake showed the highest diversity (13 species, H = 2,053, D = 0,184). Although the Secchi transparence was similar and the distance among lakes is reduced, we found differences in diversity, cover and habits distribution of the macrophytes, what suggest an effect of environmental factors different to light, possibly nutrients or geomorphology. The analysis of results is based on the previous similar investigations in Andean countries.
Keywords: Aquatic macrophytes, Cover, Submerged, Floating, Emergent, Diversity, High Andean lakes.
1. Introducción
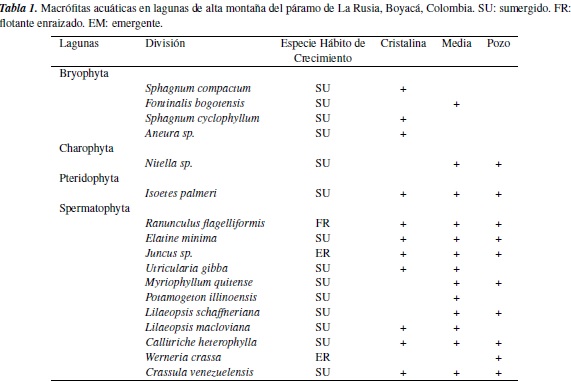
Las macrófitas acuáticas son plantas que habitan en ambientes acuáticos e inundables, para lo cual realizan diversas adaptaciones que permitan el desarrollo, crecimiento, e incluso la reproducción bajo condiciones de inundación permanente [1, 2, 3, 4]. Las macrófitas acuáticas se distribuyen en cuatro divisiones taxonómicas: Charophyta, Bryophyta, Pteridophyta y Spermatophyta [5, 6, 7, 8, 9].
Comúnmente se ha descrito a las macrófitas acuáticas como un grupo cosmopolita [8, 10, 11]. La diversidad de este grupo es mayor en el neotrópico, debido en gran parte a la contribución de la familia Podostemaceae [8, 12]. La distribución de las macrófitas acuáticas depende de factores como la topografía, la geología y el clima, además de eficaces mecanismos para dispersar sus semillas o propágulos; el éxito de dispersión a grandes distancias en las plantas acuáticas ha sido facilitado por tolerancias ecológicas y la plasticidad a diferentes condiciones; el establecimiento se atribuye en gran parte al crecimiento clonal y la abundancia de rizomas [13, 14], lo que favorece la colonización a través de la dispersión por el agua, el viento, la actividad humana y la migración de aves [11, 15].
Las plantas acuáticas pueden clasificarse de acuerdo con el hábito de crecimiento, en cuatro grupos: sumergidas, flotantes enraizadas, emergentes y flotantes libres [4, 16, 8, 15]. Las macrófitas sumergidas alcanzan el máximo nivel de adaptación acuática al desarrollar órganos fotosintéticos y reproductivos bajo la columna de agua, incluso bajo condiciones limitadas de luz; en las flotantes enraizadas, las hojas y estructura floral reposan sobre la superficie del agua y las raíces se encuentran adheridas al sedimento; las emergentes presentan las porciones basales bajo la superficiales del agua y desarrollan sus estructuras reproductivas en fase aérea; y las macrófitas de hábito flotante desarrollan sus hojas en la superficie y las raíces cuelgan libremente en la columna de agua [4, 7, 8, 16]. En general, sin importar el hábito, muchas plantas acuáticas tienen la capacidad de realizar reproducción clonal [17] extendiendo raíces rastreras a lo largo del fondo sedimentoso de los cuerpos de agua.
Junto con el fitoplancton y perifiton, las macrófitas acuáticas son los productores primarios de los ecosistemas lacustres. La dinámica trófica y disponibilidad de microhábitats depende por tanto de la cobertura y diversidad de las plantas acuáticas, las cuales además contribuyen indirectamente a los ciclos de nutrientes por la liberación de materia orgánica disuelta que a su vez, da soporte a la actividad de bacterias fijadoras de nitrógeno [16]. Aunque sus comunidades han sido ampliamente estudiadas en composición y estructura, en zonas bajas tanto templadas como tropicales [18, 16, 12, 19, 7, 20, 21], son escasas las investigaciones con relación a los sistemas naturales lacustres de alta montaña tropical [5, 22, 9). Por tanto, se desconoce el modo como las condiciones ambientales asociadas a la altitud pueden modelar la composición y estructura de las comunidades de ma-crófitas acuáticas, y si estos patrones de algún modo se escapan de lo reportado para otros escenarios.
Los cuerpos de agua de alta montaña son denominadas de origen de origen glaciar y con frecuencia han sido clasificados como oligotróficos, de pH generalmente ácido, baja conductividad y alta transparencia [7]. Es esperable que la diversidad de macrófitas en estos ambientes difiera de los demás ecosistemas acuáticos; en este contexto cabe resaltar los estudios de autores como Kiersch [5], Schmidt-Mumm [3, 9]; Cuello y Cleef [46] en los Andes del norte de Ecuador, páramo de Chingaza Colombia y Venezuela respectivamente. En el presente estudio se evaluó la diversidad, distribución y cobertura de macrófitas acuáticas en tres lagunas del páramo de La Rusia en la cordillera Oriental colombiana, con el fin de brindar herramientas que ayuden a establecer los patrones de composición y estructura en las lagunas de alta montaña tropical.
2. Materiales y métodos
2.1. Área de estudio
El estudio tuvo lugar durante el mes de julio de 2011, en el páramo de La Rusia en el municipio de Duitama, departamento de Boyacá en las lagunas Cristalina (3.745 msnm; 5o 57' 37, 38" N- 73o 05' 4,50"W), Media (3.725 msnm; 5o 57' 44,58"N- 73o 05' 6,92"W) y Pozo (3.788 msnm; 5o 57' 57,84"N-73o 05' 5,49"W). El páramo de La Rusia hace parte del corredor de conservación Altoandino Guantiva-La Rusia-Iguaque, en la cordillera Oriental entre los 2.900 y 3.800 msnm, presenta un régimen de lluvias bimodal con picos en abril-mayo y octubre-noviembre y un promedio anual de precipitación de 1.950 mm. [26]. La temperatura promedio varía entre 4 °C y 9.7 °C, lo suelos son poco fértiles, con pH ácido y una alta acumulación de materia orgánica en el horizonte superficial [26]. La cobertura vegetal es bastante heterogénea, con matorrales de Asteraceae, bosques achaparrados dominados por Polylepis quadrijuga, formaciones abiertas con Espeletia, pajonales de Calamagrostis, pastizales mixtos, turberas, chuscales y tremedales [27]. Las lagunas altoandinas son el resultado de sucesivos avances y retrocesos glaciares, que combinados con la historia reciente de levantamiento geológico, han hecho que la cordillera Oriental, con mayor altitud y complejidad, presente a su vez la mayor concentración de lagunas en Colombia [28, 29, 30]. Sin embargo, las lagunas de origen glaciar tienden a colmatarse por el permanente arrastre de sedimentos [30], especialmente a alturas en las cuales no existe suficiente cobertura vegetal. En general, las lagunas Cristalina, Media y Pozo, forman un sistema relativamente compacto, el espejo de agua no alcanza en conjunto más de 20 ha de superficie y la distancia entre ellas es muy poca (< 1 km.).
2.2. Diversidad y porcentaje de cobertura de macrófitas
En el muestreo se tuvo en cuenta la vegetación de hábitat totalmente acuático. Las plantas anfibias, que soportan periodos variables de inundación, no fueron incluidas en la investigación. Las diferentes especies de macrófitas fueron fotografiadas en vivo con una cámara sumergible, y sus rasgos particulares y diagnósticos fueron anotados después por observación directa. Rasgos como la coloración y distribución foliar, heterofolia (hojas de forma distinta en la misma planta), presencia de turiones (estructuras globosas con función carnívora), forma de crecimiento y de presentarse, floración, fueron fundamentales para efectuar la posterior identificación del material vegetal.
Para determinar la frecuencia de cada especie y usarla válidamente como un estimador de abundancia, se recurrió a una adaptación del método de cuadrantes [44,45] ubicando de forma aleatoria 20 cuadrantes de 0.5 m. de lado, que, a su vez, estaban divididos en 25 subcuadrantes de 0.1 m. Todas las franjas representativas de las zonas litoral y limné-tica (visible), fueron abarcadas con cuadrantes. En cada caso se registraron las especies y el número de subcuadrantes en que estaban presentes, con lo cual se obtuvo el porcentaje de frecuencia en función de la totalidad de cuadrantes. Estos mismos datos se emplearon para el cálculo del índice de diversidad de Shannon (H') y del índice de dominancia de Simpson (D). A la vez se calcularon los estimadores de diversidad beta Jaccard y Bray-Curtis. Cuando no era posible observar el fondo en la zona limnética, se arrojó una draga en cinco puntos al azar para determinar la presencia de macrófitas sumergidas.
En el Herbario de la Universidad Pedagógica y Tecnológica de Colombia, las fotografías fueron cotejadas con material colectado y preservado previamente en estudios de tesis en lagunas del departamento de Boyacá. El material vegetal se determinó mediante las claves de Schmidt-Mumm (1998) y Veloza et al. (2000).
2.3. Elaboración de perfiles de vegetación acuática
Para las tres lagunas se ubicaron transectos que atravesaban en longitud el cuerpo de agua; a lo largo de ellos se hizo un recorrido en bote y se arrojó cada cinco metros un mensajero que indicaba la profundidad de la laguna. Con la información procedente de los cuadrantes de muestreo, las profundidades obtenidas, el hábito de crecimiento y la longitud de las macrófitas, se trazó el perfil de la estructura vegetal de las tres lagunas.
2.4. Hábitos de crecimiento
La observación directa de cada especie, su distribución en el ecosistema acuático, y la bibliografía previa con mención de los taxones relacionados, permitió establecer en todos los casos el hábito de crecimiento y analizar las diferencias en la representatividad de cada uno de ellos en las tres lagunas. Dicha representatividad se estimó mediante el porcentaje de cobertura en las zonas litoral y limnética respectivamente.
3. Resultados
3.1. Diversidad y cobertura de macrófitas
Durante el estudio se registró un total de 17 especies (tabla 1), de las cuales R. flagelliformis, I. palmeri, E. minima, Juncus sp. C. heterophylla y C. venezuelensis estuvieron presentes en las tres lagunas y, a pesar de estar geográficamente cercanas, la riqueza y composición de macrófitas acuáticas varía levemente. La laguna Media presentó la mayor riqueza (13) seguida por la Cristalina (11) y Pozo con diez especies. Dentro de las especies únicas de cada laguna se destacan S. compactum, S. cyclophyllum (L. Cristalina), P. illinoensis y Fontinalis bogotensis (L. Media) y W. crassa (L. Pozo).
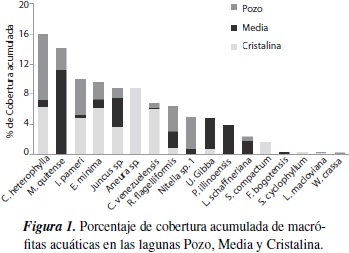
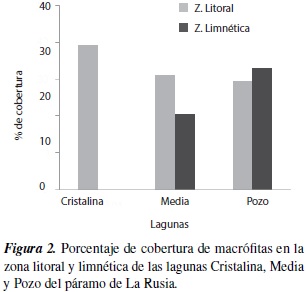
La división Spermatophyta fue la más representativa, con un total de once especies, seguida por la división Bryophyta, con cuatro especies, y Charophyta y Pteridophyta con tan solo una especie. Las macrófitas que presentaron mayor porcentaje de cobertura fueron C. heterophylla, M. quítense, I. palmeri y E. minima. C. heterophylla presentó el mayor porcentaje de cobertura acumulada en la laguna Pozo, mientras que M. quitense y E. minima dominaron en Media y en Cristalina respectivamente (figura 1).
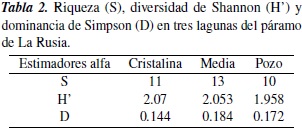
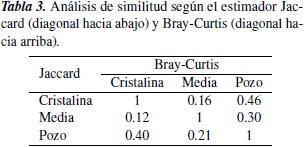
Las lagunas que indicaron mayor diversidad fueron Cristalina y Media, y la mayor dominancia se registró en Media y Pozo. En general la laguna Media fue la más diversa, pues mostró la mayor riqueza de macrófitas y la mayor dominancia de especies (tabla 2). En cuanto al análisis de diversidad beta, los estimadores Jaccard y Bray-Curtis registran que la mayor similitud se presentó entre las lagunas Cristalina y Pozo, y las lagunas que registraron los valores más bajos de similitud fueron Cristalina y Media (tabla 3).
Con relación a las coberturas, la zona litoral de estas lagunas estuvo cubierta por más de un 30 % de macrófitas, mientras que en la zona limnética de L. Cristalina no se registró ninguna macrófita. La laguna Pozo mostró la mayor cobertura general, siendo incluyo mayor en la zona limnética. Las lagunas Media y Cristalina presentaron mayor porcentaje de cobertura vegetal en la zona litoral (figura 2).
3.2. Perfiles de vegetación acuática
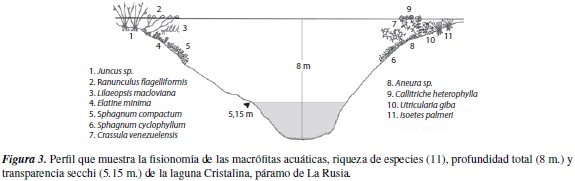
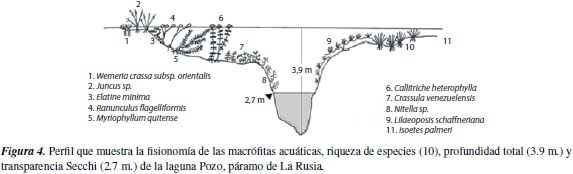
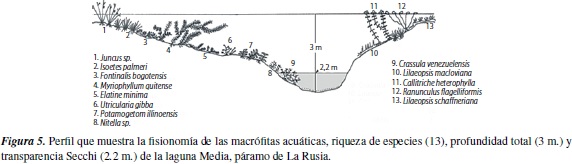
La mayor profundidad de la columna de agua fuede 8 m. y se registró en la laguna Cristalina, seguida por la laguna Pozo, con 3.9 m. y la laguna Media con 3.0 m. La profundidad de entrada de luz o zona fótica, siguió igualmente el patrón Cristalina >Pozo >Media. Las diferencias en la morfometría de las lagunas y en la entrada de luz, determinaron a su vez divergencias en la distribución de las macrófitas (figuras 3 a 5).
3.3. Hábitos de crecimiento
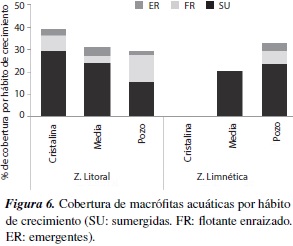
El mayor porcentaje de cobertura lo presentó el hábito sumergido en las tres lagunas, tanto en la zona litoral como limnética, seguido por el hábito flotante enraizado, y en menor proporción, el hábito emergente (figura 6).
4. Discusión
Los lagos tropicales de alta montaña se han reconocido por poseer baja variación térmica anual [31, 32], lo cual determina que las fases de circulación y estratificación no necesariamente tengan periodicidad, como ocurre en las zonas templadas, ya que los primeros se rigen más por variaciones de temperatura entre el día y la noche [33, 34]. En general son clasificados como oligotérmicos con baja estratificación, oligotróficos y de dimensiones reducidas [7, 9]. Bajo estas condiciones de baja cantidad de nutrientes y poca variabilidad a lo largo del año, es esperable que la diversidad de productores primarios sea baja en las lagunas tropicales de alta montaña. En el presente estudio, que abarcó tres lagunas del páramo de La Rusia, se encontró una riqueza total de diecisiete especies de macrófitas acuáticas, y en la laguna Media se alcanzó una riqueza de trece especies. Esta riqueza es relativamente alta, si tenemos en cuenta que Kiersch et al., reportaron en el 2004 un menor número de especies, en tres lagunas del Ecuador ubicadas por encima de los 3000 msnm, que además tienen una extensión muy superior.
Dentro del comportamiento de la diversidad alfa de macrófitas acuáticas, se ha reportado un descenso en el número de especies con ganancia de altitud (23, 24, 8); también existe una fuerte relación con la disponibilidad de nutrientes (estado trófico) de lagos, siguiendo una clásica curva gaussiana. Los lagos oligotróficos (baja carga de nutrientes) se ubican en un extremo de la escala con pocas especies; los lagos mesotróficos (carga media de nutrientes), en la parte media, tienden a sostener alta diversidad de macrófitas, mientras que la riqueza declina nuevamente en lagos eutróficos (alta concentración de nutrientes) [8, 25, 12].
La participación del hábito sumergido en todas las lagunas fue representativa, tanto en la zona litoral como la limnética, alcanzando incluso un porcentaje de cobertura cercano al 30%. Esta amplia adaptación en la comunidad de macrófitas, definitivamente es favorecida por la entrada de luz, que de acuerdo con los valores Secchi, abarca gran parte de la columna de agua y penetra hasta 5.15 m. en la laguna Cristalina (Herrera, datos no publicados). Sin embargo, es preciso considerar que la transparencia del agua realmente puede variar ampliamente en una misma laguna, dado que se han observado zonas con alta presencia de sedimentos, que se acumulan sobre las macróitas y oscurecen la supericie, y otras zonas donde había una densa red de cianobacterias, que al mezclarse con sedimentos y residuos de rizoma generan el mismo efecto. La medición de penetración de luz requiere de mayores esfuerzos, con un cubrimiento más amplio del espejo de agua, para establecer hasta qué punto este factor modela los hábitos de crecimiento de las comunidades de macrófitas. No cabe duda que las diferencias en los periles de las lagunas están relacionadas con la distribución de los hábitos y su cobertura.
Aunque los antecedentes plantean que los ambientes lacustres de alta montaña serían relativamente homogéneos, el encontrar claras diferencias en la diversidad, cobertura y distribución de macróitas entre estas tres lagunas, sugiere que existen determinantes ambientales que estarían influyendo en el componente vegetal, como las características físico-químicas del sedimento y la geomorfología [35, 36]. La tendencia general en este estudio es que existen nichos especializados, que hacen que la mayoría de las especies estén restringidas o a una sola laguna o incluso a un solo ambiente dentro de la misma; especies de los géneros Isoetes, Lilaeopsis y Werneria, junto con Potamogeton illinoensis, son algunos ejemplos. Sin embargo, esta especialización del hábitat se da solo a escala local, ya que la mayoría de los géneros encontrados en el páramo de La Rusia han sido reportados por otros estudios en Colombia [37, 22, 9], Ecuador [38, 5], Perú [39] y Bolívia [40]. Las diferencias en la zona fótica bien pueden influir en la representatividad de hábitos, pero no es claro que estas diferencias determinen la presencia de ciertas especies únicas para cada laguna.
Sin embargo, los resultados obtenidos generan más preguntas que respuestas con relación a los patrones específicos de distribución. El género Nitella, por ejemplo, que ya había sido reconocido en Bolivia como un grupo que forma praderas en sustratos pedregosos con fango, en este caso presentó mayor porcentaje de cobertura en la laguna Pozo [40], que tiene un fondo con características muy diferentes; además, este género es considerado bioindicador de condiciones oligotróficas [5, 41, 42, 10]. La especie Callitriche heterophylla había sido descrita como una especie anfibia [38], pero al registrarla en este estudio, a casi un metro de profundidad en las lagunas del páramo de La Rusia produciendo hojas a lo largo de su vástago, la consideramos como una especie de hábito sumergido. Myriophyllum quítense es considerada, por otra parte, como una especie generalista y altamente tolerante [40], lo cual no explica por qué no está presente en la laguna Cristalina, dado que las tres lagunas de estudio no estaban alejadas entre sí más de 1 km. Estos hechos refuerzan la necesidad de evaluar con detalle los diversos factores ambientales que podrían participar en la delimitación de nichos de las diferentes especies de la comunidad de macrófitas acuáticas.
En general, no existen suficientes referentes de diversidad de macrófitas acuáticas, debido en parte a que se desarrollan y crecen de manera clonal, imposibilitando el conteo de individuos. En este estudio, el uso de las frecuencias obtenidas mediante el método de cuadrantes, sirvió como un estimador válido de abundancia, que se usó finalmente para el cálculo de índices de diversidad. La dificultad del método se da cuando no existe visibilidad de la cobertura vegetal bajo el agua. Los muestreos con draga son en ese caso un complemento importante para determinar la presencia o ausencia de macrófitas en el fondo, ya que incluso se han reportado a una profundidad de 35 m. [5].
La mayoría de los estudios realizados, especialmente aquellos que han tenido lugar en el neotrópico [9, 37], han incluido vegetación palustre o transicional, que realmente corresponde a especies terrestres con capacidad de soportar temporadas de inundación. Igualmente sucede con los briófitos, que se adhieren a un sustrato de recurrente humedad. En contraste, especies de hábito totalmente acuático, como las sumergidas en zona limnética, no siempre han sido incluidas en los estudios, ya que con frecuencia los transectos o cuadrantes solo abarcan algunos metros más allá de la orilla de la laguna [37, 43]. Esto plantea un importante punto de conflicto, ya que al hacer revisiones sobre el término "macrófitas acuáticas", este puede abarcar diferentes tipos de plantas y por lo tanto, estudios comparativos sobre la biodiversidad, la cobertura o incluso la productividad primaria, estarían sujetos a un amplio margen de variabilidad. En este estudio fue relevante muestrear únicamente aquellas especies que tienen relación directa y permanente con la columna de agua, y que desarrollan para ello determinadas adaptaciones morfológicas y fisiológicas. Hacer este ajuste puede ser fundamental para llegar a aproximaciones más precisas, enfocadas a las dinámicas y al funcionamiento ecosistémico. Al continuar este tipo de investigaciones, que abarcan suficientemente las zonas someras y profundas de las lagunas altoandinas, será posible establecer patrones generales con relación a la diversidad y distribución de las macrófitas acuáticas y su asociación con la altitud.
5. Conclusiones
Se estimó la diversidad de macrófitas acuáticas en tres lagunas de alta montaña del páramo de La Rusia, Boyacá, Colombia; la laguna Media registró la mayor riqueza y dominancia de especies, seguida por Cristalina y finalmente Pozo. Estos resultados son una contribución de gran importancia para ecosistemas acuáticos de alta montaña neotropical.
Las especies Callitriche heterophylla, Myriophyllum quítense e Isoetespalmeri, presentaron el mayor porcentaje de cobertura acumulada; C. heterophylla fue mayor en la laguna Pozo, M. quitense fue significativamente mayor en Media e I. palmeri en Pozo y Cristalina.
El hábito sumergido fue el más representativo, tanto en la zona litoral como en la limnética, hecho que se atribuye principalmente a los altos valores de transparencia que presentaron las lagunas y al eficiente desarrollo clonal que muestra este tipo de vegetación.
Aunque este estudio se centró en tres lagunas de un complejo paramuno compacto y muy cercano, sometido a las mismas condiciones climáticas, se encontraron claras diferencias en la diversidad, cobertura y distribución de macrófitas acuáticas, las cuales podrían deberse a las características morfo-métricas de las lagunas o a otros factores distintos a la luz, como la presencia de nutrientes, que estaría asociada a fenómenos geomorfológicos.
Agradecimiento
El presente estudio corresponde al proyecto SGI 897, financiado por la Dirección de Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia. Adicionalmente recibió soporte logístico del Convenio Ecopetrol DHS 194: "Estudio ecológico de las comunidades Hidrobiológicas en Humedales Altoandinos de la Cordillera Oriental de Colombia". Agradecemos además la amable colaboración de Andrea Meneses, Mabel Pimiento y Judith Rodríguez.
Referencias
[1] C. K. Sculthorpe, The biology of aquatic vascular plants. Königstein: Koeltz Scientific Books, p. 610, 1958. [ Links ]
[2] C. Cook, Aquatic Plant Book. La Haya, Holanda: SPB Academic Publishing, p. 228, 1996. [ Links ]
[3] U. Schmidt-Mumm, "Vegetación acuática y palustre de la sabana de Bogotá y plano del río Ubaté: ecología y taxonomía de la flora acuática y semiacuática", tesis de maestría, Departamento de Biología, Universidad Nacional de Colombia, Bogotá, 1998. [ Links ]
[4] J. K. Cronk y M. S., Fennessy, Wetland plants: biology and ecology. Washington, D.C.: Lewis Publishers, 2001. [ Links ]
[5] B. Kiersch, R. Mühleck y G. Gunkel, "Las macrófitas de algunos lagos alto-andinos del Ecuador y su bajo potencial como bioindicadores de eutrofización", Revista de Biología Tropical, vol. 52, no. 4, pp. 829-837, diciembre, 2004. [ Links ]
[6] A. Padial, L. M. Bini y S. M. Thomaz, "The study of aquatic macrophytes in Neotropics: a scientometrical view of the main trends and gaps", Brazilian Journal of Biology, vol. 68, no. 4, pp. 1051-1059, Nov., 2008. [ Links ]
[7] G. Roldán y J. R. Ramírez, Fundamentos de limnología neotropical, 2a ed. Medellín: Universidad de Antioquia, 2008. [ Links ]
[8] P. A. Chambers, P. Lacoul, K. J. Murphy y S. M. Thomaz, "Global diversity of aquatic ma-crophytes in freshwater", Hydrobiologia, vol. 595, no. 1, pp. 9-26, Jan., 2008. [ Links ]
[9] U. Schmidt-Mumm y O. Vargas-Ríos, "Comunidades vegetales de las transiciones terrestre-acuáticas del páramo de Chingaza, Colombia", Revista de Biología Tropical, vol. 60, no. 1, pp.35-64, marzo, 2012. [ Links ]
[10] G. Bornette y S. Puijalon, "Response of aquatic plants to abiotic factors: a review", Aquatic Sciences, vol. 73, no. 1, pp. 1-14, Feb., 2011. [ Links ]
[11] E. Scremin-Dias, "Tropical aquatic plants: morphoanatomical adaptations", in Org. Encyclopedia of tropical biology and conservation management, Paris: UNESCO/EOLSS, vol. 1, p. 84-132. 2009. [ Links ]
[12] S. M. Thomaz, F. A. Esteves, K. J. Murphy, A. M. Santos Dos, A. Caliman y R. D. Guariento, "Aquatic macrophytes in the tropics: ecology of populations and communities, impacts of invasions and use by man", Tropical Biology and Conservation Management, vol. IV, 2008. [ Links ]
[13] L. Santamaría, "Why are most aquatic plants widely distributed? Dispersal, clonal growth and small-scale heterogeneity in a stressful environment", Acta oecologica, vol. 23, no. 3, pp. 137-154, Jun., 2002. [ Links ]
[14] D. H. Les, D. J. Crawford, R. T. Kimball, M. L. Moody y E. Landolt, "Biogeography of discon-tinuously distributed hydrophytes: a molecular appraisal of intercontinental disjunctions", International Journal of Plant Sciences, vol. 164, no. 6, pp. 917-932, Nov., 2003. [ Links ]
[15] N. M. Cárdenas-Avella, "Ecofisiología de macrófitas acuáticas en lagunas de alta montaña del departamento de Boyacá: una aproximación a la productividad primaria", tesis de pregrado, Escuela de Ciencias Biológicas, Universidad pedagógica y Tecnológica de Colombia, Tunja, 2013. [ Links ]
[16] S. M. Thomaz, "Fatores ecológicos associados à colonização e ao desenvolvimento de macrófitas aquáticas e desafios de manejo", Planta Daninha, vol. 20, no. 1, pp. 21-33, 2002. [ Links ]
[17] A.G. Van Der Valk , The biology of freshwater wetlands. USA: Oxford University Press, 2006. [ Links ]
[18] S. M. Thomaz y L. M. Bini, "Ecologia e manejo de macrófitas aquáticas em reservatorios". Acta Limnologica Brasiliensia, vol. 10, no. 1, pp. 103-116, 1998. [ Links ]
[19] S. M. Thomaz, D. C. Souza y L. M. Bini, "Species richness and beta diversity of aquatic ma-crophytes in a large subtropical reservoir (Itai-pu Reservoir, Brazil): the influence of limnology and morphometry", Hydrobiologia, vol. 505, no. 1-3, pp. 119-128, Sep., 2003. [ Links ]
[20] A. S. Rolon y L. Maltchik, "Environmental factors as predictors of aquatic macrophyte richness and composition in wetlands of southern Brazil", Hydrobiologia, vol. 556, no. 1, pp. 221-231, Feb., 2006. [ Links ]
[21] F. Ferreira, A. R. Mormul, S. M Thomaz. A. Pott y V. J. Pott, "Macrophytes in the upper Paraná river floodplain: checklist and comparison with other large South American wetlands", Biol. Trop, vol. 59, no. 2, pp. 541-556, Jun., 2011. [ Links ]
[22] Cleef, A. M., O. Rangel-Ch and H. Arellano. The paramo vegetation of the Sumapaz massif (Eastern Cordillera, Colombia). In: Studies on Tropical Andean Ecosystems. Vol. 7. van der Hammen., T. (ed). Instituto geografico "Agustin Codazzi" (IGAC), Germany. 1009 pp. 2008. [ Links ]
[23] J. I, Jones, W. Li y S. C. Maberly, "Area, altitude and aquatic plant diversity", Ecography, vol. 26, no. 4, pp. 411-420, Aug., 2003. [ Links ]
[24] P. Lacoul y Freedman, B. "Environmental influences on aquatic plants in freshwater ecosystems", Environmental Reviews, vol. 14, no. 2, pp. 89-136, Jun., 2006. [ Links ]
[25] J. B. Lachavanne, "The influence of accelerated eutrophication on the macrophytes of Swiss lakes: abundance and distribution", Verh. Int. Verein. Limnol, vol. 22, pp. 2950-2955, 1985. [ Links ]
[26] M. Morales, J. Otero, T. Van Der Hammen, A. Torres, C. Cadena, C. Pedraza, N. Rodríguez, C. Franco, J. C. Betancourth, E. Olaya, E. Posada y L. Cárdenas, Atlas de páramos de Colombia. Bogotá, Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, pp. 72-80, 2007. [ Links ]
[27] O. Rangel, Colombia: diversidad biótica III: la región de la vida paramuna. Bogotá, Colombia: Universidad Nacional de Colombia, Facultad de Ciencia, Instituto de Ciencias Naturales, pp. [ Links ]
[28] H. Hooghiemstra, "Vegetational and climatic history of the High Plain of Bogota, Colombia: a continues record of the last 3,5 million years", en El Cuaternario de Colombia, 10, Van der Hammen, T. (ed.). Ciudad: Cramer, 1984, 368 p. [ Links ]
[29] A. Flórez, Movilidad altitudinal de páramos y glaciares en los Andes colombianos. Presentado en Congreso Mundial de Páramos, Memorias, Paipa, Boyacá, 2002. [ Links ]
[30] A. Flórez, Colombia: evolución de sus relieves y modelados. Bogotá: Universidad Nacional de Colombia, Red de Estudio de Espacio y Territorio, RET, Unibiblos, 2003, 240 p. [ Links ]
[31] W. Vincent, W. Wurtsbaugh, C. Vincent y P. Richerson, "Seasonal dynamics of nutrient limitation in a tropical high-altitude lake (Lake Titicaca, Perú-Bolivia): application of physiological bioassays", Limnology & Oceanography, vol. 29, pp. 540-552, 1984. [ Links ]
[32] P. L. Osborne, Tropical ecosystems and ecological concepts, 1 St ed. Cambridge: Cambridge University Press, 2000, 464 p. [ Links ]
[33] T. Powell, M. H. Kirkish, P. J. Neale y P. J. Richerson, "The diurnal cycle of stratification in Lake Titicaca: Eddy diffusion", Verh. Internat. Verein. Limnol., vol. 22, pp. 1237-1243, 1984. [ Links ]
[34] J. Casallas y Gunkel, G. Algunos aspectos limnológicos de un lago altoandino: El Lago San Pablo, Ecuador. Limnetica, vol. 20, no. 2, pp. 215-232, 2001. [ Links ]
[35] G. Gunkel, "Limnología de un lago tropical de Alta Montaña, en Ecuador: características de los sedimentos y tasa de sedimentación", Revista de Biología Tropical, vol. 51, no. 2, pp. 381-390, agosto, 2003. [ Links ]
[36] A. Gasith, M. V. Hoyer, Structuring Role of Macrophytes in Lakes: Changing Influence Along Lake Size and Depth Gradients. New York: Springer, pp. 381-392, 1998. [ Links ]
[37] C. I. Veloza, I. García, C. L. Ortega y R. Dávila, "Contribución al estudio taxonómico de los hidrofitos de la Laguna Negra de la región de Taquecitos, páramo Sumapaz (Colombia)", Actualidades Biológicas, vol. 22, no. 73, pp. 177-194, mayo, 2000. [ Links ]
[38] D. Jacobsen y E. Terneus, "Aquatic macrophytes in cool aseasonal and seasonal streams: a comparison between Ecuadorian highland and Danish lowland streams", Aquatic Botany, vol. 71, pp. 281-295, diciembre, 2001. [ Links ]
[39] B. León, "Aquatic Plants of Peru: diversity, distribution and conservation", Biodiversity and Conservation, vol. 5, pp. 1169-1190, 1996. [ Links ]
[40] N. De La Barra, "Clasificación ecológica de la vegetación acuática en ambientes lacustres de Bolivia", Revista de Biología Tropical, vol. 13, pp. 65-93, 2003. [ Links ]
[41] L. P. Lamers, A. J. Smolders y J. G. Roelofs, "The restoration of fens in the Netherlands". Hydrobiologia, vol. 478, no. 1-3, pp. 107-130, Jun., 2002. [ Links ]
[42] L. Kufel e I. Kufel, "Chara beds acting as nutrient sinks in shallow lakes-a review", Aquatic Botany, vol. 72, pp. 249-260, Apr., 2002. [ Links ]
[43] E. Terneus, "Las plantas acuáticas en el sistema lacustre riberino Lagartococha, Reserva de producción faunística Cuyabeno, Ecuador". Actualidades Biológicas, vol. 29, no. 86, pp. 97-106, junio, 2007. [ Links ]
[44] D. F. Westlake, "Water plants and the aqueous environment", Biol. Human Affairs, vol. 36, no. 10,1971. [ Links ]
[45] M. L. Rodríguez-Costa y H. Raoul, "Phosphorous, nitrogen and carbon contents of macrophytes in lakes lateral to a tropical river" (Paranapanema River, São Paulo, Brazil), Acta Limnologica Brasiliensia, vol. 22, pp. 122-132, Apr./Jun., 2010. [ Links ]
[46] N. L. Cuello y A. M. Cleef, "The paramo vegetation of Ramal de Guaramacal, Trujillo State, Venezuela. 2. Azonal vegetation", Phytocoenologia, vol. 39, pp. 389-409, octubre, 2009. [ Links ]