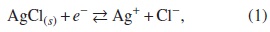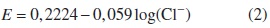Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia en Desarrollo
versão impressa ISSN 0121-7488
Ciencia en Desarrollo vol.6 no.1 Tunja jan./jun. 2015
Análisis de la electrotransformación de lignina en la guadua "Angustifolia Kunth" del Quindío
Lignin Electrotransformation Analysis in Bamboo "Angustifolia Kunth" from the Colombian Quindío Department
H. Reyes Pinedaa,*
J. A. Rodrígueza
L. C. Cardona Hernándeza
aGrupo Químico en Investigación y Desarrollo Ambiental, Facultad de Ciencias Básicas y Tecnologías, Universidad del Quindío, Armenia, Colombia.
*Autor de correspondencia: hreyes@uniquindio.edu.co.
Resumen
Este estudio se centra en la utilización de la lignina de la guadua Angustifolia KUNTH, la cual constituye, aproximadamente, el 30 % del total de la planta, en busca de su posible transformación, por vía electroquímica, a moléculas más simples. Para lograr este fin se utilizó guadua proporcionada por la Corporación Autónoma Regional del Quindío (CRQ), de su "Centro Nacional para el estudio del Bambú-Guadua". Las muestras se acondicionaron y se les realizaron las digestiones necesarias para separar la lignina de sus otros componentes. La lignina tratada se llevó al reactor electroquímico, donde su análisis mostró la posible electrotransformación, utilizando la espectroscopia IR y la voltamperometría para ver posibles cambios estructurales.
Palabras clave: Electroquímica, Guadua, Lignina, Voltamperograma.
Abstract
Guadua Angustifolia Kunth as any other plant species, is rich in cellulose, lignin and other chemicals. This study focuses on the use of lignin which is approximately 30 % of the plant, looking for its possible electrochemical transformation into simpler molecules. To this end we used the bamboo provided by the Autonomous Regional Corporation of Quindío (CRQ), from its "National Center for the Study of Bamboo-Guadua". The samples were conditioned and the necessary digestions were performed, in order to separate the lignin from its other components. The lignin analysis treated by the electrochemical reactor, showed its possible electrotransformation, by using the IR spectroscopy and the voltammetry to see its viable structural changes.
Key words: Electrochemistry, Bamboo, Lignin, Voltammogram.
1. Introducción
La Guadua angustifolia KUNTH pertenece a la familia de las Gramíneas, subfamilia Bambusoideae, especie Guadua angustifolia, orden Glumiflorales, con nombre científico, Guadua Angustifolia 1822 [1]; es el bambú más grande y rentable de los registrados en el trópico. En Colombia la encontramos principalmente en la región Andina, al igual que en Ecuador y Venezuela, y, además, en otras zonas, como la Amazonía, la Orinoquía, y otros países de Centro América [2]. Como toda especie vegetal, la guadua es rica en celulosa, ligninas y otros componentes químicos. La mayor abundancia de guadua en Colombia se encuentra en el Eje Cafetero y los departamentos del Tolima y Valle del Cauca; los terrenos arcillosos y arenosos, especialmente a orillas de los ríos, facilitan su crecimiento [3].
Los vegetales son capaces de biosintetizar gran cantidad de sustancias fenólicas, algunas de ellas fundamentales para sus procesos básicos, como la producción de metabolitos, además de producir sustancias útiles que sirven como protección ante agentes externos. La lignina tiene como constituyente principal los compuestos fenólicos que se generan, básicamente, a través de dos rutas bioéticas: una es la ruta del ácido shikímico, que por medio de la síntesis de aminoácidos aromáticos (tirosina y fenilalanina) promueve la síntesis de ácido cinámico y sus subproductos (fenoles simples, fenoles ácidos y sus subproductos, como son los lignanos, las cumarinas y otros derivados del fenilpropano); la otra vía fundamental es la de los poliacetatos, generando orcinoles, xantonas y quinonas [4].
La lignina es un polímero fenólico natural que confiere rigidez a la pared celular de las plantas maderables; es esencial, junto con la celulosa, para el soporte mecánico de tallos, ramas y hojas. Después de la celulosa, es el compuesto más abundante sobre la tierra. La lignina nativa suele contener 11 fragmentos monómeros. La conformación molecular básica de la lignina es un polímero tridimensional del grupo 4-hidroxi-4-metoxi-fenil-propano que alcanza pesos moleculares elevados (5.000-10.000 gr/mol) [4], desconociéndose hasta el momento su estructura en especies no madereras. Al separarse de los otros componentes, la lignina es una écuérica muy compleja, ya que es propia de cada planta; contiene, principalmente, átomos de carbono enlazados a radicales O-H (grupos fenólicos OH) y grupos carboxílicos [5].
En esta investigación se pretende mostrar, mediante técnicas electroquímicas, la determinación cuantitativa de la lignina presente en la guadua, luego de haber sido tratada en un reactor electroquímico.
2. Metodología
Se utilizó un espectrofotómetro ThermoNicolet 320 FT-IR, con transmisión ESP en pastillas de KBr, y un potenciostato Radiometer Copenahagen PGP 201, con software voltamaster; se construyeron electrodos de pasta de carbono (0,1137 cm2) y platino (0,0173 cm2); como electrodo auxiliar se utilizó un electrodo de grafito, y de referencia se construyó un electrodo de Ag/AgCl (0,1M en KCl); se utilizó una fuente de corriente continua, diseñada y fabricada en los laboratorios de instrumentación de la Universidad del Quindío. Se utilizó un reactor electroquímico, constituido con dos electrodos de carbón vítreo con un volumen de 20 ml y una balanza de humedad Mettler Toledo LJ 16.
2.1. Extracción de la lignina
La extracción de lignina se realizó por el método de la soda (procedimiento para obtener celulosa química a partir de materia prima lignocelulósica empleando soda cáustica al 14 %, con un tiempo de digestión de 2 horas). La digestión se realizó en un reactor accionado por vapor de caldera a 160 °C [6, 7].
Del licor extraído se separó la lignina, utilizando ácido sulfúrico y lavados con ácido clorhídrico, logrando así la precipitación de la lignina; posteriormente fue lavada con agua caliente para eliminar vestigios de Na2SO4 que se puedan haber formado en el proceso; a las aguas de lavado se le agregó BaCl2 para verificar la ausencia de BaSO4.
Para los análisis electroquímicos se utilizó guadua con tres años de edad, proporcionada por la Corporación Autónoma Regional del Quindío (CRQ), la cual fue cortada en astillas de 1x1x10 cm y secada al sol.
Cinco muestras de 0,4 kg de astillas del material fueron colocadas en sendos recipientes de acero de 2,5 L de capacidad, y se les agregó solución de hidróxido de sodio comercial al 14 % p/v en proporción sólido/líquido de 1:5. El material se sometió a digestión en un reactor accionado por vapor con los siguientes parámetros [8, 9]: tiempo, 20 min; temperatura de operación, 160 °C; tiempo a temperatura de operación, 60 min; tiempo de descenso, 35 min. El licor obtenido presentó un pH de 14.
La pulpa celulósica fue separada por filtración con tela y presión manual para la eliminación de la mayor parte del licor. El licor se neutralizó con una solución al 20 % de ácido sulfúrico grado analítico hasta alcanzar pH neutro, con lo que se logra la precipitación de la lignina. Luego, el producto fue filtrado a través de un fibra de vidrio; la lignina separada fue lavada con agua acidulada con ácido clorhídrico (pH 2,0) y llevada a ebullición por 1 h, haciendo agitación y decantación del líquido sobrenadante para eliminar la mayor parte de la hemicelulosa que hubiera quedado remanente. El producto que se obtuvo fue secado en horno de desecación por infrarrojo a 100 °C durante 1 hora, para finalmente someterlo al análisis espectroscópico.
2.2. Construcción de electrodos y método voltampétrico
Se empleó una celda electroquímica formada por tres electrodos: un electrodo de trabajo se empleó con dos diferentes materiales: pasta de carbono (0,1137 cm2) y platino (0,0173 cm2); como electrodo auxiliar se utilizó un electrodo de grafito, y de referencia se construyó un electrodo de Ag/AgCl (0,1M en KCl); por lo tanto, todos los potenciales que aquí se reportan están con respecto a este electrodo. Los electrodos de pasta se elaboraron a partir de una mezcla de carbono y nujol, como medio dispersante; al mezclar el nujol con el carbón se forma una pasta que se introduce en puntas de polietileno; el contacto eléctrico se hizo con grafito. El electrodo de platino se lavó con HNO3 concentrado y, posteriormente, con agua, secándolo con acetona, y puliéndolo luego coúmina; se repite el procedimiento, lavándolo con HNO3, agua y acetona para retirar el exceso de alúmina. Antes de cada experimento se retiró el exceso de oxigenó burbujeando durante 5 minutos con nitrógeno de 99,98 % de pureza. Todas las soluciones fueron preparadas con agua destilada [10, 11].
Electrodo de plata/cloruro de plata (Ag/AgCl) se construyó con un hilo de Ag sobre el cual se deposita AgCl, por vía electroquímica, en una solución de KCl 0,1M; en este caso, el hilo de Ag actúa como ánodo.
y su potencial de equilibrio a 25 °C es:
La electrooxidación de la lignina se llevó a cabo por cronoamperometría simultáneamente con voltamperometría a partir de una solución de NaOH 0,1 M en agua destilada; en este caso el NaOH actúa como electrolito de soporte. Se impuso un potencial de 1000 mV durante 5 minutos, con el electrodo. Para el blanco se usó una mezcla de carbono/nujol en proporción 1:2; con la lignina, la proporción fue 1:2:2 (carbono/nujol/lignina).
3. Resultados y discusión
La lignina aislada es de color café oscuro, inodora, soluble en solución de hidróxido de sodio al 1.0 %, tal como puede observarse en la figura 1.
A las diferentes muestras se les realizaron análisis infrarrojos, tras ser secadas durante 24 horas para evitar los solapamientos que pueda provocar el agua entre las bandas que se observan entre los 3000-3500 cm−1, donde encontramos las vibraciones correspondientes a los enlaces O-H del agua.
A la lignina separada se le tomaron lecturas de infrarrojo, que arrojaron el espectro mostrado en la figura 2, que se aproxima a la estructura propuesta por Alder [9]. Una banda de máxima absorción en 3411,58 cm−1, típica de las tensiones O-H en los alcoholes, y en conjunto con las bandas de los 1600 cm −1, 1507 cm−1 y 1419 cm−1; se trata de una estructura fenólica predominante en los fragmentos monoméricos de la lignina; (a) En cuanto al hombro presente entre los 2800 cm−1 y 2900 cm−1, es posible que haya un solapamiento de bandas de CH alifático y CH carbonílico (CHO), grupo presente en el monómero siringaldehído; (b) En este espectro se puede verificar que la proporción de monómeros con grupos carbonílicos es posiblemente pequeña, comparada con la cantidad de grupos aromáticos que puede ser evidenciada por la intensidad del pico a los 1600 cm−1 comparada con la que aparece a 1693 cm −1 (atribuida a los estiramientos CO de los grupos carbonilo); (c) Se puede apreciar una banda de alargamiento C-H producida por cadenas alifáticas a los 2937 cm−1 que hacen parte de varios monómeros; (d) El pico 1458 cm−1 pertenece a las vibraciones C-H de grupos metilo o metileno unidos a un anillo aromático. Las unidades siringil presentes en la lignina generan la banda débil a 1331 cm−1 atribuida a la interacción del anillo siringil con un grupo CO y otra que aparece 1118 cm−1(deformación del plano CH, en anillos tipo siringil); (e) La banda a los 1216 cm −1 atribuida a la interacción del anillo guayacil y con el estiramiento CO y la pronunciada en 1041 cm −1 por la deformación C-H y C-O presente en casi todos los monómeros; (f) Es posible que la lignina posea grupos carbonilo de ácidos (normalmente aparecen a los 1712), pues en el pico a 1693 se ve evidentemente traslapado por la intensidad del pico en 1600. Algunos picos muy pequeños entre 3000 cm −1 y 3100 cm−1, junto con los que aparecen en la región de los 600 cm− y 700 cm−1, pueden ser atribuibles a la presencia de C=C [3, 12-14].
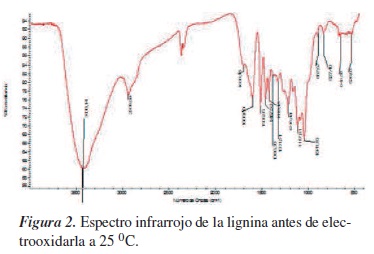
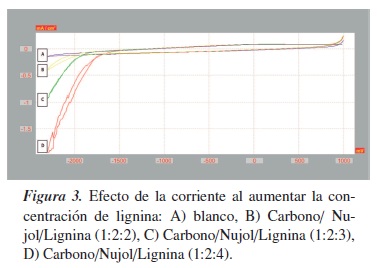
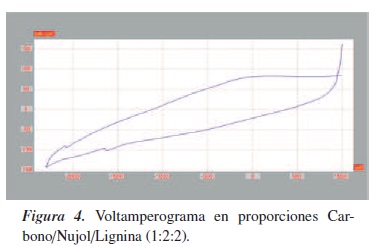
Se procedió a evaluar la influencia de la concentración de lignina en la pasta de carbono, para lo que se fabricaron electrodos de pasta con diferentes proporciones de carbono/nujol. A) el blanco está formado por Carbono/Nujol (1:2); las muestras se prepararon en las siguientes proporciones: B) Carbono/Nujol/Lignina (1:2:2), C) Carbono/Nujol/Lignina (1:2:3), D) Carbono/Nujol/Lignina (1:2:4). Los voltamperogramas para las diferentes proporciones de lignina son mostrados en la figura 3, en donde se puede apreciar cómo a medida que aumenta la proporción de lignina disminuye la corriente obtenida, lo que nos indica adsorción de la lignina y pasivación del electrodo, dando voltamperogramas no proporcionales en un incremento en corriente [15, 16].
En el caso de la pasta de carbono es difícil establecer si existe respuesta, ya que no muestra picos que nos den indicios de procesos de electrooxidación, tal como se observa en la figura 4. Se presume la formación de un depósito que pasiva el electrodo. Al parecer, la diferencia puede tener como origen la alta densidad de electrones π, lo que permite que moléculas aromáticas se adsorban sobre su superficie [17, 18].
4. Influencia del material del electrodo en la electrooxidación de la lignina con platino
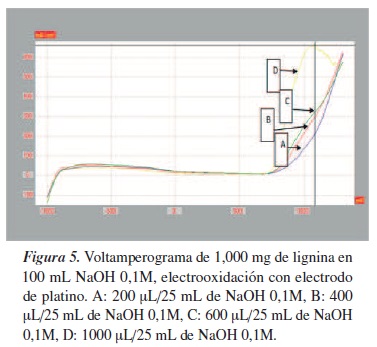
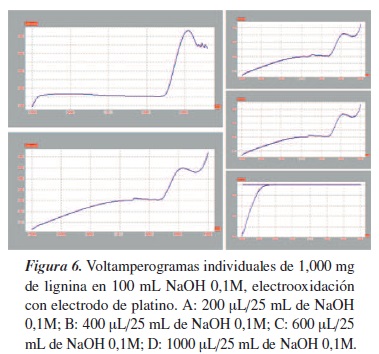
Se preparó una solución stock de 1,000 mg de lignina en 25 mL de NaOH 0,1M, de donde se sacaron las respectivas diluciones. En los voltamperogramas de las figuras 5 y 6 se puede apreciar que los picos están mejor definidos en el de platino, que en el electrodo de pasta de carbono. En el electrodo de platino se observó un pico de máxima potencial a los 1078,6 mV y una intensidad de 655.829 µA/cm2, apreciándose notablemente que el potencial incrementa en la medida que aumenta la concentración de la lignina, lo que es congruente en un análisis voltamperométrico, en los que se presenta electrotransformación de la lignina [19, 20].
Para realizar las corridas de A, B, C y D se tomaron las alícuotas de 2 microlitros de lignina stock diluida en 25 mL de NaOH; estas fueron las diluciones que mostraron las posibles electrooxidaciones de la lignina con electrodo de platino.
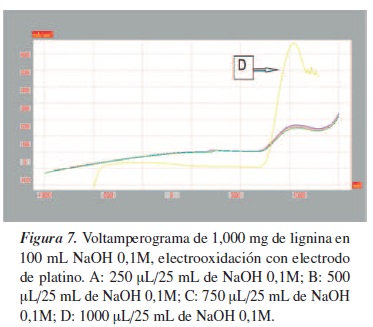
En la figura 7 se observa incremento de la concentración de lignina hacia donde más intenso es el pico, que corresponde a 1000 µL/25 mL de NaOH 0,1M, lo cual indica la electrotrasformación de la sustancia.
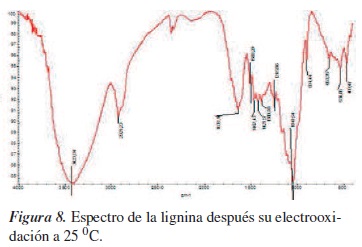
El análisis infrarrojo muestra que al aplicarle el potencial se generó una banda más intensa, 1041,54 cm−1, puede indicar la posible formación de grupos -OH, tal como se refleja en la figura 8, originando posibles rompimientos de grupos C-O-C y formación de alcoholes.
5. Conclusiones
Al realizar la voltamperometría de la lignina con el electrodo de pasta de carbono se formó en los electrodos un depósito polimérico que pudo haber afectado la transferencia de carga entre la superficie del electrodo y la sustancia, razón por la cual no se vio ningún cambio en el voltamperograma. En los análisis realizados con el electrodo de Pt no se formó ningún tipo de depósito que impidiera la transferencia de carga entre la muestra y el electrodo; ello permitió la electrooxidación de la lignina.
En los análisis realizados a la lignina en estado sólido se vio que el aglomerante no afecta notablemente en la electrodeposición, pero sí la proporción de la lignina; se observó que la cantidad de lignina depositada disminuye conforme aumenta la cantidad de aglomerante.
Las voltamperometrías cíclicas de la electrooxidación de la lignina sobre los electrodos de platino muestran un pico de oxidación máximo con un potencial de 1078,6 mV y una intensidad de 655.829 µA/cm2, que indica la posible electrotransformación de la sustancia.
Referencias
[1] P.N. Martínez Yepes, C.A. Guevara, J.A. Rodríguez, CH. Rose, C.A. Ríos. "Aprovechamiento Industrial de los Residuos y Desechos Celulósicos Generados en el Departamento del Quindío". Proyecto de Investigación no. 199 Vicerrectoría de Investigaciones, Programa de Química, Universidad del Quindío, pp. 85-88, 2004. [ Links ]
[2] P.N. Martínez Yepes, C.A. Guevara, J.A. Rodríguez, CH. Rose, C.A. Ríos, V. Restrepo. "Procesos Celulósicos con Especies no Madereras". Editorial Elizcom, Libro resultado de investigación. Universidad del Quindío, Colombia, 2005. [ Links ]
[3] E. Giraldo y A. Sabogal. Una alternativa sostenible: la guadua, técnicas de cultivo y manejo. CRQ. Armenia, Quindío, pp. 23-28, 2005. [ Links ]
[4] F. Castaño. "Definición técnica de régimen de aprovechamiento de bosques de guadua (Guadua angustifolia) CRQ Valle del Cauca-CVC", AID-ONFORDE, 2001. [ Links ]
[5] H. Cruz. "La Guadua nuestro bambú. CRQ Regional Quindío, Centro Nacional para el Estudio del Bambú", Armenia, Quindío. Colombia, 1994. [ Links ]
[6] N. E Mansouri, J. Salvadó. "Analytical methods for determining functional groups in various technical lignins". Industrial Crops and Products, 26, pp. 116-124, 2007. [ Links ]
[7] A. García y Á. Pérez-Urria. "Metabolismo Secundario de las Plantas". Reduca (Biología). Serie Fisiología Vegetal". Universidad Complutense. Madrid. 2 (3), pp. 119-145. 2009. [ Links ]
[8] J.M. Gaviria, A. Hernández A. "Técnicas fisicoquímica en el medio ambiente", UNED, 2008. [ Links ]
[9] E. Adler. "Lignin chemistry, present and future", Wood Sci. Technol., 11, pp. 169-218. 1977. [ Links ]
[10] B. Baurhoo, C.A. Ruiz-Feria C.A., & X. Zhao. "Purified lignin: Nutritional and health impacts on farm animals-A review". Animal Feed Science and Technology, 144, pp. 175-184, 2008. [ Links ]
[11] C.. G. Boeriu, D. Bravo, R. Gosselink & J.E.G Van Dam. "Characterization of structuredependent functional properties of lignin with infrared spectroscopy". Industrial Crops and Products, 20, pp. 205-218, 2004. [ Links ]
[12] C. Hamann, A. Hammnett, W. Vielstcih. Electrochemistry, Wiley, pp. 267-291, 2007. [ Links ]
[13] X. Londoño, L.G. Clark. "Ocho nuevos reportes taxonómicos y dos nuevos reportes de Bambusae de Colombia", Novon (8), pp. 408-428. 2002. [ Links ]
[14] P.N. Martínez Yepes, J.E. Garzón-Cardona, W. Henao-Escobar, A. Guarnizo Franco. "Evaluación de la producción del hongo Pleurotus ostreatus cultivado sobre los residuos derivados de la producción comercial del culmo de la guadua", 2008. [ Links ]
[15] S. Schmuki, H.S. Virtanen, M.P. IsaacS, A.J. Ryan, H. Davenport, Böhni and J. T. Stenberg. "In situ xanes investigations of Fe2O3/Cr2O3 artificial passive films". Electrochem. Soc. 145, pp. 791-796, 1998. [ Links ]
[16] K.H. Tan. "Soil Sampling, Preparation, and Analysis". Marcel Dekker, Inc. Nueva York, 1996. [ Links ]
[17] J. Wangm; Analytical. Electrochemistry, Wiley, pp. 67-:69, 2006. [ Links ]
[18] P. N. Martínez Yepes. .Evaluación de la producción del hongo Pleurotus ostreatus cultivado sobre los residuos derivados de la producción comercial del culmo de la guadua angustifolia Kunth". Revista Tumbaga, no. 3, pp. 43-53, Ibagué, Universidad del Tolima, Colombia, 2008. [ Links ]
[19] J. A. Rodríguez, P.N. Martínez Yepes. "Evaluación electroquímica de ligninas en especies no madereras". Proyecto de investigación no. 339, 87 páginas, Universidad del Quindío, Armenia, Quindío, Colombia, 2010. [ Links ]
[20] L. J. Saleger. Surfartantes, tipos y usos. Universidad de los Andes, Facultad de Ingeniería, Venezuela, 2002. [ Links ]