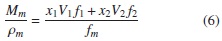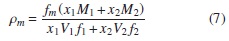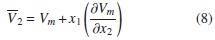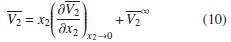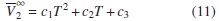Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia en Desarrollo
Print version ISSN 0121-7488
Ciencia en Desarrollo vol.6 no.2 Tunja July/Dec. 2015
Propiedades volumétricas de soluciones acuosas de etanol y [Emim]+ [CF3SO3]- a partir de datos de índice de refracción
Volumetric Properties of Ethanol and [Emim]+ [CF3SO3]- Aqueous Solutions from Refraction Index Data
D. Madrid Úsugaa,*
M. P. Urango Baqueroa
A. Portacio Lamadridb
a Facultad de Educación y Ciencia, Universidad de Sucre, Sincelejo, Sucre, Colombia.
b Facultad de Ciencias Básicas e Ingeniería, Universidad de Los Llanos, Villavicencio, Meta, Colombia.
* Autor de correspondencia: duvalier82@gmail.com
Recepción: 12-may-15 Aceptación: 24-jun-15
Resumen
Las densidades de las soluciones acuosas de etanol y de 1-Etil-3-Metilimidazolio Trifluorometanosulfonato [Emim]+[CF3SO3]- fueron estimadas a partir de datos de índice de refracción a diferentes temperaturas; los resultados obtenidos se encuentran dentro del intervalo de confianza establecido para las densidades reportadas en la literatura para estos sistemas y de las calculadas empleando la ecuación de Gladstone-Dale (GD). Las densidades estimadas en esta investigación se utilizaron para los cálculos de los volúmenes molares y volúmenes molares parciales a dilución infinita. Los datos de volumen molar parcial se correlacionaron con la concentración de soluto y la temperatura, para estudiar cualitativamente las interacciones presentes en las soluciones acuosas tratadas. Se encontró que el sistema [Emim]+[CF3SO3]- + agua tiene un carácter disruptor sobre las moléculas de agua, mientras que en el sistema etanol + agua predomina el efecto hidrofílico sobre el hidrofóbico.
Palabras clave: etanol, índice de refracción, líquido iónico, soluciones acuosas.
Abstract
Densities of ethanol and 1-Ethyl-3-methylimidazolium trifluoromethanesulfonate [Emim]+[CF3SO3]- aqueous solutions were estimated from refractive index data at different temperatures. The results are within the confidence interval established for densities reported in the literature for these systems and with calculated by using the Dale-Gladstone equation (GD). The estimated densities in this study were used to calculate the molar volumes and partial molar volumes at infinite dilution. The partial molar volume data correlated with the solute concentration and temperature to study qualitatively the interactions present in the treated aqueous solutions. The [Emim]+[CF3SO3]- + water system has a disruptor character on water molecules, whereas in the ethanol + water system the hydrophilic effect predominates over the hydrophobic.
Key words: Aqueous solutions, Ethanol, Ionic liquid, Refractive index.
1 Introducción
Los estudios sobre propiedades físicas de mezclas líquidas son de importancia para comprender la termodinámica de tales sistemas y para su uso en la industria de la ingeniería química. De hecho, la producción industrial requiere valores fiables de las propiedades físico-químicas de los compuestos puros y de sus mezclas. Este conocimiento es esencial para reducir los costos, especialmente en la producción de productos químicos y sustancias farmacéuticas. Además, el avance científico y el surgimiento de nuevas teorías para el estudio de propiedades termodinámicas y de transporte en soluciones sirven para entender y dilucidar aspectos básicos sobre las interacciones: soluto-soluto, soluto-solvente y solvente-solvente, presentes en las soluciones acuosas y no acuosas. Esto ha despertado gran interés en la comunidad científica, dado que en la literatura se encuentran diversas investigaciones sistemáticas sobre propiedades termofísicas en soluciones tales como: densidad, volumen molar, volumen molar parcial e índice de refracción, entre otras [1-4].
Por otra parte, diversas investigaciones reportan datos sobre índice de refracción, densidad y tensión superficial de las mezclas de disolventes mediante la predicción teórica o la medición de algunas de estas variables, proporcionando estimaciones confiables de propiedades de la mezcla. Entre las propiedades fisicoquímicas, el índice de refracción de mezclas de líquidos y polímeros ha recibido atención tanto por su significado como por la relativa simplicidad en la realización de las mediciones. En realidad, el índice de refracción ηD se correlaciona con la densidad, ρ, por varias expresiones teóricas y empíricas [5, 6]. Recientemente se reportan investigaciones sobre la variación del índice de refracción con la temperatura 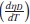 y de la variación del índice de refracción con la concentración
y de la variación del índice de refracción con la concentración 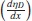 de diferentes materiales, para la estimación de la densidad de las mezclas [7-10].
de diferentes materiales, para la estimación de la densidad de las mezclas [7-10].
En este artículo se presenta el estudio de soluciones acuosas altamente diluidas, que abarcan un importante campo dentro la fisicoquímica de soluciones, por ser modelos que permiten obtener información acerca de interacciones soluto-solvente y sobre los cambios inducidos por solutos sobre la estructura del agua [11], y se consideran sistemas de estudio las soluciones acuosas de etanol y las soluciones acuosas del líquido iónico 1-Etil-3-Metilimidazolio Trifluorometanosulfonato [Emim]+ [CF3SO3]- avarias temperaturas. El estudio de las soluciones acuosas de etanol son de gran importancia, ya que presentan un comportamiento complejo, especialmente, en la zona diluida, debido a la diferente naturaleza de las interacciones entre los grupos polares y apolares con el agua [12]; además, sus múltiples propiedades como modificador de la estructura de los macrogeles incrementa su capacidad de absorber agua conforme se incrementa el contenido de etanol, obteniéndose un gel heterogéneo [13]. Por otra parte, las soluciones acuosas de líquidos iónicos han sido objeto de estudio por diferentes grupos de investigación a nivel mundial, debido a que son los modelos adecuados para describir las propiedades termodinámicas de las soluciones electrolíticas; además, tienen gran aplicación en diversas ramas de la industria fisicoquímica, debido a que pueden actuar como catalizadores o di-solventes, lo que hace que tengan gran interés como fluidos para aplicaciones de ingeniería, por lo que son llamados solventes de diseño, debido a que están formados por cationes y aniones que conducen al diseño de tareas específicas [14].
Se presentan datos experimentales de índice de refracción para los sistemas: i) etanol + agua y ii) [Emim]+ [CF3SO3]- + agua, los cuales se utilizan para estimar las densidades y propiedades volumétricas de los sistemas acuosos en estudio. Cabe anotar que los resultados de esta investigación aportan interpretaciones físicas que permiten entender el comportamiento hidrofóbico e hidrofílico del etanol y del líquido iónico [Emim]+ [CF3SO3]-. En la sección 2 se presentan el método experimental para la medición del índice de refracción de los sistemas en consideración y la descripción teórica para estimar la densidad y las propiedades volumétricas. En la sección 3 se presentan valores para las densidades estimadas a partir de los datos experimentales de índice de refracción para las soluciones acuosas de etanol y las soluciones acuosas de [Emim]+ [CF3SO3]- a varias temperaturas; además, se comparan las densidades obtenidas en este trabajo con las obtenidas mediante la ecuación de Gladstone-Dale (GD) y las reportadas en literatura para los sistemas en estudio, encontrándose buena concordancia. Finalmente, se analiza el efecto de la temperatura y la concentración sobre el índice de refracción, la densidad y el volumen molar parcial, y se interpretan los resultados en términos de interacciones intermoleculares a través de los criterios de pendiente límite y Helpler, los cuales permiten establecer el carácter hidrofílico e hidrofóbico presente en las mezclas.
2 Metodología
2.1 Medición de índice de refracción
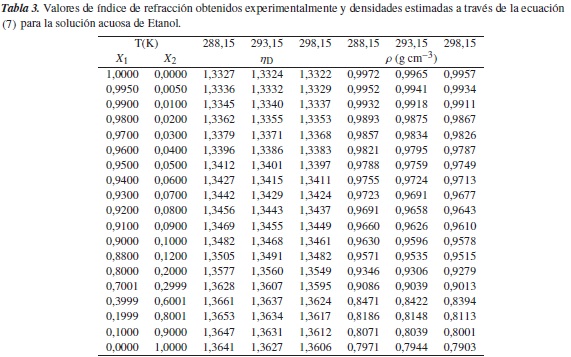
Para las mezclas requeridas utilizamos agua bidestilada, etanol al 99% de pureza (Merk) y el líquido iónico 1-Eti-3-Metlimidazolio Trifluorometanosulfonato [Emim]+ [CF3SO3]- a diferentes concentraciones; estas fueron preparadas aplicando el método de las pesadas y se guardaron en envases sellados, para minimizar las pérdidas por evaporación. El pesaje de los sistemas etanol+agua y [Emim]+ [CF3SO3]- + agua se efectuó en una balanza analítica (Explorer Ohaus), con una sensibilidad de ±10-4 genel rango más bajo de concentración. Se depositó aproximadamente 1 mL de solución en un refractómetro (Fisher Scientific) para obtener el índice de refracción de las mezclas estudiadas, así como el de los puros (etanol, agua y [Emim]+ [CF3SO3]-) para diferentes temperaturas, con la misma concentración, para compararlos con los resultados reportados en la literatura. Los datos de concentraciones e índice de refracción se emplearon para estimar los valores de densidad a través de la ecuación (7) y obtener luego los valores de volumen molar parcial con la ecuación (8).
2.2 Descripción teórica de la estimación de la densidad y propiedades volumétricas
El índice de refracción se puede usar como una forma de conocer las densidades de los líquidos; este hecho se basa en suponer que la refracción molar, definida por Lorentz-Lorentz RLL, de una determinada mezcla es una función de la fracción molar. Así, para una mezcla binaria:
Donde x1, R1, x2y R2 representan las concentraciones y refracciones molares de los puros (soluto y solvente), respectivamente.
Los volúmenes molares de las soluciones se pueden hallar conociendo sus densidades.
Donde Mm y ρm representan el peso molecular y la densidad de las mezclas.
Para tratar los valores referidos sobre los puros se tomará siempre m = 1 y m = 2 en las respectivas ecuaciones.
Así, el volumen molar de la mezcla está dado por:
Con
Donde nDm representa el índice de refracción de la mezcla.
Conociendo las densidades y los índices de refracción de los componentes puros, se puede determinar la densidad de una mezcla de composición conocida, teniendo en cuenta que para una mezcla se cumple que:
Entonces:
Por lo tanto, la densidad de la mezcla ρm será igual a [5, 15, 16] :
Por otra parte, las cantidades molares parciales pueden ser calculadas de las cantidades molares como una función de la fracción molar, como se observa en la ecuación siguiente:
Donde 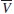 2 y Vm representan el volumen molar parcial del componente 2 y el volumen molar de la mezcla, respectivamente [17, 18].
2 y Vm representan el volumen molar parcial del componente 2 y el volumen molar de la mezcla, respectivamente [17, 18].
3 Resultados y análisis
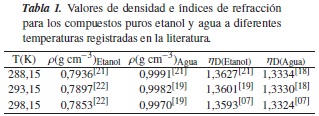
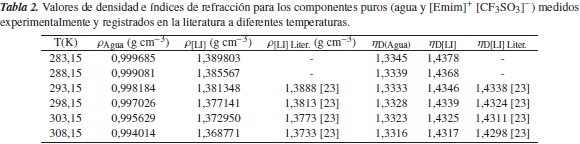
Los resultados de la literatura y los experimentales de índice de refracción ηD y densidad ρ de las soluciones acuosas de etanol y las soluciones acuosas de [Emim]+ [CF3SO3]-, para las temperaturas de 283,15 K, 288,15 K, 293,15 K, 298,15 K, 303,15 K y 308 K, se muestran en las tablas 3 y 6; se observa en ellas cómo los índices de refracción de tales soluciones disminuyen con el aumento de la temperatura, lo cual se puede atribuir al hecho de que la variación en el índice de refracción con la temperatura se compensa con el cambio de la densidad de las mezclas líquidas [19]. Sin embargo, en los casos en los que la variación es significativa con el cambio en la temperatura, pueden servir, para interpretar la estructura y las interacciones en el líquido computando, otras propiedades dieléctricas, ópticas y acústicas, usando los datos experimentales. Se observa también que la densidad de las soluciones acuosas de etanol y las de [Emim]+ [CF3SO3]-, que fueron obtenidas a través de la ecuación (8), disminuye con el aumento de la temperatura.
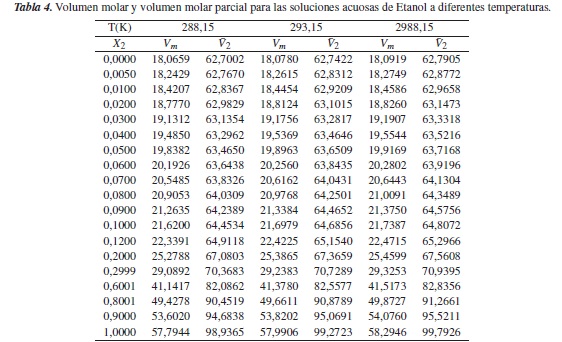
Los datos de densidad estimados para las soluciones acuosas de etanol son comparados con los estimados a través de la relación de Gladstone-Dale, dada por la ecuación (9), obteniéndose resultados aproximados a los estimados a través del método utilizado en esta investigación, como se puede observar en la tabla 5, y, por tanto, esta comparación funciona como método de validación, lo cual garantiza que los datos obtenidos de densidad para las soluciones acuosas de [Emim]+ [CF3SO3]- y de etanol son confiables.
Donde η12 es el índice de refracción de la mezcla, ρ12 es la densidad de la mezcla, w1,w2 son las fracciones de masa del solvente y el soluto, ρ1, ρ2 son las densidades de las sustancias puras y η1,η2 son los índices de refracción del solvente y el soluto [5, 20].
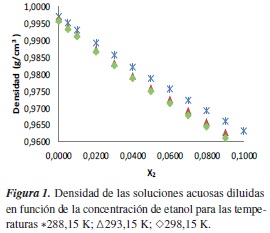
Se observa en la figura 1 que a medida que aumenta la concentración (x2) de soluto en el sistema etanol + agua, la densidad de las soluciones disminuye, lo cual afecta el índice de refracción, ya que la velocidad de las ondas de luz que se propagan a través de la solución disminuye; esto se observa en la relación ηD = 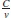 .
.
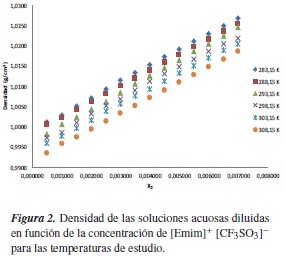
Sin embargo, en la figura 2 se observa que los valores de densidad de la solución acuosa de [Emim]+ [CF3SO3]- aumentan con el aumento de la concentración de soluto, y disminuye con el aumento de la temperatura.
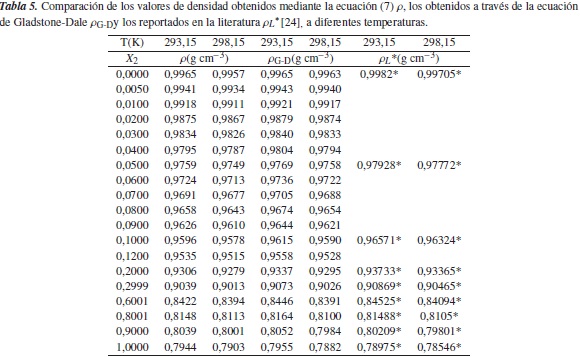
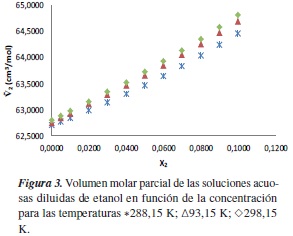
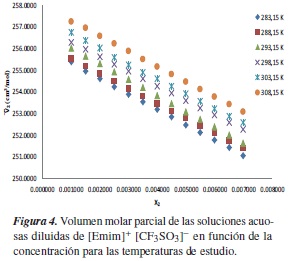
Por otra parte, los volúmenes molares y los volúmenes molares parciales del soluto de las soluciones acuosas diluidas de etanol, y las soluciones acuosas diluidas de [Emim]+ [CF3SO3]- fueron calculados usando (3) y (8), respectivamente, y se muestran en las tablas 4 y 7. Las tendencias de estas cantidades en función de la concentración se muestran en las figuras 3 y 4.
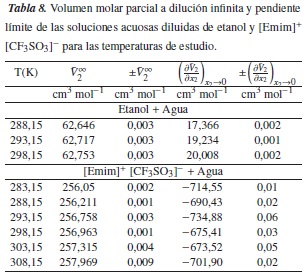
Los volúmenes molares parciales a dilución infinita del soluto (etanol y [Emim]+ [CF3SO3]-) y las pendientes límites para cada una de las temperaturas fueron obtenidas por la correlación entre los datos de volumen molar parcial de las soluciones acuosas diluidas y la concentración de soluto, como muestran las figuras 3 y 4, para lo cual se ajustaron los parámetros de la ecuación (10), donde la pendiente representa la pendiente límite 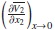 , y el intercepto
, y el intercepto 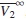 , el volumen molar parcial a dilución infinita. Los resultados de estas pendientes e intercepto se encuentran en la tabla 8, con sus respectivas incertidumbres.
, el volumen molar parcial a dilución infinita. Los resultados de estas pendientes e intercepto se encuentran en la tabla 8, con sus respectivas incertidumbres.
Experimentalmente [25] se ha encontrado que la pendiente límite del volumen molar parcial en función de la concentración de soluto genera un criterio de hidrofobicidad que se puede enunciar así: si la pendiente límite es positiva, entonces en la región diluida predomina la interacción hidrofílica sobre la interacción hidrofóbica, y cuando disminuye la pendiente límite, el predominio hidrofílico disminuye. Con base en lo anterior, se obtiene que en las soluciones acuosas de etanol predomina la interacción hidrofílica sobre interacción hidrofóbica; además, se observa que estas interacciones aumentan a medida que aumentamos la temperatura; sin embargo, para la soluciones acuosas de [Emim]+ [CF3SO3]- se observa que la interacción que predomina es la hidrofóbica sobre la hidrofílica.
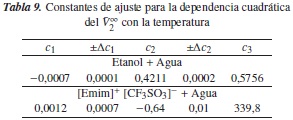
Por otra parte, el criterio Hepler postula que la segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura refleja el efecto de los solutos sobre la estructura del agua e indica el comportamiento hidrofóbico del soluto. El signo negativo se atribuye a que el soluto tiene un efecto disruptor sobre la estructura del agua, y el signo positivo, a que el soluto tiene un efecto formador [26, 27]. Así, correlacionando el 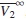 de la tabla 8 con la temperatura, mediante una ecuación cuadrática de la forma de la ecuación (11), encontramos las constantes que muestra la tabla 9, y haciendo la segunda derivada de
de la tabla 8 con la temperatura, mediante una ecuación cuadrática de la forma de la ecuación (11), encontramos las constantes que muestra la tabla 9, y haciendo la segunda derivada de 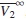 con respecto a la temperatura nos da como resultado c1, lo cual indica que el [Emim]+ [CF3SO3]- tiene un efecto formador sobre la estructura del agua, y que el etanol tiene un efecto disruptor sobre la estructura del agua, según el criterio de Helper.
con respecto a la temperatura nos da como resultado c1, lo cual indica que el [Emim]+ [CF3SO3]- tiene un efecto formador sobre la estructura del agua, y que el etanol tiene un efecto disruptor sobre la estructura del agua, según el criterio de Helper.
4 Conclusiones
A partir de los índices de refracción de las soluciones acuosas de etanol y de las de [Emim]+ [CF3SO3]- se puede determinar la concentración de soluto presente en la solución a través de la correlación que surge entre ellos; además, se pueden estimar los valores de la densidad, volúmenes molares y volumen molar parciales para cada fracción de concentración. La densidad de las soluciones acuosas de Etanol disminuye con el aumento de la concentración, y la densidad de las soluciones acuosas de [Emim]+ [CF3SO3]- aumenta al aumentar la concentración de soluto y al aumentar la temperatura; se muestran los resultados obtenidos para la segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura, y el coeficiente c1 del ajuste funcional del volumen molar parcial del soluto a dilución infinita con la temperatura (ecuación 11).
El [Emim]+ [CF3SO3]- se comporta hidrofóbicamente y, en consecuencia, puede ser catalogado como un soluto disruptor de la estructura del agua; esto fue verificado con la pendiente límite y la segunda derivada del volumen molar parcial a dilución infinita con respecto a la temperatura; por último, se observa que nuestros datos fueron trabajados en una región infinitamente diluida, para observar mejor el comportamiento soluto-solvente.
Referencias
[1] E. García Bernal, A.P. de los Ríos, F.J. Hernández Fernández, A. Larrosa-Guerrero, A. Ginestá, S. Sánchez Segado, L.J. Lozano, C. Godínez, "Aplicaciones de los líquidos iónicos en la industria química", IV Jornadas de Introducción a la Investigación de la UPCT, pp. 66-68, 2011. [ Links ]
[2] V.H. Álvarez, S. Mattedi, M. Aznar, "Density, refraction index and vapor-liquidequilibria of N-methyl-2-hydroxyethylammonium butyrate plus (methylacetate or ethyl acetate orpropyl acetate) at several temperaturas", J. Chem. Therm odynamics, vol. 62, pp. 130-141, 2013. [ Links ]
[3] L. Yu, H. Dong, C. Wu, Y. Zhang, "The density, refractive index, and thermodynamic behaviour of binary mixtures of 1,3-Diethenyl-1,1,3,3 tetramethyldisiloxane with aromatic hydrocarbons", J. Chem. Thermodynamics, vol. 72, pp. 139-151, 2014. [ Links ]
[4] A. Chen, M. Liu, Y. Zheng, D. Sun, B. Wang, X. Wang, "Density, Viscosity and Refraction Index of Aqueous Solutions of 7 Hydroxycoumarin and Ethanol or 1-Propanol at Temperatures from 293.15 to 313.15 K", J. Solution Chem., vol. 42, pp. 2213-2228, 2013. [ Links ]
[5] R. Francesconi, S. Ottani, "Correlation of density and refraction index for liquid binary mixtures containing polyglycols. Use of the group contributions in the Lorentz-Lorenz, Gladstone-Dale and Vogel equations to evaluate the density of mixtures", J. Molecular Liquids, vol. 133, pp. 125-133, 2006. [ Links ]
[6] K. Adi Kurnia, M. M. Taib, M.I. A. Mutalib, T. Murugesan, "Densities, refractive indices and excess molar volumes for binary mixtures of protic ionic liquids with methanol at T = 293.15 to 313.15 K.", J. Molecular Liquids, vol. 159, pp 211-219, 2011. [ Links ]
[7] F. J. Trujillo Santacoloma, "Química fundamental en soluciones acuosas: Teoría y aplicaciones", 2a ed. Medellin: Universidad de Medellin, 2008. [ Links ]
[8] F. J. Lamelas, "Index of Refraction, Density, and Solubility of Ammonium Iodide Solutions at High Pressure", J. Phys. Chem. B, vol. 117, pp. 2789-2795, 2013. [ Links ]
[9] S. M. García-Abarrio, L. Viloria, L. Haya, J. S. Urieta, A. M. Mainar, "Thermophysical behaviour of the mixture (±)-3,7-dimethyl-1, 6octadien-3-ol with etanol", Fluid Phase Equilibria, vol. 308, pp. 78-89, 2011. [ Links ]
[10] D. Dragoescua, D. Gheorghe, M. Bendová, Z. Wagner, "Speeds of sound, isentropic compre sibilities and refractive indices for some binary mixtures of nitromethane with chloroalkane at temperatures from 298.15 to 318.15 K. Comprson with theories", Fluid Phase Equilibria, vol. 385, pp. 105-119, 2014. [ Links ]
[11] C. M. Romero1, A. F. Suárez, E. Jiménez, "Effect of temperature on the volumetric properties of aliphatic alcohols in dilute aqueous solutions", Rev. Colomb. Quim., vol. 36, pp. 377-386, 2011. [ Links ]
[12] M. Sakurai, K. Nakamura, K. Nitta, "Volumetric Properties of Dilute Aqueous Alcohol Solutions at Different Temperatures", J. Bull Chem Soc, vol. 67, pp. 1580-1587, 1994. [ Links ]
[13] L. G. J. García, J. A. Cortés, "Síntesis de Hidrogeles de Acrilamida en Soluciones Acuosas de Etanol", Rev. Polímeros, vol. 24, pp. 752-756, 2014. [ Links ]
[14] M. S. Páez, M. K. Vergara, E. Montes, "Parámetros de Interacción Ión Volumétricos del Sistema 1-Butil-3-Metil Imidazolio Trifluorometanosulfonato + Agua a varias Temperaturas", Información Tecnológica, vol. 24, pp. 47-58, 2013. [ Links ]
[15] A. Urbanczyk, W. A. Van Hook, "The correlation of excess molar refraction and excess volume for some binary solutions; a new approach", J. Chem. Thermodynamics, vol. 27, pp. 864-875, 1996. [ Links ]
[16] A. R. Katritzky, S. Sild, M. Karelson, "General Quantitative Structure-Property Relationship Treatment of the Refractive Index of Organic Compounds", J. Chem. Inf. Comput. Sci., vol. 38, pp. 840-844, 1998. [ Links ]
[17] I. N. Levine, "Físico Química", 5ta ed., Madrid: McGraw-Hill, 2004. [ Links ]
[18] A.C. Galvão, L.G. Franzosi, A.M. da Luz, R.H. Schneider, W.S. Robazza, "Ability of the Prigogine Flory-Patterson model to predict partial molar volumes of binary liquid mixtures", J. of Molecular Liquids, vol. 203, pp. 47-51, 2015. [ Links ]
[19] V. Herráez, R. Belda, "Refractive Indices, Den-sities and Excess Molar Volumes of Monoalcohols + Water", J. Solution Chem, vol. 35, pp. 1315-1328, 2006. [ Links ]
[20] J Chen, X. Chen, R. Xu, Yu Zhu, Y. Shi, X. Zhu, "Refractive index of aqueous solution of CdTe quantum dots, optics communications", J. Chen et al. Optics Communications, vol. 281, pp. 3578-3580, 2008. [ Links ]
[21] A. Gromer, Física en la ciencia y en la industria, New York, USA: McGraw-Hill Editorial reverte S.A., 2006. [ Links ]
[22] L. Qian, S. Hong, S. Shaochuan, Y. Junxian and Y. Kejian, "Density and Viscosity of Ternary Systems (Poloxamer 188 + Ethanol Acetone + Water) at Temperatures from 288.15 K to 308.15 K." J. Chem. Engineering, vol. 19, pp.478-483, 2011. [ Links ]
[23] A. N. Soriano, B. T. Doma Jr, Meng-Hui Li, "Density and refractive index measurements of 1-ethyl-3-methylimidazolium-based ionic liquids", J. the Taiwan Institute of Chemical Engineers, vol. 41, pp.115-121, 2010. [ Links ]
[24] B. González, N. Calvar, E. Gómez, A. Dominguez, "Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K", J. Chem. Thermodynamics, vol. 39, pp. 1578-1588, 2007. [ Links ]
[25] A. Portacio Lamadrid, M. Paez Meza, L. Vergara Dueña, "Efecto de la temperatura sobre las propiedades volumétricas y viscosimétricas de soluciones acuosas de pentaeritritol", Revista Colombiana de Física, vol. 41, pp. 627-630, 2009. [ Links ]
[26] C. Romero, A. Suárez, E. Jiménez, "Efecto de la temperatura sobre las propiedades volumétricas de alcoholes alifáticos en soluciones acuosas diluidas", Revista Colombiana de Química, vol. 36, pp. 377-386, 2007. [ Links ]
[27] D. M. Makarov, G. I. Egorov, A. M. Kolker, "Density and Volumetric Properties of Aqueous Solutions of Trimethylamine N-Oxide in the Temperature Range from (278.15 to 323.15) K and at Pressres up to 100 MPa", J. Chem. Eng. Data, vol. 48, pp. A-I, 2015. [ Links ]