1. INTRODUCCIÓN
El método de pilarización es ampliamente utilizado para mejorar la estabilidad química y las propiedades texturales de los materiales tipo arcilla, puesto que logra aumentar el área superficial y proporcionar una porosidad uniforme. La pilarización de un material depende en gran medida de la estabilidad térmica del aluminosilicato, la capacidad de expansión y la carga laminar del sólido, la acidez intrínseca del material y la densidad de pilares definida como la relación de meq Al3+ por gramo de arcilla. La mayoría de estudios relacionados con la pilarización de arcillas se han realizado sobre materiales naturales, siendo muy escasos los reportes en silicatos sintéticos a pesar de sus ventajas sobre el control de propiedades desde la síntesis como la pureza y la carga del material. Entre los filosilicatos laminares sintéticos, las micas sintéticas de alta carga y de composición químicaNan[Sig-nAln]Mg6F8O20.xH2O, presentan ventajas con respecto a los minerales de origen natural como por ejemplo la alta pureza, la elevada capacidad de expansión, capacidad de intercambio iónico y control de la carga laminar desde la síntesis [1]. Estos materiales que se nombran en forma abreviada como Na-n-mica (donde n representa la carga nominal por celda unidad), tienen una estructura laminar 2:1 trioctaédrica con alta carga, producida por las sustituciones isomórficas en la capa tetraédrica de Si4+ por Al3+. El sodio es el tipo de catión interlaminar que se utiliza en la síntesis.
Los silicatos laminares Na-n-micas se han obtenido por diferentes métodos como por ejemplo el método hidrotérmico [2], el método de estado sólido [3] y el método por sol - gel [4]. El método sol - gel, consiste en la formación de redes compuestas por elementos inorgánicos obtenidos a través de dos reacciones químicas simultáneas que son la hidrólisis y condensación. Entre las ventajas más importantes del método sol - gel se destaca, la obtención de materiales con alta porosidad tanto amorfos como nanocristalinos y el buen control para la modificación química en función del tipo de precursor.
Diferentes tipos de estudios muestran el interés científico que existe en torno a revelar la naturaleza de la capacidad de pilarización en los silicatos laminares sintéticos. Yamaguchi y Col., [5] pilarizaron una mica sintética expansible de fórmula NaMg2.5Si4O10F2 empleando un polihidroxicatión de cloruro de zirconilo como agente pilarizante con el fin de aumentar el tamaño del poro. Las micas fueron previamente modificadas hidrotérmicamente con un agente director de estructura (template) de polivinil alcohol PVA para expandirla obteniendo mayor área superficial y un espaciado basal de hasta aproximadamente 27 Å en comparación con el método convencional (pilarización con el policatión de Keggin) que logró una expansión hasta 21 Å.
La familia de las micas sintéticas de alta carga, Na-4-mica y Na-3-mica, también se han pilarizado con óxidos de hierro, expandiendo previamente la interlámina con la intercalación de cationes de octilamonio para facilitar el reemplazo por cationes voluminosos formados por polihidroxicationes de Fe3+. La calcinación a 773 K y modificaciones del sol - gel de Fe3+ con tetraortosilicato dio lugar a la formación de pilares a base de Fe2O3 o Fe2O3-SiO2 en las micas y el aumento de área superficial (57 a 130 m.2/g.), al igual que incrementó la porosidad y estabilidad térmica. En particular se observó que la pilarización de la mica Na-4-mica con Fe2O3 o Fe2O3-SiO2 provocó un aumento significativo en la acidez del material. En cuanto a la estructura, este estudió indicó que las micas pilarizadas resultantes consisten en pilares fragmentados formando la estructura comúnmente conocida como "castillo de naipes'' [6].
Hasta el momento no se ha reportado la pilarización de la Na-2-mica con el agente de intercalación Keggin (Al13)7+. Este material tiene una alta carga laminar y por lo tanto la etapa de intercambio con el polihidroxicatión de Keggin estará condicionado por el tipo de catión interlaminar, lo cual afecta el grado de hidratación cuando se trata de cationes inorgánicos y el grado de expansión que puede modificarse cuando se intercambia con cationes alquilamonio.
El estudio de la síntesis de materiales funcionalizados a escala nanométrica utilizando arcillas como precursores de la matriz inorgánica, en donde se intercalan especies químicas dentro de la estructura laminar porosa, ha sido un tema de gran interés y desarrollo en las últimas décadas, debido a sus potenciales aplicaciones como catalizadores en fase heterogénea [7], dispositivos ópticos, opto-electrónicos, magnéticos y aplicaciones electroquímicas [8].
Los nanoclusters metálicos, son agregados polinucleares que contienen desde unos pocos hasta miles de átomos, y pueden cambiar su estructura alrededor de uno o más átomos metálicos. Los nanoclusters metálicos adoptan las propiedades intrínsecas del metal de partida, potencializando sus características. Es así como por ejemplo, los nanoclusters a base de manganeso muestran interesantes propiedades catalíticas [9] debido al potencial redox variable que puede presentar este metal [10].
La inmovilización de nanoclusters metálicos dentro de la estructura interlaminar de los filosilicatos laminares, permite controlar las propiedades del material funcionalizado, como por ejemplo el tamaño de los "clusters", las propiedades químicas que le confieren los metales específicos y la estabilidad química tanto de los compuestos intercalados como de la arcilla precursora[11].
La funcionalización con nanoclusters de MnS, depende en gran medida de la cantidad de manganeso intercambiado por el material, cuya fijación se relaciona con el pH, condiciones de humedad y de secado; en este sentido, algunos estudios muestran que el manganeso se adsorbe débilmente en minerales de arcilla y que su movilidad provoca a la vez baja estabilidad del material que se demuestra por el colapso de la interlámina después del tratamiento térmico a 200 °C [12,13]. En el caso de micas sintéticas de alta carga, el intercambio con cationes Mn2+ es reversible debido a que la estructura hidratada de la mica presenta un espacio interlaminar abierto que se retiene durante la reacción de intercambio iónico, lo que provoca la lixiviación del metal [14].
Galeano y Col., [15] comprobaron el crecimiento in - situ de nanoclusters metálicos de MnS dentro de las láminas de filosilicatos naturales, mediante el tratamiento con una corriente de sulfuro de hidrógeno en fase gaseosa y se evidenció la influencia de la temperatura en el crecimiento de los compuestos. También encontraron que con temperaturas superiores a 200 °C se presentaba un colapso parcial del material, por lo que se determinó que se requerían estudios más profundos para mejorar la estabilidad química de los nanoclusters intercalados, siendo la pilarización, una de las estrategias recomendadas para este fin.
En este trabajo se estudió el efecto del catión interlaminar (sodio, litio y hexadecilamonio) durante el intercambio con el policatión de Keggin y el efecto de la densidad de pilares variando la carga de Al3+ suministrados como cationes (Al13)7+ entre 10, 20 y 30 meq. Al3+ por gramo de mica. Adicionalmente se estudió la formación in - situ de nanoclusters de MnS sobre los materiales modificados previamente con aluminio, evaluando la influencia que ejerce la densidad de pilares y la temperatura de sulfidización (50, 100 y 150 °C) en la formación de nanoclusters de MnS.
2. METODOLOGÍA
Se sintetizó la Na-2-mica vía sol-gel (Na-MSG) como material precursor de los materiales que se sometieron a intercambio con cationes litio (Li-M) y hexadecilamonio (C16-M). Previamente se hicieron algunos experimentos utilizando una mica obtenida mediante método de estado sólido (Na-2-MES) sintetizada por el grupo Química de Estado Sólido FQM-212 de la Universidad de Sevilla (España), con el fin de determinar la influencia de la fase completamente hidrata obtenida por este método y la contribución de fases anhidras como producto del método de sol- gel.
2.1 Síntesis de Na-2-micavía sol-gel (Na-MSG)
El material se sintetizó en base al procedimiento realizado por Paulus y Co/.,[4] las cantidades de cada uno de los precursores se determinaron a partir de la estequiometría nominal de la mica (Na2[Si6Al2]Mg6O20F4). Se sintetizaron 8 lotes de 10 g. cada uno y se mezclaron. Previamente a esta etapa se verificó la homogeneidad de todos los lotes por DRX. Cada lote se preparó a partir de un gel monofásico disolviendo 12 mmol de Al(NO3)3.9H2O (Carlo - Erba, pureza 99 %) y 12 mmol de Mg(NO3)2.6H2O (Carlo - Erba, CAS 13446-18-9, pureza 99 %), cada uno por separado en la mínima cantidad (5 mL aproximadamente) de etanol absoluto (Mallinckrodt, pureza 99.9 % p/v). Posteriormente, se adicionó 12.6 mmol del precursor de silicio M3S (Metiltrietoxisilano - Acros Organics, pureza 95 %). La mezcla se agitó constantemente por tres horas a 20 °C. La preparación del gel se realizó bajo condiciones de reflujo manteniendo un control de la temperatura a 60 °C por tres días. El gel, se secó en estufa a 100 °C y se molió en un mortero de ágata hasta conseguir un polvo fino. Con el fin de eliminar los nitratos remanentes, cada uno de los sólidos se calcinó a 475 °C en atmósfera oxidante por 18 horas. Al polvo resultante se le adicionaron 10 g. (238 mmol) de NaF (Baker Analyzed, pureza 99 %), correspondiente a una cantidad en exceso con respecto al sodio aproximado del 100 % y se mezcló vigorosamente en un mortero de ágata. El material se calcinó a 900 °C en un crisol de platino con tapa por 18 horas con una rampa de 10 °C/min. Finalmente se molió, se lavó en agua desionizada y se secó a temperatura ambiente. Con el fin de eliminar el exceso de fluoruros, se realizó una etapa adicional donde se lavó el material obtenido con una solución de ácido bórico al 4.0 % p/v, agitando constantemente por una hora. Después se dejó el material por tres días, en una solución de cloruro de sodio al 24.0 % p/v (10 veces la CIC teórica de la mica) para compensar el sodio interlaminar que pudo haberse lixiviado durante la eliminación de los fluoruros remanentes. Los cloruros remanentes se eliminaron lavando la mica en membrana de diálisis hasta obtener una conductividad cercana al agua inicial de lavado.
2.2 Síntesis de Li-2-mica (Li-M)
Se realizó el intercambio catiónico entre el Na+ por el Li+ en base al procedimiento realizado por Pavón y Col., [16] en donde la Na-MSG se sometió a intercambio con una solución de LiCl 0,2 N (Merck, pureza 98 %) en una cantidad en exceso igual a 10 veces la CIC teórica a la mica (247 meq/100 g de mica); la mezcla se agitó por 8 horas a 20 °C repitiendo el procedimiento 3 veces. La Li-M obtenida se lavó con agua destilada en agitación por 6 horas, repitiendo 3 veces el proceso. Finalmente se dejó secar a 60 °C. Los cloruros remanentes se eliminaron lavando la mica en membrana de diálisis hasta obtener una conductividad cercana al agua inicial de lavado.
2.3 Síntesis de organomica C16-2-mica (C16-M)
La preparación de la órganomica, se realizó en base al procedimiento reportado por Alba y Col., [17]. Se disolvió 5.4 mmol n-hexadecilamina (Alfa - Aesar, pureza 90 %) satisfaciendo 2 veces la CIC teórica de la mica de partida (247 meq/100 g mica) en 50 mL de HCl 0.1 M (Panreac, pureza 36.5 %) agitando constantemente la disolución de HCl antes de usarla. La mezcla anterior se agitó a 80 °C durante 3 horas controlando la temperatura en baño maría. Posteriormente, se adicionó 1 g. de mica y se agitó a 80 °C por 3 horas. Seguidamente se lavó con 50 mL. de agua caliente a 50 °C y se agitó por 30 minutos más. Se centrifugó a 15000 r.p.m. a 6 °C durante 30 minutos y se desechó el sobrenadante. Se mezcló el sólido centrifugado con 50 mL. aproximadamente de una mezcla agua: etanol (1:1 v/v) a 50 °C, durante toda la noche con el fin de eliminar cualquier exceso de catión orgánico, al final del proceso, se centrifugó a 15000 r.p.m. por 30 min. y secó a temperatura ambiente.
2.4 Preparación de la solución intercalante
Se preparó mediante un método estándar publicado previamente por Galeano y Col., [15]. Se fijó una cantidad de aluminio expresada como meq. de aluminio por gramo de material, en este caso, se usaron tres valores para evaluar el efecto de la densidad de pilares correspondiente a 10, 20 y 30 meq. de Al3+/g. de mica. Se realizó un proceso de hidrólisis, que consistió en adicionar lentamente (1 gota / 5 s aproximadamente) una solución de NaOH 0.2 M (Panreac, pureza 99 %) sobre una solución de AlCl3.6H2O 0.2 M (Sigma -Aldrich, pureza 99 %), agitando constantemente hasta obtener una relación de hidrólisis (OH-/ Al3+) de 2.4 en todos los casos. Al finalizar la adición se dejó en calentamiento a 70 °C por 2 horas.
2.5 Proceso de Pilarización
Se adicionó lentamente y gota a gota la solución intercalante sobre una suspensión al 2,0 % p/v de mica (Na-2-mica-ss, Li-2-mica o C16-2-mica) en agua destilada en agitación constante por 2 horas a temperatura ambiente. Una vez terminada la adición se dejó en agitación por 12 horas más. Transcurrido el tiempo se dejó en reposo hasta que el sólido se depositó en el fondo, seguidamente se eliminó el sobrenadante. El sólido obtenido se lavó con agua destilada, centrifugando hasta que la conductividad del sobrenadante fue cercano a la conductividad del agua. El material resultante se calcinó a 500 °C por dos horas en aire.
2.6 Homoionización con Mn2+
Se realizó en base al procedimiento realizado por Pavón y Col., [16]. A 1 g. de cada Al2O3-mica se le adicionó 10 mL. de MnCl2.4H2O 2.47 N (Sigma - Aldrich, 99.5 %). Para asegurar el máximo nivel de intercambio con Mn2+ posible, se agitó constantemente durante 8 horas a temperatura ambiente. Una vez finalizada la agitación se dejó reposar la suspensión y se retiró el sobrenadante. Se repitió el ciclo descrito 3 veces más. Al final se lavaron los sólidos 3 veces con agua destilada en agitación por 6 horas cada vez y se centrifugó hasta que la conductividad del sobrenadante fue cercano a la conductividad del agua de lavado. Se dejó secar a 60 °C.
2.7 Sulfidización con H2S generado in - situ.
Para el proceso de sulfidización, se empleó un horno tubular provisto con control electrónico de temperatura; los materiales previamente homoionizados con Mn se sometieron a un tratamiento con flujo de sulfuro de hidrógeno generado in - situ, tras una adición lenta y gota a gota, bajo agitación continua de un exceso de HCl (Panreac, pureza 36.5 %) concentrado sobre una solución saturada de Na2S. El tratamiento se realizó durante 8 horas continuas.
Debido a la necesidad de utilizar un exceso de S2- (ion sulfuro) constante para asegurar la formación de los agregados polinucleares de sulfuro del metal (MnS), se fijó un flujo constante de H2S con una relación S2-/Mn2+= 50, establecida a partir de la información del trabajo previos donde se evaluaron diferentes relaciones Mn/S con valores de 5, 50 y 500 [18] y se pudo comprobar que la relación Mn/S = 50 permitía la formación de agregados polinucleares (verificado por la expansión de la interlámina) y al mismo tiempo, permitía conservar la estructura laminar puesto que el ataque ácido al que se sometió no fue tan prolongado. En consecuencia y con el fin de satisfacer la relación Mn/S = 50, se determinó la cantidad de manganeso presente en el material (%p/p) mediante espectrofometría de absorción atómica. A partir de esta información y de acuerdo al procedimiento desarrollado por Iacomiy Col., [19], se determinaron las mmoles de H2S necesarias (mmol H2S = 50 mmol Mn) teniendo en cuenta que tras ensayos experimentales se determinó que la reacción para la generación in - situ del ácido tiene un rendimiento del 60.3 %. Se evaluaron diferentes temperaturas para el tratamiento químico con H2S (50, 100 y 150 °C), bajo atmósfera de nitrógeno, posteriormente se sometieron a un tratamiento térmico final a 200 °C en atmósfera de nitrógeno por 2 horas.
2.8 Caracterización
Los sólidos obtenidos se caracterizaron mediante análisis de difracción de rayos X en un difractómetro marca BRUKER modelo D8 ADVANCE con geometría DaVinci operando a 40kV.y 30 mA., con una rendija divergente de 0.6 mm., empleando como fuente la radiación CuKa1, con un filtro de níquel y un tiempo de muestreo de 0.4 segundos.
La Capacidad de Intercambio Catiónico (CIC) de las muestras se determinó por el método de saturación previa con acetato de amonio [20], en donde se pesaron 0,5 g. de muestra suspendiéndolos en agua destilada al 2 % ajustando el pH a 7.0 aproximadamente agitando toda la noche. Después, la muestra se suspendió en 75 mL. de CH3COONH4 (Panreac, pureza 97 %) 2.0 M agitando por 8 horas, tiempo después del cual se centrifugó y se realizaron 2 ciclos más adicionando 50 mL de CH3COONH4 2.0 M en cada uno. El exceso de iones amonio se eliminó mediante una suspensión al 2 % en agua destilada y agitación durante toda la noche. Al final del proceso se centrifugó, desechando el sobrenadante y se secó la muestra a 60 °C. Por último, se valoró el contenido de amonio retenido por micro - Kjeldahl. Esta técnica se empleó para determinar el porcentaje de carga compensada (% CC) de cada sólido después de la modificación asociando tal compensación a la formación de los nanoclusters.
Se determinó el porcentaje de óxido de aluminio mediante técnica de absorción atómica; para este fin los materiales se sometieron a un protocolo de digestión ácida HF/HNO3 [21], en donde se pesaron 0.010 g. de muestra en un frasco plástico, se adicionaron 4.0 mL de HF (Panreac, pureza 40 % p/v) con una pipeta plástica y 1 mL. de HNO3 (J.T. Baker, pureza 63 % p/v), se dejó reaccionar por una noche agitando fuertemente en la mañana. Después se calentó en baño maría por 30 minutos (Taproximada= 60 °C), dejando enfriar el frasco parcialmente tapado, seguidamente se adicionó 50 mL.de H3BO3 (Carlo Erba, pureza 99.5 %) al 4 %, agitando y dejando reposar por una hora. Al final se añadieron 45 mL. de agua destilada agitando vigorosamente. Las muestras se midieron en el espectrofotómetro de absorción atómica Perkin Elmer 2380 de la Universidad de Nariño.
3. RESULTADOS Y DISCUSIÓN
3.1 Síntesis de las Na-2-mica, Li-2-mica y C16-2-mica.
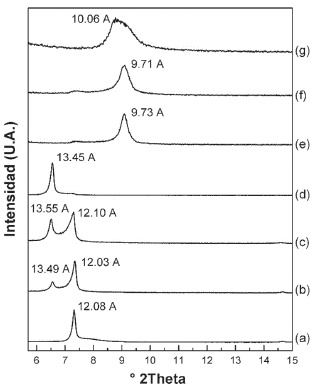
La figura 1 muestra la señal d001 de los patrones de difracción de rayos X (DRX) de los materiales precursores que se emplearon en el proceso de pilarización. La Na-MES sintetizada por el método de estado sólido (Fig.1a), Na-MSG por el método sol - gel (Fig.1b), la Li-M preparada por intercambio catiónico con Li+ (Fig.1c) y la C16-M preparada por intercambio catiónico con cationes de hexaldecilamonio (Fig.1d). El espaciado basal es similar, aproximadamente 12 Å. excepto en la organomica donde se observa un gran espaciado de 45.35 Å. (Tabla 1).
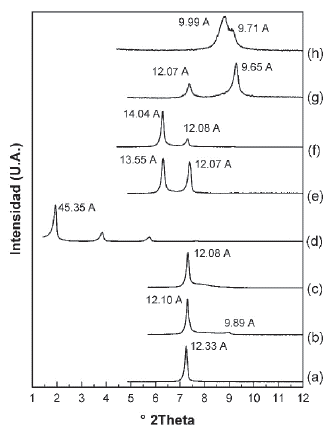
Figura 1 Difracción de rayos-X de (a) Na-MES, (b) Na-MSG, (c) Li-M, (d) C16-M, (e) AlB-(20)MES (sin calcinar), (f) Al13Li(20) (sin calcinar), (g) Al13-(20)500MES y (h) Al13-Li(20)500.
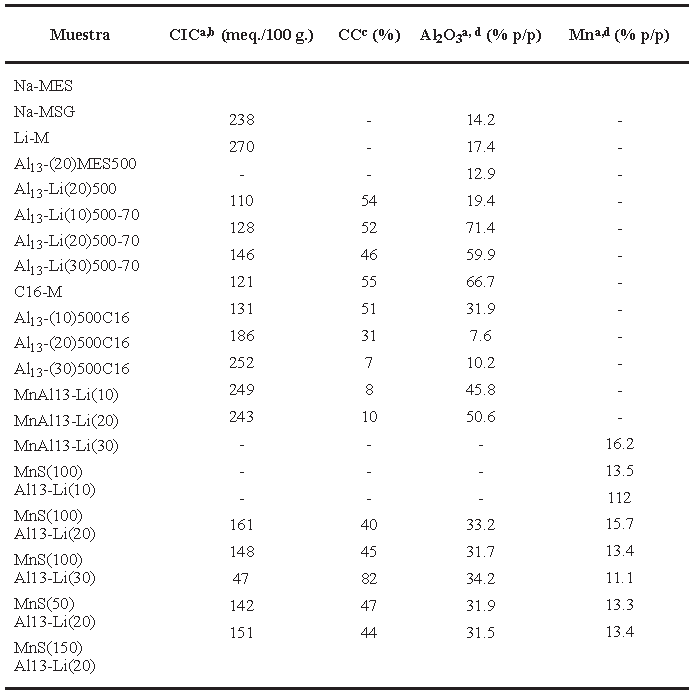
Tabla 1 Capacidad de intercambio catiónico, carga compensada y contenidos de Al y Mn en los materiales obtenidos.
c Medidas en base seca.
d CIC: Capacidad de intercambio catiónico.
e CC: Porcentaje de carga compensada definida por: 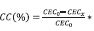 ; CIC0: CIC material de partida, CICx: CEC material x después de la modificación.
; CIC0: CIC material de partida, CICx: CEC material x después de la modificación.
f Valor estimado por espectroscopía de adsorción atómica (EAA).
Las micas sintéticas obtenidas, exhiben señales de DRX correspondientes a la fase cristalina de la mica fluoroflogopita de sodio hidratada. En particular se destaca la señal d001 para cada uno de los materiales obtenidos: d001=12.33 Å.(Fig. 1a), d001=12.10 Å. (Fig. 1b) y d001=12.08 Á. (Fig. 1c). Este espaciado basal depende del tipo de catión interlaminar y la cantidad de moléculas de agua de hidratación. La reflexión de aproximadamente 12 Å. está asociada a cationes de compensación de carga rodeados por una monocapa de agua en la interlámina [17]. La comparación entre los métodos de estado sólido y sol - gel, muestra que en la Na-MSG se obtiene también la fase anhidra de la Na-2-mica d001=9.89 Å., y otras fases acompañantes minoritarias: forsterita (Mg2SiO4 JCPDS No. 34-0189), aluminosilicato sódico (Na6Al4Si4Ov7 JCPDS No. 49-0004) y cristobalita (SiO2, JCPDS No. 29-0085).
La Na-2-mica presentó una capacidad de intercambio catiónico (CIC) teórica de 248 meq. / 100 g. de mica [22], así la determinación experimental de la CIC permite realizar un seguimiento a la cantidad de cationes residuales disponibles para el proceso de intercambio. La CIC experimental para las Na-MES y Na-MSG fueron respectivamente 238 y 270 meq. / 100 g. de mica. El exceso de cationes en la Na-MSG está relacionada con la última etapa de la síntesis por vía sol-gel en la cual se excede la cantidad estequiométrica de NaCl (Tabla 1).
3.2 Modificación de la Na-2-mica con (Al13)7+.
La Na-MES fue modificada con una solución oligomérica en donde se encuentra el catión de Keggin (Al13)7+con una densidad de pilar de 20 meq. de Al3+ suministrados como (Al13)7+ por gramo de mica. La intercalación con la solución intercalante directamente sobre la mica (Fig. 1e), produjo que una fracción del material consiguiera expandirse hasta d001= 13.55 Å. cuyo espaciado basal está asociado a la intercalación parcial de monómeros de aluminio hidratados [16]. Otra fracción del material conservó el d001= 12.07 Å. que está relacionado con la señal característica del material de partida. Pinnavaia y Col., [23] observaron que existe una relación inversamente proporcional entre la cantidad de aluminio intercalado y la carga laminar y los sitios ácidos del material a modificar, favoreciendo la hidrólisis del catión de Keggin desde su forma oligomérica hasta la obtención de monómeros o dímeros de aluminio. La pequeña expansión lograda tras el proceso de intercalación, sugiere una hidrólisis parcial del polihidroxicatión, influenciada por los sitios ácidos de la mica [22] y la elevada carga laminar que a la vez pudo contribuir al impedimento estérico sufrido por el Keggin para ingresar a la zona interlaminar de la mica.
Debido a que la modificación con el catión de Keggin directamente sobre la mica no rindió los resultados esperados, se evaluó la influencia de la expansibilidad del material de partida que en gran medida depende de la naturaleza del catión interlaminar y su grado de hidratación, así el radio iónico del catión inorgánico es inversamente proporcional al número de moléculas de agua que puede tener en su esfera de hidratación [16]. Siendo así, se esperaba que el intercambio de Na+ con Li+ aumentara el espaciado interlaminar de la mica debido a que posee un radio iónico menor que el sodio ( YNa+= 95 pm.; YLi = 90 pm.) y aumentara en consecuencia el radio de hidratación. Este intercambio se realizó sobre la Na-MSG, obteniendo la Li-M (Fig. 1c) que presentó una mayor homogeneidad en el grado de hidratación que se puso en evidencia con la ausencia de la señal asociada a la fracción anhidra del material de partida (Na-MSG) y la mayor contribución de la fase hidratada (d001= 12.08 Å.). La intercalación con la solución que contiene el Keggin sobre la Li-M (Fig. 1f) condujo a un leve aumento en la expansión pasando de d001= 12.08 Å. hasta d001= 14.04. Á vs. d001= 13.55 Å. conseguida con la intercalación sobre la Na-MES directamente (Fig. 1e). A pesar de la ventaja conseguida frente a la estrategia de homoinización previa con litio, la expansión no satisface el requerimiento para ser considerado como un material intercalado con el catión de Keggin en la región interlaminar como en las esmectitas pilarizadas que alcanzan un d001 s 18 Å. [24], obteniendo así una aluminio - mica hidratada [16].
En ambos casos el tratamiento térmico del material intercalado (Al13-(20)500MES y Al13-Li(20)500 respectivamente; Fig. 1g y h) en atmósfera oxidante a 500 °C, condujo a la formación de fases colapsadas, d001= 9,65 Å. (Fig. 1g) y d001= 9.71 Å. (Fig. 1h) producidas por la deshidratación total del Al3+hidratado en la etapa anterior (Fig. 2a). Debido al tratamiento térmico es posible que el Al3+ tenga el radio iónico apropiado para ubicarse en los agujeros ditrigonales de la capa tetraédrica de la mica (Fig. 2b). Por otra parte, laAl13-(20)500MES (Fig. 1g) se produjo una deshidratación parcial, reteniendo una fracción de mica monohidratada y otra fracción de Al2O3 - mica como capa de alúmina (d001= 9.99 Å.) y no como pilar que es lo que esperaba.
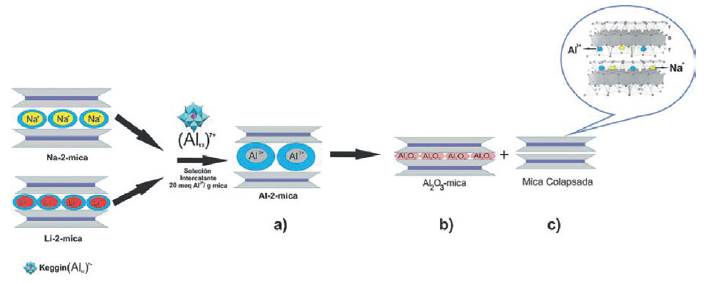
Figura 2 Resumen gráfico de la modificación de una mica sintética de alta carga con el catión de Keggin (Al13)7+.
El seguimiento a la cantidad de Al (% p/p de Al2O3 - óxido más estable) presente en los materiales modificados tras la calcinación Al13-(20)MES500 y Al13-Li(20)500 (Tabla 1), proporcionó evidencias que apoyaron la estrategia de previa homoionización con litio, reportando un mayor contenido de Al en comparación a la Al13-(20)MES500 y un porcentaje de compensación de carga laminar (%CC) similar a la Al13-(20) MES500 provocado por el enlace covalente Al - O - Al entre el aluminio que proviene de la fase alúmina interlaminar y el aluminio de la capa tetraédrica. A partir de estos resultados, se usó la Li-M como material de partida para los siguientes estudios.
3.3 Modificación de la Li-M a diferentes densidades de pilares de (Al13)7* (10, 20 y 30 meq Al3+/g de mica).
Uno de los factores importantes a considerar para pilarizar un material es la cantidad de aluminio incorporado, teniendo en cuenta la cantidad de Al3+ suministrados como (Al13)7+ que se desea proveer por gramo de mica. Otro factor determinante, es la influencia de la temperatura en la etapa de intercalación, ya que se espera que la energía térmica proveniente del calentamiento junto con la mecánica proveniente de la agitación ayuden a vencer la barrera energética que supone la elevada carga laminar del material impidiendo la efectiva intercalación de oligómeros de gran tamaño como lo es el catión de Keggin (Al13)7+. Así se evaluó conjuntamente el efecto de la temperatura de intercalación a 70 °C y la variación en la densidad de pilares. Los Difractogramas de los materiales a 10, 20 y 30 meq. en la etapa de intercalación (Fig. 3b, c y d), mostraron una tendencia favorable en cuanto a la fracción de material intercambiado a medida que aumenta la densidad de pilares, siendo el sólido Al13-Li(30)70 (Fig. 3d) el que presentó una única reflexión con un d001= 13,45 Å. relacionado como en el caso anterior, con aluminio - mica hidratada. Los sólidos calcinados, presentaron señales de colapso (Fig. 3e y f) y formación de Al2O3-mica d001= 10,06 Å. (Fig. 3g). Como se esperaba, la mayor cantidad de Al presente en los materiales calcinados y mayor %CC, corresponde a la Al13- Li(30)500-70 (Tabla 1).
3.4 Estudio de la pilarización de la Na-MSG previamente organofilizada (C16-M) a diferentes densidades de pilares de (Al13)7+ (10, 20 y 30 meq. Al3+/g. de mica).
Debido a la elevada densidad de carga que existe entre las láminas de la mica y a que esta característica afecta directamente la expansión del material y la intercalación de oligómeros que se pretenden alojar en el espacio interlaminar, se ideó una estrategia alternativa para incrementar la expansión de la Na-2-mica, en aras de posteriormente, intercalar el oligocatión de Keggin. Esta estrategia consistió en expandir previamente la mica usando cationes hexadecilamonio como surfactante. El intercambio catiónico entre los iones Na+ y hexadecilamonio (Fig. 4b) provocó un incremento en el espaciado basal desplazando la señal 001 hasta ángulos bajos, con un d001 = 45.35 Å. La mica organofilizada presentó una serie única y bien ordenada de reflexiones (tres reflexiones en total) que sugiere una distribución homogénea de carga entre las láminas [17]. El proceso de intercambio con el catión de Keggin no provocó cambios significativos en la expansión y el conjunto de armónicos de la organomica (Fig. 4c, d y e) de forma independiente a la densidad de pilares que se estuviera proporcionando; esta ausencia de cambio en el d001 puede sugerir que los oligocationes (polares) no fueron capaces de desplazar o al menos no significativamente, las cadenas externas apolares del hexadecilamonio.
Es posible que en la etapa de intercalación se genere repulsión entre los cationes con carácter polar y las cadenas alquílicas que tienen un carácter apolar, impidiendo la efectiva intercalación de los mismos.
Tras la calcinación de estos materiales a 500 °C en atmosfera oxidante (Fig. 4f, g y h), se observó una pérdida total del conjunto de señales 001 tanto de las reflexiones asociadas a la expansión por la cadena carbonada (C16), como sus armónicos. Lo anterior debido a que a 500 °C y en atmósfera oxidante las cadenas carbonadas que mantenían la expansión, se oxidaron, produciendo la pérdida de la estructura cristalina del material, es decir la delaminación de la mica. La estructura resultante más probable es la conocida como "casa de naipes" (Fig. 5c), propia de filosilicatos del tipo 2:1 delaminados [25] con partículas de Al2O3 como producto del proceso de pilarización.
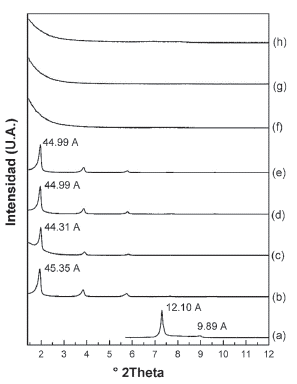
Figura 4 DRX de (a) Na-MSG, (b) C16-M, (c) Al13-(10) C16 (sin calcinar), (d) Al13-(20)C16 (sin calcinar), (e) Al13-(30)C16 (sin calcinar), (f) Al13-(10)500C16, (g) Al13- (20)500C16, (h) Al13-(30)500C16.
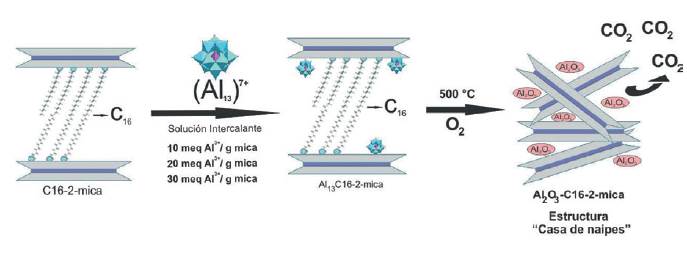
Figura 5 Resumen gráfico del estudio de la pilarización de una mica de alta carga previamente organofilizada con cationes hexadecilamonio.
La CIC de los materiales posteriormente modificados con aluminio a diferentes densidades de pilares 10, 20 y 30 meq. Al3+/g. de mica, tuvieron valores que superan la CIC del C16-M que fue el material de partida (Tabla 1). Este comportamiento se relaciona con la perdida de la estructura laminar del material tras el tratamiento térmico a 500 °C. Existe una pequeña tendencia entre los valores de CIC de los materiales resultantes, que puede estar asociada de manera inversa a la cantidad de Al2O3 y que fue adicionado en la solución intercalante, siendo el material que presentó la menor CIC el que mayor contenido de Al2O3 logró estabilizar (Tabla 1).
3.5 Formación in - situ de nanoclusters de MnS en las Al2O3-micas.
Después de la modificación de las micas con el catión de Keggin, se estudió la formación de nanoclusters de MnS sobre los materiales modificados, teniendo en cuenta en primer lugar el efecto de la densidad del pilar (10, 20 y 30 meq. Al3+/ g. de mica) y en segundo la temperatura de sulfidización (50, 100 y 150 °C). Todas las muestras se sometieron a tratamiento térmico final a 200 °C en atmósfera inerte (N2).
La formación y crecimiento de nanoclusters de MnS en la interlámina del conjunto de Al13-micas calcinadas requiere el previo intercambio de cationes interlaminares residuales por iones Mn2+. Las MnAl13-Li(10) y MnAl13-Li(20) presentan una expansión parcial del espacio interlaminar con respecto al material de partida (Fig. 7 a y b) de aproximadamente 13.58 Å.; esta señal se ha relacionado con la presencia de cationes Mn2+ con una doble capa de hidratación que presentan además diferentes arreglos y que coexisten en el espacio interlaminar de las micas [14]. Al confrontar el % Al2O3 del material de partida vs. % Mn de las muestras Mn-homoionizadas (tabla 1) se evidencia que en cuanto mayor es el contenido de Al, la cantidad de Mn intercambiada es menor; así la MnAl13-Li(30) (que procede de la muestra con mayor contenido de Al) presenta el menor porcentaje de Mn intercambiado, adicionalmente el análisis por DRX muestra que es el único material del conjunto analizado, que no expande su interlámina con respecto al material de partida. Lo anterior sugiere que los materiales MnAl13-Li(10) y MnAl13-Li(20) el ion Mn2+ se ha intercambiado en la interlámina y en la MnAl13-Li(30) es probable que se haya adsorbido en su superficie.
El tratamiento con H2S generado in-situ, provocó en todo el conjunto de materiales, una pérdida significativa del grado de cristalinidad producto de la lixiviación del aluminio en las capas octaédricas [26,27] y/o de las partículas de Al2O3 interlaminares, lo cual está relacionado con la disminución del contenido de Al (%Al2O3) con respecto a los materiales de partida (tabla 1). Los difractogramas de las MnS(100)Al13-Li(10) y MnS(100)Al13-Li(20) (Fig. 6 ayb) muestran picos anchos con un d 001 de 10.59 Á. y 10.61 Å respectivamente. A pesar de la búsqueda exhaustiva en la literatura para intentar explicar estas señales, no se ha podido relacionar con ningún trabajo en el área hasta ahora reportado, poniendo en relieve el carácter innovador de esta investigación.
Sin embargo es posible que en este espacio interlaminar se hayan formado nanoclusters de MnS de tamaño limitado debido al impedimento estérico, la alta tensión electrostática de esta mica de tan elevada carga y la coexistencia con partículas de Al2O3 interlaminares. Por otra parte la MnS(100)Al13-Li(30) presenta un comportamiento diferente consistente con la limitada Mn2+-homoionización en comparación con los otros materiales debido a que la Al13-mica de partida tiene una fase anhidra homogénea (Fig. 6c) ocupada en su totalidad por una capa de Al2O3 que al impedir el efectivo intercambio catiónico con el Mn2+, restringe la posterior formación de nanoclusters de MnS en la interlámina lo que posibilita que los nanoclusters formados se encuentren en la superficie del material. No existe una pérdida significativa del contenido de Mn en el conjunto de MnS Al13-micas sintetizadas, lo que indica que la mayoría del metal se ha estabilizado probablemente por la formación de nanoclusters de MnS.
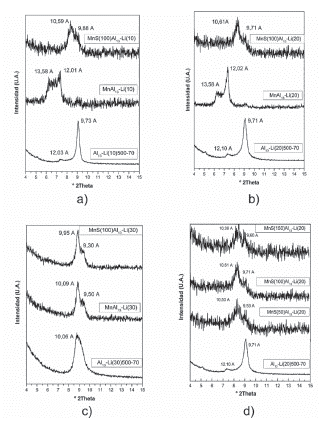
Figura 6 Difractogramas de Al13-micas con diferentes densidades de pilares, homoionizadas con Mn2+ y sulfidizadas con H2S a diferentes temperaturas: a) 10 meq. de Al3+/g. de mica, H2S/100 °C; b) 20 meq. de Al3+/g. de mica, H2S/100 °C; c) 30 meq. de Al3+/g. de mica, H2S/100 °C. d) 20 meq. de Al3+/g. de mica, H2S/50, 100 y 150 °C. Todos los sólidos se calcinaron finalmente a 200 °C en atmósfera de N2.
El análisis por DRX de la evaluación del efecto de la temperatura de tratamiento químico con H2S (50, 100 y 150 °C) en la formación in - situ de nanoclusters de MnS en la Al13-Li(20)500-70, reveló la presencia de señales con d001 de 10.53 - 10.61 - 10,38 Å. para los sólidos tratados a 50, 100 y 150 °C respectivamente (Fig. 6c) asociados como se mencionó anteriormente a la posible formación de nanoclusters de MnS en la interlámina. El seguimiento al contenido de Mn y el %CC indica que por un lado, el metal quedó estabilizado completamente con respecto a la cantidad de Mn que logró intercambiar y por otro que la temperatura de tratamiento químico con H2S no influye de forma significativa en la posible formación de nanoclusters de MnS en la interlámina.
4. CONCLUSIÓN
Se reporta por primera vez el estudio de la pilarización con el catión de Keggin como agente pilarizante sobre una mica sintética de alta carga Na-2-mica y sobre esta mica pre- expandida con cationes hexadecilamonio. El estudio reveló que la elevada carga laminar y los sitios fuertemente ácidos de la mica provocaron la hidrólisis del catión de Keggin, por lo que la intercalación de este tipo de especies voluminosas en la interlámina se vio restringida. La calcinación al final del proceso, formó una capa de Al2O3 entre las láminas en la mayoría de los casos. Por otro lado, el intercambio con cationes hexadecilamonio previo a la modificación con (Al13)7+ provocó que el espacio interlaminar se expandiera satisfactoriamente; sin embargo, la polaridad de las cadenas carbonadas interlaminares en la órganomica, generó posiblemente un efecto negativo que limitó el alojamiento del catión de Keggin en esta región; posterior a la calcinación a 500 °C como etapa final en el proceso de pilarización, el material se delaminó por completo presentando una estructura tipo "casa de naipes".
El proceso de formación y crecimiento de nanoclusters de MnS en la Na-2-mica previamente modificados con el catión de Keggin, afectó la elevada cristalinidad típica en los materiales de origen sintético, debido posiblemente al ataque ácido ejercido por los protones liberados en la etapa de sulfidización con H2S, que condujo a la lixiviación del aluminio estructural en la capa octaédrica del filosilicato. A pesar de los efectos en la elevada cristalinidad, la estructura del material no se delaminó, demostrando una alta estabilidad química aún bajo altas temperaturas.