INTRODUCCIÓN
La Producción del durazno en Colombia se concentra en los departamentos de Boyacá, Cundinamarca, Norte de Santander, Santander, Antioquia, Caldas y Nariño, el principal productor es Boyacá con 677 ha, especialmente en el municipio de Sotaquirá y en otros municipios como Jenesano, Nuevo Colón, Cómbita y Tuta; el tercer departamento productor es Norte de Santander con 480 Ha. Actualmente concentrada la producción principalmente en los municipios de Cácota, Chitagá y Pamplonita con calidad de exportación. En el campo nacional este fruto es apetecido y altamente consumido en todas las regiones1. El abuso indiscriminado en la utilización de pesticidas por parte de los agricultores superando las dosis requeridas para el control de plagas ya sea por cultura, para evitar pérdidas en la producción, aumentar la productividad e intentar reducir costos; posiblemente ocasionan que queden residuos en partes de la planta y en el fruto, los cuales llegan de forma directa a los consumidores. Según reportes de los cultivadores de la región, los productos que más usan son: el funlate score, karate, sunfire, vertimek, lannate, fipronil, microthiol, daconil, derosal, forum, manzate, finale, baycor, difenoconasol, opera, tilt, azimut, nilo. (muchos de los cuales se ha demostrado tener efectos adversos en la salud y ocasionar daño genotóxico [2-6]. La exposición a plaguicidas se ha asociado con el cáncer, enfermedades neurológicas degenerativas y respuesta inmune alterada, entre otras [7]. Estudios ] demuestra que Lambda-Cyhalothrin, componente activo de Karate Zeon (insecticida piretroide), es utilizado altamente en la agricultura y puede causar alteración de la conciencia y convulsiones ya que afecta directamente al sistema nervioso central de los seres humanos. Otros estudios involucran pesticidas como el insecticida y acaricida Lannate, el cual se identifica por contener un potencial de citotoxicidad y genotoxicidad de su componente activo metomilo (S-Metil-N-[(metilcarbamoil) oxi]tioacetamidato) [2]. A sí mismo en estudios realizados por [3-5] nos muestran una considerable genotoxicidad de metomilo en linfocitos humanos, induciendo aberraciones cromosómicas y micronúcleos. Considerando que el durazno es un fruto ampliamente producido y comercializado en el ámbito local, nacional e internacional, se hace necesario realizar estudios que nos indiquen presencia o ausencia de residuos de pesticidas, los cuales pueden llegar a generar un efecto genotóxico y cancerígeno sobre los consumidores.
MATERIALES Y MÉTODOS
Área de estudio
La muestra de durazno fue tomada en un cultivo localizado en el municipio de Cácota de Velasco, este municipio está ubicado en la zona suroccidental del Departamento Norte de Santander, siendo su posición geográfica la siguiente: desde 1.148.600 a 1.165.420 longitud oeste y desde 1.287.090 a 1.302.850 latitud norte. Su superficie tiene un área de 139.71 kilómetros cuadrados.
Toma de la muestra
Se realizaron dos [2] muestreos justo en el momento en el que son colectados para ser llevados al mercado. Tomando en total 1 kg de durazno, luego se guardó en cajas o termos de icopor para evitar cualquier tipo de contaminación y posteriormente almacenado a bajas temperaturas hasta el momento de su procesamiento.
Obtención y preparación del extracto
Se maceró 120 g de durazno durante 15 minutos hasta obtener el jugo, luego se adicionó 30 mL de acetona, posteriormente se centrifuga a 3500 rpm durante 20 minutos después de los cuales se retiró y se almaceno el sobrenadante. Este procedimiento se repite 5 veces. Para la concentración del material presente en el extracto, el sobrenadante recolectado se pasó a través de una columna que contenía amberlita XAD-2 (15g) a una velocidad de 15 mL/min; el material retenido por la amberlita fue eluido con 100 mL de diclorometano. Después de obtenido el extracto, se concentró en un evaporador rotatorio de vacío a baja presión (Heidolph modelo Laborota 400-1), hasta la sequedad, seguidamente se cuantificó el extracto seco equivalente a los 120 gramos iniciales. El extracto obtenido se dividió en dos partes, la primera parte para los análisis genotóxicos el cual se diluyó en 3 ml de dimetil sulfóxido al 1% y la parte restante para el análisis cromatográfico.
Extracción de linfocitos: Para los experimentos de genotoxicidad, se usaron linfocitos de sangre periférica, que se extrajeron de una persona joven y sana. Los linfocitos se separaron de la sangre total, usando un gradiente de ficoll-hipaque. Seguidamente, se determinó la viabilidad, la cual siempre se mantuvo por encima del 90%.
Detección de daño del ADN por el Ensayo Cometa
Se trataron alrededor de 40.000 células o linfocitos con tres dosis (100µg, 200 µg y 300 µg) de extractos de durazno, se incubaron por un periodo de 1 hora a 37°C, las placas se sumergieron 1h en solución de lisis. Las placas se lavaron con PBS y se colocaron en una unidad de electroforesis horizontal con un buffer pH>13 y se incubó por 30 minutos, luego se corrió a 25V y 300 mA por 30 minutos. Después de la electroforesis, las placas fueron lavadas con un buffer neutralizante por 10, luego se tiñeron con 50 µl de Bromuro de etidio (0.02mg/mL). Las observaciones se realizaron en un microscopio de fluorescencia (Olimpus Cx41) equipado con filtro de 515-560 nm y un filtro de barrera de 590 nm. Para estos resultados se hicieron tres experimentos por cada tratamiento y en cada uno se contaron 100 células. Como control negativo se utilizó, el DMSO al 1%, que fue el solvente de las muestras. La ocurrencia de daño en el ADN se determinó mediante el uso del software (Tritek Comet ScoreTM freeware v1.5) basado en las siguientes mediciones: longitud total del cometa, área del cometa (µm2), diámetro de la cabeza (µm), %DNA en cabeza, longitud de la cola µm, %DNA en cola.
RESULTADOS
Se observa (figura 1) el porcentaje de viabilidad de los linfocitos expuestos a las diferentes dosis de los extractos de durazno obtenidos en Cácota, así mismo, el respectivo control negativo. Los valores representan la media del porcentaje de la viabilidad celular luego de someter a las células a los diferentes extractos; se puede observar (figura 1), qué la viabilidad de los linfocitos disminuye gradualmente a medida que aumentan las dosis de los extractos, obteniendo una viabilidad menor en las dosis de 300µg, con porcentaje de 88.4. Cabe resaltar que la viabilidad se mantiene por encima del 80%.
Detección de daño del ADN por el Ensayo Cometa
En la tabla 1 se muestra la detección de Daño del ADN mediante el ensayo cometa evidenciando la genotoxicidad en linfocitos humanos expuestos a extracto de durazno. Los resultados indican que existe un efecto genotóxico (longitud del cometa), dependiente de la dosis utilizada, con un P<0.05, según la prueba Tukey. Se observa que a medida que se aumenta la dosis los valores analizados aumentan comparados con el control negativo.
Tabla 1 Daño inducido en el ADN de linfocitos humanos por diferentes dosis de extracto de durazno cultivado en el municipio de Cácota N/S.
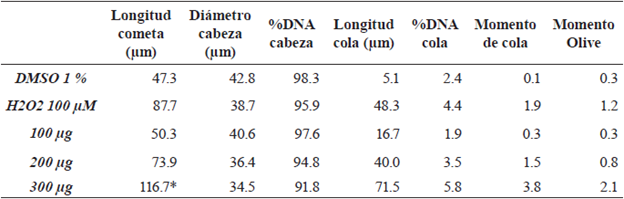
Como control negativo se utilizó DMSO 1%. Como control positivo se utilizó peróxido de hidrógeno H 2 O 2 100 µM control, Diferentes dosis de extracto de durazno 100 µg, 200 µg, 300 µg. * diferencia estadísticamente significativa con P>0.05.
Como se puede observar en la tabla 1; Las células tratadas con DMSO 1%, muestran un daño espontáneo, de 47.3 µm de longitud, de igual manera las células tratadas con H2O2 100 µM muestran un valor de 87.7 µm, superando casi el doble en longitud al control negativo. Como se puede evidenciar, la longitud del cometa para este municipio mostró un valor de 50.3 µm, para la dosis menor, que al ser comparados con el control negativo no muestra una diferencia estadísticamente significativa P>0.05 (Tabla 1, Figura 2). Si observamos la dosis de 200 |g supera aproximadamente 1 vez la respuesta del control negativo, nos damos cuenta que se genera incremento moderado del daño genético de las células expuestas al extracto. De igual manera la dosis de 300 |g supera 2.5 veces la respuesta del control negativo, indicando que a esta concentración genera un daño estadísticamente significativo >0.05. Se evidencia en la tabla 1 y figura 2, que a medida que se incrementa la concentración de extracto, disminuye el diámetro de la cabeza (µm) en comparación con el control negativo (DMSO 1%, 42.8 µm) en la dosis de 100 µg disminuye su diámetro en un 5.14%, en la dosis de 200 µg en un 14.95% y en la dosis de 300 µg en un 19.39%.
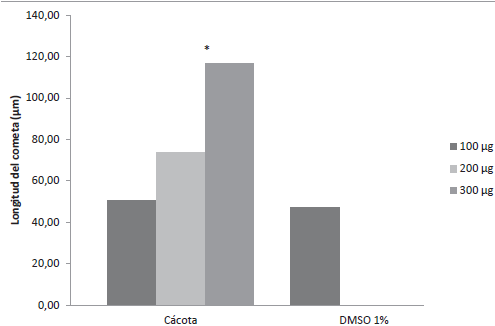
Figura 2 Longitud del cometa inducido por extracto de durazno proveniente del municipio de Cácota. Genotóxicidad inducida por extractos de durazno. *: Diferencia estadísticamente significativa respecto al control negativo, P<0.05.
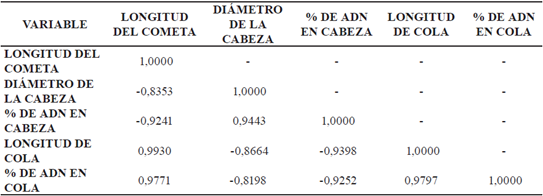
Se evidencia una correlación existente entre la longitud del cometa y diámetro de la cabeza de (0.8353) (Tabla 2), mostrando un comportamiento que es inversamente proporcional; lo que significa que a medida que aumenta la longitud del cometa, el diámetro de la cabeza de estas células disminuye significativamente. Así mismo observamos en la Tabla 2 una correlación existente entre el porcentaje de ADN en cabeza y la longitud del cometa de (-0,9241), también se observa un comportamiento inversamente proporcional. A medida que disminuye el porcentaje de ADN en cabeza, aumenta la longitud del cometa, evidenciando un claro daño de las células tratadas con las diferentes dosis de extractos de durazno. Se muestra correlación entre la longitud del cometa y dos medidas en este caso, la longitud de cola (0,9930) y el porcentaje de ADN en cola (0,9771), la cual es directamente proporcional ya que a medida que aumenta la longitud del cometa, aumenta tanto la longitud de la cola como el porcentaje de ADN den cola (tabla 2). Así mismo se observan que los rangos de porcentaje de ADN en cabeza tiene la misma tendencia a disminuir a medida que se aumenta la concentración de cada dosis de extracto de durazno. En la tabla 1 se evidencia un porcentaje de ADN en cabeza de 97.6%, dosis de 100 µg en la dosis de 200 µg 94.8%, y en la dosis de 300 µg 91.8% estos datos varían inversamente proporcional a la concentración de cada dosis; si las dosis aumentan, disminuye tanto el diámetro de la cabeza como su porcentaje de ADN. Se observa para el control negativo valores en longitud de cola de 5.1 µm., para la dosis de 100µg un aumento en 3.2 veces. la dosis de 200 µg nos muestra un aumento de 7.8 veces; de igual manera, la dosis de 300 µg nos muestra un aumento de 14 veces en la longitud de cola (Tabla 1).
DISCUSIÓN
En los resultados obtenidos en cada una de las dosis de extracto de durazno y comparados con el control negativo, se notó una tendencia creciente de daño genotóxico según el aumento de la concentración de las mismas, llevando a un incremento de las lesiones primarias sobre el ADN, lo cual está directamente relacionado con el aumento en las alteraciones genéticas celulares. Resultados similares han sido reportado por [9-10], quienes encontraron que los pesticidas inducen daño oxidativo en el ADN a través de especies reactivas de oxígeno. Estas especies reactivas de oxígeno (ROS) están implicadas en la toxicidad de diversos plaguicidas incluidos los plaguicidas organofosforados. Se sabe que ROS induce varios tipos de lesiones en el ADN incluidas rupturas simples y dobles, sitios lábiles alcalinos y oxidación de purinas y pirimidinas que son detectados fácilmente por el ensayo de cometa [11-12]. En estudios realizados por [6-13], observaron que las dosis en la que se induce mayor frecuencia de células con daño en el ADN, también muestran mayor longitud de migración del ADN. Esto podría indicar que los genotóxicos que producen más daño en el ADN, también afectan más número de células. Otros estudios demuestran que el efecto que produce alteraciones en el material genético es probablemente causado, además, por la presencia de metales, incluyendo el hierro, manganeso, cobre, zinc y arsénico, debido a su alta actividad mutagénica y genotóxica [14]. Se ha demostrado que los iones metálicos presentes en algunos pesticidas pueden interferir con la reparación del ADN y producir especies reactivas de oxígeno (ROS), que conducen a daño oxidativo [15]. Hay evidencia que demuestra que el exceso de cobre puede inducir estrés oxidativo que puede dar lugar a ataques de radicales libres, vía reacciones Fenton [16]. Aunque el cobre es un metal bioesencial para el funcionamiento normal de las células, también puede catalizar la formación de radicales libres de hidróxilo en las reacciones de Haber-Weiss catalizada por metales Fenton, lo que resulta en daño oxidativo del ADN[17]. Existen evidencias que han sugerido que el arsénico es causante de enfermedades como cáncer de vejiga, pulmón, hígado y piel, así como trastornos del sistema cardiovascular y nervioso [18]. Estudios de [19-20], describen el arsénico como causante de intercambio de cromátidas hermanas, aberraciones cromosómicas y aneuploidías. Además, se ha encontrado que causa la inhibición del crecimiento celular, bloqueo del ciclo celular en la mitosis induciendo apoptosis [21-22].
De acuerdo a los reportes en literatura y a los encontrados en este estudio, podríamos relacionar la genotoxicidad encontrada en este ensayo con la presencia de residuos de pesticidas en el fruto del durazno (datos no mostrados), dado que en análisis preliminares se evidenció la presencia del pesticidas de la familia de los organoclorados como el endosulfán II y el Beta BHC. Estudios realizados por [23] caracterizan a endosulfán como un agente carcinógeno potencial en humanos así como genotóxico en bacterias, células humanas y en células de ratones, además de ser promotor de tumores y agente mutagénico [24]. El lindano (como γ-hexaclorociclohexano BHC), hexaclorociclohexano (grado técnico) y otros isómeros de hexaclorociclohexano son razonablemente sustancias cancerígenas para el ser humano basadas en pruebas suficientes carcinogenicidad de estudios en animales [25]. Exposición oral en roedores causaron tumores en dos sitios de tejido diferentes. Administración en la dieta de lindano, α- o β-hexaclorociclohexano, o mezclas de varios isómeros causó tumores hepáticos y en el sistema linforeticular en ambos sexos de varias cepas de ratones [25-26]. Estudios realizados en ratones por [26-27] demuestran que la endrina y el lindano inducen retardo del crecimiento fetal y disminuciones en el timo fetal y pesos placentarios.
Estudios realizados por [28-29], demuestran que el endosulfán induce daños en el ADN y activó la vía de señalización de respuesta al daño del ADN (ATM / Chk2 y ATR / Chk1) y por consiguiente al control del ciclo celular. Además, el endosulfán promovió la apoptosis celular a través de la vía del receptor de muerte (complejo de señalización inductor) resultante del estrés oxidativo.
Un estudio reciente demostró que el endosulfán induce daños en el ADN y perturbaciones en el DDR (una red de vías de transducción de señales que pueden detectar y reparar el daño del ADN para mantener la integridad genómica), promoviendo así la inestabilidad genómica en las enfermedades del sistema reproductivo [30-32]. han demostrado que el endosulfán puede conducir al daño del ADN y a la detención del ciclo celular en las células endoteliales [33]. Sin embargo, si DDR está involucrado en el proceso de acción tóxica en las células endoteliales en su funcionamiento es aún poco conocido. Por lo tanto, se han diseñado diferentes investigaciones para aclarar más el papel del endosulfán en la patogénesis de las enfermedades cardiovasculares.
Podemos concluir que extractos de durazno cultivados en el municipio de Cácota y que están siendo comercializados en la provincia de pamplona, inducen actividad genotóxica en linfocitos humanos, lo cual podría constituir un factor de riesgo para la población expuesta, teniendo en cuenta la relación que existe entre daño genotóxico y aparición de enfermedades tales como el cáncer. También debemos resaltar que se deben plantear alternativas para disminuir el uso indiscriminado de plaguicidas organoclorados ya que son considerados como uno de los principales problemas ambientales y de salud humana en el mundo.