1. INTRODUCCIÓN
Desde el descubrimiento de la penicilina y su producción en masa, ha transcurrido más de medio siglo, y durante este tiempo se han desarrollado una gran cantidad de medicamentos para ser utilizados en el tratamiento de enfermedades causadas por bacterias [1]. Debido a la problemática actual frente a bacterias multirresistentes a fármacos de primera línea, es necesario el descubrimiento de nuevas moléculas que puedan ser utilizadas como antibióticos. Una de ellas es el ácido cinámico, que naturalmente se extrae del aceite de canela y se utiliza ampliamente como aditivo en alimentos, cosméticos y fragancias [2-4]. Actualmente, se estudian sus propiedades farmacéuticas en vista de su probada actividad inhibitoria frente a diferentes cepas bacterianas y hongos [5-10]. Dicha actividad antimicrobiana puede provenir de las características estructurales del compuesto como el doble enlace (C = C) y el grupo carboxilo, que le confieren carácter hidrófobo a la molécula para que pueda interactuar sobre las proteínas en las bacterias [5,9,11], pues el primero podría formar complejos n con aminoácidos aromáticos, mientras que el segundo podría interactuar con aminoácidos de carácter básicos.
Recientes estudios de complejos metálicos con ligandos que contienen anillos aromáticos han presentado resultados prometedores de actividad antibacteriana y antifúngica [12,13], demostrando que, por lo general, la presencia del metal mejora la actividad en comparación a los ligandos libres, muchas veces debido a que la quelación aumenta la deslocalización de electrones en todo el sistema quelante y mejora la lipofilicidad que puede conducir a la ruptura de la barrera de permeabilidad celular, retrasando los procesos celulares normales [14]. Trabajos realizados en nuestro grupo de investigación han demostrado que compuestos lantánidos derivados del ácido cinámico presentan actividad biológica frente a cepas fúngicas y parasitarias [15,16], sin embargo, en la actualidad el uso de estos compuestos es limitado como consecuencia de su poca solubilidad en medios acuosos. Una solución plausible para mejorar la solubilidad y actividad biológica, de los compuestos anteriormente mencionados, es la obtención de complejos de inclusión entre los complejos lantánidos (huésped) y la β-ciclodextrina (anfitrión). Debido a las características que confieren los complejos tipo anfitrión-huésped con ciclodextrinas, es posible mejorar la solubilidad de los complejos lantánidos en solventes polares. La conformación geométrica en forma de toroide de la β-ciclodextrina (β-CD), permite que la cavidad interna (al ser hidrófoba por los enlaces glucosídicos) pueda interaccionar con la molécula huésped, y la cavidad externa (al ser hidrofílica por los grupos hidroxilos presentes) facilite el aumento de la solubilidad de los compuestos.
Se ha reportado la síntesis de diferentes compuestos de inclusión utilizando moléculas huésped como, piroxicam, dexametasona, cefalosporinas, nimesulida, hidrocortisona, antimoniato de meglumina y carvacrol [17-20], en este último caso la encapsulación mejoró la solubilidad en medio acuoso del fármaco, logrando disminuir la cantidad de compuesto necesario para obtener la inhibición del crecimiento de las dos cepas bacterianas evaluadas (S. Typhimurium y E. coli K12). Además, los complejos obtenidos mejoraron su estabilidad, evitando su degradación por la luz durante el almacenamiento [19].
En este trabajo se describe la síntesis de una serie de nuevos complejos de inclusión parcial y/o asociación con la β-CD utilizando complejos lantánidos como moléculas huésped. Se evaluó la actividad antibacteriana de los compuestos libres, así como los de inclusión frente a cepas bacterianas ATTC gram-negativas y gram-positivas, empleando el método de microdilución con platos de 96 pocillos y caldo Mueller-Hinton. La posible interacción entre los complejos de inclusión y la molécula de ADN fue evaluada mediante experimentos de UV-Vis y electroforesis.
2. METODOLOGÍA
Los ácidos p-clorocinámico y p-metoxicinámico, y las sales LnCl3xH2O (Ln= La, Ce, Sm, Yb) utilizadas, son reactivos comerciales de la marca Alfa Aesar, los cuales fueron empleados directamente sin tratamiento alguno. Los espectros infrarrojos reportados se midieron en un espectrofotómetro SHIMADZU-IR Affinity-1 con aditamento ATR en un rango de 600-4000 cm-1. Los espectros raman reportados fueron registrados en un espectrofotómetro DXR Smart Raman en un rango de 200-3400 cm-1 utilizando laser de 785 nm y corrección de fluorescencia. Los espectros RMN 1H y 13C se tomaron en un espectrofotómetro Bruker Avance 400 II utilizando DMSO-d6 a temperatura ambiente. El análisis elemental (C, H) se llevó a cabo en un analizador elemental serie Flash EA 1112, y el contenido de iones lantánidos, Ln(III), fue determinado mediante valoración con EDTA. Los termogramas fueron obtenidos en un equipo Mettler Toledo TGA/DSC1 STARe System (de análisis simultaneo), se llevó a cabo el calentamiento de 30-550 °C a razón de 10 °C/min, utilizando Ar como gas de purga y N2 como gas de trabajo, los productos de descomposición fueron propuestos de acuerdo a resultados de complexometría con EDTA y análisis elemental de los residuos. Se tomaron espectros UV-vis en el espectrofotómetro SHI-MADZU UV-1700 PharmaSpec a temperatura ambiente en la región comprendida entre 200400 nm. Los diafractogramas de rayos X (DRX) en polvo fueron tomados en un rango 2Θ=5-60 ° en un diafractómetro Panalytical X'Pert PRO utilizando una fuente de radicación de Cu, con filtro de Ni y rendija de divergencia de 0.125°.
Síntesis de los complejos lantánidos
Se sintetizaron 7 complejos de Ln(III) empleando una reacción de metátesis entre el cloruro del lantánido LnCl3xH 2O con la sal de sodio correspondiente, realizando una modificación al protocolo reportado en la literatura por Deacon y colaboradores [21]. Se describe detalladamente la síntesis del complejo 1. Los compuestos 2-7 fueron obtenidos empleando la misma ruta sintética (figura 1).
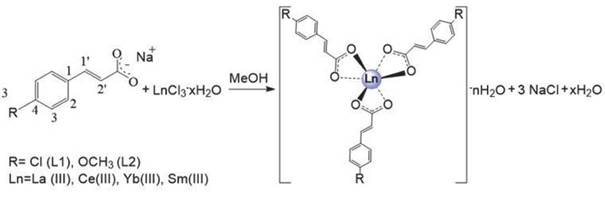
Figura 1 Esquema general propuesto para la síntesis de los complejos lantánidos con ligandos p-clorocinamato (L1) y p-metoxicinamato (L2).
Síntesis de [La(4-Clcinn)3]2.3H2O (1) Inicialmente se obtuvo el cinamato L1, [Na(4-Cl-Cinn)], para ello se disolvió NaOH (0.10 g, 2.50 mmol) en metanol (5.0 mL), luego se adicionó 4-ClCinn (399.6 mg, 2.18 mmol) y se mantuvo la solución en agitación por 10 minutos a temperatura ambiente. Al formarse un precipitado blanco, se adicionó LaCl37H2O (271.4 mg, 0.73 mmol) y 10.0 mL de metanol, se agitó por 3 h a temperatura ambiente, se filtró, se lavó con metanol y se secó a 100 °C por 24 horas. Porcentaje de rendimiento: (426.2 mg; 81.0%), C27H22.6Cl3LaO8.3, Análisis elemental: C 45.34 (calc. 47.02), H 2.78 (2.73), La 19.80 (calc. 20.14). IR (ATR cm-1): 1635 s, 1506 m, 1489 s, 1409 vs, 1390 vs, 1280 w, 1246 m, 1089 s, 1012 m, 979 s, 821 vs, 738 m, 665 w. Raman (cm-1): 3066 m, 1639 vs, 1590 vs, 1434 w, 1291 w, 1250 m, 1202 w, 1176 w, 1093 m, 747 w, 725 w, 632 w. RMN 1H (DMSO-d6) δ(ppm): 6.46 (d, 3H, 3 J=16 Hz, H-2'), 7.36 (d, 6H, 3J=8 Hz, H-2), 7.38 (d, 3H, 3J=16 Hz, H-1'), 7.55 (d, 6H, 3J=8 Hz, H-3). RMN 13C (DMSO-d6) δ (ppm): 126.6 (C-2'), 128.7 (C-3), 129.2 (C-2), 133.4 (C-1), 134.3 (C-4), 138.3 (C-1'), 176.3(C=O). DRX en polvo [espaciado-d/(0.1 nm) (I/I°)] 11.15(74), 7.38(100), 5.52(17), 5.41(5), 4.13(16), 4.00(6), 3.64(35), 2.73(5), 2.20(7), 2.00(5). TGA pérdida de masa: 0.85% (87-110 °C, 1 paso, calc. 1/3xH2O=0.87%), 5.14% (240-317 °C, 1 paso, calc. 2xH2O=5.26%), 34.65% (317-553 °C, 3 pasos, calc. Producto 0.9La2(CO3)3 = 36.46%).
Síntesis de [Ce(4-Clcinn)3]0.7H2O (2) Porcentaje de rendimiento: (391.9 mg; 76.5%), C27H19.4Cl3CeO6.7, Análisis elemental: C 44.90 (calc. 46.49), 2.73 (calc. 2.80), Ce 20.31 (calc. 20.09). IR (ATR cm-1): 1635 s, 1506 m, 1489 s, 1411 vs, 1388 vs, 1282 w, 1246 m, 1089 s, 1012 m, 979 s, 823 vs, 738 m, 667 w. Raman (cm-1): 3064 w, 1636 vs, 1588 vs, 1408 w, 1288 w, 1246 m, 1173 m, 1085 m, 748 w, 627 w. TGA pérdida de masa: 0.88% (49-110 °C, 1 paso, calc. 0.34xH2O=0.88%), 0.92% (163-225 °C, 1 paso, calc. 0.35xH2O=0.91°%), 34.80% (225-515 °C, 3 pasos, calc. Producto Ce2(CO3)3 = 32.15%).
Síntesis de [Sm(4-Clcinn)3]H2O (3) Porcentaje de rendimiento: (450.8 mg; 86.6%), C27H-20Cl3SmO7, Análisis elemental: C 45.62 (calc. 45.47) , H 2.79 (cal. 2.83), Sm 21.80 (calc. 22.49). IR (ATR cm-1): 1635 s, 1560 w, 1517 s, 1490 s, 1409 vs, 1384 vs, 1288 w, 1242 m, 1089 s, 1012 m, 981 s, 821 vs, 742 m, 667 w. Raman (cm-1): 3063 w, 1637 vs, 1588 vs, 1407 w, 1246 m, 1173 m, 1084 m, 755 w, 628 w.
Síntesis de [Yb(4-Clcinn)3] (4) Porcentaje de rendimiento: (383.6 mg; 73.2%), C27H18Cl3YbO6, Análisis elemental: C 45.10 (calc. 45.18), H 2.43 (calc. 2.53), Yb 22.32 (calc. 22.44). IR (ATR cm-1): 1639 s, 1595 m, 1558 w, 1512 m, 1489 s, 1409 vs, 1381 vs, 1288 w, 1246 m, 1087 s, 1012 w, 975 s, 815 vs, 761 m, 725 m, 657 m. Raman (cm-1): 3040 vs, 2921 m, 1639 s, 1588 s, 1408 w, 1244 m, 1175 w, 1083 w, 968 vw, 721 vw, 625 vw.
Síntesis de [Ce(4-MeOcinn)3]0.2H2O (5) Porcentaje de rendimiento: (435 mg; 76.6%), C30H27.4CeO9.2, Análisis elemental: C 51.45 (calc. 53.33), H 3.93 (calc. 4.09), Ce 22.82 (calc. 22.91). IR (ATR cm-1): 1631 m, 1604 m, 1506 s, 1423 s, 1386 vs, 1292 w, 1240 vs, 1170 vs, 1026 m, 983 m, 829 s, 779 m, 719 m. Raman (cm-1): 3069 vw, 1631 vs, 1599 vs, 1419 w, 1239 m, 1167 m, 979 vw, 856 vw, 775 w, 631 vw, 549 vw. TGA pérdida de masa: 0.58% (50-90 °C, 1 paso, calc. 2/9xH2O=0.58%), 38.80% (279-595 °C, 3 pasos, calc. 0.9 Ce2(CO3)3 = 38.32%).
Síntesis de [Sm(4-MeOcinn)3]H2O (6) Porcentaje de rendimiento: (544.5 mg; 92.5%), C30H29SmO10, Análisis elemental: C 50.52 (calc. 51.48) , H 4.09 (calc. 4.18), Sm 20.48 (calc. 21.48). IR (ATR cm-1): 1631 m, 1604 m, 1508 s, 1425 s, 1386 vs, 1303 w, 1240 vs, 1170 vs, 1024 m, 985 m, 831 s, 779 m, 723 m. Raman (cm-1): 3067 vw, 1633 vs, 1599 vs, 1435 w, 1243 s, 1167 s, 980 vw, 874 vw, 776 w, 631 vw.
Síntesis de [Yb(4-MeOcinn)3]0.5H2O (7)
Porcentaje de rendimiento: (598.3 mg; 99.0%), C30H28YbO9.5, Análisis elemental: C 50.82 (calc. 50.49) , H 3.74 (calc. 3.96), Yb 23.09 (calc. 23.67). IR (ATR cm-1): 1629 m, 1598 m, 1508 s, 1423 m, 1386 vs, 1307 w, 1238 vs, 1170 vs, 1022 m, 989 m, 825 s, 781 m, 723m. Raman (cm-1): 3040 vs, 2384 m, 1625 s, 1602 s, 1422 w, 1241 s, 1168 s, 995 vw, 773 vw.
Síntesis de los complejos de inclusión parcial y/o asociación.
Se sintetizaron 7 complejos de inclusión mediante reacciones de co-precipitación, utilizando N,N dimetilformamida (DMF) como solvente y una relación molar 1:3 (complejo lantánido: β-ciclodextrina). Se describe detalladamente la síntesis del complejo 8 (figura 2), los compuestos del 9-14 fueron obtenidos empleando la misma ruta sintética.
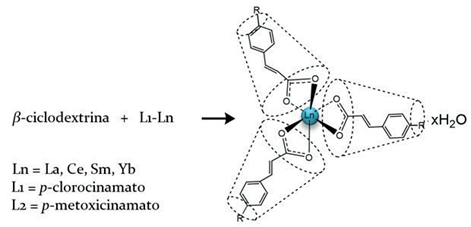
Figura 2 Esquema general de la síntesis de complejos de inclusión parcial y/o asociación. Tipo anfitrión - huésped ([Lx-Ln] β-CD).
Síntesis del [La(4-Clcinn)3] β-CD14.5H2O (8) Se disolvió (1) (30.4 mg, 0.04 mmol) en DMF (2.0 mL), luego se adicionó β-ciclodextrina (171.2 mg, 0.13 mmol), se mantuvo la solución en agitación por 3 h a temperatura ambiente. Se evaporó el solvente manteniendo la solución a 50 °C por 24 h. Finalmente, se adicionó 20.0 mL de agua destilada, se agitó y se filtró, el sobrenadante se mantuvo por 48 h a 50 °C con el fin de eliminar el agua y obtener el complejo de inclusión. Porcentaje de rendimiento: (122.3 mg; 66,3%), C153H285Cl3LaO139.5, Análisis elemental: C 40.15 (calc. 42.25), H 6.24 (calc. 5.96), La 2.83 (calc. 3.19). IR (ATR cm-1): 3331 s, 2924 vw, 1639 m, 1504 m, 1490 m, 1417 m, 1388 m, 1249 vw, 1153 m, 1078 m, 1024 vs, 997 vs, 937 m, 860 w, 825 w, 754 w, 704 w. Raman (cm-1): 2935 vs, 2904 vs, 1637 m, 1588 m, 1454 m, 1385 m, 1333 m, 1246 m, 1205 m, 1105 m, 1044 w, 941 m, 855 m, 749 w, 701 w, 572 w, 477 vs, 436 m, 348 w. RMN 1H (DMSO-d6) δ(ppm): 6.43 (d, 3H, 3J=16 Hz, H-2'), 7.34 (d, 3H, 3J=16 Hz, H-1'), 7.42 (d, 6H, 3J=8 Hz, H-2), 7.61 (d, 6H, 3J=8 Hz, H-3), 4.83 (d, 7H, 3J=4 Hz, H-a), 3.30 (m, 7H, H-b), 3.66-3.62 (m, 7H, H-c), 3.37 (m, 7H, H-d), 3.58-3.55 (m, 7H, H-e), 3.66-3.62 (m, 14H, H-f), 4.44 (t, 7H, 3J=4 Hz, OH-f), 5.72 (s, 7H, 3 J=4 Hz, OH-b), 5.77 (d, 7H, 3J=4 Hz, OH-c). RMN 13C (DMSO-d6) δ (ppm): 127.5 (C-2'), 130.5 (C-3), 130.9 (C-2), 134.4 (C-1), 135.2 (C-4), 140.0 (C-1'), 178.58 (C=O), 102.44 (C-a), 72.54 (C-b), 73.55 (C-c), 82.04 (C-d), 72.91 (C-e), 60.42 (C-f). DRX en polvo [espaciado-d/(0.1 nm) (I/I°)]14.24(27), 10.93(9), 9.89(11), 9.13(8), 8.34(34), 7.60(8), 7.11(60), 7.01(100), 6.03(6), 5.76(18), 5.52(10), 5.18(17), 5.03(20), 4.96(12), 4.82(7), 4.66(5), 4.56(22), 4.51(23), 4.29(16), 4.12(7), 3.87(7), 3.74(7), 3.66(5), 3.55(6), 3.28(8). TGA pérdida de masa: 6.08% (80-133 °C, 1 paso, calc. 14.5xH2O=5.99%), 60.85% (248-353 °C, 1 paso, calc. Producto 6 x glucopiranosa + La2(CO3)3 = 62.43%).
Síntesis de [Ce(4-Clcinn)3]·β-CD-7H2O (9) Porcentaje de rendimiento: (129.0 mg; 76.5%), C153H242Cl3CeO118, Análisis elemental: C 39.97 (calc. 43.59), H 6.56 (calc. 5.79), Ce 3.00 (calc. 3.32). IR (ATR cm-1): 3319 s, 2926 vw, 2358 vw, 2324 vw, 1660 m, 1411 m, 1153 m, 1078 m, 1022 vs, 997 vs, 937 m, 860 w, 754 w, 704 w. Raman (cm-1): 2904 vs, 1636 m, 1588 m, 1447 w, 1381 m, 1332 m, 1246 m, 1201 vw, 1123 m, 1082 m, 1043 m, 941 m, 848 m, 746 vw, 701 vw, 576 w, 473 s, 434 m, 348 w, 316 vw. TGA pérdida de masa: 3.00% (81-132 °C, 1 paso, calc. 7xH2O=2,98%), 76.59% (194-389 °C, 2 pasos, calc. Producto 3 x glucopiranosa + Ce2(CO3)3 = 75.53%).
Síntesis de [Sm (4-Clcinn)3]·β -CD18H2O (10) Porcentaje de rendimiento: (150.1 mg; 84.5%), C154H268Cl3SmO129, Análisis elemental: C 38.94 (calc. 41.66), H 6.42 (cal. 6.08), Sm 3.05 (calc. 3.39). IR (ATR cm-1): 3313 s, 2926 w, 2358 w, 2339 w, 1660 m, 1411 m, 1153 s, 1078 s, 1022 vs, 997 vs, 937 m, 862 w, 756 w, 704 w. Raman (cm-1): 2903 vs, 1635 m, 1588 m, 1454 w, 1385 m, 1333 m, 1245 w, 1125 m, 1042 w, 942 w, 848 w, 749 vw, 702 vw, 571 w, 474 s, 435 m, 345 w. TGA pérdida de masa: 7.30% (67-137 °C, 1 paso, calc. 18xH2O=7.32%), 56.88% (228-396 °C, 1 paso, calc. Producto 7 x glucopiranosa + Sm2(CO3)3 = 57.53%).
Síntesis de [Yb(4-Clcinn)3]·β -CD-23H2O (11) Porcentaje de rendimiento: (163.7 mg; 89.9%), C154H278Cl3YbO134, Análisis elemental: C 39.49 (calc. 40.62), H 6.39 (calc. 6.15), Yb 2.87 (calc. 3.80). IR (ATR cm-1): 3317 s, 2924 w, 2358 w, 2341 w, 1660 m, 1411 m, 1153 s, 1078 s, 1022 vs, 999 vs, 937 m, 862 w, 756 w, 704 m. Raman (cm-1): 2903 vs, 2589 w, 1635 m, 1588 m, 1446 w, 1382 m, 1332 m, 1242 m, 1123 m, 1039 w, 942 m, 848 m, 749 vw, 703 vw, 569 m, 473 vs, 435 m, 351 w. TGA pérdida de masa: 8.88% (39-147 °C, 1 paso, calc. 23xH2O=9.12%), 62.60% (231-394 °C, 1 paso, calc. Producto 6 x glucopiranosa + Yb2(CO3)3 = 61.03%).
Síntesis de [Ce(4-MeOcinn)3]·β -CD21H2O (12) Porcentaje de rendimiento: (157.4 mg; 86.0%), C157H283CeO135, Análisis elemental: C 40.53 (calc. 42.18), H 6.63 (calc. 6.38), Ce 2.60 (calc. 3.13). IR (ATR cm-1): 3309 s, 2924 w, 2358 m, 2341 m, 1658 m, 1512 m, 1423 m, 1244 m, 1153 s, 1078 s, 1022 vs, 999 vs, 937 m, 862 w, 754 w, 704 m. Raman (cm-1): 2905 vs, 1635 vs, 1601 vs, 1447 w, 1382 m, 1332 m, 1242 s, 1167 m, 1122 m, 1079 m, 1040 m, 941 m, 857 m, 773 vw, 703 vw, 633 vw, 573 w, 473 s, 434 m, 353 w. TGA pérdida de masa: 8.40% (45-126 °C, 1 paso, calc. 21xH2O=8.48%), 62.95% (246-396 °C, 1 paso, calc. Producto 6 x glucopiranosa + Ce2(CO3)3 = 62.20%).
Síntesis de [Sm(4-MeOcinn)3]·β-CD17H2O (13) Porcentaje de rendimiento: (140.7 mg; 81.1%), C156H271SmO121, Análisis elemental: C 39.72 (calc. 42.65), H 6.56 (calc. 6.22), Sm 2.78 (calc. 3.42). IR (ATR cm-1): 3313 s, 2922 w, 2358 m, 2341 m, 1658 m, 1512 m, 1409 m, 1242 m, 1153 s, 1078 s, 1022 vs, 997 vs, 945 m, 862 w, 829w, 754 w, 704 m. Raman (cm-1): 2938 vs, 2903 vs, 1633 vs, 1600 vs, 1447 m, 1418 m, 1330 m, 1243 s, 1167 s, 1128 m, 1041 m, 941 m, 856 m, 775 w, 701 vw, 633 vw, 570 w, 473 s, 435 w, 351 w. TGA pérdida de masa: 7.01% (81-134 °C, 1 paso, calc. 17xH2O=6.96%), 67.47% (247-384 °C, 1 paso, calc. Producto 5 x glucopiranosa + Sm2(CO3)3 = 66.20%).
Síntesis de [Yb(4-MeOcinn)3]·β-CD21H2O (14) Porcentaje de rendimiento: (150.3 mg; 81.8%), C156H279YbO135, Análisis elemental: C 39.00 (calc. 41.75), H 6.55 (calc. 6.27), Yb 2.71 (calc. 3.86). IR (ATR cm-1): 3311 s, 2922 w, 1658 m, 1641 m, 1604 w, 1512 w, 1423 m, 1247 m, 1153 s, 1101 vw, 1078 s, 1022 vs, 997 vs, 937 m, 862 w, 829 w, 754 w, 702 m, 646 m. Raman (cm-1): 2939 vs, 2905 vs, 1635 vs, 1600 vs, 1447 w, 1382 m, 1332 m, 1242 s, 1167 m, 1122 m, 1040 m, 941 m, 857 m, 773 w, 703 vw, 633 vw, 573 w, 473 s, 434 m, 347 w. TGA pérdida de masa: 8.42% (84-136 °C, 1 paso, calc. 21xH2O=8.42%), 65.68% (254356 °C, 1 paso, calc. Producto 5 x glucopiranosa + Yb2(CO3)3 = 65.29%).
Ensayos de actividad antibacteriana
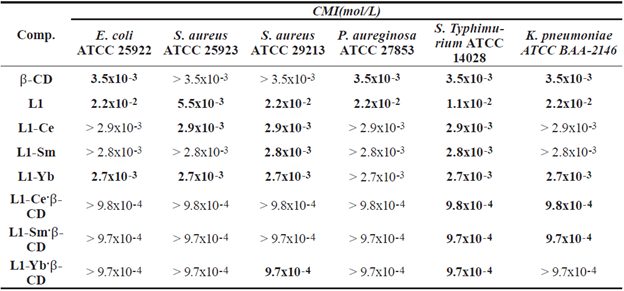
Se determinó la actividad antibacteriana en dos cepas gram-positivas (S. aureus ATCC 25923 y S. aureus ATCC 29213), y cuatro cepas gram-negativas (E. coli ATCC 25922, P. aeruginosa ATCC 27853, S. Typhimurium ATCC 14028 y K. pneumoniae ATCC BAA-2146), utilizando el método M31-A3, recomendado por el CLSI (Clinical and Laboratory Standards Institute) [22]. La concentración mínima inhibitoria (CMI), se determinó a diferentes concentraciones (4000 hasta 7.8 µg/mL). Se preparó una solución de compuesto puro en DMSO (50 mg/mL), a partir de esta solución madre se realizaron diluciones con caldo Mueller-Hinton en una placa de 96 pocillos. El inóculo se adicionó en caldo Mueller-Hinton y la suspensión se ajustó aproximadamente a 1 x 106 UFC/mL. Como control negativo se empleó caldo Mueller-Hinton sin bacterias ni compuestos, como control positivo se empleó caldo Mueller-Hinton con bacteria. Al terminar la preparación de las placas se incubaron a 37 °C por 24 horas.
Pruebas de interacción con ADN
Para evaluar la posible interacción de los compuestos obtenidos con la molécula de ADN, se utilizaron las técnicas UV-vis y electroforesis. En la primera de ellas se realizaron dos ensayos utilizando Fibras tipo I D1501 de ADN de Timo de ternera liofilizado, de la marca Sigma Aldrich. Para el método por electroforesis se empleó ADN E. coli pBR322 D9893, de la marca Sigma Aldrich. Para los ensayos por UV-vis se utilizó un equipo Jasco V-730 con control de temperatura a 20°C. Se evaluaron concentraciones entre 5-15 µM de complejo lantánido y 10-50 µM complejo de inclusión, manteniendo constante la concentración de ADN de Timo de ternera en fibras tipo I (153 µM nucleótidos). En otro ensayo se evaluaron concentraciones de ADN entre 10-50 µM nucleótidos, manteniendo constante las concentraciones de complejo lantánido (20 µM) y de inclusión (70 µM). Para la preparación de estas soluciones se utilizó un buffer de Tris-HCl (50 mM) con NaCl (5 mM) y EDTA (25 mM) a pH 7.2 y una solución de ADN Stock (2.5mg en 3.0 mL de Buffer Tris-HCl/NaCl/EDTA 50 mM/5 mM/25 mM) con relación A260/A280 igual a 1.8.
Para el segundo método se utilizó una cámara electroforética Thermo Scientific EasyCast TM B2 Mini y un transiluminador de luz visible UVP VB-26V. Las muestras se prepararon utilizando concentraciones de 10, 30 y 50 µM de complejo lantánido e inclusión, en buffer de Tris-HCl (50 mM) con NaCl (5 mM) y EDTA (25 mM) a pH 7.2 y TAE 1X (Tris-HCl/CH3COOH/EDTA) a pH 8.3, se adicionó 4.5 µL de ADN E. coli pBR322 D9893 Sigma Aldrich (100 ng/µL), y de forma intercalada 1.3 µL de H2O2 (5.0 mM). Las muestras se incubaron por dos horas a 37 °C y 900 rpm. Luego de la incubación se adicionó a cada muestra el tampón de carga (bromofenol y glicerol) y se inyectaron en el gel de agarosa 1% previamente teñida con gel Green 1X; se utilizó como marcador HyperLadder III Bioline. La corrida se llevó a cabo durante 75 minutos a 100 V y 130 mA.
3. RESULTADOS Y DISCUSIÓN
Síntesis y caracterización de los complejos lantánidos.
Los complejos lantánidos fueron sintetizados a partir de una reacción de metátesis entre el cloruro del lantánido LnCl3∙xH2O y el ligando cinamato correspondiente, obteniendo porcentajes de rendimiento entre 73-99%. Los porcentajes experimentales de H y C con respecto a los valores calculados, así como los porcentajes de metal obtenidos a partir de complexometría con EDTA, permiten sugerir las estructuras propuestas que fueron apoyadas con las diferentes técnicas de caracterización. En la caracterización de los complejos lantánidos 1-7 por espectroscopía de FT-IR (ver figuras 3a, Información suplementaria 1S-6S), se observan las bandas de vibración características de los ligandos cinamato, las bandas en la región entre 1640-1620 cm-1 corresponden a la vibración de tensión del enlace C=C de la cadena alifática, las bandas de vibración de tensión asimétrica y simétrica del CO2 entre 1520 - 1500 cm-1 y 1430 - 1400 cm-1, respectivamente. Estas bandas presentan desplazamiento batocrómico respecto a las bandas de los cinamatos cuyo Δv confirma la participación del carboxilo en la coordinación con los iones lantánidos, actuando como agentes quelantes bidentados (ver tabla 1 y figura 3a) [23]. En los espectros IR se observa la banda de vibración de deformación del enlace = C - H alifático fuera del plano entre 990 - 970 cm-1, indicando que el enlace α, β-insaturado se conserva en posición trans, mientras que la banda de estiramiento del enlace Ln - 0 se observa a 730-780 cm-1, de baja intensidad debido al predominante carácter electrostático [24].
Tabla 1 Principales bandas en FT-IR para los ligandos Na(4-Clcinn), Na(4-MeOcinn) y sus respectivos complejos con La, Ce, Sm e Yb.
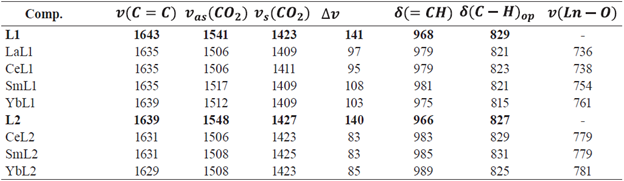
L1 = Na(4-Clcinn), L2 = Na(4-MeOcinn)
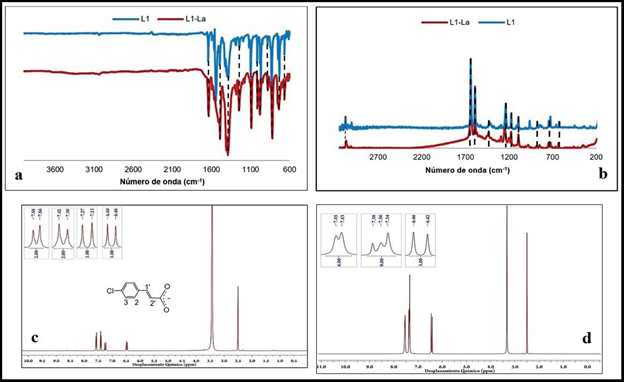
Figura 3 a) Espectro IR comparativo entre L1 y L1-La. b) Espectro Raman comparativo entre L1 y L1-La. c) Espectro RMN 1H de L1. d) Espectro RMN 1H de L1-La
En la caracterización de los compuestos 1-7 por espectroscopía Raman, se observan bandas de vibración similares a las reportadas en el infrarrojo ya que implican los mismos modos vibracionales, sin embargo, se observan corrimientos o cambios en la intensidad de las bandas, consecuencia de la dispersión causada por polarizabilidad de los enlaces presentes.
En las figuras 3b y 13S-18S (información suplementaria), se observan las bandas correspondientes a la vibración de tensión asimétrica del enlace C-H aromático entre 3060 - 3040 cm-1, las bandas de vibración de tensión del enlace C = C de la cadena alifática entre 1640 - 1620 cm-1, las bandas de vibración de tensión asimétrica y simétrica del CO2 entre 1600 - 1580 cm-1 y 1430 - 1400 cm-1, que presentan diferencias en la intensidad con respecto a las bandas del infrarrojo siendo la asimétrica más intensa que la simétrica (ver figura 3b), lo cual se explica por la polarizabilidad del enlace carboxilo. También se logra identificar la banda de estiramiento del enlace Ln - 0 entre 620 - 640 cm-1. En el espectro RMN 1H del Na(4-Clcinn) (figura 3c) se observan cuatro señales, un doblete en 6.50 ppm asignado al protón 2' desplazado a campo alto por el efecto inductivo del grupo carboxilo, un doblete a 7.27 ppm asignado al protón 1' donde 3 J entre 1' y 2' es 16 Hz, lo cual indica que los hidrógenos están dispuestos en posición trans, también se observan los dobletes asignados al protón 2 en 7.42 ppm y al protón 3 en 7.58 ppm, este último desplazado a campo bajo porque el cloro actúa como grupo electroatractor, 3 J entre 2 y 3 es igual 8 Hz indicando que son protones vecinos.
En el espectro RMN 1H del complejo L1-La (figura 3d) se observan las mismas señales obtenidas para el espectro del ligando Na(4-Clcinn) (figura 3c), conservando las mismas constantes de acoplamiento, pero se desplazan a campo alto por el efecto protector ocasionado por la deslocalización de los electrones del carboxilo al coordinarse al metal.
De acuerdo al estudio vibracional y la caracterización espectroscópica se propone que toda la serie de complejos lantánidos sintetizados presentan coordinación bidentada a través de los oxígenos carboxílicos del cinamato y los iones lantánidos.
Síntesis y caracterización de los complejos de inclusión parcial.
Para la síntesis de los complejos de inclusión parcial se empleó la reacción de co-precipitación entre la β-CD y los complejos lantánidos utilizando N,N dimetilformamida (DMF) como solvente. Se obtuvieron porcentajes de rendimientos entre 66-90%.
Se realizó el estudio vibracional por FT-IR y Raman para observar el desplazamiento o desaparición de las bandas de la molécula huésped. En el FT-IR comparativo de la Figura 4a se puede observar la aparición de nuevas bandas que corresponden a la β-CD, algunas de ellas son la banda de vibración de tensión del enlace O - H entre 3330 - 3300 cm-1, la banda de vibración de deformación en el plano del enlace O - H entre 1160 - 1150 cm-1, la banda de vibración de tensión del enlace C - O entre 1030 - 1020 cm-1 y la banda de vibración de deformación fuera del plano del enlace O - H en 704 cm-1, las señales coinciden a lo reportado en la literatura [25].
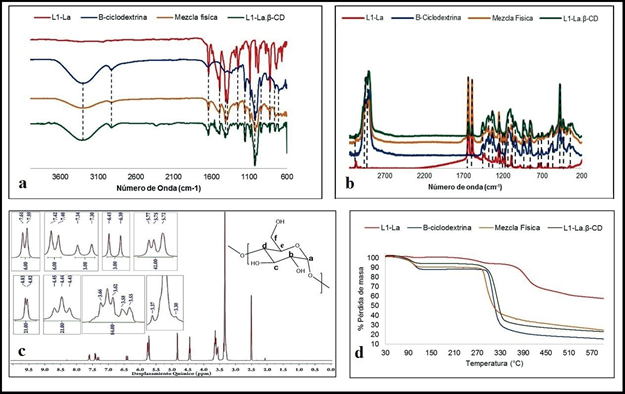
Figura 4 a) Espectro FT-IR comparativo (entre L1-La, β-CD, Mezcla física (L1-La/ β-CD) y L1-La- β-CD). b) Espectro Raman comparativo c) Espectro RMN 1H de L1-La- β-CD d) TGA comparativo.
Además, se observa en los complejos de inclusión el desplazamiento de las bandas correspondientes a la β-CD a menor frecuencia (ver figura 4a, información suplementaria 7S-12S), la disminución de la intensidad de las bandas correspondientes a los enlaces C = C y CO 2, lo cual infiere la formación del enlace de hidrógeno que modifica las vibraciones de la molécula y disminuye la interacción de la misma con la radiación electromagnética del FT-IR.
En la figura 4b se observan los espectros Raman superpuestos de la β-CD, la mezcla física (L1-La/β-CD) y el complejo de inclusión. Se identifican las mismas bandas de vibración que se observan en los espectros de la figura 4a, además de bandas observadas por la presencia de la β-CD, como las de vibración de tensión de enlace C - H asimétrica y simétrica entre 2940 -2930 cm-1 y 2910 - 2900 cm-1, respectivamente. Igualmente, se asignan las bandas de vibración de deformación fuera del plano del anillo de la glucopiranosa entre 580 - 570 cm-1 y 480 - 470 cm-1. Se conservan con menor intensidad algunas bandas del ligando como la banda de vibración de tensión del enlace C = C de la cadena alifática, las bandas de vibración de tensión asimétrica y simétrica del CO 2 y la banda de vibración de deformación del enlace C - H aromático en el plano, sin embargo, se nota la desaparición del resto de bandas incluyendo la banda correspondiente a la vibración de tensión asimétrica del CO 2 .
En el espectro RMN 1H del complejo de inclusión L1-La β -CD (figura 4c), se observan las señales del ligando Na(4-Clcinn), así como las señales de la β -CD. Para la β-CD se tiene a campo alto, superpuestas con la señal del agua, las señales correspondientes a los multipletes del protón b en 3.30 ppm y el d en 3.37 ppm, luego el multiplete para el protón c entre 3.66-3.62 ppm superpuesto con el multiplete de los protones f y el multiplete del protón e entre 3.58-3.55 ppm, el protón a se observa a 4.83 ppm como doblete. Para los hidroxilos se tienen tres señales, la primera a campo alto perteneciente al OH-f en 4.44 ppm observándose como un triplete, un singlete que corresponde a la señal de OH-c en 5.72 ppm y un doblete a 5.77 ppm correspondiente a la señal de OH-b desplazado a campo bajo por el efecto desprotector del enlace glucosídico.
En la tabla 2 se comparan las señales obtenidas de los RMN 1H de las figuras 3c, 3d, 4c y 25S. De acuerdo a los desplazamientos químicos (ppm), obtenidos para los diferentes compuestos, se puede proponer la estructura que se observa en la figura 2 como la obtenida para los complejos de inclusión sintetizados, de esta forma la cavidad de menor diámetro de la β -CD estaría interactuando con el enlace a, P-insaturado del Na(4-Clcinn), ya que el protón 1' sufre un mayor desplazamiento a campo bajo por la presencia de un grupo electroa-tractor que pueden ser los hidroxilos secundarios de la β -CD [26,27].
Tabla 2 Comparación de los desplazamientos químicos (ppm) del RMN 1H de L1, L1-La, L1-La- β-CD y β-CD.
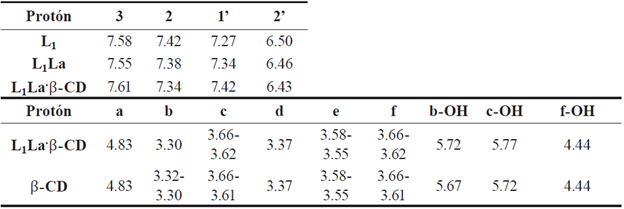
Por otro lado, se observa el desplazamiento del protón 2 a campo alto, lo que sugiere que el campo magnético no interactúa con la misma intensidad debido a la posible formación del enlace de hidrógeno entre el protón c de la β -CD y el protón 2 del Na(4-Clcinn). Finalmente, se observa que el protón 3 se desplaza a campo bajo por la presencia de los hidroxilos primarios de la β -CD.
Además de los análisis espectroscópicos, se realizó un estudio termogravimétrico de los complejos sintetizados para determinar el contenido de moléculas de agua, la variación del punto de fusión y los productos de descomposición que se forman a lo largo del análisis termogravimétrico, permitiendo proponer la estequiometría de los complejos de inclusión. Se ha reportado que el análisis termogravimétrico de la β -CD presenta cuatro eventos térmicos: deshidratación, transición de fase, fusión [28] y finalmente apertura de los anillos de β -CD, seguido de la descomposición de la glucopiranosa produciendo mayoritariamente dióxido de carbono, agua y furanos [29]. En la figura 4d se puede observar que la β -CD empleada al calentarse se deshidrató perdiendo 10.57% de masa lo que equivale a 7 moléculas de agua, presenta la transición de fase a 226 °C, funde a 305.4 °C y luego se descompone. Al comparar el termograma de la β -CD con el del complejo L1-LaP β -CD se destaca que este último pierde 6.08% de masa en el mismo rango de temperatura para la deshidratación de la β -CD, el cambio se atribuye a un menor número de moléculas de agua en el complejo de inclusión (ver tabla 3); este cambio puede deberse a que el complejo lantánido al ingresar a la cavidad interna de la β -CD desplaza las moléculas de agua de hidratación que tenía inicialmente.
Tabla 3 Resultados de la descomposición térmica en atmósfera de nitrógeno de los complejos lantánidos y de inclusión con La (III), Ce (III), Sm (III) e Yb (III).
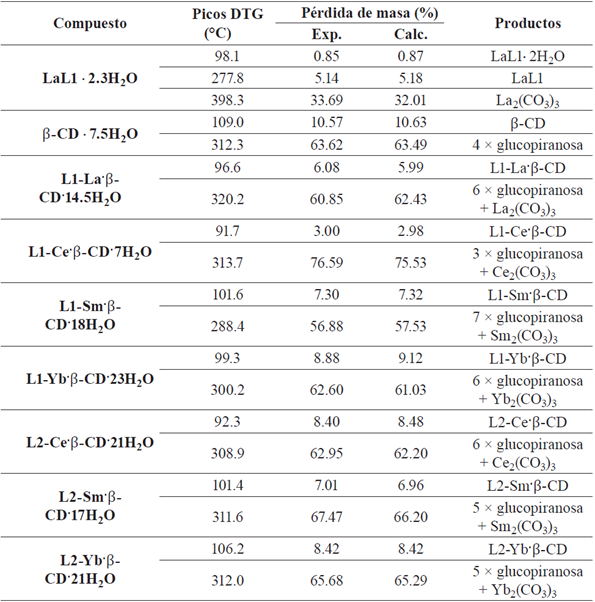
Además de observar el primer evento térmico (deshidratación), se observaron varios cambios para el punto de fusión en los termogramas de las figuras 34S-55S (información suplementaria), el primero de ellos es que la mezcla física (L1-La/β-CD) funde a 306.0 °C, lo que permite suponer la existencia de algún tipo de interacción, y el segundo es que el complejo L1-La·β-CD funde y se descompone entre 290 - 340 °C en un solo paso. Este patrón se conserva en los demás complejos de inclusión sintetizados, por lo cual se puede suponer que mejoró la estabilidad térmica de los compuestos [30].
Para evaluar la cristalinidad de los sólidos obtenidos, se realizó un estudio por DRX. En las figuras 30S-33S (información suplementaria) se puede observar y comparar los difractogramas de los complejos L1-La y L1-La β -CD, la β -CD y la mezcla física (L1-La/ β -CD). En el análisis de los DRX obtenidos es claro que se presentan diferentes perfiles difractográficos; para el complejo L1-La se observan picos característicos a 7.90 °, 12.00 ° y 24.40 ° (2θ) y para la β -CD a 10.60 ° y 12.40 ° (2θ), mientras que la mezcla física pasa de 43 picos a 26 en el complejo de inclusión. La obtención de un nuevo patrón de difracción evidencia que L1-La β -CD es un compuesto totalmente diferente a la mezcla, solo se conservan los picos a 8.10 ° y 12.01 ° (2θ) de L1-La y algunos picos de la β -CD aunque con menor intensidad a la inicial, este resultado permite inferir la pérdida de cristalinidad al incluir el complejo lantánido en la β -CD [25].
Mediante estudios de UV-Vis se encontró que la longitud de onda de máxima absorbancia en el caso de los complejos con L1 fue a 274 nm y con L2 fue a 286 nm, variación generada por efecto del sustituyente en el anillo aromático. Para los compuestos carbonílicos y aromáticos se observa una banda entre 220-250 nm (transiciones electrónicas 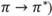 debido a la conjugación entre ambos grupos y no a la superposición de los espectros independientes del anillo aromático y del ácido carboxílico [31]. En los complejos de inclusión se observa que la intensidad de la banda y el coeficiente de absortividad para la transición
debido a la conjugación entre ambos grupos y no a la superposición de los espectros independientes del anillo aromático y del ácido carboxílico [31]. En los complejos de inclusión se observa que la intensidad de la banda y el coeficiente de absortividad para la transición 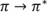 disminuyen, esto puede deberse a que la luz incidente interactúa menos con el sistema conjugado y no permite que se den de igual forma las transiciones electrónicas (ver figuras información suplementaria 56S-69S). Por medio de espectroscopía UV-Vis también fue posible determinar la solubilidad de los complejos obtenidos, se prepararon soluciones sobresaturadas y se confirmó un aumento en la intensidad de las bandas dependiente de la concentración de cada compuesto, los resultados se observan en la Tabla 4.
disminuyen, esto puede deberse a que la luz incidente interactúa menos con el sistema conjugado y no permite que se den de igual forma las transiciones electrónicas (ver figuras información suplementaria 56S-69S). Por medio de espectroscopía UV-Vis también fue posible determinar la solubilidad de los complejos obtenidos, se prepararon soluciones sobresaturadas y se confirmó un aumento en la intensidad de las bandas dependiente de la concentración de cada compuesto, los resultados se observan en la Tabla 4.
Tabla 4 Solubilidad en agua a temperatura ambiente de los complejos lantánidos libres e incluidos parcialmente.
Los resultados de la caracterización estructural de los complejos permiten proponer que por medio del método de co-precipitación se obtuvo un complejo de inclusión parcial con posible relación estequiométrica 1:3 complejo lantánido: β -CD, de forma que el enlace α, β-insaturado del ligando interactúa con los hidroxilos secundarios del anfitrión logrando desplazar las 7 moléculas de agua que se encontraban inicialmente dentro del toroide, además el complejo de inclusión es más estable a la descomposición térmica en comparación al complejo lantánido sin inclusión.
Pruebas antibacterianas
Para la realización de las pruebas antibacterianas, se utilizaron dos cepas bacterianas gram-positivas (S. aureus ATCC 25923 y S. aureus ATCC 29213), y cuatro cepas bacterianas gram-negativas (E. coli ATCC 25922, P. aeruginosa ATCC 27853, S. Typhimurium ATCC 14028 y K. pneumoniae ATCC BAA-2146). Se evaluaron los cloruros de lantánido correspondientes y se encontró que no presentaban actividad antibacteriana en las concentraciones evaluadas (4000 - 7,8 µg/ mL), sin embargo, los complejos lantánidos presentaron menor CMI al compararlos con el resultado para L1, esto demuestra el efecto sinérgico entre el metal y el ligando. Esta disminución en la CMI o mayor actividad de los complejos puede ser a causa de la deslocalización que se produce de los electrones π lo cual aumenta el carácter lipofílico de la molécula permitiendo que penetre más fácilmente las membranas lipídicas [32,33].
En la tabla 5 se presentan los resultados de las pruebas antibacterianas con los compuestos seleccionados. Al comparar los valores de CMI obtenidos para las bacterias gram-positivas y gram-negativas, no se observó un patrón que permita relacionar la actividad antimicrobiana de los complejos con la funcionalidad de la membrana celular de las bacterias, por lo que estos resultados sugieren descartar la posibilidad de que los compuestos estudiados empleen un mecanismo de acción por alteración de la membrana citoplasmática, que es uno de los cinco mecanismos de acción antibacteriana reportados en la literatura [34]. Adicionalmente, se observó que la CMI para los complejos de inclusión es menor en comparación a la CMI para los complejos lantánidos, esto puede deberse al incremento de la solubilidad en el medio, abriendo la posibilidad de ser aplicado en el diseño racional de nuevos metalofármacos que permitan aumentar su efecto biológico; sin embargo, los complejos evaluados no tuvieron la misma acción antibacteriana en todas las cepas. De las cepas evaluadas, podemos concluir que la que presenta mayor resistencia a la acción antibacteriana de los complejos evaluados es la P. aureginosa, ningún complejo fue activo a la mayor concentración evaluada. En la literatura se ha reportado que esta cepa presenta mayor resistencia a antibióticos sin ser claro el mecanismo de defensa de la misma [35].
Interacción con ADN
Una vez evaluada la actividad antimicrobiana de los complejos sintetizados, se realizaron dos ensayos con el fin de evaluar el tipo de interacción intermolécular de los complejos con la macromolécula de ADN. En el primer ensayo, se estudió por UV-vis la posible interacción de los complejos con ADN de timo de ternera y para la segunda prueba se empleó ADN plasmídico de E. coli pBR322 utilizando la técnica de electro-foresis. Para estos ensayos fueron seleccionados dos complejos: L1-Sm (3) y L1-Sm β-CD (10), los cuales presentaron mayor solubilidad y mayor actividad antibacteriana.
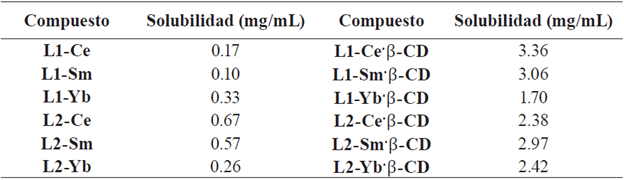
En el ensayo UV-Vis se observó hipercromismo con desplazamiento hacia el rojo cuando se mantuvo constante la concentración de ADN de timo de ternera mientras se aumentaba la concentración de complejo lantánido o del complejo de inclusión (figuras 5a y 5c), mientras que, al aumentar la concentración de ADN, manteniendo constante la concentración de complejo lantánido o complejo de inclusión, se observó hipercromismo con desplazamiento hacia el azul (Figura 5b y 5d).
Figura 5 Estudios de interacción: a) L1-Sm a 5-15 µM y concentración constante de ADN de Timo de ternera (153 µM nucleótidos); b) ADN de timo de ternera a 10-50 µM nucleótidos y concentración constante de L1-Sm (20 µM). c) L1-Sm-β -CD a 10-50 µM y concentración constante de ADN de Timo de ternera (153 µM nucleótidos); d) ADN de timo de ternera a 10-50 μM nucleótidos y concentración constante de complejo de inclusión (70 μM).
La intercalación de pequeñas moléculas en la doble hélice del ADN, genera en los espectros UV-Vis dos efectos: hipocromismo y desplazamiento hacia el rojo, lo cual es atribuido al apilamiento de los compuestos entre las bases nitrogenadas que restringen las transiciones electrónicas, algunos ejemplos de intercalantes son el cisplatino, Ni(Pirox)2(DMF)2 y [Mn(sal) (phen)2]ClO4 [36-38]. De acuerdo a los resultados obtenidos es factible proponer que los complejos evaluados no se intercalan en la molécula de ADN, además, la ausencia de un punto isobéstico claro en el espectro UV-Vis, indica que existe más de un tipo de enlace o interacción en el sistema estudiado. Igualmente, se ha reportado que la unión electrostática generada por la interacción entre el centro metálico y los grupos fosfatos de las hebras de ADN puede generar hipercromismo [39], en donde la hidrofobicidad del ligando y el tamaño del complejo lo afectan directamente [40].
Para el segundo ensayo se evaluó la posible interacción de los complejos con el ADN de un organismo procariota (E. coli). Para esto se realizaron experimentos de electroforesis empleando ADN plasmídico, el cual se caracteriza por tener tres tipos de conformación: lineal, circular relajada y superenrrollada. Además, puede poseer genes que le confieren a las bacterias ventajas adaptativas como resistencia a antibióticos, producción de sustancias tóxicas o codificación de enzimas para degradar sustancias químicas. En este caso el ADN plasmídico pBR322 codifica resistencia a la ampicilina y la tetraciclina. En la figura 6 se observa que presenta tres bandas, la primera para la conformación II (circular relajada) mayor a 10000 pb, la segunda para la conformación III (lineal) aproximadamente a 5000 pb y por último la tercera para la conformación I (superenrrollada) aproximadamente a 3000 pb.
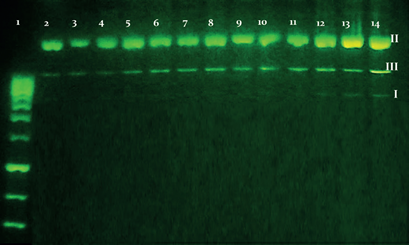
Figura 6 Electroforesis en gel de agarosa 1% para el ADN plasmídico pBR322 después de 75 minutos de incubación a 37 °C. Carril 1, HyperLadder III Bioline; Carril 2, control de ADN; Carril 3, ADN + 10(10 µM); Carril 4, ADN + 10(10 µM) + H2O2; Carril 5, ADN + 10 (30 µM); Carril 6, ADN + 10(30 µM) + H2O2; Carril 7, ADN + 10 (50 µM); Carril 8, ADN + 10(50 µM) + H2O2; Carril 9, ADN + 3 (10 µM); Carril 10, ADN + 3(10 µM) + H2O2; Carril 11, ADN + 3 (30 µM); Carril 12, ADN + 3(30 µM) + H2O2; Carril 13, ADN + 3 (50 µM); Carril 14, ADN + 3(50 µM) + H2O2.
Cabe denotar que no se observó ningún cambio en los carriles 3-12 al compararlos con el control de ADN, sin embargo en el carril 13 se observa el aumento cualitativo de la intensidad de la banda correspondiente a la forma II, lo que podría indicar que la forma superenrrollada se relaja y adopta mayoritariamente la forma circular, y en el carril 14 disminuye un poco la intensidad de la banda de la forma II y aumenta la intensidad de la banda de la forma III, es decir, que para este último carril podría ocurrir que se desnaturalice un porcentaje del ADN de la forma II aumentando el ADN que se encuentra en forma lineal; algunos autores explican los cambios conformacionales del plásmido debido a que los Ln(III), por sus altos números de coordinación, pueden actuar como catalizadores en la hidrolisis de los enlaces fosfodiéster de las cadenas de ADN y ARN [41]. Se ha reportado que compuestos con iones lantánidos en soluciones acuosas, exhiben características similares a las nucleasas promoviendo la formación de un intermediario que facilita la hidrólisis de los enlaces fosfodiéster de las macromoléculas de ADN y ARN [42,43].
4. CONCLUSIONES
Se sintetizó y caracterizó una serie de complejos lantánidos con ligandos cinámicos. De acuerdo a la caracterización vibracional y espectroscópica se propone que presentan coordinación bidentada a través de los oxígenos carboxílicos del cinamato y los iones lantánidos. Por medio del método de co-precipitación se obtuvieron los nuevos complejos correspondientes de inclusión parcial y/o asociación, de acuerdo a la caracterización vibracional, espectroscópica y térmica, se propone que el complejo sintetizado presenta una estequiometria 1:3 complejo lantánido: β -CD, donde el enlace a, β -insaturado del ligando interactúa con los hidroxilos secundarios del anfitrión, la formación de este compuesto aumenta la estabilidad térmica y la solubilidad del complejo lantánido. Los ensayos de actividad antibacteriana permitieron evidenciar en los complejos lantánidos el efecto sinérgico entre el catión lantánido y el ligando cinamato. Además, los complejos de inclusión presentaron disminución en la concentración mínima inhibitoria (CMI) respecto a los complejos lantánidos iniciales, lo cual se podría deber al aumento de la solubilidad de los complejos lantánidos. Los ensayos con ADN permitieron evidenciar su posible interacción con los complejos evaluados, donde el catión lantánido estaría interaccionando electrostáticamente con la cadena de fosfatos del ADN de timo de ternera, a su vez participaría en la relajación de la forma superenrrollada y escisión de la forma circular del ADN plasmídico pBR322 al hidrolizar la cadena de fosfatos.