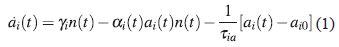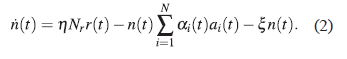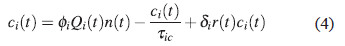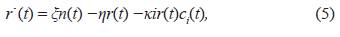1. INTRODUCCIÓN
La enfermedad de Chagas es una enfermedad endémica de América Latina, causada por el parásito protozoario Trypanosoma cruzi (T. cruzi). Actualmente afecta aproximadamente a más de 25 millones de personas, mayormente en América Latina, y causa en promedio cerca de 10000 muertes al año [1]. En Colombia, en particular, la infección se ha detectado a lo largo del valle del río Magdalena, las regiones del Catatumbo, la Sierra Nevada de Santa Marta, los Llanos Orientales y la Serranía de la Macarena, donde destacan los departamentos de Santander, Norte de Santander, Cundinamarca, Boyacá, Casanare, Arauca y algunas comunidades en la Sierra Nevada de Santa Marta por poseer el mayor número de infectados. Hasta el 2012 se registraba entre 700 mil y 1.200.000 personas infectados y 8 millones en riego de adquirirla [2]. El parásito T. cruzi se transmite de diferentes maneras: transmisión sanguínea, desde la madre al feto a través de la placenta, en trasplante de órganos, infección accidental en el laboratorio y, la más común, a través de las heces contaminadas de un insecto hematófogo triatomino [3,4]. Este proceso de infección comienza cuando un insecto infectado succiona sangre de un animal o humano sano. Casi inmediatamente después, contiguo al lugar donde el insecto tomó su alimento, el animal defeca depositando en sus heces el parásito sobre la piel de su víctima, la cual se rasca para aliviar la picazón producido por la picadura del insecto. Al rasgar la piel los parásitos entran en el organismo de su nuevo anfitrión mamífero. Los parásitos se diferencian a su estado circulante tripomastigote y llegan al flujo sanguíneo donde pueden detenerse y penetrar una variedad de células, preferiblemente del tejido del músculo cardíaco o del tejido digestivo. Una vez dentro de las células los parásitos se transforman en amastigotes (estado intracelular) y se replican por fisión binaria hasta llenarla por completo. Debido a este proceso de replicación la célula se rompe descargando nuevos parásitos (que se diferencian de nuevo en tripomastigotes) en el torrente sanguíneo. Estos nuevos parásitos circulantes continuarán su viaje por el flujo sanguíneo y colonizarán nuevas células, del mismo órgano o de otro tejido, continuando con la expansión de la infección en el organismo anfitrión. Estos parásitos pueden ser succionados en una nueva picadura de un insecto sano para continuar la dispersión de la enfermedad [5, 6]. De manera homóloga, el sistema inmune del anfitrión mamífero lanza una respuesta inmune específica cuando la infección representa un reto antigénico y ha traspasado las barreras de la respuesta inmune innata. La defensa empieza cuando las células presentadoras de antígenos muestran una fracción del antígeno unido a una molécula de Clase II del complejo principal de histocompatibilidad (conocida como MHC II, por sus siglas en inglés) en su superficie, las cuales son reconocidas por células T cooperadoras específicas (THCs). Durante está interacción se secretan citokinas para activar la proliferación de células B y células T citotóxicas (CTCs). A partir de aquí la respuesta inmune sigue dos trayectorias. La primera es la respuesta inmune celular a partir de las CTCs, cuya función principal es destruir las células infectadas con patógenos intracelulares tales como bacteria, virus o parásitos inaccesibles para los anticuerpos. Una CTC produce la lisis de una célula infectada cuando esta expresa sobre su superficie un epítopo (parte de un antígeno) ligado a una molecula de clase I del complejo mayor de histocompatibilidad (conocida como MHC I, por sus siglas en inglés). La segunda es la respuesta inmune humoral, mediada por células B o linfocitos B. Los mamíferos poseen diferentes tipos (millones) de células B, las cuales al madurar se diferencian en células plasma, cuya función principal es la producción de anticuerpos que circulan en el flujo sanguíneo, y son capaces de enlazar antígenos envueltos en una infección. Un número de esas células B se convierten en células B de Memoria, las cuales serán células B antígeno-especifícas disponibles para un segundo contacto con el mismo antígeno [7, 8, 9]. Para controlar la infección de Chagas es necesaria la acción sinérgica de las respuestas inmune humoral y celular mediante una gran producción de anticuerpos, una producción poderosa de citokinas Tipo I y la activación de células T CD8+, las cuales permiten el reconocimiento de las celulas anfitriones infectadas por el parásito [10, 11, 12, 13].
En este trabajo se presenta la extensión de un modelo matemático que inicialmente solo describía la respuesta inmune humoral [14], basado en que la producción de anticuerpos es una función lineal del número de parásitos circulantes. En el modelo se omite el efecto de las células T cooperadoras en la producción y secreción de anticuerpos. El modelo fue ampliado para estudiar la interacción de la respuesta inmune humoral cuando el mamífero es infectado por dos cepas del T. cruzi [15], y cuando es infectado por otro parásito (T. rangeli) considerado inocuo y propuesto como una eventual vacuna para la enfermedad [16, 17]. En esta oportunidad, introducimos la respuesta inmune celular de manera similar a la propuesta en el modelo de Yang, la cual es mediada por linfocitos o células T citotóxicas, considerando su proceso de proliferación y clonación debido al reconocimiento de células infectadas. La respuesta inmune celular estabiliza la coexistencia de la respuesta inmune en general y la población parasitaria del T. cruzi eliminando la posibilidad de un crecimiento exponencial del número de parásitos y, por lo tanto, desaparece el caso de muerte como posible estado asintótico existente cuando solo considerábamos la respuesta inmune humoral. Este artículo está organizado de la siguiente manera: en la Sección II se presenta el modelo, cuyos estados estacionarios son discutidos en la Sección III y mostrados en un diagrama de fase descrito en términos del número de parásitos promedio salientes en el rompimiento celular y la tasa de generación de anticuerpos. Las propiedades dinámicas son analizadas en la Sección IV, para finalizar con una breve discusión de los resultados en la sección V.
2. EL MODELO
El modelo en que nos basaremos solamente considera la reacción inmune humoral [18]. Para incluir ambas reacciones inmunes en el nuevo modelo se consideran cinco poblaciones: N diferentes especies de anticuerpos a i (t) capaces de eliminar los parásitos circulantes en la sangre, los cuales son denotados por n(t), M tipos de CTCs no activas Q i (t), y M tipos de CTCs activos c i (t) encargadas de remover las células infectadas, denotadas por r(t). Se considera que la presencia parasitaria estimula la producción de anticuerpos a una tasa γ, los cuales quedan inhabilitados al enlazarse a un parásito en un encuentro que se produce a una taza αi. La ecuación para describir la evolución de la población de anticuerpos es:
Donde α i,0 es la cantidad inicial de anticuerpos en ausencia de infección, y τ iα es su tiempo de vida intrínseco. El coeficiente de eliminación αi es descrito por una función dependiente del tiempo, α i (t) = α A,i + α B,i (1 − exp(−t/T i )), donde T i es el “Tiempo de aprendizaje”, el cual hace referencia a la habilidad del sistema inmune para producir anticuerpos con una eficiencia que incrementa suavemente hasta un cierto valor de saturación α A,i + α B,i [19]. Debido a la interacción con los anticuerpos, la población de parásitos circulantes también decrece con el mismo coeficiente de eliminación αi, al tiempo que se incrementa debido al rompimiento de las células infectadas r(t) liberando nuevos T. cruzi. El decrecimiento en el número de tripomastigotes en sangre, debido a su penetración en células sanas, trae como consecuencia el aumento del número de células infectadas r(t). Denotando Nr como el número promedio de tripomastigotes que emergen de una ruptura celular, η a la probabilidad por unidad de tiempo de rompimiento de una célula infectada (citotoxicidad), y ξ la tasa a la cual los parásitos circulantes penetran dentro de una célula (infectividad), la ecuación para describir la población de tripomastigotes (parásito en su estado circulante) está dada por:
La replicación binaria intracelular del T. cruzi en su estado amastigotico es considerada a través del número de células infectadas r(t) [20, 21, 22, 23]. Para introducir el efecto de la reacción inmune celular, y siguiendo el modelo propuesto por Yang [24], consideraremos dos poblaciones: las células T citotóxicas no-activas, Q i (t), y las células T citotóxicas activas c i (t). Suponemos que existen M diferentes especies de células T citotóxicas no activados que se producen en la médula ósea a una tasa constante σ i . Esta tasa se toma constante debido a la capacidad del cuerpo humano para mantener un equilibrio con las otras respuestas inmunes (homeostasis). La ecuación de evolución de esta población de células T citotóxicas no-activas está dada por,
El segundo término de la Ec.(3) representa la muerte natural de los CTCs no-activas, las cuales poseen un tiempo de vida intrínseco T iq , y el tercer término indica el cambio del estado de no-activado al activado. Este proceso de activación es debido a la estimulación por citokinas, como resultado de la interacción entre células T cooperadoras y células presentadoras de antígeno. Este proceso de activación ocurre a una tasa φ i . y es proporcional a la cantidad de parásitos circulantes que logran desencadenar esta reacción. Una vez las células linfociticas logran activarse pueden ser eliminadas por muerte natural con un tiempo de vida τ ic ... Como consecuencia la dinámica de evolución para las células T activas es descrita por la ecuación,
El último término representa la proliferación causada por el proceso de clonación debido al reconocimiento de una célula infectada por una célula T activa c i (t); proceso que ocurre a una tasa δ i . Las células infectadas son el blanco de los CTCs activas y por ende su misión es eliminarlas. Debido a este proceso de eliminación la ecuación para describir la evolución temporal de las células infectadas r(t) es:
donde el primer término representa el aumento de células infectadas por la penetración de tripomastigotes, el segundo el rompimiento de la célula debido al proceso de replicación y colonización en estado amastigotico del parásito y el último término la eliminación de las células infectadas a una tasa constante κ i por parte de los CTCs activos.
3. ESTADOS ESTACIONARIOS
Por simplicidad se toma una sola especie de anticuerpos y de CTCs haciendo N = M = 1. Las ecuaciones del modelo se igualan a cero estableciendo los puntos fijos del comportamiento del sistema. De esta manera se obtienen los valores de las poblaciones en sus estados estacionarios los cuales clasificamos en dos casos:
I Curación: si N r < 1 + αα 0 /ξ (baja cantidad de parásitos emergiendo de la ruptura de células infectadas), las poblaciones de parásitos y células infectadas desaparecen mientras las respuestas inmune humoral y celular regresan a sus condiciones iniciales (r s = n s = 0, α s = α 0, T s = στT , cs = 0) para cualquier valor de γ. Es interesante ver que este caso depende sólo de la cantidad inicial de anticuerpos (α 0) y no de la tasa de producción de anticuerpos inducida por la presencia de parásitos circulantes (γ). Si el número de parásitos es muy bajo, el sistema inmune no es lo suficientemente estimulado como para producir anticuerpos específicos, sin embargo estos son eliminados debido a su alta eficiencia (α). Cabe añadir que si los parásitos son poco infectivos, es decir tienen poca probabilidad de penetrar en la célula pueden ser eliminados más fácilmente por los anticuerpos y por ende la condición para alcanzar este estado de curación es más amplia.
II (a y b) Enfermedad Crónica: N r > 1 + αα 0 /ξ , la infección parasitaria persiste y no es erradicada. Todas las poblaciones alcanzan valores diferentes de cero para cualquier valor de γ. Las expresiones para los valores de los estados estacionarios son muy largas y complicadas por lo cual no son incluidas de manera explícita en este documento. Este estado puede ser dividido en dos, de acuerdo al tamaño de las poblaciones de anticuerpo en estado estacionario. Si la tasa de producción de anticuerpos es más grande (o más pequeña) que cierto umbral (αα 0), la población de anticuerpos en estado estacionario, α s , será entonces más grande (o más pequeña) que su valor inicial α 0. Esto es importante ya que el diagnóstico de la enfermedad de Chagas es realizado a través del test de ELISA, observando el número de anticuerpos que se forman en contra del T. cruzi. Si estos valores son altos, entonces el paciente posiblemente esté infectado con Chagas. Esto significa que de acuerdo a las observaciones clínicas la enfermedad de Chagas en humanos pertenecería al caso IIa. Esto no descarta que el caso IIb no exista en la naturaleza en algún otro mamífero.
La estabilidad de las soluciones de los estados estacionarios es probada usando el criterio de Routh-Hurwitz [25]. Estos resultados de la invasión parasitaria son mejor descritos a través de diagramas de fase en un plano definido por los parámetros y y Nr. En la Fig.1(a) se puede observar el diagrama de fase obtenido cuando solo considerábamos la respuesta humoral, y el nuevo diagrama de fase considerando ambas respuestas inmunes (humoral y celular) en la Fig.1(b). En las figuras, los parámetros fueron escogidos arbitrariamente para una mejor visualización del diagrama de fase y los diferentes estados estacionarios. En Fig.1(a) nosotros observamos cuatro casos diferentes según el modelo anterior: I) Curación bajo las mismas características descritas anteriormente, II) Enfermedad Crónica, III) Muerte, en el cual el parásito crece sin control, y IIIb) donde el resultado de la infección depende del tamaño de la inoculación. Al comparar ambos diagramas de fase se puede observar que la inclusión de la respuesta inmune celular produce la desaparición del caso de muerte (Caso III) y de la inestabilidad producida por el tamaño de la inoculación parasitaria, mientras el borde entre los casos Crónico y Curación sigue siendo la misma. Esto significa que la respuesta inmune celular ayuda al sistema a controlar la infección, y por ende, evita la destrucción del anfitrión mamífero; lo que constituye una ventaja evolucionaria para el T. cruzi. Ahora el parásito puede reproducirse por un período muy largo sin que resulte en la destrucción de su propio "habitat", aún si el hospedero tuviese una reacción inmune muy débil.
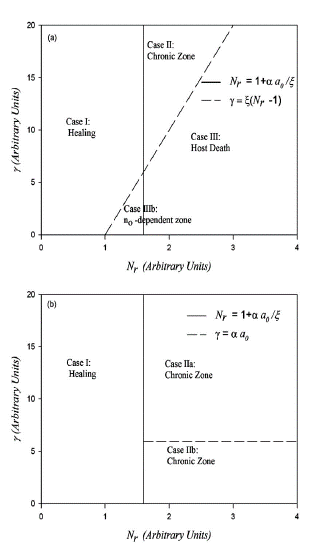
Figura 1 Diagrama de fase y - N r describiendo los resultados de la infección parasitaria, y: tasa de producción de anticuerpos y Nr: número de parásitos saliendo en una ruptura celular. (a) Considerando solo la respuesta inmune humoral (figura tomada de [14]). (b) Considerando ambas respuestas inmunes: celular y humoral (figura tomada de [26]). Los valores de los parámetros están dados en la Tabla 1.
4. DINÁMICA
Las soluciones en función del tiempo de las Ecs. (1)-(5) fueron obtenidas numéricamente usando una rutina ODE solver de R. Estas soluciones se muestran a través de retratos de fase, los cuales consisten en la parametrización de la variable tiempo, conformando un plano donde se comparan a vs n, r vs Q y r vs c. Al unir los valores de esas variables se muestra una trayectoria que describe la evolución del sistema a partir de unas condiciones iniciales dadas. Los retratos de fase se construyen automáticamente usando R, también pueden construirse en otros software como MATLAB o MATHEMATICA. Se puede hacer ciertas conclusiones generales sobre la dinámica del modelo mirando los retratos de fase presentados en las Figs (2), en donde se muestran la evolución de las diferentes poblaciones para los dos estados estacionarios: Curación (Nr = 1) y Crónico (Nr = 14). Los valores de los parámetros elegidos para la construcción de las figuras se muestran en la Tabla 1. En ellas se evidencian trayectorias que terminan en un punto fijo o atractor, el cual para el caso de Curación es (rs = n s = 0, α s = 2, Q s = 30, c s = 0), mientras que para el caso Crónico su valor es (rs =0.15, n s =0.33, α =1.09, Q=3.9, c =38.19). El símbolo * nos indica las condiciones inciales del sistema del sistema: (r0 =0, n0 =10, α0 =2, Q s =30, c0 =0). En todas las figuras observamos para el caso crónico como las poblaciones oscilan en el tiempo hasta alcanzar su respectivo valor atractor. Debido a los valores de los parámetros escogidos se muestran simulaciones de las poblaciones pertenecientes al caso II.b y se aprecia como la población final de anticuerpos es menor al valor inicial α 0 = 2 (Fig. 2(a)).
Tabla 1 Los valores de los parámetros fueron escogidos arbitrariamente para una mejor comprensión del los resultados expuestos en el diagrama de fase presentados en la Fig. 1.
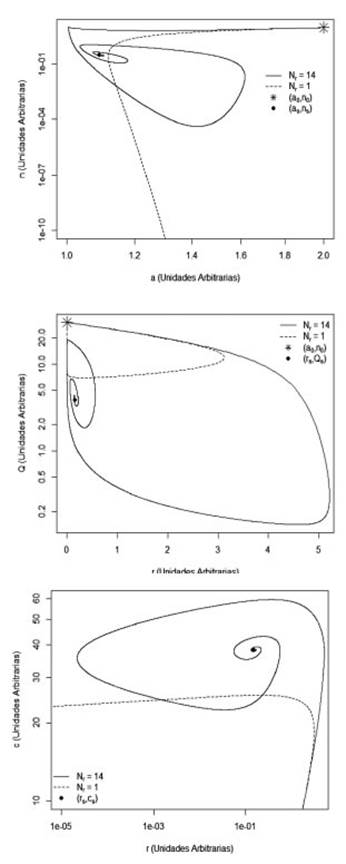
Figura 2 Retratos de fase (a) α vs n (b) r vs Q (c) r vs c. Las condiciones iniciales son (α0 = 2, n0 = 10, r0 = 0, Q0 = 30, c0 = 0), y = 3. Cada tipo de linea corresponde a un estado estacionario, la linea sólida corresponde al estado de cronicidad y la linea punteada corresponde al estado de curación.
5. DISCUSIÓN Y RESULTADOS
El modelo desarrollado es útil al analizar la dependencia de la interacción parásito-sistema inmune con los parámetros del modelo y la valoración cuantitativa de los parámetros en caso de considerar una intervención externa para la erradicación de la enfermedad. El diagrama de fase se divide en dos regiones asociados a los casos Curación y Crónico (Fig. 1). Comparando con el modelo anterior, sin considerar la respuesta inmune humoral, desaparece la región del caso de Muerte (crecimiento exponencial del número de parásitos) y el caso de muerte (inestable) dependiente del tamaño de la inoculación parasitaria. Esto podría esperarse ya que se han incrementado los mecanismos de erradicación de la enfermedad. Se observa además que la frontera entre el caso de curación y el de cronicidad sigue siendo la misma; es decir, depende únicamente de los mismos parámetros de la respuesta humoral, lo que implica que la respuesta inmune celular, por sí sola, no sería capaz de remover la infección parasitaria. Lo anterior nos permite aseverar como consecuencia de que una gran cantidad de anticuerpos iniciales a 0 y una alta eficiencia de eliminación de la respuesta inmune humoral, a, serían los objetivos a analizar en las investigaciones que apuntan hacia la cura de esta enfermedad [27] . Debemos mencionar que el diagrama de fase obtenido en este trabajo, al estudiar el efecto de ambas respuestas inmunes, no reproduce de manera inmediata todos los resultados clínicos observados. En particular la posible muerte de los hospederos durante la fase aguda. Esta puede ser incluida al tener en cuenta el efecto acumulativo del daño celular, que resulta en la falla del órgano donde el tejido infectado se encuentra, tal como se ha observado en modelos murinos encontrados en la literatura. A primera vista la respuesta inmune celular beneficia al organismo mamífero anfitrión del parásito, ya que elimina la posibilidad del crecimiento exponencial de la población parasitaria y por ende extiende su período de vida. Sin embargo, esta situación también ayuda al parásito ya que logra extender el estado de coexistencia con el hospedero y la respuesta inmune lanzada por este. El efecto sinérgico de coexistencia y limitación de la reproducción parasitaria no permite que el parásito destruya su hábitat, aumentando las posibilidades de transmisión a otro mamífero. Esta situación puede considerarse una ventaja evolucionaria, puesto que le permite al T. cruzi establecerse firmemente en un ecosistema, por ejemplo los Incas sufrieron del Mal de Chagas [28] y nuestro modelo puede explicar como esta enfermedad puede coexistir en los seres humanos por tanto tiempo.
Nuestro trabajo a futuro es lograr la validación del modelo a partir del ajuste de los datos experimentales, además del estudio de la dinámica de las diferentes poblaciones a partir de la variación de los diferentes parámetros del modelo.