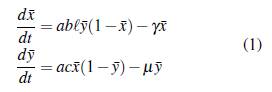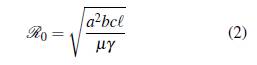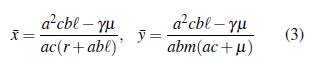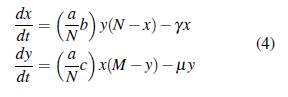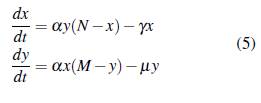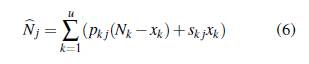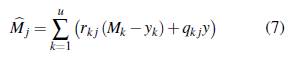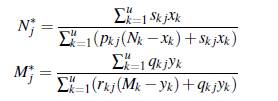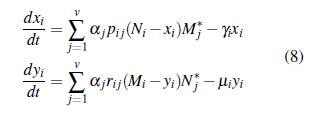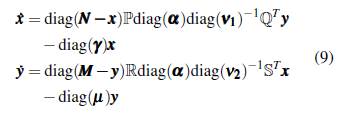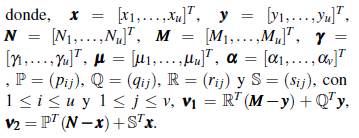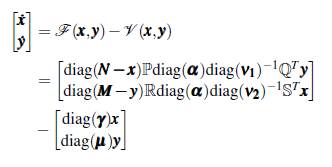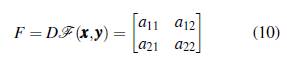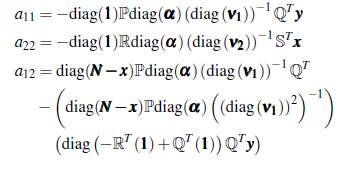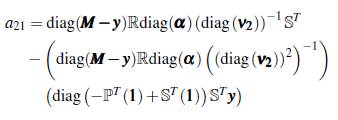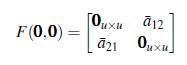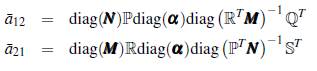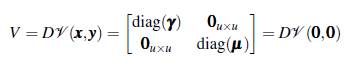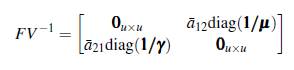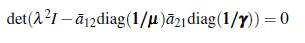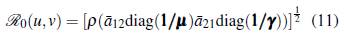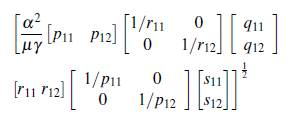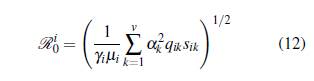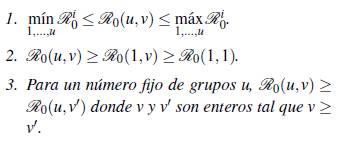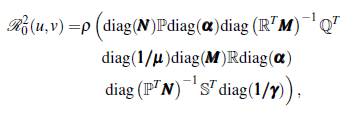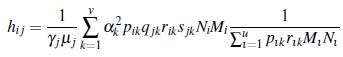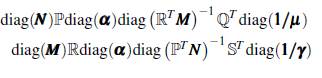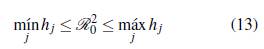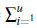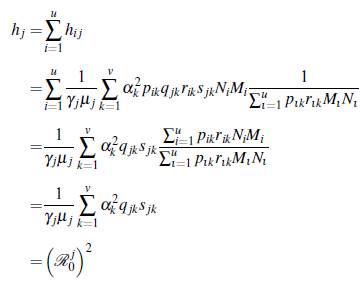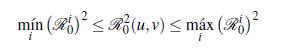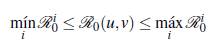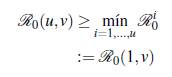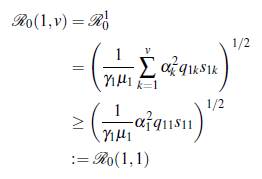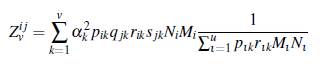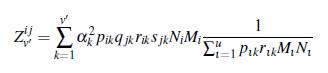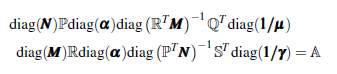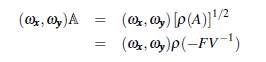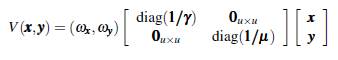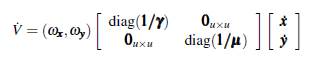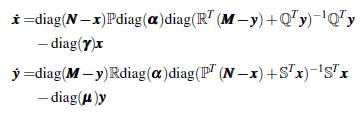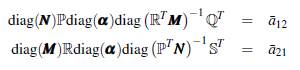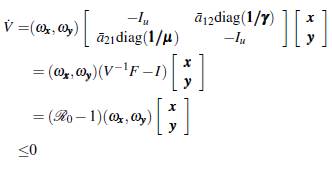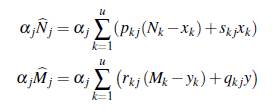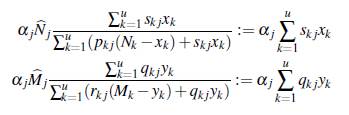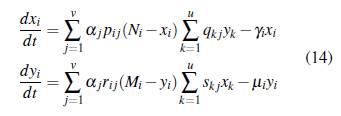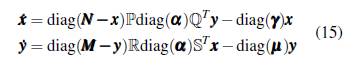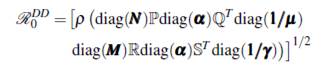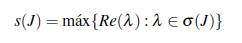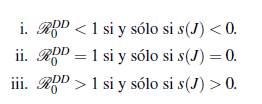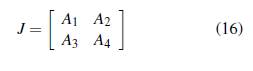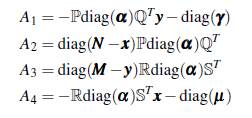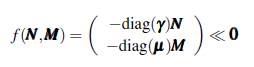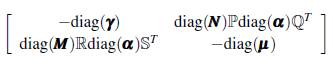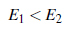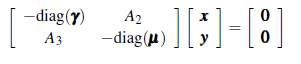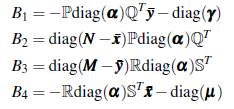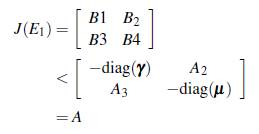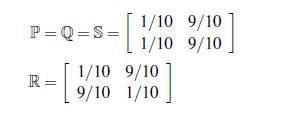1. Introducción
La malaria es considerada una de las enfermedades más antiguas de la humanidad y en la actualidad la mitad de la población mundial está en riesgo, lo que la convierte en un problema de salud pública. En 2016 hubo 216 millones de casos distribuidos en 91 países, un aumento de aproximadamente 5 millones con respecto a 2015, que según las estimaciones costaron la vida de 445 mil personas. Entre los años 2015 y 2016 las tasas de mortalidad se mantuvieron constantes en el Sudeste Asiático, el Pacífico Occidental y África; sin embargo, aumentaron en las regiones del Mediterráneo Oriental y en América; en esta última, los países más afectados son Colombia y Brasil que reportan 36 y 37 casos de muertes, respectivamente. En este sentido la Organización Mundial de la Salud (OMS) constantemente elabora estrategias para combatirla y eliminarla, actualmente está vigente la Estrategia Técnica Mundial Contra la Malaria 2016-2030 [1,2].
En Colombia, los departamentos más afectados por la malaria son: Chocó, Cauca, Nariño y Valle del Cauca, que registran más de diez casos por mil habitantes y agrupan el 82 % de todos los notificados [3]; particularmente, Nariño aporta el 10% de los casos totales en el país y concretamente en el 2014 el departamento reportó 5175 casos de morbilidad, de los cuales el 99 % corresponden a la zona del Pacífico Nariñense [4, 5].
En cuanto a la etiología de la malaria es una enfermedad causada por el parásito protozoario del género plasmodium, que se transmite al ser humano por la picadura de mosquitos hembra infectados del género anopheles [2]. Se conocen más de 175 especies de las cuales cuatro afectan al hombre: plasmodium falciparum, plasmodium vivax, plasmodium malariae y plasmodium ovale [6]. El plasmodium vivax es la causa más frecuente de la enfermedad que rara vez es mortal y el plasmodium falciparum no es común pero produce la mayoría de las muertes [7]. En Colombia, el 72% de los casos son por plasmodium vivax, el 27.1 % por plasmodium falciparum y el 0.8% por malaria mixta; esta relación se invierte en los departamentos de la Costa Pacífica Colombiana, en la cual por lo menos el 80 % de los casos son por plasmodium falciparum [8, 9].
El anopheles es un género de mosquito de la familia culicidae que habita en prácticamente todo el mundo, con especial intensidad en las zonas templadas, tropicales y subtropicales. El macho se alimenta de néctar y jugos de frutas, mientras que la hembra se alimenta principalmente de sangre. La taxonomía depende en gran medida de los orígenes geográficos, es por eso que en cada región los mosquitos tienen diferentes hábitos de alimentación, afectando de manera distinta a las personas [10].
Determinar la especie de anopheles presente en un lugar específico es esencial para estudiar las estrategias que permitan el control de la malaria, pues existen cerca de 422 especies de mosquitos, incluyendo las 70 transmisoras del agente causal de la malaria [10]. En Colombia se han encontrado alrededor de 43, de las cuales 7 son causantes de la enfermedad; los vectores primarios son: anopheles albimanus wiedemann, anopheles darlingi root y anopheles nuneztovari gabaldón; los vectores secundarios son: anopheles puntimacula dyar, anopheles pseudopunctipennis theobald, anopheles lepidotus zavortink y anopheles neivai [11].
Algunos estudios han determinado que además de los vectores primarios y secundarios reportados en [11], hay otras especies dominantes de importancia local en algunas áreas, es el caso del departamento de Nariño en el cual se distingue como vector primario al anopheles calderoni; en esta región se seleccionaron 22 localidades específicas según la incidencia histórica de la malaria, encontrando que el mosquito anopheles calderoni está en 14 localidades y se presenta en mayor abundancia en tres municipios, Boca de Prieta, Roberto Payán y Olaya Herrera. En Boca de Prieta, ejemplares fueron sometidos a ensayo inmunoenzimático (ELISA) y resultaron positivos para plasmodium falciparum y plasmodium vivax [12,13].
La importancia de determinar que el anopheles calderoni está presente en Nariño, radica en que tiene un comportamiento diferente en relación con las otras especies encontradas en Colombia; lo más preocuparte es que la hembra se alimenta a cualquier hora del día, de manera que se hace evidente la necesidad de introducir herramientas adicionales dirigidas a la transmisión al aire libre para disminuir el contacto humano-vector en la Costa Pacífica Nariñense [13].
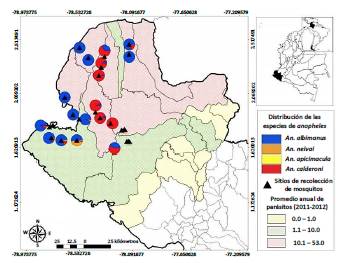
Por otra parte, la distribución espacial del mosquito anopheles en el departamento de Nariño como se muestra en la figura 1, motiva a estudiar la malaria con subpoblaciones disyuntas de vectores y de humanos, dado que los puntos en el mapa son precisamente las regiones donde hay municipios o corregimientos como se corrobora en la figura 2, en la que además se muestra el número de casos en algunas poblaciones [12, 13].
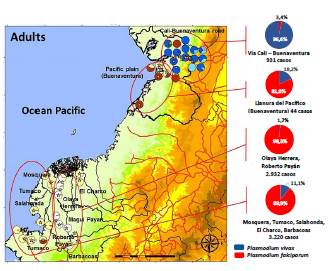
Figura 2 Distribución de especies de anopheles en el sur de la Costa Pacífica Colombiana y casos reportados de malaria [12].
Los puntos en los mapas de las figuras 1 y 2 están "conectados" dado que las personas que habitan las diferentes zonas viajan de un lugar a otro, causando que los individuos se infecten de malaria en alguno de estos sitios; también, los mosquitos pueden desplazarse de una zona a otra utilizando medios de transporte humano, lo cual podría cambiar la dinámica de la enfermedad [14].
Por lo expuesto anteriormente en este artículo se propone estudiar la malaria con un modelo en parches dada la distribución mostrada en las figuras 1 y 2. Además, se consideran diferentes grupos con la intención de dividir las poblaciones dependiendo del impacto de la enfermedad, por ejemplo, diferenciar los humanos según la edad o por estratos socioeconómicos y los vectores entre mosquitos resistentes o no resistentes a los insecticidas. Así, en este artículo, se estudia la dinámica de la malaria considerando que los individuos pertenecen a un grupo determinado y se distribuyen en parcelas disyuntas que están conectadas de algún modo, para lo cual se plantea un modelo multiparche y multigrupo utilizando el modelo de Ross-Macdonald para la transmisión de la malaria, en el cual se incorpora la movilidad desde un enfoque lagrangiano, donde todos los individuos pertenecen a un grupo específico, pero pasan parte de su tiempo en un número arbitrario de parches.
2. Metodología
Para el desarrollo del presente escrito se tiene en cuenta que hay una región en Colombia, la Costa Pacífica Nariñense que aporta cifras significativas de la enfermedad en el país; es una zona donde no sólo el vector primario tiene un comportamiento diferente que afecta las medidas que sugieren las entidades de salud para disminuir el contacto con el mosquito, sino también, la mayoría de los casos de malaria son por plasmodium falciparum, patógeno que causa más muertes.
Además, la distribución espacial que tiene la población y el hecho de que en la literatura se puede encontrar diversos modelos en ecuaciones diferenciales ordinarias para la dinámica de la malaria, donde se considera que la población esta distribuida homogéneamente sin considerar la movilidad ni los grupos [15, 16, 17, 18, 19, 20, 21], propicia la idea de estudiar el efecto de estos aspectos en un modelo clásico como el de Ross-Macdonald. Una base fundamental para formular el modelo se encuentra desarrollada en el artículo [22], en el cual proponen un modelo multiparche y multigrupo para la dinámica SEIRS.
El análisis del modelo se desarrolla de acuerdo a la teoría de los sistemas dinámicos desarrollada en [23], en la cual se establece la condición para que un sistema de ecuaciones diferenciales ordinarias genere un flujo fuertemente monótono, principalmente consiste en que la matriz jacobiana del campo vectorial debe ser irreducible en cada punto, resultado que se puede aplicar para mostrar que la órbita genérica de un sistema irreducible converge al equilibrio. La hipótesis de la irreducibilidad también permite establecer que la estabilidad de un equilibrio está determinada por el valor propio dominante de la matriz jacobiana, cuando ésta es cuasi-positiva.
3. Resultados y discusión
3.1. Modelo de Ross-Macdonald
Entre los modelos matemáticos existentes para la malaria, el modelo de Ross y Macdonald ha sentado las bases de la mayoría de los modelos epidemiológicos actuales, dado que estudia la dinámica de manera "sencilla" y se ajusta al fenómeno biológico [24]. El modelo describe los cambios en los humanos infectados y los mosquitos portadores, la población susceptible se modela implícitamente ya que el tamaño de las poblaciones se mantiene constante.
Los supuestos para el modelo son: N el tamaño de la población de humanos,
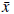 la proporción de humanos infectados, M el tamaño de la población de mosquitos, y la proporción de mosquitos infectados, ℓ = M/N el número de mosquitos por persona, a el número de picaduras de mosquitos por humano por unidad de tiempo, b la proporción de picaduras necesarias para que un mosquito transmita la infección, c la probabilidad de infección de mosquitos, y la tasa de recuperación por persona infecciosa y μ la tasa de mortalidad de los mosquitos. Con lo anterior se obtiene el siguiente sistema de ecuaciones diferenciales.
la proporción de humanos infectados, M el tamaño de la población de mosquitos, y la proporción de mosquitos infectados, ℓ = M/N el número de mosquitos por persona, a el número de picaduras de mosquitos por humano por unidad de tiempo, b la proporción de picaduras necesarias para que un mosquito transmita la infección, c la probabilidad de infección de mosquitos, y la tasa de recuperación por persona infecciosa y μ la tasa de mortalidad de los mosquitos. Con lo anterior se obtiene el siguiente sistema de ecuaciones diferenciales.
En este modelo se supone que la tasa de mortalidad de los seres humanos es insignificante cuando se compara con su tasa de recuperación, y la tasa de recuperación de los mosquitos es despreciable cuando se compara con su tasa de mortalidad. El equilibrio libre de la enfermedad E0 = (0,0) es estable o inestable dependiendo del número reproductivo básico ℛ0, el cual se calcula con el operador de la siguiente generación y está dado por
Luego si ℛ0 < 1, la enfermedad desaparece y E0 es asintóticamente estable. Si ℛ0 > 1, el equilibrio E0 es inestable y hay un punto de equilibrio endémico con coordenadas
que es asintóticamente estable [24].
3.2. Modelo de Ross-Macdonald en grupos y en parches
Para formular el modelo en parches y en grupos, es necesario precisar que el número de individuos no necesariamente es el mismo en cada grupo, por lo que se define el modelo de Ross-Macdonald con números absolutos de humanos y mosquitos, para lo cual se hace el cambio de variable x = N
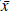 e y = M
e y = M
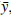 , obteniéndose
, obteniéndose
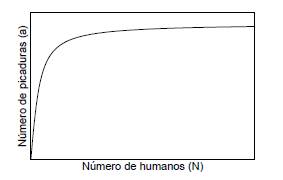
Los mosquitos incrementan el número de picaduras por humano por unidad de tiempo en forma lineal cuando la población de humanos es pequeña; sin embargo, a medida que crece la población de personas la tasa de picaduras decrece, por lo tanto se puede relacionar el número de picaduras de mosquitos a con el tamaño de la población de humanos N. En el artículo [25] proponen una función a = g(N), donde g(N) puede ajustarse a la curva de la figura 3.
Por el comportamiento de g(N), en el artículo [25] proponen que el número de picaduras por humano por unidad de tiempo a es proporcional al tamaño de la población N para bajas densidades de personas, es decir a = kN donde k es la constante de proporcionalidad; si se supone además que la probabilidad b de que un humano se infecte es igual a la probabilidad c de que un mosquito pase a ser portador, como lo sugieren en el artículo [26], se obtiene Kb = kc = a, por lo tanto el modelo (4) puede reescribirse como
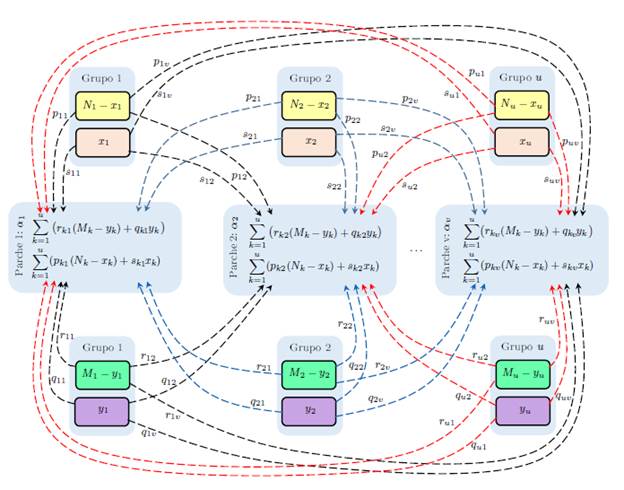
Ahora, se considera que la población está estructurada de forma arbitraria en u grupos que interactúan en v parches, cada grupo tiene la dinámica del modelo (5), x i e y i representan la población de humanos y mosquitos infectados del grupo i con i = 1,..., u; los humanos susceptibles e infectados del grupo i permanecen una proporción de tiempo p i j y s i j, respectivamente en el parche j con j = 1 , . . . , v; los mosquitos no portadores y portadores del grupo i permanecen una proporción de tiempo r i j y q i j, respectivamente en el parche j. La población de humanos en el parche j en un tiempo t está dada por
y la población de mosquitos en el parche j en un tiempo t está dada por
Las poblaciones descritas en (6) y (7) describen la dinámica temporal de cada una de las poblaciones en el parche j, ponderada por los patrones de movilidad de cada grupo y cada estado epidemiológico. La población de humanos infectados y de mosquitos portadores es
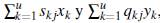 , respectivamente; por lo tanto la proporción de infectados en el parche j está dada por
, respectivamente; por lo tanto la proporción de infectados en el parche j está dada por
Los individuos susceptibles del grupo i pueden infectarse en cualquier parche j, durante la permanencia en ese lugar, por lo tanto la dinámica en u grupos y v parches es
En el modelo (8) se estructura las poblaciones en un número arbitrario de grupos; estas poblaciones, con diferentes estados epidemiológicos, pasan cierto tiempo en algún parche, donde pueden infectarse o infectar a otros. En cada ubicación se tiene un riesgo particular de infección vinculado a sus condiciones ambientales.
En particular los humanos susceptibles del grupo į, N į - x į se infectan cuando están en contacto con la proporción de mosquitos portadores del parche j, a una tasa α j asociada al riesgo de contraer la enfermedad en ese parche; la tasa de recuperación de los humanos infectados en el grupo i es y i , independientemente del lugar. Una explicación similar se puede dar para la infección de mosquitos susceptibles del grupo i. El esquema de la dinámica se muestra en la figura 4.
Con el propósito de analizar la dinámica del modelo multiparche y multigrupo, se reescribe (8) de la forma
Para el análisis del modelo (9) es necesario que la matriz ℙℚT ℝ
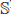 T sea irreducible, esto significa que con una condición inicial de un mosquito portador o de un humano infectado en cualquier sitio, la enfermedad es capaz de extenderse por todos los grupos y los parches, dado que el grafo asociado a la matriz es fuertemente conectado y ningún lugar queda excepto del contacto humano-vector.
T sea irreducible, esto significa que con una condición inicial de un mosquito portador o de un humano infectado en cualquier sitio, la enfermedad es capaz de extenderse por todos los grupos y los parches, dado que el grafo asociado a la matriz es fuertemente conectado y ningún lugar queda excepto del contacto humano-vector.
3.3. Número reproductivo básico
Para calcular el número de reproductivo básico ℛ0, es necesario descomponer los compartimentos infectados de (9) como una suma de los términos de infección ∱ y los términos de transición Ѵ como describe en [24], es decir
La matriz jacobiana de ∱ (x, y) es
donde,
Evaluando la matriz (10) en el punto de equilibrio E0 = (0,0) se tiene
La matriz jacobiana de Ѵ está dada por
Ahora, como V es invertible se puede calcular FV -1
El polinomio característico de FV -1 está dado por
Por lo tanto, el número reproductivo básico ℛ0 es
La ecuación (11) representa el número de infecciones secundarias ocasionadas por la llegada de una persona infectada a una población de susceptibles.
3.4. Efectos de la heterogeneidad en el número reproductivo básico
En este apartado se estudia los efectos que tiene la proporción de tiempo que pasan los individuos de un grupo i en algún parche j, además la influencia del número de grupos y de parches en el número reproductivo básico (11).
Particularmente, el tiempo de permanencia de los individuos en algún parche influye en el brote epidémico o en la extinción de la enfermedad, para mostrar que esto puede suceder se supone el modelo (8) en un grupo y dos parches, con su respectivo número reproductivo básico ℛ0(1,2) expresado como sigue
Además, si se supone que el número reproductivo básico en un parche y un grupo es menor que uno, se puede observar el efecto de las matrices ℙ, ℚ, ℝ y
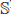 con el siguiente ejemplo.
con el siguiente ejemplo.
Sea ℛ0(1,1) = 0,55, entonces
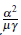 = 0,3 y reemplazando este valor en el número reproductivo básico del modelo (8) en un grupo y dos parches con la siguiente opción para las matrices de tiempo de residencia ℙ1 = (1/3 2/3), ℚ1 = (1/4 3/4), ℝ1 = (1/2 1/2) y
= 0,3 y reemplazando este valor en el número reproductivo básico del modelo (8) en un grupo y dos parches con la siguiente opción para las matrices de tiempo de residencia ℙ1 = (1/3 2/3), ℚ1 = (1/4 3/4), ℝ1 = (1/2 1/2) y
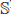 1 = (1/5 4/5) se tiene ℛ0(1,2) = 0,59. Sin embargo, escogiendo ℙ2 = (3/4 1/4), ℚ2 = (7/8 1/8), ℝ2 = (4/16 12/16) y
1 = (1/5 4/5) se tiene ℛ0(1,2) = 0,59. Sin embargo, escogiendo ℙ2 = (3/4 1/4), ℚ2 = (7/8 1/8), ℝ2 = (4/16 12/16) y
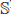 2 = (3/7 4/7), se obtiene ℛ0(1,2) = 1,35.
2 = (3/7 4/7), se obtiene ℛ0(1,2) = 1,35.
Lo anterior muestra que si la dinámica tiene varios parches, el tiempo de permanencia de los individuos puede repercutir en un brote epidémico en el modelo (8), es decir ℛ0(1,2) > 1; aunque el número reproductivo básico ℛ0(1,1) sea menor que uno.
A continuación se presenta un resultado formal de como ℛ0(u, v) cambia dependiendo del número de parches y de grupos, para lo cual se define el número reproductivo básico de un grupo específico i como
Teorema 3.1. Se tienen las siguientes desigualdades
Demostración.
1. El número reproductivo básico del modelo (8) está dado por
un elemento de la matriz es
Si el producto de las matrices ℙℚTℝ
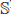 T es irreducible, la matriz
T es irreducible, la matriz
es irreducible, entonces el radio espectral satisface la inecuación de Frobenius de acuerdo a [22]
de (13) se obtiene
por lo tanto
2. Usando la inecuación del item 1 se tiene
Además,
3. Si el número de grupos es fijo en el número reproductivo básico de la ecuación (11), los parámetros son los mismos para cualquier cantidad de parches, así la demostración se reduce a comparar Z v y Z v ' definidas a continuación. Para v parches se tiene
Para v' parches se tiene
Así, para v ≥ v', se tiene que
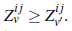 Por lo tanto ℛ0(u, v) ≥ ℛ0(u, v') por el teorema de Perron-Frobenius (ver teorema 3.1 en [23], p. 60).
Por lo tanto ℛ0(u, v) ≥ ℛ0(u, v') por el teorema de Perron-Frobenius (ver teorema 3.1 en [23], p. 60).
3.5. Estabilidad global del punto de equilibrio libre de infección
A continuación, usando el Principio de Invarianza de LaSalle (ver corolario 3.1 en [27], p. 116) y el teorema de Lyapunov (ver teorema 3 en [28], p. 131) se prueba la estabilidad asintótica global de la solución de equilibrio libre de infección E0.
Teorema 3.2. Si ℛ
0
(u, v) ≤ 1 entonces E
0
es global y asintóticamente estable, siempre que el producto de las matrices ℙℚTℝ
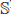 T
sea irreducible.
T
sea irreducible.
Demostración. Sea (ω x, ω y ) un valor propio izquierdo asociado a la matriz
luego,
como el producto de las matrices ℙℚT ℝ
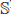 T es irreducible, entonces la matriz A es irreducible, lo cual implica que (ω
x, ω
y
) >> 0 (ver teorema 3.1 en [23], p. 60). Entonces
T es irreducible, entonces la matriz A es irreducible, lo cual implica que (ω
x, ω
y
) >> 0 (ver teorema 3.1 en [23], p. 60). Entonces
es una función de Lyapunov que tiene como derivada orbital a
donde,
factorizando el vector [x y]T y denotando
se tiene que la derivada orbital V puede ser expresada como
Ahora para probar que es asintóticamente estable, se debe demostrar que ninguna solución de (8) que entra a la región
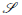 = {(x,y) e ℝ2u:
= {(x,y) e ℝ2u:
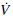 (x,y)
= 0} permanece allí indefinidamente salvo la solución trivial, según el Principio de LaSalle, la única posibilidad es que
(x,y)
= 0} permanece allí indefinidamente salvo la solución trivial, según el Principio de LaSalle, la única posibilidad es que
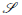 = {(x,y) e R
2u
:
x
= 0 Λ
y
= 0}, es decir, E0 es el único punto de
= {(x,y) e R
2u
:
x
= 0 Λ
y
= 0}, es decir, E0 es el único punto de
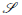 , entonces E
0 es global y asintóticamente estable.
, entonces E
0 es global y asintóticamente estable.
3.6. Estabilidad del equilibrio endémico
Determinar la existencia del equilibrio endémico puede ser laborioso, de hecho en el artículo [22] muestran que las no linealidades intrincadas del modelo (8) pueden conllevar a multiples equilibrios endémicos, por tal razón se estudia la dinámica en un caso particular, en el cual el riesgo de contraer la enfermedad depende de los tamaños de cada una de las poblaciones, más específicamente se supone que el riesgo de infección en cada parche es proporcional al tamaño de la población del mismo, esto es
Así, la tasas con que los individuos susceptibles humanos y mosquitos pasan a ser infectados en el parche j son
Por lo tanto, el modelo (8) queda expresado como
Reescribiendo el sistema dinámico (14) en forma matricial se tiene
El número reproductivo básico del modelo (15) es
que se obtiene de (11).
El siguiente teorema muestra la existencia y la estabilidad del equilibrio endémico del modelo (14), para obtener el resultado se utiliza el módulo de estabilidad s(J) definido por
donde Re(λ) es la parte real del valor propio λ y σ(J) es el conjunto de los valores propios de la matriz jacobiana J, s(J) determina las propiedades de estabilidad de los equilibrios, puesto que si el máximo de los valores propios es negativo los otros también lo son. Además se puede relacionar con el número reproductivo básico ℛ 0 DD de acuerdo al artículo [29], en el cual mencionan y demuestran los siguientes items
Teorema 3.3. Existe un único equilibrio endémico que es local y asintóticamente estable cuando ℛ 0 DD > 1.
Demostración. La demostración se realiza con la teoría de los sistemas irreducibles encontrada en el capítulo 4 del libro [23], para lo cual se necesita que el sistema (15) sea estrictamente monótono; es decir, que la matriz jacobiana (16) sea irreducible (ver teorema 1.1 en [23], p.56).
donde
La matriz (16) es irreducible si el grafo asociado es fuertemente conectado (ver definición 2.6 en [30], p. 30), lo cual es cierto si se supone que ( x, y) ≠ ( N, M) y que un solo individuo infectado puede causar la infección en todos los parches.
Por otro lado, sea f (x,y) el campo vectorial descrito por (15), entonces
luego, el flujo Øt (N,M) converge monótonamente a un equilibrio para cualquier (N, M) (ver proposición 2.1 en [23], p. 34). Ahora se prueba la existencia de un equilibrio endémico utilizando la solución trivial ( 0, 0) y la matriz jacobiana evaluada en este punto
Como el sistema es estrictamente monótono no tiene órbitas periódicas, luego para que exista un punto endémico basta con que el número reproductivo básico ℛ0 DD sea mayor que uno, lo que implica que el módulo de estabilidad s(J) > 0, garantizando al menos un valor propio positivo, así E 0 es inestable y por lo tanto existe al menos un equilibrio positivo E1 de el sistema (14) (ver corolario 3.2 en [23], p. 60)
Ahora, para probar que el sistema (14) tiene un único equilibrio, se supone que existe otro, E 2. Se debe demostrar que E1 = E2, se argumenta por contradicción. Sea E 1 ≠ E 2, sin pérdida de generalidad
Dado que E 1 y E 2 son puntos de equilibrio satisfacen el sistema
Se observa que el sistema anterior es de la forma Ax = 0, luego s(A) es cero, por lo tanto A(E1) y A(E2) tienen el mismo módulo de estabilidad. Sin embargo, como A es cuasi-positiva, es decir las componentes son no negativas excepto las de la diagonal principal, entonces s(A(E 2)) < s(A(E 1)) (ver corolario 3.2 en [23], p. 60), lo cual es una contradicción; en consecuencia únicamente existe un equilibrio distinto de E 0.
Finalmente se demuestra que E1
=
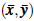 es local y asintóticamente estable, para lo cual se denota
es local y asintóticamente estable, para lo cual se denota
y se verifica la siguiente desigualdad
es decir, s(J) < s(A). Como AE 1 = 0, dado que E 1 es un punto de equilibrio entonces s(A) = 0, lo cual implica que el módulo de estabilidad de la matriz jacobiana es menor que cero, garantizando que todos los valores propios de la matriz de la linealización son negativos; por lo tanto, E 1 es local y asintóticamente estable.
Simulación numérica
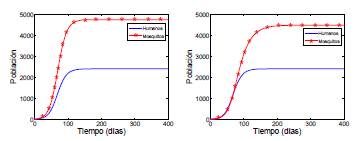
Las simulaciones numéricas permiten visualizar el comportamiento de las soluciones haciendo uso de los métodos numéricos, con lo cual se obtiene soluciones aproximadas. En la figura 5 se muestra la solución numérica para un caso particular del modelo (8), en un tiempo de 500 días con condición inicial (20, 0); el valor de la tasa de recuperación de los humanos es y = 0,0029 y la tasa de mortalidad de los mosquitos es μi
= 0,0039, los cuales son tomados de [31]; el riesgo de infección es αj
= 0,03 y las matrices de permanencia para dos parches son ℙ = ℚ = ℝ =
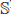 = (1/10 9/10). En la simulación con un grupo y dos parches (figura de la derecha) se observa que la población de infectados crece en menos tiempo en relación con el crecimiento en un parche y un grupo (figura de la izquierda), lo cual indica que ℛ0(1,2) es mayor que ℛ0(1,1) que está en concordancia con el teorema 3.1, donde se ve el efecto del número de parches y grupos en el ℛ0
(u, v).
= (1/10 9/10). En la simulación con un grupo y dos parches (figura de la derecha) se observa que la población de infectados crece en menos tiempo en relación con el crecimiento en un parche y un grupo (figura de la izquierda), lo cual indica que ℛ0(1,2) es mayor que ℛ0(1,1) que está en concordancia con el teorema 3.1, donde se ve el efecto del número de parches y grupos en el ℛ0
(u, v).
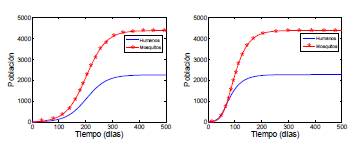
Figura 5 Solución numérica del modelo (8): imagen izquierda, un grupo y un parche; imagen derecha, un grupo y dos parches.
En la figura 6 se muestra la solución numérica en dos parches y en dos grupos con los mismos parámetros de 5 y con las siguientes matrices de permanencia
Se supuso la matriz de permanencia ℝ distinta a las demás para obtener dos grupos con dinámicas diferentes, en los cuales se observa que la población de cada grupo crece en menor tiempo con respecto a la simulación 5, es decir, ℛ0(2, 2) es mayor que ℛ0(1, 2) que está de acuerdo a lo demostrado en el teorema 3.1.
4. Conclusiones
El modelo matemático de Ross-Macdonald extendido a parches y a grupos permite inferir los siguientes resultados.
■ Si el producto de las matrices de permanencia no son irreducibles el sistema dinámico se desacopla y el problema se reduce a estudiar el comportamiento de cada parche.
■ El número reproductivo básico ℛ0(u, v) depende de la permanencia de los individuos en las diferentes zonas.
■ Si el producto de las matrices de permanencia es irreducible, entonces el número reproductivo básico en u grupos y en v parches está acotado por el mínimo y el máximo ℛi 0 de los grupos.
■ Si se fija la cantidad de grupos, el número reproductivo básico ℛ0(u, v) incrementa a medida que aumenta el número de parches.
■ Si el número reproductivo básico ℛ0(u, v) ≤ 1 el equilibrio libre de infección E0 es global y asintóticamente estable, es decir la enfermedad se extingue.
■ En el caso de que la tasa de infección asociada al parche dependa del tamaño de la población, existe un equilibrio endémico E1 que es local y asintóticamente estable cuando ℛ 0 DD (u, v) > 1, lo cual indica que la enfermedad persiste.
El análisis del modelo propuesto evidencia que la movilidad y los grupos influyen en la dinámica de transmisión de la malaria y aunque el resultado es teórico muestra características de la problemática; por lo cual, se puede sugerir que se empleen estrategias que tengan en cuenta la migración de la población. Un procedimiento que se puede seguir para disminuir el número de casos es identificar un foco de infección y aislarlo hasta que pueda ser controlado.