INTRODUCCIÓN
Crotalus durissus, es una serpiente de cascabel considerada una de las especies más letales de América Latina. En Colombia, según las estadísticas del Instituto Nacional de Salud, los accidentes por serpientes venenosas tienen una incidencia de 10,1 por cada 100,000 habitantes. Alrededor del 5-9% de los eventos en Colombia son fatales y el 6-10% tienen secuelas [1], [2]. En el departamento del Tolima no hay estudios que permitan precisar con certeza la magnitud del accidente ofídico causado por esta especie; sin embargo, según los reportes del Instituto Nacional de Salud hasta el segundo periodo del 2014 se reportaron 99 registros de casos de accidentes para el departamento, los cuales fueron ocasionados en su mayoría por serpientes de los géneros Bothrops y Crotalus [3].
El veneno de C. durissus se compone de una mezcla compleja de péptidos, enzimas de tipo fosfolipasas A2, metaloproteinasas, Serin-Proteinasas y otras familias de proteínas tales como las proteínas tipo Lectina C, Desintegrinas, y L-aminoácido Oxidasas [4]-[8] y toxinas (Crotamina, Giroxina, Convulxina, entre otros) los cuales son los responsables de la alta actividad neurotóxica, nefrotóxica y miotóxica del veneno [9], sin embargo se ha demostrado que la abundancia de estos componentes puede variar, por ejemplo las actividades biológicas de los venenos de serpientes capturadas en diferentes áreas geográficas varían significativamente, no obstante, el estudio de los perfiles proteicos, y su bioactividad, permite establecer aproximaciones de manera cualitativa con la presencia de ciertas proteínas y enzimas relacionadas con la fisiopatología de los envenenamientos por su comparaciones con los perfiles de otras especies [10].
El veneno de las serpientes de la familia Viperidae se ha venido estudiando como una fuente importante para el aislamiento de moléculas con potencial uso farmacológico, en algunas de ellas ya se ha demostrado su eficiencia en el tratamiento de enfermedades cardiovasculares y del sistema nervioso [11]. Para el caso de varias especies del género Crotalus, se han encontrado algunas enzimas con propiedades antibacterianas, tanto para bacterias gram positivas como gram negativas y antifúngicas [12]. Estudios recientes han mostrado el potencial antibacterial del veneno crudo de Crotalus durissus terrificus sobre Staphylococcus aureus, Pseudomonas aureaginosa, Micrococcus luteus, Corynebacterium glutamicum y Salmonella enterica serovar typhimurium [13] valorando este recurso como fuente de nuevos agentes antimicrobianos, cuyo blanco principal parece estar más relacionado con los daños causados a nivel de la membrana celular.
De acuerdo a lo anterior, es pertinente evaluar el veneno de C. durissus teniendo en cuenta que la especie está sujeta a variaciones interespecíficas que son de importancia al momento de comprender los efectos locales y sistémicos que se generan producto de la mordedura, y los posibles usos biotecnológicos, los cuales dependen de variaciones en la composición de diferentes proteínas, tales como metaloproteinasas, fosfolipasas y toxinas de tres dedos [14]. Por tanto, el objetivo de este estudio fue evaluar algunas actividades bioquímicas y reconocer preliminarmente el potencial antimicrobiano del veneno de Crotalus durissus (cascabel) de la zona de Natagaima Tolima, Colombia.
ANIMALES Y VENENO.
El veneno crudo se obtuvo de tres individuos de C. durissus con las siguientes medidas de longitud total: 98 cm, 115 cm y 123 cm, colectados a los alrededores del municipio de Natagaima, Tolima, Colombia. La extracción del veneno se realizó mediante la técnica de ordeño manual presionando las glándulas productoras de veneno. La secreción colectada se liofilizó y almacenó a -80°C. La concentración de proteína se determinó mediante el Método de Bradford [15]. Los individuos fueron capturados en el sitio de colecta y liberados después de la extracción del veneno.
ELECTROFORESIS EN GEL DE POLIACRILAMIDA.
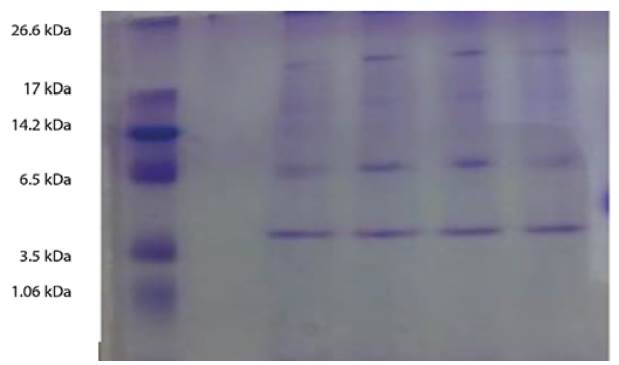
Previa determinación del contenido de proteína del veneno por el Método de Bradford, el perfil por electroforesis en gel de poliacrilamida en condiciones denaturantes, con dódecil sulfato de sodio (PAGE-SDS) se realizó siguiendo el protocolo sugerido [16] en geles al 12 %. Se aplicó un voltaje constante de 100 Voltios durante 60 minutos, la tinción se hizo con azul de Comassie R-250 y el peso molecular se estimó con el marcador estándar marca Sigma Aldrich C6210 (1.06 kDa-26.6kDa).
ACTIVIDAD FOSFOLIPASA
La actividad fosfolipasa del veneno se evaluó a 4 concentraciones diferentes (2 μg/μl., 1 μg/ [μl. y 0.5 μg/μl.) sobre una solución lipoproteica a partir de yema de huevo en presencia de Cloruro de Calcio (CaCl2), y un control negativo con buffer fosfato 0,25M.
La hidrolisis de los fosfolípidos se detectó luego de realizarse una incubación durante 15 minutos a una temperatura de 37°C de la solución lipoproteica con el veneno, se tituló con Hidróxido de Sodio (NaOH) 0,01 N, y se expresaron los resultados en UA/mg. de veneno [17]. Todas las concentraciones y blancos se realizaron por triplicado.
ACTIVIDAD HEMOLÍTICA INDIRECTA E INDIRECTA
Se evaluó utilizando geles de agarosa con glóbulos rojos, con presencia y sin presencia de Cloruro de Calcio (CaCl2) con solución de yema de huevo, asumiendo Dosis Hemolítica Indirecta Mínima (DHeIM) como la dosis de veneno que produce un halo hemolítico de 20 mm. de diámetro en un tiempo de 24 horas [18], los diámetros fueron medidos con Escala de Vernier.
El veneno fue disuelto en buffer fosfato 0,25M pH 7.0, se probaron diferentes concentraciones (400,200 y 100ug/ml), adicionadas en pozos de 3mm de diámetro dentro del gel. Como control negativo se utilizó buffer fosfato 0,25M pH 7,0 [19], [20].
ACTIVIDAD BACTERICIDA EN AGAR Y MICRODILUCIÓN EN PLACA.
Se utilizaron cepas de bacterias obtenidas de la colección de cepas patogénicas del Grupo de Investigación en Productos Naturales de la Universidad del Tolima (GIPRONUT): Escherichia coli (ATCC25922), Pseudomonas aeruginosa (ATCC27853) y Staphylococcus aureus (ATCC29213) en concentraciones de 400, 200, 100 y 50 μg/mL. Las bacterias se sembraron en Agar de Soja Tríptico (cajas de 9 cm. Ө), se adicionó en pozos 5 μl. de las concentraciones señaladas y se incubó durante 24 horas a 37 °C., se midió el diámetro del halo inhibitorio mediante el uso de la Escala de Vernier. Como control negativo se usó buffer fosfato pH 7.
Como ensayo confirmatorio se realizó medición de la actividad antibacteriana en microplacas de 96 pozos. Se depositó 130 μl. del cultivo bacteriano activo en fase exponencial, ajustado a 0,5 en la escala de McFarland en caldo Infusión Cerebro Corazón y 70 μl. de las diluciones del veneno. Se incubó 24 horas a 37 °C. y se determinó el crecimiento bacteriano midiendo la absorbancia de cada pozo a 610 nm. en un espectrofotómetro para microplacas Multiskan™ Go [21]-[23]. El porcentaje de inhibición se calculó a partir de la comparación entre las curvas de crecimiento de las bacterias en el medio de cultivo control frente a los medios de cultivo tratados con las respectivas concentraciones de veneno. Como sustancia de referencia de usó oxitetraciclina a 80 μg/mL.
ANIMALES Y VENENO.
El total de la producción de veneno crudo de los tres individuos se obtuvo de una única extracción. Los individuos no se mantuvieron en cautiverio para futuras extracciones ya que no se contaba con instalaciones apropiadas para su adecuada manutención y manipulación (Fig.1). La cantidad extraída fue aproximadamente 0.5 ml equivalentes a 130 mg. de veneno liofilizado. La cuantificación de proteína del veneno crudo determinó que 821 mg/g. corresponden a proteína pura, cantidad que se ajusta al número y tamaño de los individuos colectados.
ELECTROFORESIS DE POLIACRILAMIDA SDS-PAGE.
El gel de electroforesis de poliacrilamida (SDS-PAGE) al 12% mostró 4 bandas para el veneno crudo de los individuos de C. durissus de Natagaima, Tolima, Colombia (Fig.2). La primera banda presentó un peso superior a 17 KDa., la segunda banda, menos definida oscila entre los 17 -14 KDa., y finalmente se observaron dos bandas de peso molecular bajo entre los 6.5 kDa. y los 3.5 KDa. Estas bandas concuerdan con pesos moleculares reportados para el veneno de esta especie en sur américa, el predominio de proteínas con pesos moleculares por debajo de 20 kDa. [8], [24] que posiblemente corresponden a proteínas de tipo fosfolipasa, ya que las fosfolipasas A2 (sPLA2) se caracterizan por tener baja masa molecular (13-18 kDa.), junto con la Crotoxina B, cuya masa molecular es de 14.197,6 KDa., [25]-[27]
ACTIVIDAD FOSFOLIPASA.
El veneno crudo de C. durissus presentó actividad fosfolipasa de 1.25 UA/mg. ± 0.88, la cual es baja si se compara con reportes previos desarrollados bajo el método de coagulación de yema de huevo. Al respecto se ha reportado [17] para esta especie en Perú, actividad de 3,50 UA/ mg, mientras que para la especie C. durissus terrifions se ha reportado actividad de 3.14 UA/ mg [28]. Por otro lado, a nivel de subfamilia, la actividad enzimática reportada para especies como Bothrops atrox con esta metodología oscila entre 2,7 UA/mg. y 0,8UA/mg. [29]. Métodos más precisos como el espectrofotométricos se han usado para determinar la actividad fosfolipasa en venenos de serpiente [30], no obstante el método de coagulación de yema de huevo es un método reproducible y de fácil acceso para realizar evaluaciones de actividad fosfolipasa que se sigue usando para evaluar la actividad de esta enzima [31].
ACTIVIDAD HEMOLÍTICA DIRECTA E INDIRECTA
La actividad hemolítica indirecta fue dosis dependiente (Tabla 1), con una Dosis Hemolítica Indirecta Mínima (DHelM) de 200 μg, mientras que la actividad hemolítica directa fue más baja, y sin apreciable efecto dosis respuesta. Esta actividad suele estar asociada con la presencia de enzimas de tipo metaloproteinasa en el veneno, mientras que la actividad indirecta está mediada por la presencia de un cofactor que se atribuye a la presencia de enzimas de tipo Fosfolipasa A2 dependientes de Ca+2 en el veneno, debido a que las fosfolipasas A2 secretadas (sPLA2) presentan numerosos puentes disulfuro, residuos catalíticos histidilo y aspartilo y una región de unión a Calcio (Ca+2) altamente conservada [27], [32]-[34].
Tabla. 1 Actividad hemolítica directa e indirecta del veneno crudo de C. durissus evaluado a diferentes concentraciones.
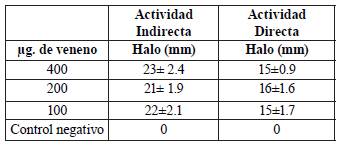
Estos valores son acordes con los resultados de actividad fosfolipasa presentados previamente, además contrastan con datos reportados previamente para el veneno crudo de esta especie. para C. durissus cumanensis en Venezuela (DHelM) de 379,51 μg [32], dosis de 350 μg. para Crotalus durissus ruruima de Brasil [35] y actividad hemolítica indirecta de fracciones en el complejo de Crotoxina del veneno de Crotalus durissus cumanensis de 25 μg. y 12.25 μg. [25], de acuerdo a lo anterior se observó que el veneno de C. durissus de Natagaima, Tolima, Colombia presenta un actividad hemolítica alta que los reportes previos mencionados con anterioridad. En general el conocimiento de la actividad hemolítica es de particular interés ya que se asocia con los efectos hemorrágicos y necróticos asociados con el envenenamiento, pero además en el caso de la actividad hemolítica indirecta se ha relacionado con el daño de membranas, y de allí su asociación con el potencial antibacteriano de venenos de serpientes mediado por las fosfolipasas [36].
ACTIVIDAD BACTERICIDA
El veneno crudo y las diluciones no presentaron en placa de agar actividad bactericida contra bacterias Gram +, sin embargo, en bacterias Gram- la cepa de E. coli (ATCC25922) fue en la única sobre la que se observó halo de inhibición de crecimiento. Este efecto selectivo se ha reportado previamente, y depende de varios factores, siendo uno de ellos el tipo de fosfolipasas presentes en el veneno[36]. Una evaluación posterior de la actividad bactericida en microplacas realizado con esta cepa bacteriana permitió establecer un efecto bacteriostático moderado que a las diferentes concentraciones evaluadas no superó el 50% de la inhibición del crecimiento (Tabla 2).
Tabla 2 Porcentajes de inhibición del crecimiento sobre E. coli (ATCC25922) a diferentes concentraciones de veneno de C. durissus
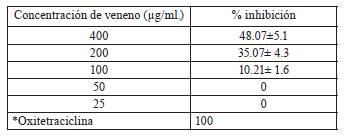
Estos resultados contrastan con reportes de actividad bactericida por parte del veneno de esta especie en diferentes cepas bacterianas ya que resulto ser potente frente a lo que se conoce de reportes previos, y al parecer de menor espectro ya que como se indicó solo se observó efecto moderado sobre E. coli, no obstante se ha reportado para el veneno crudo de Crotalus durissus terrificus actividad sobre bacterias Gram + y Gram - con valores de CIM para S. aureus ATCC 25923 de 125 μg/mL., P. aeruginosa ATCC 27853 de 62.5 Ug/ml. y Micrococcus luteus ATCC 9341 de ≤500 μg/mg. [13], también hay reportes para C. durissus cascavella contra Staphylococcus mutans, y Xanthomonas axonopodispvpassiflorae, mientras que Crotalus durissus cumanensis contra S. aureus y Acinetobacter baumannii [37].
Por otro lado, se ha reportado potencial antifúngico sobre Candida albicans e inhibición sobre el crecimiento de bacterias Gram-positivas y Gram-negativas junto con una inhibición débil en el crecimiento de E. coli, P. aeruginosa, S. aureus y M. luteus tratados con Crotamina, uno de los componentes del veneno [38]. La Crotamina mostró una Concentración Mínima Inhibitoria de 25, 50 y 100 μg/ml. contra tres cepas de E. coli (O157: H7, ML-35p y ATCC 25922), respectivamente, mientras que no se observó un crecimiento bacteriano de inhibición completa contra otras dos bacterias Gram negativas (P. aeruginosa y Salmonella typhimurium) y dos bacterias Gram positivas (S. aureus y Listeria monocytogenes) en concentraciones de hasta 200 μg/ ml.
De modo general, se sabe que las fosfolipasas A2 de los venenos de serpientes son reconocidas por sus actividades fisiológicas, como miotoxicidad, neurotoxicidad, actividad anticoagulante, la actividad edematizante, cardiotoxicidad, efecto antiparasitario, actividad agregante de las plaquetas y su potencial terapéutico a nivel antibacteriano como antibióticos, ya que, por ejemplo, la Crotamina es un antibiótico peptídico de espectro estrecho con preferencias hacia ciertas especies bacterianas [13], [24], [25], [38], [39].
Diferentes estudios han demostrado que el veneno de cada especie es diferente tanto a nivel interespecífico como intraespecífico, lo que determina que los efectos sobre un organismo vivo y sus manifestaciones clínicas sean diferentes [10], así por ejemplo, la variación intraespecífica es muestra de que el veneno de Crotalus durissus terrificus ha evidenciado diferencia en composición de proteínas [40]. Además, se reporta que las actividades biológicas de los venenos de serpientes capturadas en diferentes áreas geográficas varían significativamente [33].
CONCLUSIÓN
Estos resultados muestran que al igual que otras especies de serpiente Cascabel, especímenes C. durissus colectados en el departamento del Tolima presentan actividades enzimáticas y hemolíticas que son comunes dentro de la familia, y que pueden ayudar a comprender los síntomas de los pacientes por envenenamiento de esta especie que se puedan presentar en el departamento, y los riesgos de daño tisular o hemolítico significativo producto de un eventual accidente ofídico.
Igualmente, de forma preliminar se estableció que el veneno crudo presentó baja actividad bactericida y de menor espectro, manifestándose efecto diferencial y bacteriostático a las concentraciones con la bacteria Gram negativa E. coli, no obstante dados los efectos que la variación intraespecífica causa sobre la composición y actividad biológica del veneno, se requieren de más estudios que permitan establecer con mayor detalle el rango de acción bactericida, así como otras actividades biológicas de interés del veneno crudo, de la serpiente de cascabel del Tolima.