INTRODUCCIÓN
El planeta posee 3,682 millones de hectáreas de bosque natural, de las cuales el 4% pertenece a bosques de montaña, y el 60% de estas se ubican en centro y sur América. Los bosques montanos y montanos bajos se encuentran distribuidos a lo largo del territorio latinoamericano y del Caribe. Son muchos los motivos que corroboran la importancia de estos bosques, uno de los principales radica en la protección crucial de las cuencas hidrográficas, ya que captan y regulan grandes cantidades de agua. Estos bosques debido a su característica nubosa adicionan generalmente entre 5% y 20% del volumen normal de lluvias. Además, su alta diversidad y endemismos es otra característica que los resalta [1] .
Desafortunadamente, todos estos bosques han sido transformados y fragmentados, esto es asociado con procesos progresivos de pérdida de hábitat causados por el mal uso del territorio. La transformación y la reducción en el tamaño de las coberturas de bosque dan lugar a diferentes efectos negativos como: la pérdida de hábitat y disminución del tamaño de las poblaciones de fauna y flora, aumento en la temperatura de la superficie del suelo, disminución en la evapotranspiración y precipitación, lo que conlleva a la alteración de múltiples procesos ecológicos [2] , [3] . Adicional a esto, la mayoría de los fragmentos de bosque húmedo montano bajo (BHMB) que aún quedan, son sometidos a quemas, extracción de leña, maderas y especies ornamentales nativas, lo que genera anomalías en su diversidad, y cambios en su composición [4] .
En Colombia, los BHMB se encuentran ubicados en la región Andina donde se presenta el mayor asentamiento humano del país, y es ahí donde predominan muchas de las áreas degradadas con evidencias de los problemas antes mencionados [1] , [5] . Para restaurar parte de estas áreas degradadas, el gobierno de Colombia firmó el Desafío de Bonn, con el compromiso de hacer restauración ecológica de un millón de hectáreas para el año 2020 [6] . Para cumplir con este compromiso, es muy importante desarrollar herramientas que propendan por una restauración ecológica exitosa. Saber cuáles especies se deben seleccionar en la restauración ecológica, es una de las preguntas cruciales que se deben responder en este tipo de iniciativas. En algunos casos se han cometido muchos errores en este tipo de selección, lo cual conlleva a procesos de reforestación que no implican necesariamente restauración. Generar herramientas que ayuden en esta selección sería de gran importancia para los investigadores y técnicos. Es necesario, buscar opciones de restauración ecológica donde se hace uso de los recursos naturales o del ambiente, a fin de imitar la estructura, función, diversidad y dinámica del ecosistema específico [7] . Además de estas consideraciones, para la restauración ecológica, se deben tener en cuenta, los pisos térmicos, las características físico-químicas, ambientales, y múltiples zonas de vida que son propias de los diversos ecosistemas de Colombia [8] .
Estos cambios de las condiciones naturales en los fragmentos de BHMB, afectan directamente los bancos y lluvias de semillas nativas, debido a la erosión del suelo, mayor depredación de semillas, condiciones climáticas extremas, baja viabilidad de propágulos, y mayor competencia con pastos [9] . Para algunos autores, la baja cantidad de bancos y lluvias de semillas, es una de las mayores limitaciones para la regeneración de los bosques [10] , [11] . Estas son algunas de las razones por las cuales es importante conocer las dinámicas de frutos y semillas de los remanentes de BHMB que aún quedan. Infortunadamente, en la actualidad, en estos bosques, son pobremente entendidos los mecanismos que gobiernan la diversidad funcional de frutos y semillas, y la efectividad de la dispersión [12] , [13] . De otro lado, la selección de especies nativas asociada a semillas y otros propágulos para la restauración es un proceso complejo, ya que debe ser acorde a cada lugar, y debe tener en cuenta los grupos funcionales y la sucesión vegetal, información que por lo general se encuentra de forma imprecisa, lo que trae consigo, fracasos de la restauración [14] , [15] , [13] .
Una de las problemáticas frecuentemente escuchadas por parte de los restauradores, consiste en la dificultad de hacer clasificación ecológica de las especies, es decir agrupar las especies de plantas en grupos ecológicos y funcionales, esto incluye el manejo y comportamiento de las especies [16] . Por ejemplo, para Garwood [17] las clasificaciones de plántulas no son 100% precisas, pero han sido muy útiles para proveer información sobre la importancia ecológica y funcional de los rasgos morfológicos iniciales de las plantas. Aunque no existe un consenso entre los investigadores respecto a la clasificación ideal, es frecuente encontrar en la literatura clasificaciones o agrupaciones útiles y funcionales. Por ejemplo, algunos autores, clasifican especies de plantas dependiendo de su dispersión (autocoria, anemocoria, y zoocoria) [18] , [19] , otros lo hacen con base a los requerimientos de luz de las plantas [20] , al tamaño del claro [21] , incluso los términos utilizados para denominar el grupo ecológico puede variar, para Martinez- Ramos [22] las especies pueden agruparse como pioneras, nómadas y tolerantes, mientras que para Kageyama y Viana [23] las especies se agrupan entre pioneras, secundarias iniciales, secundarias tardías y clímax.
Desde el punto de vista de la restauración ecológica, una clasificación muy detallada de las especies puede ser confusa para los investigadores. Algunas propuestas simplifican y agrupan las especies en dos tipos: pioneras y no pioneras, estas últimas llamadas también persistentes [21] , [24] . Esta clasificación está basada en la autoecología de las especies y su ocupación dentro de la regeneración natural del bosque [24] .
En el presente trabajo se quiere aportar información general sobre frutos y semillas encontrados en el BHMB, la capacidad de germinación de algunas de estas especies y su agrupación ecológica básica (pioneras y no pioneras). Se espera que esta información sirva como herramienta para la selección y posterior uso de especies de BHMB en procesos de restauración ecológica y/o compensación ambiental.
MATERIALES Y MÉTODOS
Área de estudio
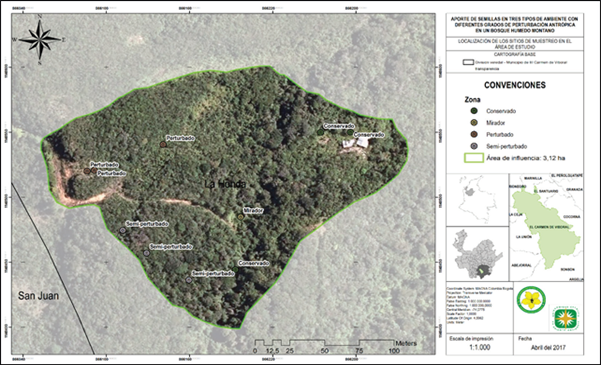
El presente estudio se realizó en un bosque alto andino de 500 ha, ubicado en la vereda La Honda al occidente de la cabecera municipal de El Carmen de Viboral, en límites con el municipio de La Unión, departamento de Antioquia. Las coordenadas son: 5° 56.293' al norte y 75° 17.107' al occidente. El área de muestreo presenta una altitud de 2,587 m.s.n.m, una temperatura promedio de 14°C y una precipitación anual promedio de 2,402 mm. De acuerdo con Holdrige [25] el área se encuentra en la zona de vida Bosque muy húmedo Montano Bajo (figura, 1).
Selección de las zonas en el área de estudio
De acuerdo con la de intervención antrópica se seleccionaron tres clases de áreas dentro del bosque que presentaban atributos contrastantes y fácilmente diferenciables (tabla 1.). Se aclara que en cada zona fueron implementados varios transectos con fines de muestreo, los cuales no necesariamente presentaban una ubicación continua.
Tabla 1 Selección de zonas dentro del bosque para su evaluación
| Clasificación del Área | Descripción |
|---|---|
| 1 | El tipo de área 1 fue la más intervenida, presentando discontinuidad en su dosel, con evidentes cambios de estructura y composición de la vegetación. Esta área estuvo constituida principalmente por pastos y arbustos de poca altura fustal y parches de suelo sin ningún tipo de cobertura. Además, los suelos presentaron cambios debido a actividades antrópicas anteriores en el borde del bosque, principalmente por la construcción de una carretera, viviendas y áreas agrícolas. Estas actividades fueron realizadas hace aproximadamente 20 años. |
| 2 | El área 2 presentó una intervención moderada, debido a que el bosque ha venido siendo utilizado para la extracción de madera. Dicha extracción ha afectado la composición de especies y su riqueza, en especial las maderables. La extracción de madera en este bosque terminó en los años 80, debido a la presencia de grupos armados. |
| 3 | El área 3, es la más conservada del bosque remanente, debido posiblemente a las dificultades de acceso, lo que evitó la extracción de madera. Es la zona con presencia de árboles de buen porte, dosel cerrado, y presencia de palmas y epífitas en su sotobosque. Está zona sirvió como referencia ya que su composición y estructura ha sido poco alterada. De acuerdo con pobladores de la región, esta zona ha permanecido intacta en los últimos 200 años. |
Análisis de suelos
En todas las áreas se tomaron muestras de suelo para su posterior análisis. Los análisis de las variables físicas fueron realizados en el laboratorio de suelos de la Universidad Católica de Oriente. Para dichos efectos se utilizó la metodología propuesta por Jaramillo [26] en donde se evaluó: perfil, estructura, color, densidad aparente, porcentaje de materia orgánica y pH de cada muestra (tabla 6). Los parámetros químicos fueron realizados por un laboratorio comercial, el cual utilizó las metodologías propuestas por Soil Survey Laboratory, en donde se analizó: pH del suelo: 1:1 (v) pH-metro; Materia Orgánica (M.O.): Walkley & Black; Al extractable: 1M KCl; Ca, Mg, K: 1M Acetato de amonio pH 7; capacidad de intercambio catiónico efectiva (C.E.C). Fe: Olsen-EDTA. Los resultados y las metodologías para las variables químicas se encuentran en las tablas 5 y 6.
Análisis florístico
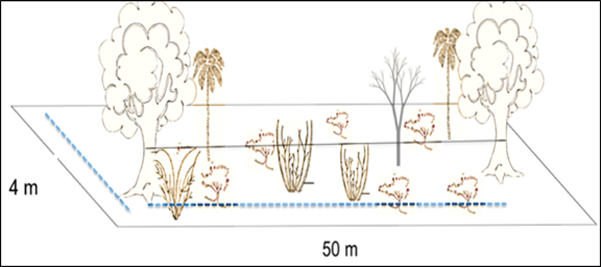
En cada una de las zonas se realizó un inventario florístico, representado por nueve transectos de acuerdo a la metodología propuesta por [27] ISA-JAUM (2001). A cada individuo colectado al lado derecho del transecto se le midieron variables como DAP, Altura total (HT) y Fustal (HF), hábito de crecimiento de la especie y toda la información dendrológica necesaria para su identificación, como presencia de exudados, olores, entre otros [28] , [29] . Al lado izquierdo solo se colectaron muestras botánicas de las especies que tuvieran un DAP mayor a 2,5 cm (figura 2).
Para el proceso de herborización (colecta, secado, identificación, e inclusión en el herbario) del material colectado, se aplicó la metodología propuesta por Lisner [30] . Todas las muestras fueron llevadas y depositadas en el herbario de la Universidad Católica de Oriente (HUCO).
Para la descripción de la estructura de la vegetación del bosque y resaltar las especies más representativas de la zona, se tuvo en cuenta el número de estratos (estructura vertical) mediante hábitos de crecimiento y perfiles esquemáticos empleando la información de uno de los transectos. Para esto se siguió la metodología propuesta por Rangel y Lozano [31] ajustada para ecosistemas andinos, en la cual se contemplan los siguientes tipos de estratos: arbustivo (1,5-5 m.); subarbóreo (5-12 m.); arbóreo inferior (12-25 m.) y arbóreo superior (25-28 m.). La estructura horizontal del bosque se describe a partir de la distribución del número de árboles por clase diamétrica [32] .
Para cuantificar la diversidad dentro del bosque se calcularon los índices de diversidad de Shannon, Simpson y Margalef. Además, con el fin de analizar el predominio de las especies en las diferentes zonas de estudio se calculó el índice de valor de importancia (IVI) de acuerdo a la metodología propuesta por Curtis and Mcintosh [33] .
Especies pioneras y persistentes.
Las especies de árboles y arbustos encontradas, se separaron en dos grupos ecológicos, de acuerdo a su estado sucesional (pioneras y no pioneros o persistentes), todo esto basado en la autoecología y la ocupación de cada especie dentro del bosque o su regeneración, basado en la metodología propuesta por Martínez-Ramos et al. [20] . Las especies pioneras fueron asociadas a grandes claros, áreas intervenidas, luz directa, o cercanía a cultivos y carreteras. Las especies persistentes (no pioneras) fueron asociadas a las encontradas en el interior del bosque donde se observaron también plántulas que se desarrollaban con el dosel cerrado y con bajos requerimientos de luz. A su vez, fueron incluidas aquellas que se encontraban en claros pequeños, con baja intensidad de luz solar directa.
Frutos y semillas
Muestreo de frutos. Se realizaron visitas periódicas a todas las zonas, realizando en ellas observaciones de campo e identificando las plantas que presentaban fructificación. Una vez reconocidas las plantas fructificadas, se tomaron datos de interés para la identificación de estas, tales como: altura de la planta, DAP, número de frutos por planta, color del fruto, exudados, olores, entre otros. Toda esta información fue diligenciada en formatos previamente elaborados, para posteriormente realizar el debido registro fotográfico tanto de la planta, como del fruto y la semilla. Cada individuo fue colectado utilizando cinta adhesiva y bolsas de papel previamente marcadas con el número de colecta y lugar, para ser llevado y procesado en el Herbario de la Universidad Católica de Oriente (HUCO). Una vez en el laboratorio, se realizaron mediciones y cortes transversales de cada uno de ellos, con el objetivo de visualizar diferentes aspectos morfológicos y tipos de frutos. Los frutos fueron clasificados como secos, carnosos, dehiscentes e indehiscentes, dando así un adecuado manejo de las semillas. En el caso de los frutos dehiscentes se esperó un poco más de tiempo para que liberaran naturalmente las semillas [34] .
Conteo de semillas. Las semillas de cada fruto colectado, fueron cuidadosamente disectadas, teniendo en cuenta el número de semillas por fruto y otros aspectos morfológicos tales como: tamaño, color, textura y presencia de arilo u otro tipo de exudados. Las semillas extraídas fueron lavadas para así retirar los restos de arilo o endocarpio y evitar la aparición de hongos, secándose a temperatura ambiente. Para finalizar se realizó el registro fotográfico de todas las semillas extraídas, las cuales, fueron almacenadas en bolsas plásticas herméticas con un duplicado para la colección de semillas del Herbario Universidad Católica de Oriente (HUCO) y algunas fueron seleccionadas para realizar las pruebas de germinación.
Pruebas de germinación. Las semillas fueron secadas en el horno por 1 minuto con el fin de esterilizarlas. Algunas semillas se sembraron en medios esterilizados como papel filtro o algodón dentro de cajas de Petri. En dichos medios fueron sembradas 10 semillas por fruto y cada caja fue marcada con el respectivo código de colecta y de especie. Para dar lugar a la germinación, las semillas permanecieron a temperatura ambiente y con la luz solar indirecta durante el día. La hidratación de las mismas se realizaba cada tres días por medio de un gotero y una vez iniciado el proceso de germinación de las semillas, la fecha de germinación y el número de semillas germinadas fueron registrados en la libreta de campo e incluidos en una base de datos.
Análisis de datos
Para cuantificar la diversidad alfa dentro del bosque se calcularon los índices de diversidad de Shannon, Simpson y Margalef. Los cálculos anteriores se realizaron mediante el software Biodiversity-Pro, [35] [36] . Además, se determinó el índice de valor de importancia (IVI) [33] y se realizaron perfiles de vegetación, con el fin de hacer análisis estructurales y florísticos de cada zona.
RESULTADOS
Riqueza y Composición florística del área de estudio
En total en el bosque se encontraron 291 individuos distribuidos en 162 especies, 83 géneros y 54 familias. Datos similares encontró Ocaña-Figueroa [37] en bosques andinos de Santander, evidenciando 128 especies, 78 géneros y 41 familias. De acuerdo a los datos, el área 3 y el área 1, presentaron una mayor cantidad de especies, con valores de 75 y 74 respectivamente, por el contrario, el área 2, presentó el número más bajo de especies, 43 en total (tabla 2).
Tabla 2 Número de familias, géneros y especies de cada zona
| Zona | Familia | Géneros | Especies |
| 3 | 37 | 51 | 75 |
| 2 | 27 | 36 | 43 |
| 1 | 34 | 51 | 74 |
Las familias más representativas encontradas para todas las áreas fueron: Aquifoliaceae (1 género y 5 especies), Asteraceae (5 géneros y 7 especies), Clusiaceae (2 géneros y 5 especies), Ericaceae (4 géneros y 8 especies), Melastomataceae (6 géneros y 16 especies) y Rubiaceae (2 géneros y 10 especies). Los géneros más frecuentes fueron: Cavendishia (4 especies), Clusia (4 especies), Ilex (5 especies), Miconia (11 especies) y Palicourea (9 especies). Si bien las características de cobertura de copa, estructura vertical y diversidad de vegetación en las tres zonas son muy diferentes (figuras 3, 4 y 5), se encontraron cinco especies comunes entre ellas, las cuales fueron: Clethra fagifolia, Clusia multiflora, Cavendishia pubescens, Palicourea angustifolia y Vismia laevis.
De las especies encontradas durante el inventario florístico, se destacan dos nuevos registros para la ciencia en el género Schefflera (Araliaceae), las cuales se encuentran en proceso de descripción. Así mismo se han encontrado especies de palmas y orquídeas que se encuentran registradas en los libros rojos a nivel nacional como es el caso de: Ceroxylon quindiuense (EN), Bactris coloniata (LC), Euterpe precatoria (LC), Geonoma undata (NT) y Miltoniopsis vexillaria (VU) [38] .
Índices de riqueza y diversidad
El bosque en general refleja alta diversidad beta, pues al comparar las tres áreas, se aprecia una marcada diferenciación entre las especies encontradas.
Como se mencionó anteriormente solo cinco especies de las 162 se encuentran en todas las áreas. En cuanto al índice de Simpson, se encontraron valores superiores a 0.9, lo que sugiere que no existe un predominio marcado de pocas especies. El índice de Shannon también arrojó valores importantes ya que dos de los sitios evaluados, área C (Bosque conservado) y área A (Bosque intervenido) presentaron datos superiores a 3.3, lo que refleja una considerable diversidad. En cuanto al índice de Margalef, todas las áreas evaluadas presentaron alta diversidad con valores superiores a 2.0. Cuando los datos son inferiores a esta cantidad, pueden ser consideradas como áreas de baja riqueza específica [39] . Se aclara que el área B (Bosque medianamente intervenido) presentó valores inferiores en todos los índices con respecto a los demás sitios (tabla 3).
Tabla 3 Índices de Diversidad
| Índice | Conservado | Medianamente intervenido | Intervenido |
|---|---|---|---|
| Simpson | 0.960 | 0.935 | 0.965 |
| Shannon | 3.324 | 2.804 | 3.414 |
| Margalef | 8.184 | 5.584 | 8.794 |
En cuanto a los resultados del índice de valor de importancia, fueron seleccionadas 10 especies con valores sobresalientes, de las cuales las de mayor IVI fueron Miconia resima y Palicurea angustifolia. En general estas 10 especies, son claves para el área de estudio, debido a la alta densidad y frecuencia que presentan. Además, P. angustifolia, C. pubescens, C. multiflora, C. fagifolia, y V. laevis son comunes en las tres áreas muestreadas (tabla 4).
Tabla 4 Índice de Valor de Importancia
| Familia | Nombre científico | IVI |
|---|---|---|
| Melastomataceae | Miconia resima | 5.13 |
| Rubiaceae | Palicourea angustifolia | 4.90 |
| Rubiaceae | Palicourea garciae | 4.49 |
| Ericaceae | Cavendishia pubescens | 4.49 |
| Clusiaceae | Clusia multiflora | 4.49 |
| Clusiaceae | Clusia ducuoides | 4.07 |
| Clethraceae | Clethra fagifolia | 3.42 |
| Hypericaceae | Vismia laevis | 3.19 |
| Aquifoliaceae | Ilex danielis | 3.19 |
| Rubiaceae | Ladenbergia macrocarpa | 2.78 |
Características generales de cada zona.
Suelos
Los análisis físico químicos, corroboran en parte el deterioro del suelo en el área 1, con los valores más bajos en materia orgánica, P, y N-N03 (tablas 5y 6), comparada con las demás, esta área presentó disminución en todos los parámetros. Por ejemplo, el pH fue de 5,4 en comparación con el pH de 4,3 de los otros sitios, esto es debido posiblemente al uso del suelo (tabla, 5).
Tabla 5 Parámetros químicos de las tres áreas de estudio.
| Parámetros químicos | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| pH | N-N03 | P | S | Fe | Cu | Zu | B | ||||
| 1 | 5.4 | 7.7 | 0.675 | 7 | 4 | 90 | 12 | 5 | 8 | 0.01 | |
| 2 | 4.3 | 11.4 | 29 | 9 | 3 | 1 | 21 | 1 | 0.01 | ||
| 3 | 4.3 | 15.2 | 26 | 3 | 1 | 21 | 1 | 0.01 | |||
pH suelo: 1:1 (v.) pH-metro; Materia Orgánica (M.O.): Walkley & Black; Al extractable: 1M KCl; Ca, Mg, K: 1M Acetato de amonio pH 7; capacidad de intercambio catiónico efectiva (C.E.C). Fe: Olsen-EDTA.
Como se esperaba, el área 1 presento la mayor densidad aparente, este valor fue bajando a medida que disminuía la intervención (tabla 6).
COMPOSICIÓN FLORÍSTICA
Área 1
En esta área fue frecuente encontrar suelos desnudos, lo que favorece la erosión del suelo y cambios bruscos de temperatura. La flora documentada tuvo un predominio de arvenses y arbustos (figura 3) que fue clasificada en estrato herbáceo, arbustivo y subarbóreo. A continuación, se presentan las especies en cada estrato.
Estrato herbáceo: Ageratina popayanensis, Ageratum conyzoides, Anthurium angosturense, Anthurium cupreum, Baccharis brachylaenoides, Burmeistera glabrata, Cavendishia Sp2, Cavendishia Sp1 , Chrysochlamys colombiana, Clethra fagifolia, Clusia ducuoides,, Clusia multiflora, Columnea consanguínea, Elleanthus aurantiacus, Emilia sonchifolia, Erato vul-canica, Guzmania multiflora, Hesperomeles obtusifolia, Ilex danielis, Lonicera japónica, Mezobromelia capituligera, Miconia jahnii, Miconia Sp, Monochaetum multiflorum, Myrsine coriácea, Nastus chusque, Palicourea angustifolia, Palicourea aschersonianoides, Palicourea demissa, Palicourea garciae, Piper artanthe, Psammisia breviflora, Rubus bogotensis, Rubus guyanensis y Vismia laevis.
Estrato arbustivo: Ageratina popayanensis, Baccharis latifolia, Bejaria aestuans, Billia rosea, Cavendishia angustifolia, Cavendishia pubescens, Clethra fagifolia, Cyathea caracasana, Cybianthus iteoides, Disterigma acuminatum, Drimys granadensis, Graffenrieda emarginata, Hedyosmum bonplandianum, Hieronyma antioquensis, Hypericum juniperinum, Ilex danielis, Ilex laurina, Ilex pernervata, Ladenbergia macrocarpa, Miconia affinis, Miconia resima, Miconia theaezans, Monnina fastigiata, Morella pubescens, Myrsine coriácea, Myrsine pellucida, Oreopanax bogotensis, Palicourea demissa, Palicourea garciae.
Estrato subarboreo: Aegiphila alba, Axinaea macrophylla, Brunellia goudotii, Clusia alata, Clusia ducuoides, Escallonia paniculata, Ilex kunthiana, Palicourea apicata, Vismia laevis.
Área 2
Esta área se encuentra moderadamente intervenida y es frecuente encontrar grupos de árboles conformando un dosel, al igual que claros de tamaño variable (figura 4). Entre las especies presentes en este sitio, se destacan por su abundancia: Axinaea macrophylla, Cavendishia pubescens y Vismia laevis. No hay presencia de estrato herbáceo y las especies presentes en el estrato arbustivo y el estrato subarbóreo son mostradas a continuación.
Estrato arbustivo: Aegiphila alba, Axinaea macrophylla, Baccharis brachyphylla, Bactris coloniata, Casearia quinduensis, Cavendishia pubescens, Clethra fagifolia, Clusia alata, Clusia ducuoides, Clusia multiflora, Drimys granadensis, Euterpe precatoria, Gaiadendron punctatum, Graffenrieda emarginata, Hedyosmum goudotianum, Ilex danielis, Ilex laurina, Meriania nobilis, Miconia wurdackii, Myrcia tomentosa, Ocotea kunthiana, Palicourea angustifolia, Palicourea demissa, Scheffleraferruginea, Tibouchina lepidota, Varronia cylindrostachya y Viburnum antioquiense.
Estrato subarbóreo: Axinaea macrophylla, Billia rosea, Clusia ducu, Cybianthus marginatus, Geonoma undata, Graffenrieda emarginata, Hedyosmum goudotianum, Hieronyma huilensis, Myrcia tomentosa, Myrsine coriacea, Palicourea angustifolia, Palicourea garciae.
Área 3
Esta área es la mejor conservada y su perfil vertical está compuesto por cuatro estratos: estrato arbustivo, estrato subarbóreo, estrato arbóreo superior y estrato arbóreo inferior (figura 5). Se destacan por su abundancia las especies: Palicourea angustifolia, Miconia resima, Clethra fagifolia y Alchornea latifolia. A continuación, se muestran las especies presentes en cada estrato.
Estrato arbustivo: Alchornea latifolia, Aniba riparia, Annona quinduensis Kunth, Billia rosea, Cavendishia pubescens, Clethrafagifolia, Cyathea andina, Cyathea caracasana var. Meridensis, Elleanthus Sp, Hedyosmum bonplandianum, Ilex danielis, Lacepedea pinnata, Ladenbergia macro-carpa, Meriania nobilis, Miconia asperrima, Miconia lehmannii, Miconia ligustrina, Miconia resima. Miconia resima, Monnina aestuans, Morella parvifolia, Myrciafallax, Myrsine coriácea, Palicourea acetosoides, Palicourea angustifolia, Palicourea garciae, Palicourea guianensis, Palicourea thyrsiflora, Piper calceolarium, Saurauia chiliantha, Schefflera quinduensis, Symplocos phaeoneura, Tapura colombiana, Tontelea attenuata, Varronia cylindrostachya.
Estrato subarbóreo: Alchornea latifolia, Alchornea verticilata, Aniba riparia, Annona quinduensis, Axinaea macrophylla, Billia rosea, Cavendishia pubescens, Chamaedorea liebmannii, Clethra fagifolia, Clusia alata, Clusia ducuoides, Clusia multiflora, Cyathea divergens, Hieronyma antioquensis, Ilex danielis, Ilex laurina, Ilex pustulosa, Lacepedea pinnata, Meriania nobilis, Miconia dolichopoda, Miconia ligustrina, Miconia resima, Morella parvifolia, Myrcia tomentosa, Nectandra lineata, Palicourea angustifolia, Palicourea garciae, Piper archeri, Piper calceolarium, Sapium stylare, Schefflera trianae, Viburnum anabaptista, Viburnum undulatum, Vismia baccifera, Vismia laevis, Weinmannia pubescens, y Zanthoxylum melanostictum.
Estrato arbóreo inferior: Alchornea latifolia, Alchornea verticilata, Ceroxylon quindiuense, Chamaedorea liebmannii, Conceveibaparvifolia, Graffenrieda emarginata, Hieronyma antioquensis y Myrcia tomentosa.
Estrato arbóreo superior: Conceveiba parvifolia.
Especies pioneras y persistentes encontradas
En restauración ecológica, es usual focalizar un ecosistema de referencia, en este caso, un bosque para entender de este la dinámica arbórea, la composición, función, y estructura [40] . Esa información es generalmente utilizada para la selección de especies con potencial para la restauración. Por lo general los restauradores utilizan especies pioneras en sus proyectos, ya que estás crecen rápidamente, son heliófilas, y se adaptan más fácilmente a condiciones adversas. En este estudio, se clasificaron 42 especies de árboles en dos grupos, pioneras y persistentes (no pioneras) (tabla 7).
Tabla 7 Árboles pioneros y persistentes encontrados
| Nombre Científico | Familia | Grupo ecológico |
|---|---|---|
| Aegiphila alba Moldenke | Lamiaceae | Pionera |
| Alchornea latifolia Sw. | Euphorbiaceae | Persistente |
| Alchornea verticilata Renteria y Franco | Euphorbiaceae | Persistente |
| Annona quinduensis Kunth | Annonaceae | Persistente |
| Axinaea macrophylla (Naudin) Triana | Melastomataceae | Persistente |
| Billia rosea (Planch. & Linden) C. Ulloa & P. Jerg. | Sapindaceae | Persistente |
| Brunellia goudotii Tul. | Brunelliaceae | Pionera |
| Ceroxylon quindiuense (H. Karst.) H. Wendl. | Arecaceae | Persistente |
| Chamaedorea liebmannii Mart. | Arecaceae | Persistente |
| Clethra fagifolia Kunth | Clethraceae | Persistente |
| Clusia alata Planch. & Triana | Clusiaceae | Pionera |
| Clusia multiflora Kunth | Clusiaceae | Pionera |
| Conceveiba parvifolia McPherson | Euphorbiaceae | Persistente |
| Cyathea andina (H. Karst.) Domin | Cyatheaceae | Persistente |
| Cyathea caracasana var. meridensis (H. Karst.) R.M. Tryon | Cyatheaceae | Persistente |
| Cyathea divergens Kunze | Cyatheaceae | Persistente |
| Cybianthus marginatus (Benth.) Pipoly | Primulaceae | Pionera |
| Graffenrieda emarginata (Ruiz & Pav.) Triana | Melastomataceae | Persistente |
| Hieronyma antioquensis Cuatrec. | Phyllanthaceae | Persistente |
| Hieronyma huilensis Cuatrec. | Euphorbiaceae | Persistente |
| Ilex pustulosa Triana | Aquifoliaceae | Persistente |
| Ladenbergia macrocarpa (Vahl) Klotzsch | Rubiaceae | Pionera |
| Meriania nobilis Triana | Melastomataceae | Pionera |
| Miconia lehmannii Cogn | Melastomataceae | Pionera |
| Myrcia tomentosa (Aubl.) DC. | Myrtaceae | Persistente |
| Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. | Primulaceae | Pionera |
| Nectandra lineata (Kunth) Rohwer | Lauraceae | Persistente |
| Palicourea acetosoides Wernham | Rubiaceae | Persistente |
| Palicourea angustifolia Kunth | Rubiaceae | Pionera |
| Piper calceolarium C. DC. | Piperaceae | Persistente |
| Prunus integrifolia (C. Presl) Walp. | Rosaceae | Persistente |
| Sapium stylare Müll. Arg. | Euphorbiaceae | Persistente |
| Schefflera ferruginea (Willd. ex Schult.) Harms | Araliaceae | Pionera |
| Schefflera trianae (Planch. & Linden ex Marchal) Harms | Araliaceae | Pionera |
| Solanum nutans Ruiz & Pav. | Solanaceae | Pionera |
| Symplocosphaeoneura B. Stãhl | Symplocaceae | Persistente |
| Tontelea attenuata Miers | Celastraceae | Persistente |
| Varronia cylindrostachya Ruiz & Pav. | Boraginaceae | Persistente |
| Vismia baccifera (L.) Triana & Planch. | Hypericaceae | Pionera |
| Vismia laevis Triana & Planch. | Hypericaceae | Pionera |
| Zanthoxylum melanostictum Schltdl. & Cham. | Rutaceae | Persistente |
| Zanthoxylum monophyllum (Lam.) P. Wilson | Rutaceae | Persistente |
Como se puede observar en la tabla 7, en las áreas 1 y 2 hubo un predominio de especies pioneras, esto se debe principalmente a la aparición de claros de tamaño variable, favoreciendo a este grupo ecológico. En estas especies la floración y fructificación fueron constantes a lo largo de los muestreos realizados [41]
Frutos y semillas
Se colectaron aproximadamente 114 frutos en las tres áreas muestreadas, de los cuales a 100 frutos fue posible extraerles las sus semillas para pruebas de germinación. Cuarenta especies presentaron germinación con valores que oscilan entre el 10 y el 100%, mientras que en las semillas de 60 especies la germinación fue nula (tabla 8). La baja germinación o la ausencia de esta se debió en su mayoría a la contaminación de las semillas en el proceso de almacenamiento y en las cajas de Petri, ya que a pesar de que se realizó esterilización de los medios y de las semillas se observó en repetidas ocasiones la presencia de hongos. En el área 1 y 2 se encontró un mayor número de frutos y semillas, posiblemente debido al predomino de arvenses y arbustos, entre los cuales las arvenses presentaron porcentajes de germinación por encima del 90%. En la tabla 8 solo se presentan datos principalmente de árboles y arbustos, debido a que estos son más frecuentemente usados en procesos de restauración ecológica.
Tabla 8 Generalidades de algunas especies estudiadas.
| Especie | Habito Crecimiento | Tamaño fruto (cm) Largo/ Ancho | Semillas por fruto | Tamaño semilla (mm) Largo/ Ancho | Germinación (%) | Zona colecta |
|---|---|---|---|---|---|---|
| Coccocypselum hirsutum | Hierba | 1.7/0.7 | 8 | 1.5/1.0 | 90 | Z1 |
| Galium hypocarpium | Hierba | 0.4/0.5 | 2 | 2.0/1.5 | 60 | Z1 |
| Morella pubescens | Arbusto | 0.5/0.5 | 1 | 3.0/2.5 | 70 | Z1 |
| Miconia myrtillifolia | Arbusto | 0.9/1.0 | Más de 1000 | 0.5/0.25 | 90 | Z1 |
| Cavendishia guatapeensis | Arbusto | 0.5/1.0 | Entre 200-300 | 1.0/0.5 | 0 | Z1 |
| Vismia laevis | Arbusto | 1.6/0.9 | 35 | 1.5/1.0 | 0 | Z1 |
| Macrocarpea macrophylla | Arbusto | 2.4/0.7 | Más de 1,000 | 0.6/0.5 | 10 | Z1 |
| Monnina solandrifolia | Arbusto | 0.5/0.3 | 1 | 5.0/2.1 | 0 | Z1 |
| Cladocolea archeri | Parásita | 0.5/0.4 | 1 | 5.0/3.0 | 0 | Z1 |
| Shefflera sp | Árbol | 0.6/0.4 | 3 | 3.0/1.2 | 0 | Z1 |
| Centropogum sp. | Hierba | 2.6/3.5 | 250 A 300 | 1.0/0.5 | 100 | Z1 |
| Blakea albertiae | Árbol | 0.9/1.0 | 200 | 1.2 /1.0 | 0 | Z1 |
| Miconia resima | Árbol | 0.4/0.2 | 200 | 0.1/0.2 | 0 | Z1 |
| Cybianthus iteoides | Arbusto | 0.6/0.3 | 1 | 1.0/1.0 | 0 | Z1 |
| Palicourea apicata | Arbusto | 0.7/0.6 | 2 | 5.0/4.5 | 0 | Z1 |
| Dendrophtora linteniana | Trepadora | 0.5/0.4 | 1 | 2.0/1.0 | 0 | Z1 |
| Varronia cylindrostachya | Arbusto | 0.5/0.5 | 1 | 3.0/3.0 | 0 | Z1 |
| Nertera granadensis | Hierba Rastrera | 0.6/0.6 | 2 | 3.0/2.0 | 0 | Z1 |
| Psammisa sp. | Arbusto | 0.4/0.4 | 60 A 70 | 0.5/0.5 | 0 | Z2 |
| Burmeistera glabrata | Hierba | 2.0/2.5 | 600 A 700 | 1.0/0.5 | 90 | Z2 |
| Glossoloma sp. | Hierba | 1.4/1.3 | 200 | 1.0/0.5 | 80 | Z2 |
| Cavendishia antioquensis | Arbusto | 1.1/1.6 | 300 A 350 | 1.0/1.0 | 90 | Z2 |
| Piper artanthe | Arbusto | 0.1/0.1 | 1 | 1.0/1.0 | 0 | Z2 |
| Burmeistera muntipomunn | Hierba | 2.5/3.2 | más de 500 | 0.5/1.0 | 0 | Z2 |
| Agertaina popayanensis | Hierba | - | 1 | 2.0/0.5 | 20 | Z2 |
| Clusia alata | Árbol | 3.8/2.8 | 10 | 7.0/3.0 | 0 | Z2 |
| Pitcairnia basicurva | Hierba | 2.3/0.8 | Más de 1,000 | 6.0/0.2 | 0 | Z2 |
| Satyra warszewiczii | Arbusto | 1.5/0.8 | 30 A 40 | 1.0/0.5 | 0 | Z2 |
| Cavendishia | Arbusto | 0.6/0.8 | 30 | 2.0/0.9 | 0 | Z2 |
| Centropogum sp. | Hierba | 1.7 /2.0 | más de 500 | 1.0/1.0 | 0 | Z2 |
| Cavendichia angustifolia | Arbusto | 0.7/0.8 | 200 A 300 | 0.8/0.5 | 0 | Z2 |
| Hierba | 0.9/0.5 | 20 | 2.0/3.5 | 0 | Z3 | |
| Vismia sp. | Arbusto | 2.2/1.0 | Entre 13 y 15 | 3.0/1.0 | 0 | Z2 |
| Palicourea aschersonianoides | Hierba | 1.0/1.2 | 2 | 4.0/2.5 | 0 | Z2 |
| Cavendishia adenophora | Arbusto | 3.0/1.0 | Más de 200 | 1.0/0.6 | 0 | Z2 |
| Capsicum annuum | Hierba | 0.6/0.8 | 20 | 2.0/1.5 | 75 | Z2 |
| Hesperometes obtusifolia | Arbusto | 0.7/0.7 | 5 | 5.0/2.5 | 80 | Z2 |
| Clusia ducoides. | Árbol | 5.3/3.1 | 12 | 5.0/2.5 | 0 | Z2 |
| Bomarea angustipetala | Hierba | 5.0/6.0 | 10 | 4.0/3.0 | 0 | Z2 |
| Macrocarpea sp. | Arbusto | 2.4/0.7 | Más de 1,000 | 0.6/0.5 | 90 | Z2 |
| Disterigma acuminatum | Arbusto | 0.6/0.8 | 10 | 0.8/0.1 | 0 | Z2 |
| Cavendishia sp. | Arbusto | 0.1/0.5 | 200 | 1.0/0.8 | 40 | Z2 |
| Miconia cladonia | Arbusto | 1.2/1.1 | 100 | 1.0/0.5 | 40 | Z2 |
| Symbolanthus pterocalyx | Arbusto | 8.5/5.3 | 500 A 600 | 1.0/0.5 | 70 | Z2 |
| Axinaea macrophylla | Arbusto | 0.7/1.1 | 300 | 1.0/0.5 | 60 | Z2 |
| Cavendishia bracteata | Arbusto | 1.5/1.1 | 300 | 1.0/0.5 | 0 | Z2 |
| Cyclanthus sp. | Hierba | 3.0/1.0 | 22 | 1.4/0.8 | 0 | Z2 |
| Tibouchina kingii | Hierba | 0.5/0.3 | 100 | 0.6/0.4 | 80 | Z1 |
| Symplocos sp. | Parásita | 0.2/0.1 | 1 | 4.0/3.0 | 0 | Z1 |
| Hepifita | 0.6/0.4 | 1.0/0.3 | 100 | Z1 | ||
| Ilex caliana | Arbusto | 0.4/0.2 | 4 | 2.0/1.2 | 0 | Z1 |
| Viburnum | Arbusto | 0.6/0.6 | 1 | 1.3/4.5 | 0 | Z1 |
| Burmeistera motipomum | Arbusto | 5.2/2.3 | más de 500 | 0.8/0.1 | 20 | Z1 |
| Guzmania conifera | Hepífita | 4.2/0.5 | más de 500 | 0.2/0.1 | 0 | Z2 |
| Blakea calyptrata | Arbusto | 1.1/1.0 | más de 500 | 1.1/0.8 | 30 | Z2 |
| Palicurea sp. | Arbusto | 0.4/0.2 | 60 | 5.0/3.1 | 0 | Z2 |
| Solanum oblongifolium | Arbusto | 1.5/1.2 | Más de 200 | .1/2.8 | 100 | Z2 |
| Vaccinium meridionale | Arbusto | 6.5/7.2 | Más de 500 | 1.5/1.0 | 10 | Z2 |
| Varronia cylindrostachya | Arbusto | 0.5/0.4 | 1 | 7.0/4.0 | 0 | Z2 |
| Saurauia chiliantha | Arbusto | 1.5/1.4 | Más de 300 | 1.3/1.0 | 20 | Z2 |
| Miconia legmanii | Arbusto | 0.4/0.5 | 6.0/0.5 | 10 | Z2 | |
| Gaiandendron emarginata | Arbusto | 1.4/1.1 | 1 | 5.0/3.0 | 0 | Z2 |
| Ilex laurina | Arbusto | 0.5/0.6 | 4 | 4.0/1.5 | 0 | Z2 |
| Racinaea penlandii | Hepífita | 1.4/0.3 | 10 | 2.0/0.1 | 0 | Z2 |
| Meriania nobilis | Arbusto | 2.0/1.8 | Más de 500 | 2.0/0.7 | 60 | Z2 |
| Cavendishia pubescens | Arbusto | 0.8/0.8 | 150 | 1.0/0.1 | 10 | Z2 |
| Meriania nobilis | Arbusto | 2.0/1.8 | 300 | 2.0/1.0 | 20 | Z1 |
| Disterigma alaternoides | Arbusto | 0.1/0.1 | 100 | 2.0/1.0 | 10 | Z1 |
DISCUSIÓN
Conocer la flora de los bosques cercanos a las áreas a restaurar, es muy importante, ya que en muchos casos es de las pocas opciones que se tienen para conocer cuales especies estaban presentes en el área afectada. De acuerdo con Vargas et al. [40] , definir un ecosistema de referencia no es sencillo, ya que depende de las descripciones ecológicas y listados de especies antes de la perturbación. La información florística aquí obtenida, esta corroborada por otros estudios en bosques andinos [37] , [42] , [43] . Asimismo, de acuerdo a Barrera et al. [44] la caracterización de la vegetación vascular, permite el desarrollo de estrategias de restauración, lo que finalmente contribuirá al equilibrio de los ecosistemas disturbados.
Desde el punto de vista de la composición, estudios realizados en los cerros orientales de Bogotá, arrojaron promedios de 3.61 para el índice de Shannon y 0.97 para el índice de Simpson [45] , lo que concuerda con los resultados aquí obtenidos (tabla 3). Esto es posiblemente debido a que ambos estudios se realizaron en condiciones ambientales similares.
Es interesante anotar que C. multiflora, y otras especies del género Vismia, han sido reportadas con valores de IVI altos en bosques andinos de Santander [37] . Otros autores han sugerido el uso de individuos del género Vismia para revegetalizar áreas degradadas en combinación con algunas arvenses [46] . Además, especies de las familias Rubiaceae, Melastomataceae, Lauraceae, Arecaceae y Euphorbiaceae, fueron encontradas con frecuencia en las áreas 1 y 2, algunas en áreas con claros grandes, dinámica ya reportada por Rincón-Velázquez et al. [43] .
El conocimiento de la sucesión vegetal y los grupos ecológicos a partir de los ecosistemas de referencia [40] , han facilitado el trabajo de los restauradores. Algunos autores lo han denominado el enfoque sucesional, porque permite predecir la dinámica de las especies en el corto y largo plazo, lo que facilita sugerir las futuras trayectorias del modelo propuesto [47] . Un método frecuentemente utilizado consiste en establecer un grupo pequeño de especies pioneras (como las que se presentan en la tabla 7) que produzcan rápidamente una cubierta de copas. En este modelo, la sombra se encarga de controlar malezas y pastos, y permite la colonización de nuevas especies procedentes de bosques cercanos [48] . Pero no solo las especies pioneras son adecuadas para la restauración, mezclas de diferentes grupos ecológicos han sido utilizadas con éxito [49] , incluso en Brasil han incursionado implementando el enfoque fitosociológico para la restauración, que incluye a todos los grupos ecológicos con excelentes resultados [47] . Se debe tener en cuenta que la selección de especies debe ser acorde a las particularidades de cada caso, porque dependen del estado del área a restaurar (factores bióticos y abióticos), historia de usos del suelo, resiliencia del ecosistema, y el contexto del paisaje [50] . No tener identificados los disturbios, y una definición clara de lo que se quiere alcanzar en restauración genera errores que pueden afectar negativamente las trayectorias deseadas. Por ejemplo, en Sao Pablo Brasil se presentó un caso emblemático de fracaso al seleccionar las especies. En esta experiencia los investigadores utilizaron especies pioneras en áreas muy degradadas, las cuales estaba aisladas de bosques nativos. Este aislamiento generó una sucesión arrestada debido a que no llegaban propágulos del exterior a los sitios y finalmente la mayoría de las especies murieron [47] . En este caso, los investigadores omitieron el aislamiento de las áreas y por eso la selección de especies no fue la adecuada. En conclusión, la definición de especies debe ser una decisión de los restauradores, que será basada en las condiciones del sitio, y el conocimiento que se tenga sobre el estado del ecosistema que se va a restaurar.
Pero no basta con seleccionar bien las especies para la restauración, también es importante conocer de manera integral el comportamiento y manejo de las especies nativas que serán utilizadas en el ecosistema, además, obtener de forma masiva propágulos de especies nativas, no es tarea fácil [51] . A partir de fuentes semilleras procedentes de ecosistemas de referencia, se puede adquirir información que ayude suplir las necesidades que requiera el restaurador [52] y también se facilita la iniciación de estudios de ecología básica de semillas como los aquí propuestos, que incluyen porcentajes de germinación, tamaños de frutos y semillas, y cantidad de semillas producidas. Existe una experiencia muy interesante en la mata atlántica brasilera, en donde se quiere restaurar 15 millones de hectáreas de bosque tropical en 40 años, su estrategia se basa en tecnología efectiva que se somete a mejoras permanentes, enseñanza continua, esfuerzos de divulgación y desarrollo de capacidades, presencia de intelectuales locales, mantenimiento de un entorno legal claro y transparente y presencia de instrumentos económicos e incentivos efectivos para los propietarios de tierras. En esta iniciativa, cada comunidad maneja los ecosistemas de referencia, y en compañía de los investigadores seleccionan y manejan las especies que se utilizaran de forma específica en cada área a restaurar [53] .
CONCLUSIONES
De acuerdo con las características generales del área de estudio, el bosque estudiado sería un buen ecosistema de referencia para futuros proyectos de restauración ecológica en el oriente antioqueño. Debido a que cuenta con una buena disponibilidad de propágulos tanto de árboles como de arbustos pioneros y persistentes, lo cual se traduce en materia prima para dotar viveros de conservación, y a su vez, se garantizaría la producción masiva de plántulas acordes a las necesidades del restaurador.
Trabajos como este muestran que es posible pensar en una propagación exitosa de especies silvestres en este tipo de ecosistemas. Es necesario generar protocolos de propagación de especies nativas en estos bosques con miras a la selección de especies, que contribuyan en procesos de restauración ecológica y no simplemente de reforestación.