INTRODUCCIÓN
El marlo es un material de desecho lignocelulósico, procedente de la planta de maíz [1,2]. Generalmente, se encuentra en abundancia y se desperdicia o se quema, causando contaminación ambiental sin ningún provecho [3]. Se compone principalmente de celulosa, hemicelulosa, lignina, ceniza y pectina [4,5]. Desde hace décadas, investigaciones acerca de tratamientos de efluentes contaminados con biomasas, comprueban que esta clase de materiales pueden tener valor agregado, ya que funcionan como biosorbentes de bajo costo, para la remoción de detergentes, colorantes, sales, aceite, grasa y metales pesados en solución [6-8]. Sus componentes estructurales proteínicos, polisacáridos o nucleótidos, que a su vez contienen grupos funcionales como carbonilos, carboxilos, hidroxilos y aminos y su estructura física irregular, porosa y con buena área superficial, le confieren la capacidad de atrapamiento de partículas en suspensión sobre su biomasa, mediante procesos de complejación, adsorción física e intercambio iónico [2-4,6].
La unión marlo - metal depende de la morfología, estructura composicional y propiedades químicas de la biomasa y del metal, así como también de las propiedades químicas, temperatura y fuerza iónica del medio [1]. Piboon et al., (2017) demostrado que el tratamientos de remediación de efluentes por métodos de modificación con alcalinizantes fuertes o ácidos orgánicos, pueden alterar la estructura heterogénea de las biomasas, adicionando grupos funcionales que disminuyen la cristalinidad e incrementan el área superficial y la porosidad, por tanto confiriéndole mejores propiedades de remoción de metales [9].
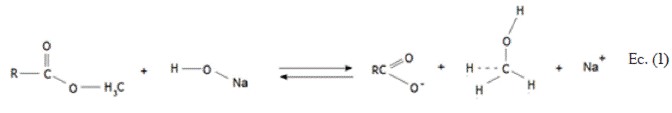
Peñaranda O. et al., (2008), en su estudio de modificación química de almidones, afirman que al modificar biomasas con NaOH se favorece la disposición de grupos hidroxilos dentro de la estructura del marlo y se aumenta el área superficial interna, generando una morfología idónea para el atrapamiento de metales [10]. En otra investigación, Feng et al., (2010) indican que la estructura lignocelulósica de la biomasa contiene ésteres metílicos que se transforman a ligandos de carboxilato, luego de una modificación con NaOH, haciendo que se aumente la capacidad de unión biomasa-metal [11] . En la Ec. (1) se muestra la reacción de hidrólisis básica que sufre dichos ésteres metílicos:
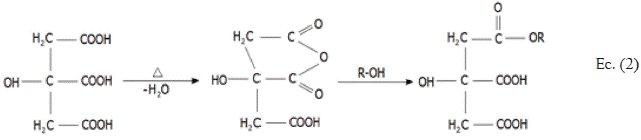
Por otra parte, Goyal étal, (2007) en su investigación acera de la caracterización de la biomasa de maíz modificada con ácido cítrico (C6H8O7) afirma que se obtienen biomateriales eficaces para la remoción de metales, prolongando su ciclo reutilizable [12] [13]. Se le atribuye al anión carboxilato del grupo ácido su capacidad de unión de cationes en la biomasa, ya que este se convierte en un sitio activo para el atrapamiento de los metales [14]. En la Ec. (2) se observa la modificación de la fibra de maíz con C6H8O7, mediante un proceso de carboxilación, en donde el ácido por calentamiento produce un anhídrido cítrico el cual, al estar en mezcla con la biomasa forma un éster, adiciona grupos carboxílicos que posteriormente interactuarán con los iones metálicos de la solución a tratar [15].
Teniendo en cuenta lo expuesto, la biomasa del marlo de maíz se muestra como una alternativa atractiva en la remoción de metales en medios acuosos ya que es abundante, variable, de bajo costo y de fácil acceso [4]. Este tipo de tratamientos podría contribuir con alternativas de solución al gremio minero que mayoritariamente se encuentra interesado en incorporar métodos que minimicen los impactos ambientales generados por los drenajes ácidos de mina (DAM) de una manera económica, sustentable y ambientalmente favorable.
Los DAM de la minería de metales y carbón se consideran una de las principales fuentes de contaminación de los recursos hídricos y suelen ser peligrosos según sus constituyentes metálicos, representando así una amenaza para los ecosistemas y la salud de las personas [16]. Se caracterizan por tener bajos pH y una alta concentración de hierro. Ellos se originan de minas que contienen rocas sulfuradas que al entrar en contacto con el oxígeno y el agua del ambiente, reducen la solubilidad del hierro y liberan ácidos minerales permitiendo la disolución de metales [17].
En general los estudios que emplean marlo de maíz para la remoción de metales en solución se han evaluado a escala de laboratorio (10 - 50 mL), utilizando sistemas "ideales" que permiten uniformidad de las reacciones y reducen la ocurrencia de reacciones secundarias que afectan el proceso [18]. Estos reactores tipo "batch" permiten el control de factores como composición, temperatura y presión durante el tratamiento. Sin embargo, aunque son sistemas comunes en las industrias tienden a ser costosos y no se consideran viables en el tratamiento de aguas, ya que se requiere tratar volúmenes considerables [19].
Este panorama suscita analizar la eficiencia de un lecho empacado con marlo nativo y modificado con NaOH y C6H8O7 para la remoción de hierro contenido en DAM preparados a nivel laboratorio con características muy similares a los drenajes provenientes de la mina de carbón Milpa-2 de la empresa INCARSA LTDA del municipio de Samacá - Boyacá. La evaluación de la eficiencia se hizo mediante el análisis de las interacciones fisicoquímicas marlo - hierro, mientras que la remoción de hierro del DAM se determinó por espectroscopia de absorción atómica (EAA) y los cambios estructurales en la biomasa utilizada por espectroscopia infrarroja con transformada de Fourier (FTIR). Finalmente, la estimación de remoción de hierro en el lecho se hizo acorde a los resultados que se obtuvieron en cada uno de los procesos llevados a cabo.
MATERIALES Y MÉTODOS
Preparación y modificación del marlo de maíz:
Se recolectó 12 Kg de marlo de maíz en una plaza de mercado ubicada en el sur de la ciudad de Tunja capital de Boyacá (Colombia). Se lavó con abundante agua, para eliminar impurezas y se secó a temperatura ambiente por 3 días. Posteriormente, se trituró a un tamaño de partícula -2 +30 (según la serie de tamices Tyler) y, mediante la técnica de cuarteo, se seleccionaron muestras de aproximadamente 2 Kg para los diferentes procesos experimentales.
Las modificaciones del marlo de maíz se llevaron a cabo de acuerdo con el procedimiento propuesto por Altún & Pehlivan (2012) [20]. Inicialmente, se trató la biomasa con una solución de NaOH 1 M en una proporción 0.4 g de marlo a 1.0 mL de solución, llevando la mezcla a una temperatura de 60°C por 24 h. Finalmente, se lavó el producto con agua desionizada y se secó por 24 h a 55°C. Siguiendo el mismo procedimiento anterior, se modificó el marlo con C6H8O7, cambiando la solución de NaOH 1 M por C6H8O7 1 M [2,18].
El marlo de maíz con y sin modificación se caracterizó mediante mediciones de pH en solución acuosa, humedad, densidad aparente, densidad real y porosidad siguiendo los procedimientos descritos por Pintado (2018) [21]. Además, se calculó el porcentaje de incorporación del modificante (% IM) en la biomasa, para lo cual se tomó 4 g de marlo y se suspendió en 50 mL de agua, llevándose a agitación a 100 rpm durante 30 min. El sólido obtenido se recuperó mediante filtración por gravedad, se lavó con agua y se secó a 105°C. El % IM se calcula con la Ec. (3), donde MA representa la cantidad en g de modificante agregado y MR la cantidad en g del modificante recuperado [14].
Por otra parte, la modificación de marlo de maíz se analizó por microscopía electrónica de barrido (SEM), con un equipo Leica - Zeiss LEO 440, tomando micrografías con un transformador de tensión extra alta (EHT) de 20 kV, un detector tipo I (SE1) a una distancia de trabajo de 9 mm, con una escala de 20 μm. También, se determinó cambios composicionales, mediante Espectroscopia Infrarroja con Transformada de Fourier (FTIR), con un equipo Thermo Scientific Nicolet 5300, mediante la técnica de Reflectancia Total Atenuada (ATR), generando espectrogramas con un rango espectral entre 4,000 a 400 cm-1 a una resolución de 4 cm-1 con 32 barridos.
Preparación del drenaje ácido de mina (DAM)
El DAM se preparó, teniendo en cuenta el rango histórico de concentración de hierro y pH de efluentes provenientes una mina de carbón del municipio de Samacá (Boyacá) y lo establecido por Zagury et al. (2006). Para esto, se dejó 2 L de agua en reposo por 24 h, luego se le añadió 1.074 g de CaCO3 y se agitó durante 12 h. Seguidamente, se adicionó el FeSO4•7 H2O (II) (comercial) bajo agitación continua por 24 h hasta obtener la concentración deseada de hierro (2,000 ppm, 1,000 ppm y 500 ppm). Finalmente, se dejó en reposo y se ajustó el pH del DAM a 2.7, empleando una solución acuosa de NaOH 1 M [22].
Ensayos en biorreactores de lecho empacado
Se utilizó un sistema de lecho empacado, el cual constaba de 3 columnas en acrílico de 20 cm de largo por 5 cm de diámetro, con su respectiva conexión de mangueras, empaques y recipientes de recolecta. La biomasa estuvo contenida entre 2 camas de algodón, de aproximadamente 2 cm de espesor, las cuales sirvieron tanto para evitar la obstrucción del sistema, como para garantizar una distribución uniforme del DAM a través del lecho empacado. Cada lecho empacado fue de 40 g de biomasa, compuesto por marlo de maíz modificado (con NaOH y C6H8O7) o sin modificar, por el cual se filtró DAM sintético, a tres concentraciones de hierro: 500 ppm, 1,000 ppm y 2,000 ppm.
Todos los ensayos se hicieron por triplicado y tuvieron 3 etapas de proceso: (i) empaque y adecuación del marlo, a fin de eliminar posibles agentes solubles que hayan resultado en su modificación, (ii) fase de filtrado, donde se pasaron 2,000 mL de DAM a través del lecho, a un caudal de 5 mLxmin-1 y (iii) lavado de columna con agua destilada, luego de culminar la primera etapa, a fin de remover los metales que no fueron retenidos en la biomasa.
Adicionalmente, se ejecutaron ensayos con similitud a los anteriores, pero, con lavados del marlo de maíz con agua destilada, cada vez que pasaban 400 mL de efluente por la columna.
Todos los experimentos fueron monitoreados cada 400 mL mediante mediciones de pH, utilizando un pH-metro marca 850 SI ANALYTICS y análisis de concentración de hierro en solución por espectroscopia de absorción atómica (EAA), utilizando un equipo marca Shimadzu modelo AA 7000, mediante el método 7000B-USEPA (con límite de detección de 0.03-4.0 ppm) [23]. Al finalizar los procesos de filtración, el marlo de maíz se analizó por espectroscopia infrarroja con transformada de Fourier (FTIR), mediante la técnica de Reflectancia Total Atenuada (ATR).
RESULTADOS
Caracterización del marlo de maíz con y sin modificación química
En la Tabla (1) se muestra el consolidado de resultados obtenidos en la caracterización del marlo de maíz con y sin modificación química. Se evidencia que la biomasa aumenta su pH al ser modificada con NaOH, mientras que disminuye cuando es modificada con C6H8O7 Así mismo, se observa que la modificación química del marlo de maíz incrementó la humedad, densidad y porosidad. Adicionalmente, el porcentaje de incorporación del NaOH y el C6H8O7 fue de aproximadamente de un 90% para ambos casos.
Tabla 1 Propiedades fisicoquímicas del marlo de maíz con y sin modificación química.
| Marlo Característica | Nativo | Mod. NaOH | Mod. C6H8O7 | p Valor |
| pH | 5.45 ± 0.06 | 10.54 ± 0.09 | 2.53 ± 0.15 | <0.0001 |
| Humedad (%) | 15.13 ± 0.98 | 18.62 ± 0.85 | 16.47 ± 0.71 | 0.007 |
| Densidad aparente (gxmL-1) | 0.32 ± 0.04 | 0.68 ± 0.06 | 0.55 ± 0.05 | 0.0004 |
| Densidad real gxmL-1) | 0.78 ± 0.05 | 1.91 ± 0.07 | 1.51 ± 0.03 | <0.0001 |
| Porosidad (%) | 59 ± 5.00 | 64 ± 5.00 | 63 ± 5.00 | 0.4116 |
| Incorporación del modificante (%) | - | 91.31 ± 1.77 | 89.95 ± 1.56 | 0.4989 |
Por otra parte, la Figura (1) representa las micrografias del marlo de maíz con y sin modificación química. En general, los resultados coinciden con el de otras investigaciones, donde caracterizan bio-masas de productos agricolas en su estado natural y modificadas con NaOH y C6H8O7. Se reporta que su morfología es totalmente adecuada para la retención, atrapamiento y adsorción de iones metálico. En el caso del marlo nativo (Figura 1a), se evidenció una morfología heterogénea, rugosa y de poros abiertos con una estructura en forma de panal de abejas, con celdillas hexagonales conformadas por una diversidad de láminas plegadas que se unen unas a otras, formando pequeños prismas de manera repetitiva.
La micrografia de la Figura (1b) corresponde al marlo de maíz modificado con NaOH. Se observó una estructura cubierta por el modificante de manera heterogénea e imperfecta. El escaneo de la Figura (1c) pertenece al marlo de maíz modificado con C6H8O7, donde se evidenciaron estructuras fibrosas, cilíndricas heterogéneas con fomas y tamaños regulares y fijos.
Ensayos en reactores de lecho empacado
La Figura (2) muestra la variación de pH con respecto al volumen de DAM filtrado, usando marlo de maíz nativo y modificado, donde la Figura 2(a) representa los ensayos sin lavar y la Figura 2(b) los ensayos con lavados cada 400 mL de efluente. En general, en los primeros 400 mL de DAM filtrado, se presenta un incremento de pH de 2.70 ± 0.02 a 3.29 ± 0.10 al utilizar marlo nativo, y a 5.14 ± 0.10, usando marlo modificado con NaOH. Por el contrario, al emplear marlo modificado con C6H8O7, el pH disminuye a 2.61 ± 0.10. En posterior filtración (para los ensayos sin lavar) con marlo nativo y modificado con NaOH, el pH disminuye y se estabiliza hacia un valor cercano al del DAM inicial, luego de los 800 mL alimentados, con excepción del ensayo con C6H8O7, el cual tendió a 3.0. En el caso de los ensayos con lavados, el pH del DAM disminuye drásticamente durante los siguientes 1,600 mL. Estos resultados se comprobaron estadísticamente mediante un ANOVA que solamente existen efectos significativos en el pH del DAM filtrado a causa del tipo de marlo (con o sin modificación química) utilizado para el filtrado (p = 3.63 E-09). De igual forma, se verificó que no hay interacción entre estos factores y que evidentemente se presenta un mayor valor de pH usando marlo modificado con NaOH (Media = 3.67).
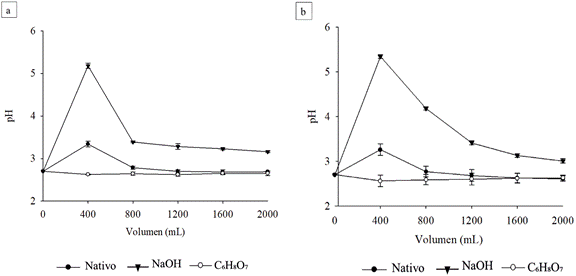
Figura 2 pH vs. volumen de DAM tratado con marlo de maíz nativo y modificado con NaOH y C6H8O7. (a) corresponde a los ensayos sin lavar y (b) pertenece a los ensayos con lavados cada 400 mL de efluente.
Por otra parte, la Figura (3) muestra en los ensayos evaluados, la remoción de hierro (II) del DAM. En general, se observó una remoción máxima en los primeros 400 mL de efluente tratado, donde los ensayos con marlo modificado con NaOH alcanzaron los máximos valores (mayores a 50%, con una concentración inicial de hierro en el DAM mayor a 1,000 ppm), seguidos por los ensayos con marlo nativo (alrededor del 40 % con una concentración inicial de hierro en el DAM mayor a 1,000 ppm) y marlo modificado con C6H8O7 (entre 20% y 38%). Sin embargo, al aumentar el volumen de DAM filtrado, la remoción de hierro disminuye en todos los casos, siendo menos notoria en los ensayos con marlo modificado con NaOH, especialmente cuando el DAM tuvo una concentración inicial de hierro superior a 1,000 ppm tendiendo a estabilizar a un valor aproximado del 15 % para los últimos volúmenes tratados (Figuras 3a y 3b). Como caso particular, los ensayos con marlo modificado con C6H8O7 y DAM a concentraciones iniciales de hierro de 500 ppm y 1,000 ppm tuvieron una drástica disminución del índice de remoción de hierro luego de filtrar 800 mL. de DAM, lo cual pudo ocurrir por la redisolución del hierro contenido en la columna (valores de remoción negativos) (Figuras 3b y 3c).
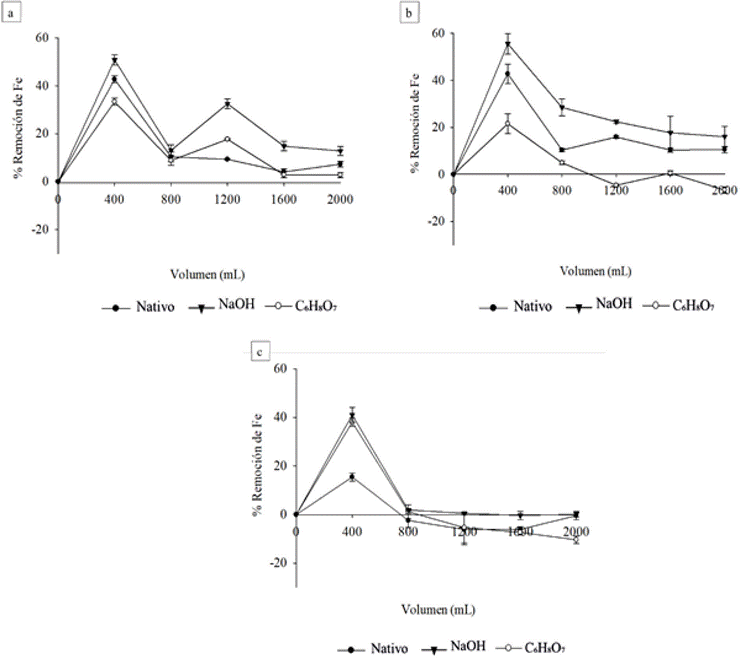
Figura 3 Remoción de hierro de DAM tratado con marlo de maíz nativo y modificado químicamente con NaOH y C6H8O7 (ensayos sin lavar). a) 2,000 ppm, b) 1,000 ppm y c) 500 ppm.
De igual manera, mediante un análisis ANOVA, se confirmó que existen diferencias estadísticamente significativas entre los niveles de concentración de hierro (p = 0.035) y el tipo de marlo utilizado (p = 0.048) en la remoción de hierro de DAM filtrado. Además, se estableció que no hubo interacción entre la concentración del DAM preparado y el marlo utilizado (p = 0.618). Así mismo, se evidencia que se presenta mayor remoción de hierro en DAM con concentración inicial de hierro de 2,000 ppm (Media = 17.54%) y con marlo de maíz modificado con NaOH (Media = 20.49%).
La Figura (4) muestra los tratamientos que tuvieron los lavados del marlo de maíz cada 400 mL de alimentación de DAM. De la misma manera que en los ensayos sin lavados, se evidenció una máxima remoción de hierro (alrededor del 50%) al utilizar marlo modificado con NaOH, a concentraciones mayores de hierro de 1,000 ppm, seguido por los ensayos con marlo nativo, que lograron remociones del 40% (Figuras 4a y 4b). Aunque, al aumentar el volumen de DAM la remoción disminuye, el valor se mantiene estable en los ensayos con marlo modificado, entre un 28 ± 2% aproximadamente. Es importante resaltar como en los ensayos de marlo nativo con DAM a concentraciones de hierro de 500 ppm se presentaron remociones del 18% y se mostró una tendencia más estable, en contraste con los ensayos sin lavado alguno (Figura 4c). Sin embargo, se demostró mediante un ANOVA que no existen efectos estadísticamente significativos en la remoción de hierro entre los niveles de concentración de hierro en el DAM (p = 0.852), pero sí se presentaron diferencias significativas con el tipo de modificación del marlo (p = 0.001). De igual manera, se demostró que no hubo interacción entre estos factores. Es importante destacar, que el análisis confirma una mayor remoción de hierro con concentraciones de 1,000 ppm (Media = 28.06 %) y usando marlo modificado con NaOH (Media = 33.67%).
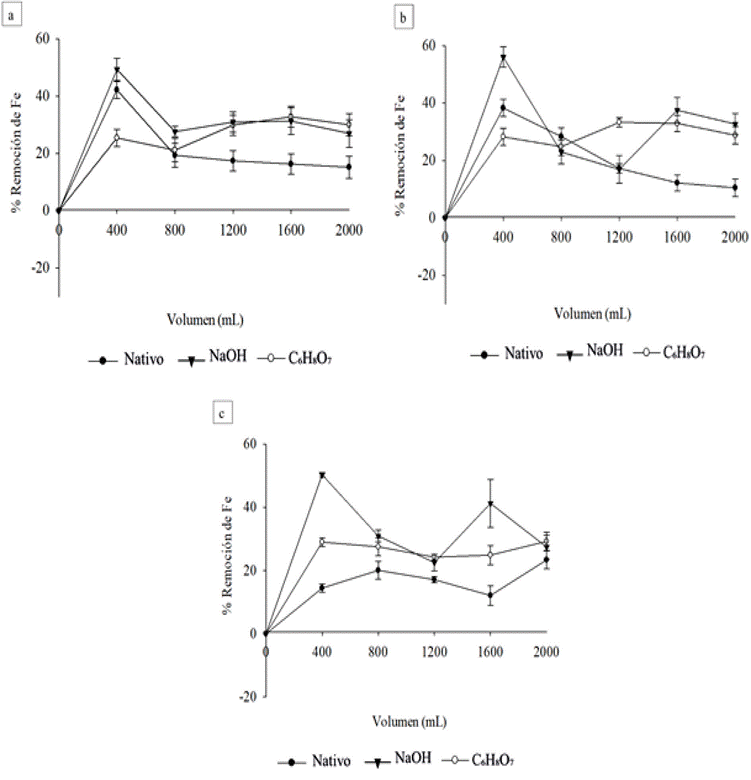
Figura 4 Remoción de hierro de DAM tratado con marlo de maíz nativo y modificado químicamente con NaOH y C6H8O7, incluidos lavados con agua destilada cada 400 mL de efluente. a) 2,000 ppm, b) 1,000 ppm, c) 500 ppm.
En resumen, la remoción de hierro global con los lechos de marlo de maíz nativo y modificado se muestran en la Figura (5). Complementado a lo observado en la Figura 3, para los ensayos sin lavar, el uso de marlo modificado con NaOH permitió obtener las mayores eficiencias (Figura 5a), para concentraciones de hierro superiores a 1,000 ppm (Figura 5a). En contraste, la modificación de marlo de maíz con C6H8O7 influyó negativamente sobre el proceso, disminuyendo el alcance observado para marlo nativo. Así mismo, el tratamiento de DAM con una concentración de hierro de 500 ppm, tiende a reducir su eficiencia (Figura 5b).
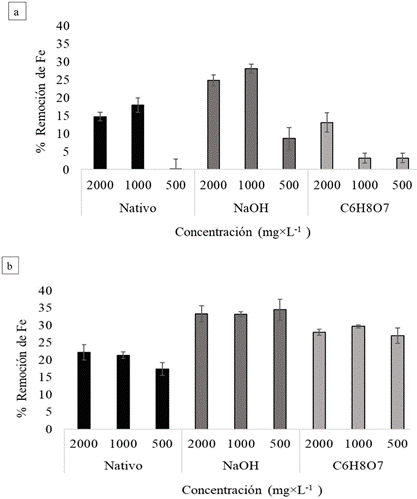
Figura 5 Remoción global de hierro, para los ensayos con marlo de maíz modificado y nativo, a diferentes concentraciones de hierro en el DAM. (a) corresponde a los ensayos sin lavar y (b) pertenece a los ensayos con lavados cada 400 mL de efluente.
Por otra parte, al implementar los lavados en todos los casos (Figura 5b), puede observarse un aumento notorio en la remoción y desaparición significativa de las diferencias relacionadas con la concentración de hierro, especialmente para los marlos modificados. Adicionalmente, el uso de marlo de maíz modificado con C6H8O7 permitió obtener mejores remociones que al utilizar marlo nativo, con valores aproximadamente 5% menores a los obtenidos con marlo modificado con NaOH.
Estadísticamente se comprobó lo mencionado anteriormente, ya que se evidencian diferencias significativas en la remoción de hierro, teniendo en cuenta la concentración del metal contenido en el DAM (p = 0.039) y la modificación del marlo (p = <0.001). De igual modo, se reitera que no hay interacción entre estos factores. A su vez, se comprueba la mayor remoción de metal en DAM con concentraciones de hierro de 2,000 ppm (Media = 22.7%) siendo remociones muy cercanas a los valores obtenidos con DAM de 1,000 ppm (Media = 22.2%) y se verificó que usando marlo modificado con NaOH (Media (Lavados) = 33.7% y Media (Sin lavados) = 20.5%) se obtienen los mayores porcentajes de remoción de hierro.
Análisis del marlo de maíz después de la filtración de DAM
La Figura (6) representa los espectros FTIR del marlo de maíz, donde la Figura (6a) corresponde a los espectros del marlo nativo y modificado con NaOH y C6H8O7, la Figura (6b) corresponde a los FTIR del marlo luego de los ensayos sin lavar y la Figura (6c) pertenece a los espectros FTIR luego de los ensayos con lavados cada 400 mL de efluente. En general, en la Figura (6a) se muestran los cambios estructurales luego de los procesos de modificación. Se observó la típica estructura lignocelulósica del marlo nativo debido a la presencia de una banda a 3,307 cm-1 atribuida a los grupos hidroxilos (-OH) [24]. Luego de modificar el marlo con NaOH y C6H8O7, la señal de los grupos hidroxilo cambia a 3,333 cm-1 y 3,336 cm-1, respectivamente, lo cual se debe a la desestructuración de este grupo por los tratamientos químicos [9,25]. Las vibraciones de estiramiento de los grupos metilo (-CH3) y metileno (=CH2), son característicos de los grupos lignocelulósicos y se muestran en la banda a 2,922 cm-1, la cual no muestra efectos significativos después de la modificación química [26].
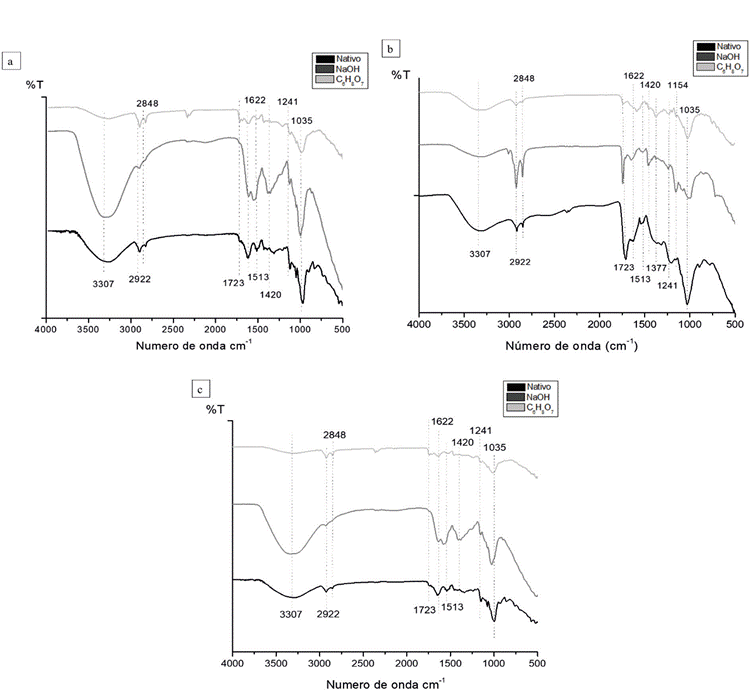
Figura 6 a) FTIR del marlo de maíz nativo y modificado, (b) FTIR luego de los ensayos sin lavar y (c) FTIR luego de los ensayos con lavados cada 400 mL de efluente.
Por otro lado, se observó el pico de vibración a 1,723 cm-1 atribuido a la tensión y flexión en el plano del grupo ésteres (RCOOR'), debido al estiramiento de la vibración del carbono y el oxígeno por su alto contenido de hemicelulosa. Esta señal tiende a disminuir, al modificar con NaOH y se incrementa levemente modificando con C6H8O7 [27]. La banda a 1,622 cm-1 es característica de la presencia de lignina y corresponde al estiramiento asimétrico del doble enlace del grupo carboxilo (-COOH), la cual evidencia un incremento en la señal luego de las modificaciones con NaOH y C6H8O7 a 1,640 cm-1 y 1,636 cm-1 cuyo comportamiento se asocia principalmente a las vibraciones de flexión del agua absorbida por la celulosa [28].
Las señales a 1,510 cm-1 indican la existencia de grupos aminos (-NH2) y se muestra un incremento considerable al modificar la biomasa con NaOH. Las bandas a 1,420 cm-1 corresponden al estiramiento vibracional del grupo carboxílico (-COOH), las cuales sufren un incremento en la señal al modificar con NaOH y se le atribuye a la posible descomposición de la lignina [29]. La banda a 1,241 cm-1 corresponde a la vibración de tensión y flexión en el plano del grupo de los ésteres, cuya intensidad de señal disminuye en ambos casos de modificación e indica que los grupos hidroxilo (-OH) y carboxilo (-COOH) están involucrados en la incorporación del modificante en el marlo [29,30]. Finalmente, las bandas que se observan a aproximadamente 1,035 cm-1 se atribuye a la presencia de anhídridos en el marlo, esta señal disminuye con C6H8O7 como consecuencia de la formación de citratos de almidón durante el proceso de modificación [28].
Por otro lado, las Figuras (6b) y (6c), muestran que la biomasa tiende a retener su estructura composicional inicial al hacer lavados intermitentes cada 400 mL, en contraste con los ensayos sin lavado. En el caso de los ensayos sin lavar (Figura 6b), no se observaron cambios en las señales de los grupos hidroxilo (3,307 cm-1) y metilo (2,922 cm-1), cuando se empleó marlo nativo, indicando que hay presencia de alcoholes y metilos en la estructura al final del proceso [26]. Caso contrario sucede en las señales a 2,922 cm-1, 2,848 cm-1 y 1,723 cm-1 las cuales aumentan su intensidad, a causa de la formación de complejos con grupos C-H y como consecuencia de la formación de grupos anhídridos, debido a las vibraciones de estiramiento de los grupos carboxilo o carbonilo conjugados [26,28,31]. A su vez, las intensidades de las señales a 1,622 cm-1 y 1,035 cm-1 aumentan, quizás a causa de la saturación por la formación de complejos con los grupos carboxilos y anhídridos presentes en la estructura [28]. Así mismo, al usar marlo modificado con C6H8O7 no se presentaron cambios significativos en las bandas de los grupos hidroxilo, metilo y metileno, pero sí en las señales de los grupos amino (1,513 cm-1) y ácidos carboxílicos (1,420 cm-1), tal vez como consecuencia de la formación de complejos de hierro [32,33]. Respecto a los ensayos utilizando marlo modificado con NaOH, en las Figuras (6b) y (6c) se evidencia una disminución en la intensidad de las señales a 3,307 cm-1, 1,622 cm-1, 1,513 cm-1, 1,420 cm-1 y 1,035 cm-1. En contraste con el marlo antes del proceso (Figura 6a); pueden surgir cambios posiblemente por los grupos funcionales contenidos en la lignina y celulosa, los cuales son los encargados de atrapar en la biomasa, a los cationes de hierro en solución [4,28].
DISCUSIÓN
El presente trabajo apunta a evaluar la capacidad de remoción de hierro de un marlo de maíz modificado con NaOH y C6H8O7 a partir de un DAM preparado a nivel de laboratorio. La modificación química del marlo de maíz se hizo con la única finalidad de conferirle propiedades morfológicas (tamaño y forma de partículas) para aumentar el área de contacto y así garantizar una destacada capacidad de remoción de hierro [33,34]. Las imágenes de la Figura (1) muestran espacios existentes entre las partículas del marlo de maíz nativo y modificado, lo cual se favorece el atrapamiento e inmovilización del metal. Por otro lado, las micrografías de las modificaciones del marlo con NaOH y C6H8O7 muestran estructuras heterogéneas, con imperfecciones y partículas de diferentes dimensiones, formas, tamaños regulares y fijos, resultando ser superficies apropiadas para la adsorción [2,9,21,35]. Wiwin et al., (2014) presentaron estructuras de marlo muy similares a este estudio. Ellos evidenciaron una estructura conformada por fibrillas con distribución desordenada y desigual, que luego de ser modificada con NaOH se hidroliza, resultando ser más porosa [35-38]. De igual modo, Gökben et al., (2015) muestran las micrografías resultantes de la modificación de biomasa vegetal con C6H8O7, siendo muy parecida a las obtenidas con el marlo de maíz utilizado en este trabajo, además, indican que la modificación ocurre principalmente en su superficie haciendo que se vuelva más esponjosa y áspera, aumentando posiblemente la capacidad de remoción de metales, puesto que es una morfología óptima para el atrapamiento de partículas [39][40].
La humedad y la densidad en el marlo aumentan con la modificación química (Tabla 1), lo cual se relacionan con el hinchamiento que le ocurre a la biomasa durante los procesos de modificación y de incorporación del NaOH y C6H8O7 [9,12]. Morales et al., (2008) y Vargas et al., (2013) comprueban que un alto porcentaje de humedad y una baja densidad en un sistema de lecho empacado podría repercutir negativamente en el sistema, ya que puede formar aglomerados provocando el taponamiento del sistema, disminuyendo la caída de presión y el flujo libre de la disolución. Sin embargo, en esta investigación no se presentó este tipo de inconvenientes con ningún tipo de lecho, lo que se le puede atribuir al tamaño de partícula (-2 +30 #Ty) [37-42]. Quoc et al., (2019) por su parte indicó que la porosidad en la biomasa dentro de un sistema de lecho empacado es un parámetro muy importante, puesto que aumenta la capacidad de atrapamiento de los iones metálicos dentro de los sitios activos de adsorción. Lo anterior indica que la porosidad del marlo de maíz influye de manera positiva en la remoción del hierro, tal vez, esta propiedad influyó en gran medida en la capacidad de remoción de hierro con marlo [43].
No obstante, cabe agregar que la remoción de hierro en el DAM con marlo de maíz se ve afectada tanto por las características fisicoquímicas de la biomasa (pH, humedad, densidad, porosidad, tamaño, morfología y composición), como por las propiedades del metal a remover [44].
Las propiedades superficiales y el estado iónico de los grupos funcionales del marlo dependen del pH, considerándolo como un factor control en la remoción de metales [28]. Las Figuras (2) y (6) demuestran lo expuesto anteriormente, pues, los resultados evidencian un incremento del pH en el DAM, al usar lechos con marlo nativo y modificado con NaOH, siendo mucho más neutralizante este último, debido a la sustitución nucleofílica de grupos hidroxilos en la biomasa por la modificación (Figura 6a), la cual provoca un aumento en el pH del marlo, confiriéndole así mayor capacidad de neutralización de efluentes ácidos (Tabla 1), especialmente en los primeros 400 mL de DAM filtrado [11]. Sin embargo, a medida que aumenta el volumen de DAM a tratar su pH disminuye (entre 1 a 1.5 unidades de pH respecto al pH inicial) así como la capacidad de remoción de hierro, esto se debe a que los grupos funcionales de la biomasa tienden a neutralizarse o se cargan positivamente cuando interaccionan con el hierro (se protonan). Por esto, a medida que se aumenta el volumen de DAM a tratar su pH decrece hasta estabilizarse, dado que la superficie se protona y tiende a disminuir así mismo la afinidad con los cationes del metal [45].
Por otra parte, en los ensayos de marlo modificado con C6H8O7 se observó que el pH del DAM en los primeros 400 mL filtrados disminuye y luego tiende a estabilizarse al pH del DAM original, lo cual pudo suceder por la modificación con el C6H8O7, ya que se aumenta el contenido de H+ que se unen a los grupos funcionales, generando mayor número de sitios ácidos, además de lograr la neutralización de los grupos aminos, acidificando la biomasa y afectando la capacidad de unión entre el marlo - hierro, haciendo que se sature más rápidamente la superficie de la biomasa por el DAM filtrado [12,42,43]. Es importante destacar que los resultados de pH en los DAM filtrados no se vieron significativamente afectados por la concentración inicial del hierro en el DAM y presentaron similitud durante los ensayos con el mismo tipo de lecho, debido a que los drenajes fueron preparados con el mismo valor de pH (2.7).
La capacidad de remoción de hierro del marlo de maíz fue gracias a su estructura lignocelulósica y a su contenido de proteínas y carbohidratos que se componen de grupos funcionales de ácidos débiles, grupos hidroxilo y carboxílicos (Figura 6a) [28,36]. La remoción de hierro con marlo de maíz puede pasar por interacciones de intercambio iónico (concentrándose el hierro sobre la superficie), por fuerzas de Van der Waals o mediante la formación de enlaces en los centros activos de la biomasa [44,45].
Es importante mencionar que una modificación química en la biomasa puede generar productos con alto intercambio iónico, por esto, la investigación incluyó modificaciones del marlo con NaOH y C6H8O7 [14,46]. Luego de modificar el marlo se evidenció que se mantiene su estructura lignocelulósica debido a su amplio contenido de grupos hidroxilo, que le permitieron formar enlaces libres e intermoleculares (Figura 6a). En el caso del marlo modificado con NaOH se obtiene una estructura con alta presencia de grupos hidroxilo debido a la hidrólisis que sufrió la biomasa durante la formación de ligandos de carboxilato (R-COO-) y metoxilos (CH3O-), en cambio, en el marlo modificado con C6H8O7 la presencia de los grupos hidroxilos es menor debido a la formación de anhídridos cítricos y citratos de almidón [12,34]. Por su parte, Tejada et al., (2014) en su estudio acerca de la remoción de metales como Pb, Ni y Cr con desechos agrícolas coincide en asignarle la capacidad de secuestrar iones metálicos por donación de un par de electrones para la formación de complejos a los grupos carboxílicos e hidroxilo [47,48].
Como caso particular, el marlo modificado con NaOH muestra mayor capacidad de remoción de hierro (Figura 6) debido a la reacción de deslignificación del marlo durante la modificación. El rompimiento de los enlaces de éster de la lignina y su disolución junto a la hemicelulosa genera cambios internos en la estructura del marlo, haciendo que su capacidad de hidrólisis aumente, debido a la presencia de un mayor contenido de ácidos carboxílicos y alcoholes en la pared celular del marlo de maíz [1][49]. En la Figura (6a) se evidencia la modificación del marlo con NaOH y se observa una mayor exposición de grupos hidroxilo y carboxilo, los cuales están involucrados en la reacción de incorporación del modificante en la biomasa, producto de la deslignificación, dicho proceso conlleva a la formación de agujeros en la superficie de la biomasa, incrementando el área superficial interna de la fracción lignocelulósica [9,47,48].
Por otra parte, la remoción de hierro en DAM, utilizando marlo de maíz modificado con C6H8O7, ocurre gracias a los aniones carboxilato del grupo ácido contenido en las moléculas de aminoácidos presentes en la estructura del marlo modificado (Figura 6a), confiriéndole a la biomasa el suficiente potencial para unir iones de hierro, ya que dichos aniones se convierten en posibles sitios activos para su retención. Otras investigaciones han descubierto que la capacidad de la biomasa modificada con C6H8O7 se torna más eficiente cuando se tratan efluentes con pH superiores a 5 [17,50,51]. No obstante, los tratamientos llevados a cabo en los ensayos sin lavar (Figura 3) indican que la disminución en la capacidad de remoción de hierro, pudo deberse a la acidificación de la biomasa, la cual hace que se rechacen los iones metálicos de soluciones con pH ácido, desfavoreciendo su adsorción [45].
Reportes preliminares en literatura muestran que el pH del efluente influye en la capacidad de remoción de metales, ya que aumenta la posibilidad de interferir en la solubilidad de los iones, debido a la activación de los grupos funcionales de la biomasa. Así mismo, la presencia de iones H3O+ compiten con los iones del metal por los sitios activos del marlo [2,47]. Por tal motivo, investigaciones como la de Raj et. al. (2013) buscan estrategias para aumentar el pH de la biomasa y desprotonizar la superficie [8,10,11].
Es preciso destacar que estudios de remoción de metales con marlo de maíz nativo han demostrado capacidades adsorvativas entre el 50% y 98% de iones metálicos como Fe, Pb, Zn y Cu. Sin embargo, esta investigación alcanzó capacidades de remoción de hierro entre el 15% y 30% (Figura 3), incluso con marlo modificado. Esto se le puede atribuir al tipo de sistema implementado para el tratamiento, ya que, en la mayoría de las investigaciones de tratamientos de efluentes con marlo, se utilizan sistemas o reactores tipo batch o sistemas continuos con agitación, los cuales maximizan la conversión y la selectividad de las reacciones, porque se pueden controlar y predicen la conducta y las condiciones de operación (tiempo de retención hidráulica, agitación (rpm), temperatura, etc) del sistema [16,17,28]. En contraste, la configuración en lecho empacado permite procesar cantidades significativas de efluente, los tiempos de tratamiento son cortos y para su implementación no se necesita de altas inversiones de dinero puesto que no requiere de exigencias como grandes extensiones de tierra, parámetros de diseño, operación y manetnimiento complejos [20,52][53].
Las diferencias significativas de remoción en los ensayos sin lavar (Figura 3), respecto a la concentración de hierro en el DAM, pudo deberse a una falta de resistencia en la transferencia de masa. Probablemente, una mayor concentración permite un aumento en el número de colisiones entre el metal y la biomasa, permitiendo el proceso de adsorción de hierro [42,54]. En contraste, la más baja concentración de Fe del DAM evaluado (500 ppm) sumado a una acidificación como la que se presentó en los ensayos con marlo modificado con C6H8O7, posiblemente causaron disminución de las interacciones electrostáticas, debido a la ocupación metálica de los sitios activos, puesto que la biomasa modificada pudo generar agregados ácidos que limitaron la movilidad de los iones por la reducción del área superficial, generando incluso resolubilización del metal en la medida que se continuaba filtrando el efluente (Figura 6b) [11,39,51]. Investigaciones de otros autores corroboran lo expuesto, al mostrar que este tipo de lechos tiene potencial uso para la captura de cationes metálicos, cuando se trabaja con pH entre 4 y 7, ya que a medida que el valor de pH crece hasta alcanzar un pH neutro, la superficie de la biomasa se desprotona y aumentan su afinidad con las especies catiónicas [45].
Los resultados obtenidos en los ensayos con lavados intermitentes, cada 400 mL de DAM filtrado (Figura 4), permitieron indicar una acción relevante del DAM sobre el marlo de maíz (nativo o modificado). Los incrementos en la remoción indican que el DAM puede afectar considerablemente los sitios activos de unión, posiblemente al ser ocupados por la alta concentración de protones en la solución (pH bajos), reduciendo el área de superficie efectiva disponible para el atrapamiento de hierro [55,56]. Por tanto, la caída drástica de remoción, a menores concentraciones de hierro, también puede ser causada por un déficit de la fuerza direccional, encargada de superar la resistencia de transferencia de masa en el proceso de adsorción. Dicho de otra manera, si se aumenta la concentración inicial de los iones de hierro será mayor la adsorción, debido al incremento de colisiones entre el hierro y el marlo [42,57]. Además, se pudo presentar posibles disoluciones de hierro durante los filtrados, ya que el equilibrio sólido-líquido factiblemente se vería limitado por la difusión de los iones hacia los sitios activos del marlo, los cuales ya estaban ocupados o saturados [58].
Por otro lado, los ensayos que evidenciaron bajas remociones muestran que estas tienden a estabilizarse a medida que incrementa el volumen de DAM filtrado (Figuras 3 y 4). Investigadores aseguran que la remoción de metales es altamente dependiente de la concentración del metal en el efluente y que tiende a estabilizarse durante el proceso, a causa de la saturación de los sitios activos de adsorción, dificultando la interacción biomasa-metal, evidenciando así que no existe competencia significativa de los sitios activos entre el agua (solvente) y el catión Fe+2 [43,46]. No obstante, los ensayos con lavados intermitentes permiten evidenciar que, de superarse los inconvenientes generados por la naturaleza de los DAM, la recuperación del lecho agotado por el proceso de remoción de contaminantes se puede llevar a cabo, simplemente con procesos de desorción física, utilizando agua, lo cual brindaría una mayor capacidad de atracción catiónica, debido al arrastre de los agregados ácidos, regenerando los sitios activos y exponiendo de mejor manera sus aniones carboxilato sobre la superficie de la biomasa (Figura 6c).
CONCLUSIONES
La interacción entre el marlo de maíz y DAM es dependiente de las propiedades fisicoquímicas de ambos componentes y de las condiciones del medio. En el caso de la biomasa, la estructura composicional lignocelulósica contiene grupos funcionales carboxílicos e hidroxilicos que favorecen la unión metal - biomasa. Los mecanismos que explican la remoción del metal son la complejación, la adsorción física y el intercambio iónico, procesos que permiten el atrapamiento de cationes en los centros activos, mediante la formación de complejos en la pared celular. Es importante agregar que, al someter el marlo de maíz a una modificación termoquímica, se logra obtener productos que pueden mejorar la capacidad de intercambio iónico, debido a la adición de grupos polares en su superficie.
En este trabajo en particular, la modificación con NaOH es la mejor alternativa, ya que contrarresta el efecto de la acidez de DAM. Uno de los principales factores que puede afectar negativamente la remoción de hierro, en especial cuando se trabaja con concentraciones de hierro por debajo de 1,000 ppm, debido a una competencia de los protones de la solución por los sitios activos del lecho, reduciendo el área de superficie efectiva disponible. Se pudo corroborar que dicho fenómeno sólo se podría solventar si las concentraciones de hierro superan los 2,000 ppm, debido al incremento de colisiones entre el hierro y el marlo de maíz, que mitigaría el efecto del pH. La premisa anterior también indica el por qué la modificación con C6H8O7 no es conveniente para tratar efluentes ácidos, ya que al tener biomasa acidificada, las altas interacciones protónicas generan una repulsión que ve afectada la adsorción de los iones metálicos.
Frente a los niveles de remoción alcanzados en los ensayos, es necesario recurrir a nueva estrategias con el fin de aumentar la capacidad de atracción metálica por los lechos, si se quisiera implementar este tipo de procesos a nivel industrial frente a DAM reales donde hay varios tipos de metales además de sulfatos. Así mismo, podría evaluarse e incluso implementarse su aplicación como pre o postratamiento de sistemas de tratamiento de DAM ya existentes, por ejemplo, en el caso de disponer altas concentraciones de metales pesados. Futuros trabajos deben considerar la evaluación de caudales de alimentación, que permitan obtener un mayor grado de remoción. También podría aplicarse en una etapa posterior a una neutralización de los efluentes.