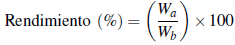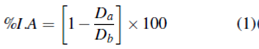1 Introducción
En los trópicos se han identificado desde poblaciones de cazadores-recolectores diferentes especies de plantas que han sido utilizadas como sustento alimenticio 1. Este proceso ha llevado a que muchas especies, hayan sido domesticadas por parte del hombre, de tal forma que se ha generado una dependencia entre el hombre y las plantas 2. En este sentido, una especie vegetal de gran importancia nutricional que ha sido utilizada desde el Holoceno hasta el presente es el ñame 2. Taxonómicamente las especies de este tubérculo corresponde al género Dioscorea, el cual pertenece a la familia de monocotiledóneas Dioscoreaceae 3 y está representado en el Caribe colombiano por diferentes variedades que no han sido clasificadas taxonómicamente 4.
En Colombia según reportes elaborados en 2010 se ha establecido que anualmente se producen alrededor 295.374 ton de ñame, lo cual ha llevado a incluir al territorio nacional dentro de los 12 países con mayor producción en las Américas. Este cultivo, es producido principalmente en departamentos como Córdoba, Bolívar, Atlántico y Sucre, donde es considerado de consumo básico en comunidades campesinas, y por lo tanto, de suma importancia socioeconómica para esta región 5. Asimismo, es empleado en el abastecimiento de mercados locales y alimento para animales 6. No obstante, y a pesar de su importancia en la economía local del Caribe colombiano, son poco los estudios que se han realizado para mejorar su calidad y producción, la cual se ha visto afectada en los últimos años por diferentes enfermedades producidas por hongos que han causado pérdidas de más del 90% en cultivos 12. Bajo este contexto, el tubérculo del ñame se ha visto afectado por la incidencia principalmente de Colletotrichum gloeosporioides ((Penz.) Penz. Y Sacc.) 7.
C. gloeosporioides es una especie de hongo cuya identidad taxonómica ha estado sujeta a variaciones debido a la dificultad en su identificación y similitudes morfológicas hacia otros taxones 8,9. Sin embargo, en términos generales este linaje ha sido establecido dentro de la familia Glomerellaceae y su distribución se encuentra en las regiones tropicales y subtropicales del mundo 10. Este hongo es el causante de la enfermedad conocida como antracnosis 10, la cual reduce la eficiencia fotosintética de la planta hasta ocasionar disminución de la calidad de los tubérculos y una reducción de alrededor del 90% de la producción 7,10. C. gloeosporioides también es causante de grandes pérdidas económicas en diferentes cultivos como frutales, cereales, pastos, vegetales, legumbres y cultivos perennes 11. Además, ha sido reportado en cultivos de guanábana (Annona muricata L.) causando hasta el 90% de pérdidas en huertos no tecnificados 12. De igual forma, se ha registrado en tomate de árbol (Cyphomandra betacea (Cav.) Sendt.), manzano (Malus domestica Borkh) y mora (Rubus glaucus Benth), dentro de los cuales ha provocado reducciones productivas superiores al 50% 13. La antracnosis en al aguacate (Persea americana Mill.) ha afectado la calidad de los frutos y pérdidas cercanas al 20% de la producción 14.
En este contexto, diferentes mecanismos han sido empleados para mitigar, controlar y exterminar las poblaciones de C. gloeosporioides15. Sin embargo, diferentes estudios han demostrado que los compuestos químicos utilizados en el control de este hongo como el Benomil producen problemas ambientales, en la salud de humanos 16, animales y en la diversidad microbiana 15. En este sentido, sobre los últimos años se vienen implementando diferentes compuestos orgánicos biológicamente activos, extraídos de especies de plantas que presentan la capacidad de eliminar a microorganismos patógenos por sí mismas, debido al desarrollo de antibióticos 17. Estos han demostrado su eficiencia al momento de mitigar este hongo (18, 19) y con esto reducir el impacto ambiental de las fumigaciones.
De los compuestos identificados como agentes químicos o en este caso antibióticos, se encuentran principalmente los aceites esenciales o también llamados compuestos volátiles 20. Estos son considerados líquidos de consistencia aceitosa, aromáticos de origen vegetal (flores, los brotes, semillas, hojas, corteza, hierbas, madera, frutas y raíces), compuestos por sustancias lipofílicas, especialmente monoterpenos y sesquiterpenos, y sus derivados oxigenados (alcoholes, aldehídos, cetonas, fenoles, ácidos, ésteres y éteres) en distintas cantidades 20,21.
A la fecha se han encontrado aceites esenciales en una gran variedad de plantas a las cuales se les ha probado cierta actividad antimicrobiana 22, incluyendo Zingiberaceae 23,24. Esta familia es un clado de monocotiledóneas perteneciente al orden Zingiberales, la cual cuenta con más de mil especies segregadas en 50 géneros y cuya distribución es pantropical 3. En linajes al interior de esta familia diferentes estudios han demostrado su utilidad como agentes repelentes en mosquitos 23,25, actividad antimicrobiana 26,27 y anti-fúngica 24,28,29. En este sentido, dos especies relevantes en términos de su importancia económica y etnobotánica se encuentran Curcuma longa L. y Zingiber officinale Roscoe. Según lo anterior, a las plantas de C. longa o como es conocida en la región del Caribe colombiano en su nombre vernáculo como cúrcuma se le atribuyen propiedades antioxidantes 30, hepatoprotectoras 31, anticancerígenas 32 y quimioprotectoras 33; además se han hallado aceites esenciales en las raíces que corresponden a una mezcla de terpenos y turmerona como componentes mayoritarios 34. Componentes que han sido registrados con agentes potenciales de actividad antimicrobiana 35. Con respecto a Z. officinale o también denominado en la región caribeña en Colombia como Jengibre se ha estudiado que contiene hasta 3% de un aceite esencial aromático, cuyos principales constituyentes son sesquiterpenoides, con zingibereno como el elemento principal; también su olor y sabor característicos son causados por una mezcla de zingerona, shogaoles y gingeroles a los cuales se ha reportado ciertas propiedades antibacterianas 26,29.
En el departamento de Sucre se está implementando un programa para el aprovechamiento de recursos naturales según el conocimiento etnobotánico 5, para ser utilizados como potencial biológico, realizando estudios que permitan el descubrimiento de moléculas bioactivas novedosas, las cuales pueden ser halladas a partir de fuentes vegetales, como la Curcuma longa y Zingiber officinale, cuyo potencial biológico aunque ha sido establecido como fungicida 36,37 aún se desconoce en cuanto a la inhibición de Colletotrichum gloeosporioides (Penz.) Penz. y Sacc en el cultivo de ñame. Según lo anterior, en el presente artículo se evalúa el potencial biológico de los aceites esenciales extraídos de las raíces de estas dos especies de monocotiledóneas sobre C. gloeosporioides, identificado en cultivos de Dioscorea rotundata Poir. desarrollados en el departamento de Sucre, Colombia. Para lo anterior, se llevó a cabo una caracterización química de los compuestos naturales, los cuales fueron probados sobre cepas del hongo obtenidas e identificadas a partir de D. rotundata.
2 Materiales y métodos
2.1 Recolección del material vegetal, fúngico y verificación taxonómica
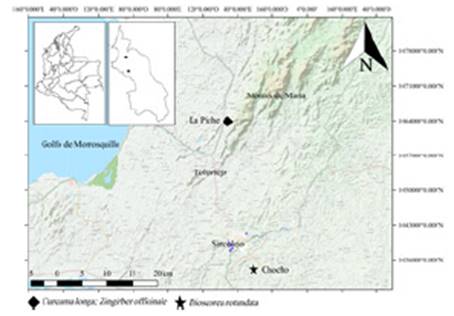
Las muestras de Curcuma longa y Zingiber officinale fueron recolectadas en el municipio de Toluviejo (Sucre), en la zona rural de la Piche (Figura 1). El área de muestreo presenta una temperatura de 26° y 30 °C, la precipitación anual es de 1.500 mm y la humedad relativa se encuentra entre 75 % y 85 %. El régimen pluviométrico es bimodal, con valores máximos en los meses de septiembre a noviembre y mayo a junio 38. La vegetación corresponde a bosque seco tropical, aunque actualmente solo existen pequeños parches de bosque aislados y fragmentados, de tal forma que paisaje corresponde a cultivos de orden comercial como Manihot esculenta (yuca), Carica papaya (papaya), entre otros.
Una vez recolectado el material, fue procesado según los parámetros convencionales del herbario en su secado y prensado; además su identificación taxonómica fue corroborada en el herbario de la Universidad de Sucre (HEUS) y almacenadas según la enumeración de Mercado-Gómez J.
Las cepas para los ensayos antifúngicos fueron aisladas a partir de hojas de ñame espino (nombre vernáculo) provenientes de cultivos en la vereda el Choncho (-75°24'48.5"-9°30'46.11"N) del municipio de Sincelejo (Figura 1). Una vez aislado el fitopatógeno según la metodología de Saldarriaga et al., (2008), las cepas de los hongos fueron enviadas a CorpoGen - Bogotá, Colombia para la extracción de DNA e identificación molecular.
3 Extracción de aceites esenciales y análisis químico
La obtención de los aceites esenciales se realizó por el método de hidrodestilación asistida por microondas (MWHD), empleando un equipo de hidrodestilación con capacidad para 2 L (balón de destilación). Se pesaron 300 g de material vegetal fresco (raíces), en buen estado; es decir, carente de evidencias de malformaciones o presencia de parásitos u otros. Este fue introducido en un balón de destilación con 800 mL de agua destilada. El tiempo de extracción fue de 1 hora para todas las muestras. Como fuente de radiación microondas se empleó un horno convencional, con un ciclo de irradiación de 60 minutos a una potencia de 70% 39,40. Los aceites esenciales obtenidos, fueron secados con sulfato de sodio anhídrido y conservados en viales sellados a 4 °C protegidos de la luz, hasta su posterior utilización 41. Posteriormente fue medido el rendimiento (% w/w) del extracto, según el método propuesto por Díaz et al. 42 mediante la siguiente ecuación:
Donde Wa corresponde al peso del extracto seco, y Wb al peso del material vegetal seco y molido.
Finalizada la extracción y medición del rendimiento, se procedió a determinar los componentes químicos de los aceites esenciales mediante la técnica instrumental de Cromatografía de Gases con detector selectivo de Masa (GC/MS), utilizando un equipo Agilent 6890 N acoplado a un detector selectivo de masa Agilent 5973 N y con el inyector en modo splitless. Los índices de Kóvats fueron determinados en una columna capilar no polar DB_1MS y utilizando como gas de arrastre el Helio. La programación del horno se dividió en cuatro pasos: inicialmente la temperatura fue de 50 °C y se mantuvo allí por 0,33 min, luego se incrementó la temperatura a razón de 5 °C/min hasta 150 °C y se mantuvo allí por 4,34 min. Posteriormente, se incrementó la temperatura de 10 °C/min hasta 250 °C y se mantuvo por 3 min en la última. Por último, se incrementó la temperatura a razón de 15 °C/min hasta 300 °C y se mantuvo por 4 min. Este proceso tomo un tiempo total de 45 min.
La identificación tentativa de los compuestos registrados se estableció según sus espectros de masas, usando la base de datos que presente una mayor probabilidad de coincidencia para las NIST02.L y NIST5a.L mayores a 90% o en su defecto usando la información de NIST98. L. Toda la información importante como tiempo de retención y porcentaje de área fue generada por el software MSD ChemStation.
3.1 Inhibición del crecimiento micelial
Para la prueba de inhibición del crecimiento micelial se siguió la metodología de siembra directa propuesta por Pérez et. al 43, con modificaciones. En esta prueba se utilizaron aislados de aproximadamente 7 mm de diámetro de área de crecimiento del fitopatógeno, los cuales se sembraron sobre la superficie del medio, papa destroza y agar enriquecido con cloranfenicol, rifampicina y ampicilina. Con el fin de establecer las posibles concentraciones de susceptibilidad del hongo ante los aceites, se elaboraron cuatro tratamientos de 3,000, 5,000, 8,000 y 10,000 mg/L de aceites de C. longa y Z. officinale, con el objeto que los aislados quedarán impregnados. De cada tratamiento, 60 |jL fueron adicionados a los aislados de 7 mm del fitopatógeno. Los tratamientos fueron comparados con el control positivo, los cuales presentaban benomil 1g/L, bajo la dosis utilizada por los cultivadores de ñame en el departamento de Sucre; además, se empleó un testigo absoluto sin ningún tipo de tratamiento.
Los ensayos se incubaron de 28±2 °C por 8 días en intervalos de 12 horas de luz y 12 horas de oscuridad. La actividad antifúngica se evaluó midiendo el crecimiento radial de cada aislado con los diferentes tratamientos en el día octavo. El resultado se interpreta como porcentaje de índice antifúngico mediante la siguiente ecuación:
Donde Da corresponde al crecimiento de cada tratamiento y Db al crecimiento del testigo absoluto 44.
3.2 Prueba múltiple de rango para el porcentaje de índice antifúngico (% I.A)
Para establecer si existían diferencias significativas entre las pruebas elaboradas a partir de los aceites y un testigo, se llevó a cabo un diseño completamente al azar con 3 réplicas por tratamiento. En este sentido, se determinaron tres factores experimentales: las concentraciones (3,000, 5,000, 8,000 y 10,000 ppm), los bioproductos (aceites de C. longa y Z. officinale), cepas de hongos de Colletotrichum sp. y una variable respuesta que fue el porcentaje de índice antifúngico sobre el crecimiento micelial, para un total de 384 unidades experimentales. En todos los tratamientos, se adiciono una prueba positiva en contra del fitopatógeno a través del benomil.
Para contrastar la normalidad de los datos se realizó el test de Shapiro-Wilkse (p = 0,06016333); una vez verificada la normalidad de los datun un ANOVA con arreglo factorial simple con muestreo en las unidades experimentales se llevó a cabo. Finalmente, se realizó la prueba de Tukey para comparar la diferencia entre la media de los niveles de los factores y así establecer cuales factores presentaron las diferencias significativas. Todos los análisis estadísticos fueron elaborados en el programa PAST 45.
4 Resultados
4.1 Recolección del material vegetal, fúngico e identificación taxonómica
La verificación taxonómica de las muestras vegetales confirmó que de los ejemplares recolectados en campo corresponden a Curcuma longa L., Zingiber officinale Roscoe y Dioscorea rotundata Poir. En el caso de las cepas de hongo, los resultados del análisis molecular de las 16 cepas de objeto de estudio, mostraron un 100% de identidad de su longitud y similitud con secuencias de ITS almacenadas en banco genómicos (GeneBank) que corresponden a Colletotrichum gloeosporioides.
4.2 Extracción de aceites esenciales y análisis químico
Mediante la hidrodestilación se realizaron seis extracciones del aceite esencial a partir 300 g de cada una de las dos especies durante una hora, obteniéndose en promedio por cada extracción 0.50 g de un líquido amarillo pálido para los rizomas de C. longa, con un rendimiento de 0.25 % (Tabla 1); y 0.85 g de un líquido color amarillo verdoso para los rizomas de Z. officinale, con un rendimiento de 0.43 % (Tabla 2).
Tabla 1 Resultados de las extracciones mediante hidrodestilación para los rizomas de C. longa y Z. officinale.
| Extracciones | Masa de Aceite (g) | Rendimiento (%) | ||
|---|---|---|---|---|
| C. longa | Z. oficcinale | C. longa | Z. oficcinale | |
| 1 | 0.50 | 0.86 | 0.25 | 0.43 |
| 2 | 0.48 | 0.88 | 0.24 | 0.44 |
| 3 | 0.52 | 0.86 | 0.26 | 0.43 |
| 4 | 0.49 | 0.85 | 0.245 | 0.425 |
| 5 | 0.51 | 0.85 | 0.255 | 0.425 |
| 6 | 0.50 | 0.86 | 0.25 | 0.43 |
Tabla 2 Composición química del aceite esencial de Curcuma longa. Los compuestos marcados con asterisco presentan mayor cantidad en los aceites.
| Identificación | Tiempo de reacción | % área |
|---|---|---|
| Pineno | 7.140 | 5.13 |
| ϐPineno | 7.528 | 1.57 |
| 3-Thujeno | 8.040* | 25.57* |
| Terpileno | 8.465 | 5.25 |
| Eucaliptol | 8.779 | 7.98 |
| trans- ϐ-Ocimeno | 9.050 | 0.75 |
| ƴ-Terpineno | 9.364 | 3.25 |
| Terpinoleno | 10.374* | 19.09* |
| 1,5,8-p-Mentatrieno | 10.710 | 0.08 |
| cis-p-Ment-2-en-1-ol | 10.901 | 0.12 |
| 4-Metil Ciclohexeno | 11.925 | 0.21 |
| 4-Carvomentenol | 12.327 | 1.12 |
| Sabinol | 12.890 | 0.35 |
| trans-Piperitol | 13,095 | 0.11 |
| 1-(2-metoxi-fenil)-etanol | 13.805 | 0.79 |
| p-ment-1-en-3-ona | 14.032 | 0.13 |
| Linalool butirato | 14.434 | 0.32 |
| 2-Undecanona | 15.341 | 0.29 |
| Etanona, 1-(2-tienil) | 15.905 | 0.92 |
| Metil cinnamato | 17.302 | 0.38 |
| Geranil acetato | 17.587 | 0.20 |
| 3-Metil-5-pirazolidinona | 17.777 | 0.34 |
| Cariofileno | 18.897 | 0.33 |
| cis-ϐ-Farneseno | 19.796 | 1.76 |
| a-Farneseno | 21.011 | 0.98 |
| ϐ-Sesquifelandreno | 21.442 | 0.43 |
| Nerolidol | 22.445 | 0.32 |
| α-Bisabolol | 23.279 | 0.15 |
| cis-b-Santalol | 23.710 | 0.15 |
| α -Bisabolol | 24.149 | 0.27 |
| Tumerona | 25.985 | 7.12 |
| Curlona | 26.739 | 3.07 |
4.3 Inhibición del crecimiento micelial
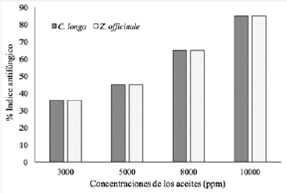
Los aceites esenciales obtenidos de C. longa y Z. officinale, presentaron mayor actividad antifúngica a concentración de 10000 mg/L contra las cepas del hongo C. gloeosporioides con un índice antifúngico de 85 %, efecto similar al encontrado para el control positivo con benomil (% I.A de 100 %). Las concentraciones de los aceites de 3,000 mg/L presentaron inhibición del 36 %; 5,000 mg/L con un 45 % y 8,000 mg/L con un 60 % contra C. gloeosporioides (Figura 2).
Los resultados del análisis químico de los dos tipos de aceites muestran que hay una gran variabilidad de compuestos (Tabla 2 y 3). Para el caso de C. longa se presentan componentes mayoritarios al 3-Thujeno (25.57 %) y Terpinoleno (19.09 %) (Tabla 2); mientras que en Z. officinale el citral (15.40%) presenta la mayor concentración (Tabla 3).
Tabla 3 Composición química del aceite esencial de Zingiber officinale. Los compuestos marcados con asterisco presentan mayor cantidad en los aceites.
| Identificación | Tiempo de reacción | % área |
|---|---|---|
| 1R- α-Pineno | 6.189 | 1.91 |
| Canfeno | 6.548 | 4.38 |
| ϐ-Pineno | 7.491 | 1.50 |
| α -Felandreno | 7.784 | 0.33 |
| Y-Terpineno | 8.567 | 7.65 |
| Linalool | 10.248 | 1.23 |
| Borneol | 11.991 | 1.88 |
| (+)-α -Terpineol (p-ment-1-en-8-ol) | 12.642 | 2.39 |
| Citral | 15.261* | 15.40* |
| 2,6-Dimetil-2,6-octadien-8-il acetato | 17.777 | 1.93 |
| Curcumeno | 20.433 | 4.21 |
| Biciclo [3.1.1]hept-2-eno, 2,6-dimetil-6-(4-metil-3-pentenil) | 20.959 | 5.99 |
| 1,3-Ciclohexadieno, 5-(1,5-dimetil-4-hexenil)-2-metil-, [S- (R*, S*)]- | 21,091 | 4,94 |
| α -Farneseno | 21.384 | 5.95 |
| ϐ -Sesquifelandreno | 21.823 | 4.53 |
| Eremofileno (7CI) | 22.598 | 1.41 |
| Dehidrolinalool | 24.376 | 1.36 |
| ϐ -Eudesmol | 25.473 | 1.13 |
| α -Cedreno | 26.622 | 1.91 |
4.4 Prueba múltiple de rango para el porcentaje de índice antifúngico (% I.A)
Se encontraron diferencias significativas entre las concentraciones de los dos aceites evaluados contra C. gloeosporioides, puesto que el p-valor está por debajo de 0.05 con un nivel de confianza del 95%. Las pruebas estadísticas (Tukey) indican diferencias significativas con respecto a la concentración de los aceiteses enciales. Los mayores índices de inhibición (85%) en ambos aceites fueron encontrados cuando se utilizaron concentraciones de 10,000 mg/L con respecto a los menores % I.A, quienes fueron observadas a de 3,000 y 5,000 mg/L, respectivamente. El % I.A del volumen 10000 mg/L fue muy similar al control positivo con benomil.
Discusión
Los aceites esenciales de C. longa y Z. officinale reportaron un rendimiento promedio de 0.25 % y 0.43 % respectivamente, esto en relación a los mililitros obtenidos por gramo de muestra fresca. Estos resultados de rendimiento muestran un porcentaje de producción relativamente bajo en el proceso de extracción de los aceites al compararlos con otros estudios, como el realizado por Mesa, et al. 34, quienes hallaron niveles superiores en su investigación. Lo anterior puede ser el producto de las diferentes condiciones tanto del material vegetal como de las condiciones ambientales en que se encuentre el cultivo. Barbosa, et al. 46 reporta que al someter la planta a un proceso de secado se reduce entre un 12% y un 17% del contenido de aceite en comparación con el contenido del mismo en la planta fresca, debido a la volatilización de una parte del aceite en el proceso. Mejía, et al. 47 y Delgado, et al. 48, reportan que el contenido de humedad del material vegetal al momento de la extracción es un factor importante en el rendimiento de los aceites esenciales ya que afecta la concentración de los mismos.
Del mismo modo, Fornari, et al. 20, también indicaron que los factores ambientales, como las propiedades del suelo y el estrés por el agua o la temperatura en la zona cultivada tienen influencia en la productividad de los aceites por parte de las especies, pero tienen poco efecto en la composición del aceite esencial. Sin embargo, estos resultados de rendimiento son satisfactorios debido que sus valores están por encima de 0.1% que es dato límite mínimo de rendimiento según Joulain 49; en otras palabras, aunque los valores son inferiores a los reportados en otros estudios, es posible proponer su explotación desde el punto de vista industrial.
Los aceites esenciales obtenidos de C. longa y Z. officinale, presentaron mayor actividad antifúngica a concentración de 10,000 mg/L contra las cepas del hongo C. gloesporioides con un índice antifúngico de 85 %, efecto similar al encontrado para el control positivo con benomil (% I.A de 100 %). Se puede inferir que la concentración mínima inhibitoria se encuentre en este valor (10,000 mg/L). No obstante, algunos investigadores han observado, que los aceites de C. longa pueden tener un efecto positivo a concentraciones más bajas 50,51, por ejemplo, se pudo determinar que 5,000 mg/L genera una actividad del 70 %. Empero, al igual que en presente estudio, Sitara, et al. 52 al comparar la efectividad del aceite esencial de C. longa con fungicidas comerciales contra Aspergillus flavus, observaron una total de inhibición del crecimiento del hongo a concentraciones de aceite de 10,000 mg/L.
En la composición química del aceite esencial de cúrcuma, este mostró la presencia de monoterpenos y sesquiterpenos. Chen, et al. 53 establecieron que los extractos de C. longa generan efectos inhibitorios contra el hongo Fusarium graminearum, generando la rotura de la membrana celular fúngica y la inhibición de la síntesis de ergosterol. De igual forma, Avano et al. 54 reportaron actividad antifúngica sobre Fusarium verticillioides, en el cual la producción de ergosterol disminuyo significativamente, indicando un efecto del aceite en la biomasa del hongo; en otras palabras, los aceites presentaron propiedades antioxidantes. Asimismo, Hu, et al. 55 también establecieron más evidencias de la actividad antifúngica de C. longa, determinando un efecto relacionado a la disrupción del sistema de endomembrana celular.
En el caso de Z. officinale son varios los estudios que han demostrado su eficiencia en contra de diferentes fitopatógenos 56,57. Aniedi-Abasi Akpan, et al. 58 encontraron su eficacia al momento de reducir la biomasa micelial de Lasiodiplodia theobromae en especies de D. rotundata. Del mismo modo, Gwa and Nwankiti 59 evaluaron aceites esenciales de diferentes especies, incluyendo Z. officinale en cepas de Colletotrichum sp. extraídas de D. rotundata. Gwa and Nwankiti 59 también pudieron establecer que el aceite de Z. officinale es el más eficiente en contra del crecimiento de la biomasa del hongo; no obstante, dado que estos autores solo llegaron a nivel de género en la identificación del hongo, se desconoce sobre cual especie los resultados de eficacia antifúngica son tan altos. De esta forma en el presente estudio, dado que fue posible llegar a la identificación taxonómica a través de herramientas molecular de la especie C. gloesporioides, los resultados aquí obtenidos muestran que los aceites de Z. officinale son una alternativa de fácil acceso y uso por parte de comunidades rurales para mitigar la expansión de la antracnosis.
6 Conclusiones
Los resultados obtenidos en esta investigación muestran la importancia que tienen los aceites esenciales en la búsqueda de nuevas alternativas para el control de fitopatógenos que afectan los cultivos de interés agrícola. En este sentido, es posible asumir que los aceites esenciales de C. longa y Z. officinale presentaron actividad inhibitoria contra C. gloesporioides. Por lo tanto, se abre un área de investigación que ayude a buscar alternativas biológicas a contrarrestar los efectos de estos fitopatógenos en cultivos de D. rotundata, convirtiéndose este estudio in vitro en el primer reporte a nivel nacional como una alternativa promisoria para el manejo de la antracnosis causada por especies de C. gloesporioides en cultivo de D. rotundata.
Estos aceites esenciales mostraron como compuestos mayoritarios 3-Thujeno y citral respectivamente; no obstante, es necesario realizar pruebas más profundas, extrayendo estos compuestos y detallando su efectividad sobre el hongo. Ya que en el caso del citral se ha demostrado que tiene gran capacidad para inhibir el crecimiento microbial 60. Del mismo modo, con base en los resultados obtenidos de antagonismos es posible sugerir que estos aceites pueden ser una alternativa biológica amigable con el ecosistema para el control de la antracnosis en los cultivos de D. rotundata en el departamento de Sucre, Colombia