1 Introducción
El rol fisiológico de los antioxidantes es prevenir el daño a los componentes celulares que surgen como consecuencia de reacciones químicas que involucran radicales libres [1,2]. Son inhibidores del proceso oxidativo y constituyen la primera línea de defensa contra el daño generado por los radicales libres, siendo esenciales para mantener una salud óptima [3]. Los antioxidantes son una serie de compuestos químicos pertenecientes a metabolitos secundarios tales como flavonoides, ácido ascórbico (Vitamina C), carotenoides (Vitamina A) y tocoferoles (Vitamina E) [4-7].
Los musgos pertenecen a la división Bryophyta, el grupo más complejo entre las briofitas [8], que a su vez conforma el clado más diverso, con aproximadamente 12,000 especies [9], en su gran mayoría de amplia distribución [10-12]. Son componentes florísticos conspicuos en todos los hábitats terrestres adecuados para su crecimiento, transitando por el frío antártico hasta los exuberantes bosques tropicales [13]. Colombia goza de una gran diversidad briológica, con 932 especies de musgos, 704 hepáticas y 15 antocerotes reportadas [14, 15]. Dicha diversidad se concentra principalmente en la región Andina del país, la cual ocupa aproximadamente el 25% de la nación y contiene más del 90% de las especies de musgos [16].
El aprovechamiento de las briofitas como plantas medicinales ha sido común y frecuente en China e India y entre los nativos americanos desde tiempos antiguos [17]. Existen registros desde la etnobriología que exponen una serie de usos muy heterogéneos, entre los cuales están aliviar quemaduras, contusiones, heridas, fracturas [18-20], detener hemorragias, curar enfermedades oculares [19, 21, 22], combatir infecciones fúngicas, aprovechar propiedades anti apetitosas [21, 23], tratar enfermedades cardiovasculares y crisis nerviosas, reducir inflamación, y hasta usos como diurético, laxante, coagulante, contra el resfriado común. Además, se reportan propiedades antitumorales [5, 17-25], actividades antiriníticas, antipiréticas, anticonceptivas, antiflogísticas, hemostáticas, como antídotos, y tratando la ictericia, faringitis, amigdalitis, mastitis, neumonía, entre otras [26-29]. Incluso, algunos musgos pueden servir como alimento para humanos al tener un sabor dulce [30].
La aplicación de carácter farmacéutico tiene su razón en las sustancias biológicamente activas presentes en las briofitas [27, 31]. Estos se han descuidado durante mucho tiempo, porque los musgos son generalmente pequeños y difíciles de recolectar, siendo difícil la recolección de una especie particular en altas cantidades sin poner en peligro las poblaciones naturales; además, el muestreo puede causar que se entremezclen otras especies en las muestras. Por lo tanto, solo un pequeño porcentaje de taxones ha sido analizado desde el punto de vista fitoquímico [29, 30, 32, 33].
Entre los metabolitos secundarios de los musgos se detectan flavonoides, terpenoides, esteroides, compuestos aromáticos simples, cromanoles, alcaloides, derivados del bibencilo, del ácido ftálico, de cromonas, de p-terfenilo, cumarinas, saponinas, benzonaftoxanthenonas, compuestos que contienen nitrógeno y, además, acetogeninas, antocianinas, vitamina B2, triglicéridos y ácidos grasos altamente insaturados [11, 27, 30, 34-40]. También se detectaron compuestos volátiles, oxilipinas, fenoles, azúcares reductores, glucósidos, taninos y san-ioninas, entre otros [41-46]. En virtud de la presencia diversa de metabolitos secundarios, se logran determinar compuestos bioactivos, muchos de los cuales muestran una variedad excepcional de actividades y propiedades medicinales [27]. De ese modo, a los musgos se confieren actividades antifúngicas, antivirales, antibacterianas, citotóxicas, antiinflamatorias [22,23,43,47-51] y actividades anticancerígenas y antitumorales [25, 30, 52-54]. Adicionalmente, los musgos disponen de una actividad antioxidante [23, 32, 55-66], la cual se ve influenciada en algunos casos debido a distintos tipos de estrés fisiológico, ya sea por adquisición de metales pesados, desecación, choque térmico, radiación, o salinidad [24, 67-69].
En la actualidad, alrededor de un 5% del total de la brioflora mundial se ha estudiado químicamente [29]; entre estos estudios, los musgos, aunque más diversos que las hepáticas, han sido relativamente menos explorados en cuanto a sus metabolitos secundarios [39, 70-72]. En Colombia, los estudios de actividad biológica en musgos son exiguos. Sin embargo, en las últimas décadas se han realizado investigaciones determinando los principales metabolitos secundarios, la actividad antimicrobiana y la capacidad citotóxica del musgo Polytrichum juniperinum Hedw. [73]. Además, fue evaluada la capacidad antioxidante de los extractos totales de los musgos: Breutelia chrysea (Müll. Hal.) A. Jaeger, Dicranum frigidum Müll. Hal., Hypnum amabile (Mitt.) Hampe, Leptodontium luteum (Taylor) Mitt., Sphagnum sp. y Thuidium peruvianum Mitt. [74]. Pereañez et al. (2010) [75] examinaron el efecto de los extractos de 36 plantas entre las cuales se incluyeron seis especies de musgos (Breutelia chrysea, Dicranum frigidum, Leptodontium luteum, Sphagnum recurvum P. Beauv., Sphagnum sp. yThuidium peruvianum) sobre algunas actividades inducidas por el veneno total de la serpiente Bothrops asper Garman. El trabajo más reciente es Rodríguez-Rodríguez et al. (2012) [76], donde se evaluó la actividad antibacteriana de extractos etanólicos de los musgos Hypnum amabile y Sphagnum magellanicum Brid y de las hepáticas Metzgeria decipiens (C. Massal.) Schiffn. y Trichocolea tomentosa (Sw.) Gottsche.
En consecuencia, éste estudio pretende realizar un aporte al conocimiento sobre la actividad biológica de las briofitas de Colombia, contribuyendo en la investigación de antioxidantes naturales [66]. El objetivo principal fue la evaluación de la actividad antioxidante de extractos de musgos terrestres representativos de los bosques subandinos alrededor de Bogotá D.C., considerando tres especies de diferentes grupos filogenéticos: Breutelia subdisticha (Hampe) A. Jaeger (familia Bartramiaceae, Orden Bartramiales), Leptodontium viticulosoides (P. Beauv.) Wijk & Margad. (familia Pottiaceae, orden Pottiales) y Pylaisia falcata Schimp. (familia Hypnaceae, orden Hypnales). El segundo objetivo fue la comparación de dos métodos de extracción (etanólico y diclorometano) y dos métodos de medida de actividad antioxidante, DPPH* (2,2-difenil-1-picrilhidracilo) y ABTS*+ (Acido 2,2'-Azino-bis-3-Etilbenzotiazolin-6-Sulfonico), los cuales se basan en su capacidad para bloquear, atenuar o secuestrar radicales libres [77, 78, 79]. Ambos ensayos están basados en la transferencia de electrones. DPPH* es un radical nitrogenado orgánico y estable y posee un intenso color púrpura. La capacidad antioxidante se basa en la disminución de color, medida a 515 nm, por acción de un compuesto antioxidante, monitoreado espectrofotométricamente [80, 81]. Por su parte, el radical ABTS*+se basa en la capacidad antioxidante para secuestrar aniones radicales de larga vida. En el ensayo el ABTS*+ es oxidado por radical peróxido u otro oxidante [82-84] hasta formar el radical catiónico. Este método se basa en la capacidad de las moléculas antioxidantes (Trolox) para saciar la larga vida ABTS*+, un cromóforo azul-verde, medida a 754 nm, monitoreado igualmente mediante espectrofotometría [80, 85, 86].
2 Materiales y métodos
2.1 Material vegetal
Las especies seleccionadas para este estudio fueron los musgos Breutelia subdisticha (Bartramiaceae), Leptodontium viticulosoides (Pottiaceae) y Pylaisia falcata (Hypnaceae). Estas especies presentan una amplia distribución: B. subdisticha en el Neotrópico, desde México hasta Perú y el sureste de Brazil; L. viticulosoides en todo el trópico incluso las fajas subtropicales a subtemperadas en Norteamérica, Suráfrica, Asia y Australia; y Pylaisia falcata con una distribución supuestamente anfi-Pacífica, aunque mayormente ocurre en los Andes y las Cordilleras Centroamericanas hasta el centro de México, mientras los reportes de Asia son cuestionables. En Colombia, las tres especies se reconocen para la región de los Andes y la Sierra Nevada de Santa Marta en elevaciones desde los 1150 a 3680 m, en los departamentos de Arauca, Antioquia, Boyacá, Caldas, Casanare, Cauca, Cundinamarca, Magdalena, Nariño, Norte de Santander, Putumayo, Risaralda, Santander y Valle del Cauca [14, 16].
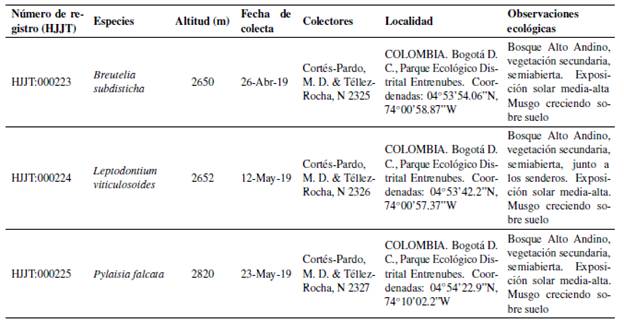
La recolección de los musgos motivo de estudio se realizó entre los meses de abril y junio de 2019, siguiendo el protocolo de Churchill & Linares [16], en el Parque Ecológico Distrital Entrenubes, ubicado en los cerros surorientales de la ciudad de Bogotá D.C. Este parque cuenta con un área de 627 hectáreas, entre los 2600 a 3100 m. Las coordenadas, sustrato y altura exactos de los musgos recolectados fueron: 4°53'90.1"N, 74°0.9'81.2"W, suelo, 2650 m (Breutelia subdisticha), 4°53'42.2"N, 74°0.9'56.2"W, suelo, 2652 m (Leptodontium viticulosoides) y 4°54'22.9"N, 74°10'02.2"W, suelo, 2820 m (Pylaisia falcata). Para las tres especies se recolectó solamente la fase gametofítica (sin esporófitos). Una vez recolectado, se procedió a trasladar el material al laboratorio, para separar especies entremezcladas y material que no correspondiera a los musgos (suelo, materia orgánica, etc.). Posteriormente el material se dejó deshidratar a temperatura ambiente durante 20 días. Se obtuvo de masa inicial para B. subdisticha 50.00 g, para L. viticulosoides 38.78 g y para P falcata 17.10 g.
La identificación taxonómica fue realizada en el Herbario José Jerónimo Triana (HJJT) por un especialista. Muestras representativas fueron depositadas en el mismo herbario, con los códigos de recolección 2325, 2326 y 2327, respectivamente (Tabla Suplementaria S1).
2.2 Preparación de extractos
Para la extracción total de los compuestos químicos presentes, se siguió el protocolo de Asakawa & Ludwiczuk [33]. Para ello, los musgos previamente deshidratados fueron triturados de forma manual. Seguidamente se empleó la técnica de extracción "Soxhlet", en donde se introdujo en el equipo Soxleth separadamente el material de cada musgo (B. subdisticha: 50.00 g; L. viticulosoides: 38.78 g; P falcata: 17.10 g) y se inició la extracción con solvente de media polaridad (CH2Cl2), con posterior extracción con solvente de alta polaridad (EtOH). El tipo de extracción fue sólido-líquido, con duración de 8 días, a temperatura de ebullición según el solvente. Una vez culminados los ciclos correspondientes, los extractos se concentraron en el rotaevaporador a una presión de 760 mbar para el extracto diclorometano y 200 mbar para el extracto etanólico, a una temperatura de 40°C y 70 rpm, obteniéndose los extractos deseados.
2.3 Preparación de soluciones patrón
Como soluciones patrón se realizaron preparaciones del radical DPPH*, radical ABTS*+, trolox, rutina y ácido ascórbico. Estas soluciones se prepararon de la siguiente manera.
Preparación radical DPPH * : se disolvieron (0.1 mMolar) 3.94 mg de DPPH* (2,2-difenil-1-picrilhidracilo), de la casa comercial Sigma-Aldrich, en 100 mL de metanol grado analítico. La solución se dejó reaccionar a temperatura ambiente durante 24 horas en la oscuridad. Posteriormente fueron preparadas soluciones de trabajo hasta obtener una absorbancia de 0.750 ± 0.050 para todos los casos, a una longitud de onda de 517 nm.
Preparación del radical ABTS*+: se disolvieron (7 mMolar) 360 mg de ABTS*+ (Ácido 2,2'-Azino-bis-3-Etilbenzotiazolin-6-Sulfonico), de la casa comercial Sigma-Aldrich, en 10 mL de agua desionizada: Luego se adicionó 66.23 mg. de persulfato de potasio (K2S2O8), (2.45 mMolar) aforándose a 100 ml de solución total con metanol. La solución se dejó reaccionar a una temperatura de 3 °C durante 48 horas en la oscuridad. Posteriormente fueron preparadas soluciones de trabajo hasta obtener una absorbancia de 0.750 ± 0.050 para todos los casos, a una longitud de onda de 754 nm.
Preparación de trolox: se preparó una solución stock (3.995 mMolar) en metanol disolviendo 10 mg de ácido 6-hidroxi-2,5,7,8-tetrametilcromo-2-carboxílico 97% (trolox), de la casa comercial Acros Organics, en 10 mL de metanol.
Preparación de rutina: se preparó una solución stock 1000 ppm (1.637 mMolar) de metanol disolviendo 10 mg de rutina, en 10 mL de metanol.
Preparación de ácido ascórbico: se preparó una solución stock 1000 ppm (5.68 mMolar), disolviendo 10 mg de ácido ascórbico (Vitamina C) en 10 mL de metanol.
2.4 Metodología para los ensayos
Curva de referencia del ácido ascórbico y rutina para DPPH*: en celdas de volumen reducido de 1.5 ml se prepararon 7 diluciones de 8 a 20 ppm para el ácido ascórbico y 9 diluciones entre 4 a 20 ppm de rutina, leyendo en espectrofotómetro visible a 517 nm, con intervalos de 10 minutos hasta 60 minutos.
Curva de referencia del ácido ascórbico, trolox y rutina para ABTS*+: en celdas de volumen reducido de 1.5 ml se prepararon 4 diluciones de 1 a 4 ppm para el ácido ascórbico y trolox y 9 diluciones entre 4 a 20 ppm de rutina, leyendo en espectrofotómetro visible a 754 nm, con intervalos de 10 minutos hasta 60 minutos.
Actividad captadora de radicales libres DPPH * y ABTS*+: se prepararon 9 diluciones entre 40 y 200 ppm de los extractos de las especies (Breutelia subdisticha, Leptodontium viticulosoides y Pylaisia falcata), utilizado el respectivo antioxidante DPPH* o ABTS*+ midiendo la absorbancia cada 10 min hasta 60 min. Para luego determinar los porcentajes de captación de radicales libres. El experimento se realizó por triplicado. Para los dos métodos el porcentaje de captación se calculó con base en la siguiente ecuación: % de Captación = [(A inicial - A final) / (A inicial)] x 100.
2.5 Determinación de la Concentración Media Inhibitoria IC50
De acuerdo con la ecuación de la curva logarítmica de la concentración inhibitoria, donde Y = m ln(x) + b obtenida de los (%) porcentajes de captación de radicales libres con respecto a sus concentraciones, se obtuvieron los valores del intercepto (b) y la pendiente ( m) , y tomando Y = 50 se determinó a ( x) que corresponde a la IC50.
2.6 Actividad antioxidante relativa (% AAR)
La actividad antioxidante relativa se determinó al obtener el cociente de la IC50 de cada extracto con respecto a la IC50 de cada patrón.
La experimentación se llevó a cabo en el laboratorio de Fitoquímica de la Fundación Universitaria Juan N. Corpas. Bogotá, Colombia.
2.7 Análisis estadístico
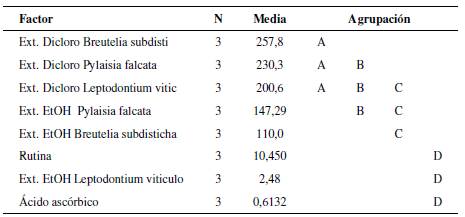
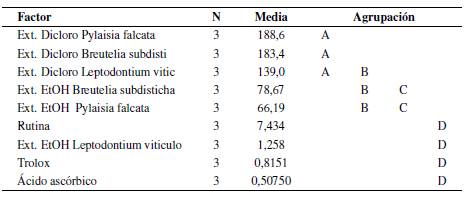
Los resultados de actividad antioxidante obtenidos por los dos métodos DPPH* y ABTS*+ (Tabla Suplementaria S2) fueron analizados por Análisis de Varianza a una vía (ANOVA) y comparación post-hoc de Tukey. Se consideraron diferencias significativas para p < 0.05. Para el análisis, se utilizó el programa estadístico Minitab 19. En el ANOVA, las variables respuesta corresponden a los valores de IC50, expresado en ppm, y las variables explicativas corresponden al porcentaje (%) de captación de los radicales libres. En el análisis de varianza de post-hoc de Tukey, las letras (A, B, C, D), corresponden al agrupamiento que se da como resultado de la similitud entre los datos del análisis de varianza.
3 Resultados
Los resultados de la evaluación de la capacidad antioxidante de los musgos B. subdisticha, L. viticulosoides y P. falcata, mediante los métodos aplicados de DPPH* y ABTS*+, fueron.
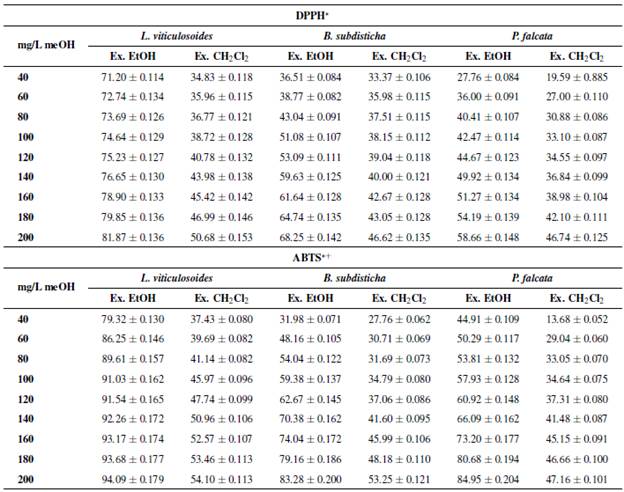
Método de decoloración DPPH*: los datos correspondientes al porcentaje de captación del radical DPPH* para los extractos etanólicos de las tres especies mostraron los mejores valores de absorción respecto a los extractos de diclorometano (Tabla 1). En primer lugar, se encontró L. viticulosoides, con 71.20 ± 0.114 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 81.87 ± 0.136 en una concentración de 200 mg/L. Para B. subdisticha, se observaron 36.51 ± 0.084 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 68.25 ± 0.142 en una concentración de 200 mg/L. Por último, siguió P. falcata, con 27.76 ± 0.084 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 58.66 ± 0.148 en una concentración de 200 mg/L (Tabla 1).
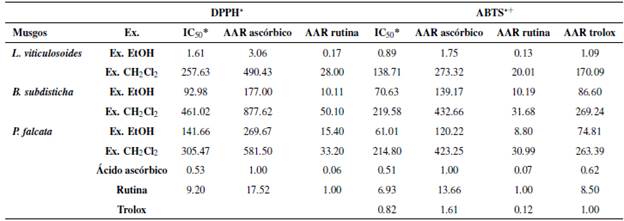
Con los porcentajes de captación de radicales libres por los métodos de decoloración DPPH* y ABTS*+ (Tabla 1) se calculó la concentración media inhibitoria IC50 (Tabla 2).
Tabla 2 IC50 y Actividad Antioxidante Relativa (% ARR) por métodos DPPH* y ABTS*+
Nota: *Concentración inhibitoria 50 (IC50) en mg/L de MeOH.
Los extractos etanólicos de las tres especies presentaron valores de IC50 más bajos que los estándares, es decir, mostraron una mayor capacidad antioxidante. Leptodontium viticulosoides presentó los mejores valores 81.61, llegando a superar al patrón rutina, seguido por B. subdisticha (92.98) y por último P. falcata (141.66) (Figura 1).
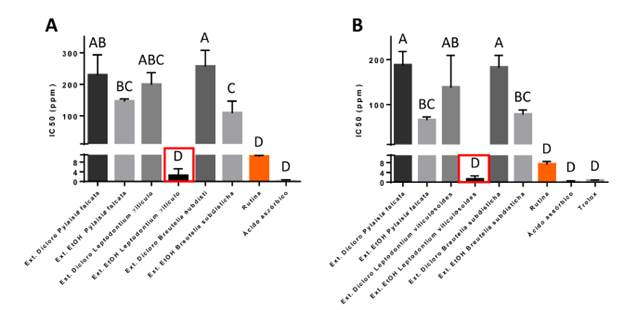
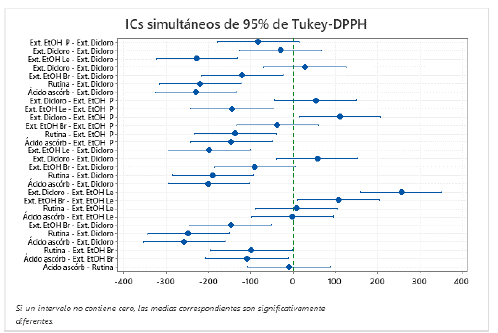
Figura 1 Valores de la IC50 para los diferentes extractos de las especies ensayadas y los controles positivos (ácido ascórbico, rutina y trolox). A. DPPH*; B. ABTS*+. Las letras más pequeñas de A, B, C, D indican los resultados de la comparación post-hoc de Tukey (nivel de confianza de 95%; Tablas y Figuras Suplementarias S3, S4, S5, S6). Se resalta en rojo el extracto con mayor capacidad antioxidante (menor valor de la IC50) el extracto etanólico de L. viticulosoides, el cual mostró capacidad antioxidante sin diferencias significativas con los controles positivos empleados (ANOVA a una vía, post-hoc de Tukey).
La actividad antioxidante relativa (% ARR) del extracto etanólico de L. viticulosoides, con respecto al ácido ascórbico, fue de 3.06 y 0.17 con relación a la rutina; el de B. subdisticha fue de 177.00 y 10.11, y el de P. falcata de 269.67 y 15.40. Los extractos etanólicos presentaron mayor actividad antioxidante, encontrándose como mejor extracto el de L. viticulosoides.
Método de decoloración del radical ABTS* + : los datos correspondientes al porcentaje de captación del radical ABTS*+ para los extractos etanólicos de las tres especies mostraron los mejores valores de absorción respecto a los extractos de diclorometano. En primer lugar, se encontró L. viticulosoides, con 79.32 ± 0.130 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 94.09 ± 0.179 en una concentración de 200 mg/L. Para P. falcata, se observaron 44.91 ± 0.109 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 84.95 ± 0.204. Por último B. subdisticha, con 31.98 ± 0.071 en una concentración de 40 mg/L y un máximo de absorción total del extracto de 83.28 ± 0.200 (Tabla 1). Con estos porcentajes de absorción de radicales libres se calculó la IC50 (Tabla 2).
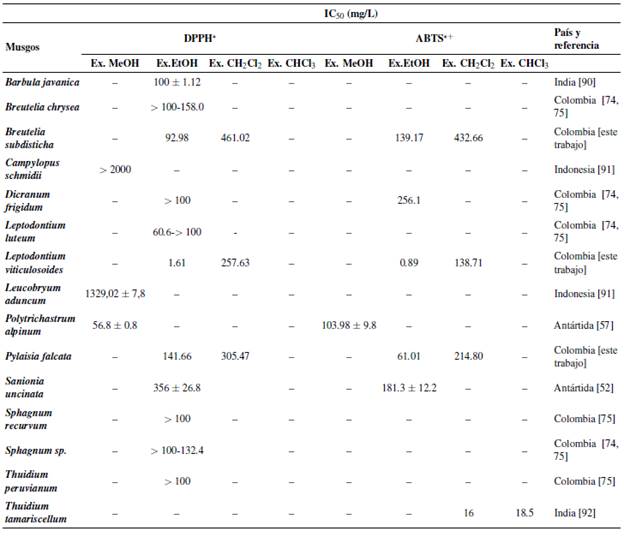
Tabla 3 Análisis de la actividad antioxidante por métodos DPPH* y ABTS*+ según diferentes estudios. Las especies están en órden alfabético
Igual como con el método anterior, cada uno de los extractos etanólicos de las tres especies presentaron los valores de IC50 más bajos que los estándares, exhibiendo una mayor capacidad antioxidante. Nuevamente L. viticulosoides presentó los mejores valores (0.89), llegando a superar al patrón rutina, seguido por P. falcata 61.01 y B. subdisticha (70.63).
La actividad antioxidante relativa (% ARR) del extracto etanólico de L. viticulosoides, con respecto al ácido ascórbico, fue de 1.75 con relación a la rutina 0.13 y 1.09 respecto a trolox. Para P. falcata, los valores fueron de 120.22, 8.80 y 74.81, respectivamente, mientras que para B. subdisticha fueron de 139.17, 10.19 y 86.60. Como en el método anterior, los extractos etanólicos fueron los que presentaron mayor actividad antioxidante, encontrándose como mejor extracto el de L. viticulosoides.
4 Discusión
En este estudio se reporta por primera vez la actividad antioxidante para los musgos Breutelia subdisticha, Leptodontium viticulosoides y Pylaisia falcata, especies terrestres comunes en las zonas andinas de Colombia y con amplia distribución al menos en el Neotrópico. Con este trabajo, también se logró la comparación directa entre diferentes grupos filogenéticos (Bartramiales, Pottiales e Hypnales) [13, 14, 87, 88, 89], diferentes métodos de extracción (CH2Cl2 y EtOH) y diferentes métodos de medición de la actividad antioxidante (DPPH*, ABTS*+). Esto permite conclusiones sobre posibles relaciones de la actividad antioxidante con la filogenia y los factores asociados (morfología, ecología) y, a partir de los métodos de extracción y medición de actividad antioxidante, sobre los posibles metabolitos secundarios que pueden ser involucrados en la actividad antioxidante. Al comparar nuestros resultados con estudios previos con otras especies de musgos que usaron los mismos métodos, se observa algunos patrones (Tabla 3). Primero, estudios de la actividad antioxidante en musgos usando los métodos DPPH* y ABTS*+ hasta ahora solo se han hecho en Colombia [74,75; este trabajo], India [90,92], Indonesia [91] y con especies originando de la Antártida [52, 57]. Segundo, hay pocos géneros para los cuales se investigaron más de una especie, y en ningún caso más de dos (Breutelia, Leptodontium, Sphagnum, Thuidium), y solo para dos familias se investigaron más de un género: Leucobryaceae (Campylopus, Leucobryum) y Pottiaceae (Barbula, Leptodontium). Para dos de los tres géneros considerados en nuestro estudio, Breutelia y Leptodontium, existe datos para otras especies, B. chrysea y L. luteum (para Ex.EtOH y DPPH*), ambas estudiadas también en Colombia [74, 75]. Mientras los resultados entre las dos especies de Breutelia son comparables (IC50 entre 90 y 160), teniendo B. subdisticha una actividad antioxidante ligeramente más alta que B. chrysea, se encontraron diferencias notables entre L. luteum y L. viticulosoides, el IC50 del último siendo casi dos órdenes de magnitud más baja (Tabla 3). Entre las dos especies de Sphagnum estudios en otros trabajos [74, 75] no se encontraron diferencias notables, mientras que para las dos especies de Thuidium, también incluido en otros estudios [75, 92], no hay datos directamente comparables. Con respeto a L. viticulosoides es notable que posee una mayor actividad antioxidante a partir del extracto etanólico que todas las demás especies investigadas, incluso Barbula javanica Dozy & Molk., una especie de otro género de la misma familia [90]. En el único otro caso de dos especies estudiados de diferentes géneros de la misma familia, Campylopus schmidii (Müll. Hal.) A. Jaeger y Leucobryum aduncum Dozy & Molk. (Leucobryaceae), los datos disponibles con base en los extractos metanólicos indican un nivel bajo de actividad antioxidante en ambos casos [91].
Estos resultados muestran que las relaciones filogenéticas no necesariamente permiten predecir el nivel de actividad antioxidante, ya que puede variar sustancialmente entre especies del mismo género (Leptodontium) y entre géneros de la misma familia (Barbula, Leptodontium), aunque en otros casos (especies de Breutelia y géneros de Leucobryaceae) es comparable. Alternativamente, se podría considerar factores ecológicos y exposición a contaminación. Por ejemplo, los ejemplares de Breutelia subdisticha utilizados en nuestro estudio se encontraron en un parque que hace parte de la ciudad de Bogotá, mientras que los ejemplares de Breutelia chrysea (Müll. Hal.) A. Jaeger fueron recolectados en áreas rurales del departamento de Antioquia [74, 75].
Al comparar todas las especies investigadas (Tabla 3), se evidencia que la variación en la actividad antioxidante según especie oscila entre más de tres órdenes de magnitud (IC50 de 1.61 hasta > 2000). Después de Leptodontium viticulosoides, siguen en forma ordenada de mayor a menor grado de actividad antioxidante las siguientes especies: Thuidium tamariscellum (Müll. Hal.) Bosch & Sande Lac. (Thuidiaceae, Hypnales) [92], Polytrichastrum alpinum (Hedw.) G.L. Sm. (Polytrichaceae, Polytrichales), [57], Leptodontium luteum (Potti-aceae, Pottiales) [74], Breutelia subdisticha (Bartramiaceae, Bartramiales) [este trabajo], Barbula javanica Dozy & Molk. (Pottiaceae, Pottiales) [90], Dicranum frigidum (Dicranaceae, Dicranales), Sphagnum recurvum (Sphagnaceae, Sphagnales) y Thuidium peruvianum (Thuidiaceae, Hypnales) [75], Sphagnum sp. (Sphagnaceae, Sphagnales) [74], Pylaisia falcata (Hypnaceae, Hypnales) [este trabajo], Breutelia chrysea (Bartramiaceae, Bartramiales) [74], Sanionia uncinata (Hedw.) Loeske (Scorpidiaceae, Hypnales) [52], Leucobryum aduncum (Leucobryaceae, Dicranales) y Campylopus schmidii (Leucobryaceae, Dicranales) [91]. Como mencionamos anteriormente, el patrón observado parece ser independiente de la relación filogenética entre los géneros y las especies [14, 88, 89]. Sin embargo, se reconoce que miembros de las familias Polytrichaceae y Pottiaceae presentan niveles de actividad antioxidante mediana a alta, mientras que en miembros de la familia Leucobryaceae es más baja. Notablemente, miembros de las familias Polytrichaceae y Pottiaceae generalmente viven en zonas abiertas, expuestas directamente a los rayos solares, mientras que especies de la familia Leucobryaceae prefieren suelos y maderas en descomposición en bosques húmedos tropicales a bosques andinos [16]. Esto suele soportar la hipótesis expuesta anteriormente que la ecología, más que la filogenia, determina el potencial antioxidante, a nivel de especie, género o familia. De esta forma nos podría llevar a predecir que especies, géneros y familias de musgos presentes en áreas urbanas o con mayor exposición a rayos solares y altos niveles de contaminación podrían ser los más prometedores términos de actividad antioxidante. Sin embargo, es importante notar que las dos especies estudiadas de la Antártida, Polytrichastrum alpinum y Sanonia uncinata [52, 57], defendiblemente occurriendo en un habitat extremo, demuestran niveles de actividad antioxidante variable (Tabla 3).
Los patrones con relación al ensayo ABTS*+ en su mayoría son comparables con los de DPPH*. Igualmente, L. viticulosoides presentó la mejor actividad antioxidante, seguido por Thuidium tamariscellum [92], Sphagnum sp. [74], Pyalisia falcata, Polytrichastrum alpinum [57], Breutelia subdisticha, Sanonia uncinata [52] y Dicranum frigidum [74]. Nuevamente encontramos que, en musgos expuestos directamente a los rayos solares, L. viticulosoides y T. tamariscellum [92], los aspectos ecológicos podrían ser un factor clave para el reconocimiento de especies con altas niveles actividad antioxidante. Como fue encontrado para DPPH*, igualmente para ABTS*+, la especie Sanionia uncinata, aunque basado en material de la Antártida, presenta menor actividad antioxidante [52], lo que indica que podría haber otros factores que determinan el potencial antioxidante en una especie dada. Sanonia uncinata es una especie de altas montañas y tierras frías ampliamente distribuida en el hemisferio norte. Se ha cuestionado su ocurrencia en el hemisferio sur, pero los autores del estudio [52] confirmaron su identificación mediante el marcador molecular del ITS, con el registro de GenBank de EU267027, el cual indica que S. uncinata en efecto es una especie cosmopolita, incluyendo como potencial sinónimo a S. georgicouncinata (Müll. Hal.) Ochyra & Hedenás, una especie descrita desde la Antártida. Aunque típica de tierras frías, S. uncinata crece en micrositios protegidos que se caracterizan por inversión local de temperatura, lo que podría explicar su bajo nivel de actividad antioxidante. Aparte de las diferencias entre grupos filogenéticos y taxones con diferente ecología, nuestro trabajo también confirma resultados de otros estudios que la actividad antioxidante varia bastante según método de extracción y de medida, es decir DPPH* y ABTS*+. La actividad antioxidante, evaluada en este estudio como la concentración de extracto que reduce el 50% de DPPH* y ABTS*+ (concentración inhibitoria 50; IC50), se clasifica de acuerdo a Makajanma et al., 2020 [91] en cinco categorías: muy fuerte (< 50 mg/L), fuerte (50-100 mg/L), moderada (101250 mg/L), débil (251-500 mg/L), y muy débil (> 500 mg/L). Por ende, según los valores obtenidos para DPPH* mediante el extracto diclorometano (CH2Cl2), B. subdisticha presentó una actividad moderada, mientras que L. viticulosoides y P. falcata presentaron una actividad débil. Por el contrario, según los valores obtenidos mediante el extracto etanólico (EtOH), L. viticulosoides mostró una actividad muy fuerte, B. subdisticha una actividad fuerte y P. falcata una actividad moderada. Una variación semejante se encontró con los valores obtenidos para ABTS*+. Con el extracto diclorometano (CH2Cl2), L. viticulosoides y P. falcata presentaron una actividad moderada y B. subdisticha una actividad débil, mientras que con el extracto etanólico (EtOH), L. viticulosoides mostró una actividad muy fuerte, P. falcata una actividad fuerte y B. subdisticha una actividad moderada. Es preciso señalar que el método DPPH* es más selectivo que el método ABTS*+ y se ha reportado que en el caso de los polifenoles la capacidad antioxidante cambia significativamente entre un método y otro [74]. Por lo tanto, las diferencias observadas entre los diferentes métodos podrían causarse por diferentes afinidades de los métodos a diferentes clases de sustancias involucradas en la actividad antioxidante. De ser así, el potencial antioxidante de una especie no se calcularía como promedio de los resultados de los diferentes métodos sino se indicaría por el valor que corresponde a la categoría más fuerte, la cual permite conclusiones sobre los metabolitos secundarios involucrados en el mecanismo antioxidante. Nuestro trabajo es el primero para musgos donde se permite comparar la sensibilidad de métodos de extracción (etanólicos versus clorofórmicos), claramente indicando que el método etanólico es más efectivo para sustancias con potencial antioxidante.
En cuanto a los métodos DPPH* y ABTS*+, las especies estudiadas muestran patrones diferentes. Categorías de potencial antioxidante más fuertes para DPPH* en comparación con ABTS*+ se encontraron para Dicranum frigidum [74, 75] y Polytrichastrum alpinum [57], mientras que el patrón invertido fue encontrado en Leptodontium visiculosoides, Pylaisia falcata [ambas este trabajo], Sanionia uncinata [52] y Sphagnum sp. [74, 75]; para Breutelia subdisticha [este trabajo] y Thuidium tamariscellum [92] no se encontraron diferencias sustanciales (Tabla 3). Notablemente, estas diferencias no se relacionan con la filogenia de estas especies [87, 88, 89].
Es importante notar que, tanto por el método DPPH* como por el método ABTS*+, Leptodontium viticulosoides presentó la actividad antioxidante más fuerte en comparación con las demás especies de musgos, prácticamente un orden de magnitud mejor que la segunda especie, Thuidium tamarisellum (Tabla 3). De hecho, L. viticulosoides mostró valores que no se distinguen significativamente de los patrones (ácido ascórbico, rutina y trolox), todos saliendo en el grupo D de la prueba de ANOVA y la comparación post-hoc de Tukey. Este nivel del potencial antioxidante se podría considerar extraordinario, indicando que L. viticulosoides constituye una fuente natural potente e importante de capacidad antioxidante, pero es necesario confirmar con más estudios. Leptodontium visiculosoides es una especie común, con amplia distribución, siendo pantropical y extendiéndose a zonas subtropicales y parcialmente templadas en Norteamérica, Suráfrica y Asia. Su abundancia y su amplia distribución indican que es una especie exitosa en términos evolutivos y su alto potencial antioxidante podría ser uno de los factores explicando esta distribución.
Considerando que los extractos etanólicos poseen una alta polaridad, la observación que dan los mejores resultados en términos de actividad antioxidante se podría explicar por la probable presencia de polifenoles [74]. Dentro de los polifenoles, se hallan los flavonoides, los cuales presentan actividad antioxidante con posible aplicación farmacológica [93]. Infortunadamente, para Breutelia subdisticha (Bartramiaceae) y Pylaisia falcata (Hypnaceae) no se encontraron datos sobre sus metabolitos secundarios, aunque en otras especies de Bartrami-aceae se han detectado flavonoides (biflavonoides, triflavonoides) [94, 95, 96, 99] y para otras especies de Hypnaceae se han reportado terpenoides (monoterpenoides, diterpenoides, sesquiterpenoides) [93, 97, 102-104] y flavonoides (biflavonoides) [98, 99, 100]. Para Leptodontium viticulosoides (Pottiaceae), un estudio registró la presencia de terpenoides (sesquiterpenoides) [105], mientras estudios enfocados en otros géneros de la misma familia han detectado terpenoides y flavonoides (biflavonoides) [99, 101]. Estos metabolitos secundarios actúan como compuestos bioactivos [39], catalogándose principalmente como antioxidantes, es decir, como moléculas con actividad redox, dinámicamente involucradas en el mantenimiento del equilibrio redox en la célula. Además, ejercen un efecto inhibidor sobre el crecimiento y desarrollo de patógenos [61, 106].
Los terpenoides y flavonoides son los antioxidantes mejor conocidos en el metabolismo secundario de las briofitas, mostrando un alto nivel de variabilidad en términos de abundancia relativa dentro de las diferentes especies [92, 106]. Los flavonoides son potentes captadores de radicales libres y pueden ser utilizados en terapias contra enfermedades asociados a estos radicales [107]. Lo mismo aplica a los terpenoides que, además de poseer la capacidad de prevenir la progresión de células tumorales, pueden modular el estado redox y actuar sobre procesos celulares como la proliferación celular, diferenciación, inflamación, apoptosis y angiogénesis [100]. Al mismo tiempo, se ha encontrado que la vía biosintética de los polifenoles en los musgos se activa tras el ataque de diferentes patógenos, lo que indica el papel importante de estos metabolitos secundarios en la protección, defensa y acción enzimática de estos organismos [106, 108]. Notablemente, el contenido de dichos compuestos fenólicos depende de varios factores como el tipo de sustrato, altitud, clima, hábitat, la condición ambiental o el genotipo [100], lo que soporta la hipótesis anteriormente mencionada de la relación entre el potencial antioxidante de las especies de musgos y su ecología. De hecho, se ha reportado que tanto flavonoides como terpenoides son los componentes principales de la tolerancia al estrés biótico y abiótico [109], incluyendo protección contra la luz, mediación con respecto a las interacciones bióticas y patógenas y cierta tolerancia a bajas temperaturas y la desecación [110-114], Por ejemplo, los musgos pueden sobrevivir períodos prolongados de estrés por frío mediante la producción incrementada de ciertos terpenoides [110]. Estas adaptaciones bioquímicas se ven acompañadas por adaptaciones morfo-anatómicas, particularmente con respecto a la tolerancia a la desecación. Aunque los musgos son poiquilohídricos, para solucionar el problema funcional de conciliar la conducción externa con las necesidades de intercambio de gases, poseen hojas papilosas (Pottiaceae) u hojas cóncavas que permiten tanto la conducción capilar externa como el intercambio de gas libre, o hojas cerosas repelentes al agua (Bartramiaceae) que facilitan la conducción periférica [111].
Los musgos estudiados aquí poseen diferentes hábitos de crecimiento [88, 89]. Leptodontium viticulosoides y B. subdisticha son acrocárpicos mientras que P. falcata es pleurocárpico. Notablemente, esto tiene una relación estrecha con la actividad antioxidante que exponen, siendo más fuerte en las dos especies acrocárpicos a partir de los extractos etanólicos por el método DPPH*. Esto se podría explicar por la observación que los musgos acrocárpicos contienen más alta concentración de flavonoides que los pleurocárpicos [115]. Curiosamente, esos autores encontraron que el contenido total de flavonoides de los briófitos que crecen a niveles de luz más bajos es generalmente más alto que las que crecen a pleno sol [115] lo que suele contradecir la hipótesis que el potencial antioxidante incrementa con la exposición solar. Sin embargo, el trabajo mencionado no aplica un análisis multivariado de los datos, así que no se puede excluir efectos de interacción entre los diferentes parámetros ambientales, tales como luz, hábitat, altitud y latitud [115]. Considerando que otros trabajos han señalado una relación entre el contenido total de flavonoides y factores ambientales como luz, hábitat, altitud y latitud [70], es evidente el potencial de estudios por adelante que podrían ayudar a resolver la importancia de estos factores.
5 Conclusiones
Nuestro estudio y la comparación con trabajos anteriores ha demostrado que la variación del potencial antioxidante en especies de musgos sigue un patrón complejo, dependiendo no solamente de parámetros como la ecología y factores como las relaciones filogenéticas, sino también de los métodos aplicados, tanto de extracción como medida de actividad antioxidante. Los datos disponibles hasta la fecha indican que la ecología juega un papel más importante que la filogenia. Los resultados sugieren que musgos que viven en zonas abiertas, expuestas directamente a los rayos solares, tales como áreas urbanas, por ejemplo, frecuente en especies de la familia Pottiaceae, podrían ser elementos prometedores de estudios sobre su posible actividad antioxidante. Sin embargo, la evidencia es parcialmente contradictoria y además es difícil desenredar las correlaciones que se dan entre la filogenia, morfología y ecología de las especies.
Nuestro estudio es el primero que suele indicar que la extracción etanólica es más efectiva que la extracción con diclorometano, pero hasta ahora no existen estudios que han comparado los cuatro métodos de extracción, incluyendo también la metanólica y la clorofórmica. Por lo tanto, no es posible poner los resultados de estudios que usaron solamente la extracción metanólica en contexto.
A partir de estos resultados, se recomienda seguir con estudios más profundos en cuatro direcciones: primero, una mayor comparación de muchas especies de musgos usando una amplia gama de métodos de extracción y poner los resultados en un contexto multivariado de parámetros ambientales, al mismo tiempo considerando las relaciones filogenéticas de las especies estudiadas; segundo, estudios sobre la composición de metabolitos secundarios de una amplia gama de especies; tercero, el enfoque en especies "modelo" donde se analiza la misma especie encontrada bajo diferentes condiciones, para evaluar el nivel de variación intraespecífica; y cuarto, hacer ensayos de tipo antitumoral para ver el potencial clínico de estos patrones.
Para las tres últimas direcciones, Leptodontium visiculosoides podría ser una especie candidata promisoria, considerando el alto potencial antioxidante encontrado para esta especie en nuestro trabajo, obteniendo valores de IC50 comparables a los patrones utilizados (ácido ascórbico, rutina y trolox). En consecuencia, se sugiere que este musgo L. viticulosoides sea objeto de investigaciones posteriores detalladas, realizándole aislamiento, purificación, y caracterización de los compuestos antioxidantes bioactivos y buscando aplicaciones como agentes terapéuticos, anticancerígenos y antitumorales.