1 Introducción
Los bosques riparios o ribereños son uno de los ecosistemas con mayor dinamismo, diversidad y complejidad en el Neotrópico [1]. Estos bosques son importantes dado que prestan diversos servicios ecológicos como: la protección de los cuerpos de agua en épocas de sequía y temporada de lluvia, permiten la generación de grandes cantidades de nutrientes que ayudan en la formación de redes de conexión y hábitats para diferentes especies [2, 3], funcionan como áreas de amortiguación que preservan las condiciones microclimáticas y químicas del agua, protegiéndola de agentes externos, y así evitar procesos de erosión de los márgenes de las corrientes y estabilizando los lechos de los ríos [4]. Asimismo, interfieren en la regulación del clima, la calidad del aire, el secuestro y almacenamiento de carbono para su transformación en biomasa [5]. Lo anterior convierte a estos ecosistemas en una zona de flujo constante de energía, jugando un papel fundamental en la preservación de los recursos loticos [5].
Dada una mayor disponibilidad de agua, pueden ser consideradas como áreas de transición entre diferentes ecosistemas adyacentes [6] y, por lo tanto, actúan como corredores biológicos en paisajes fragmentados [7, 8]. No obstante, sus beneficios hídricos también son empleados por el hombre, lo que los ha llevado estar fuertemente sometidos a presiones antrópicas producto de la expansión de las fronteras agrícolas y ganaderas [9]. El aumento de la deforestación y la extracción selectiva de especies para el comercio, ha provocado que la dinámica de estas zonas boscosas se vea gravemente afectada y en consecuencia el estado de conservación de su biodiversidad, provocando una drástica disminución de su cobertura vegetal, y sus servicios ecosistémicos [10].
Otro de los grandes problemas que presentan los bosques riparios es la falta de estudios que permitan conocer su diversidad y dinámica ecológica. En Colombia, son pocos los estudios florísticos realizados [11-14]. De hecho, la falta de conocimiento ha llevado a que estos sean tratados en términos de diversidad como otras zonas de vida. Por ejemplo, los fragmentos de bosque localizados alrededor de los arroyos dentro de la zona de vida propuesta por Holdridge [15] como seco tropical, son considerados como estacionalmente secos. No obstante, es claro que durante los periodos de sequía los arroyos generan diferentes condiciones de humedad que pueden brindar mejores condiciones para aquellas especies menos tolerantes a la desecación extrema [16]. En este sentido, García-Martinez and Mercado-Gómez [16] e Iriarte-Cárdenas, et al. [17] en los Montes de María (departamento de Sucre) localizados sobre los bosques secos de la llanura del Caribe colombiano, hallaron diferentes comunidades de briófitos asociadas principalmente a estos cuerpos de agua. De esta forma, es posible que una comunidad de plantas leñosas diferentes a las del bosque seco tropical puedan ocurrir en estas áreas. En este contexto, Mercado Gómez, et al. [18], analizaron la estructura ecológica en diferentes localidades en los Montes de María, incluyendo fragmentos de bosque seco sin fuentes hídricas cercanas y otros con presencia de arroyos. Estos autores hallaron que los fragmentos riparios presentan una estructura ecológica diferentes a aquellos sin presencia de fuentes hídricas. Además, algunos estudios han identificado que los bosques riparios son claves para proponer estrategias de conservación, dado que pueden funcionar como corredores biológicos [8, 19]; no obstante, datos sobre la estructura fisionómica de estas localidades son carentes, los cuales son claves para determinar el grado de perturbación y con esto establecer correctamente planes para su conservación y así emplearlos como posibles corredores biológicos en los Montes de María.
La toma de decisiones en torno a la conservación, el uso y el manejo de los bosques ribereños tropicales depende de la información consolidada sobre las especies de plantas que los componen, la forma en que éstas se distribuyen en el espacio y las comunidades que constituyen [11]. Según lo anterior, se hace necesario conocer la estructura fisionómica de estos bosques, ampliando así el conocimiento sobre la estructura vertical y horizontal de la flora leñosa, cobertura boscosa y taxones importantes [20]. Estos datos son relevantes para conocer la dinámica de la vegetación y así generar una aproximación sobre el estado de conservación de estos fragmentos [20]. El objetivo de esta investigación fue analizar la estructura fisonómica y diversidad de la flora leñosa de dos fragmentos de bosques riparios asociados al bosque seco tropical en los Montes de María en el departamento de Sucre. Además, la información fisionómica de los fragmentos fue empleada para conocer el grado de alteración antrópica a la cual se han visto afectados estos ecosistemas en los Montes de María, uno de los fragmentos de bosque seco tropical en mayor tamaño y mejor estado de conservación en el Caribe colombiano [21].
2 Materiales y métodos
Área de estudio. El estudio se realizó en dos localidades de los Montes de María (el departamento de Sucre). De acuerdo a los resultados obtenidos por Mercado Gómez, et al. [18], fue posible establecer dos localidades, El principio (municipio Ovejas) y Bremen, arroyo Colomuto (municipio de Morroa) que corresponden a ensamblajes de especies diferentes a bosque seco tropical, y por lo tanto, consideradas como bosques riparios. Geomorfológicamente, estas áreas pertenecen a las estribaciones septentrionales de la serranía de San Jerónimo, la cual es el resultado de diferentes eventos tectónicos del Mioceno, dando lugar a una zona de colinas y montañas conocidas actualmente como Montes de María y Serranía de San Jacinto [22]. Los Montes de María presentan un clima cálido con una temperatura promedio de 28 °C, humedad relativa entre 75% durante los periodos de sequía y 85% durante la lluvia. Presenta precipitaciones anuales de 1800 mm, con periodos de lluvias desde el mes de abril hasta noviembre, interrumpido en julio por un periodo ligeramente seco [23]. Asimismo, presenta un prologado periodo de sequía entre los meses de diciembre a marzo donde está alcanza los 100 mm [23].
Con respecto a la vegetación, esta corresponde a bosque seco tropical, dentro del cual Fabaceae, Malvaceae, Meliaceae, Sapindaceae, Capparaceae, Rubiaceae y Cactaceae son las familias de plantas más importantes; mientras que, en el caso de las especies, Ampelocera edentula Kuhlm, Aspidosperma polyneuron Mull. Arg, Brosimum alicastrum Swartz, Myrcia fallax (Rich.) DC. y Simira cordifolia (Hook.F) Steyerm, son las más abundantes [23]. No obstante, como gran parte del bosque seco tropical colombiano, estos fragmentos se encuentran en un mosaico de vegetación conformado por bosques, cultivos y zonas de pastoreo de ganadería [24].
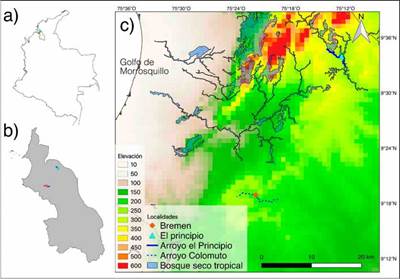
Figura 1 Localización geográfica de los puntos de muestreo en (a) Colombia, (b) departamento de Sucre y (c) los Montes de María, con rangos altitudinales, el bosque seco tropical y los arroyos Colomuto y El Principio.
Levantamiento de la flora leñosa. En Bremen y el Principio se muestreó un área total de 0,1 ha, siguiendo la metodología de transeptos tipo RAP propuesta por Gentry [25], con modificaciones realizadas por Mendoza [26]. En este sentido, se realizó el censo total de todos los individuos con un diámetro a la altura del pecho (DAP) ≥ 1 cm, y con una altura mayor de 150 cm. Una vez recolectados los ejemplares, todos los datos que pudieran perderse durante el proceso de prensado, fueron tomados con el fin de mejorar el proceso de identificación taxonómica. Posteriormente, los ejemplares recolectados fueron procesados de acuerdo a los protocolos estándares de prensado y secado del Herbario de la Universidad de Sucre (HEUS).
Composición florística. Para establecer la composición de las especies, se llevó a cabo el proceso de identificación taxonómica a través de claves taxonómicas [27-32]. Además, se realizaron comparaciones directas con ejemplares del Herbario HEUS y los casos de no contar con especímenes de referencias, fueron visitadas las plataformas virtuales de los herbarios COL (http://www.biovirtual.unal. edu.co), HUH (http://huh.harvard.edu), NY (http://www.nybg.org), y Jstor Plant Science (http://www.jstor.org/). Todas las muestras fueron depositadas en el herbario HEUS según la enumeracion de Alvarez. Todos los acronimos de herbario siguen a Holmgren, et al. [33] y las actualizaciones de Thiers [34].
Estructura de la vegetación. Para establecer si los muestreos fueron representativos fue calculado el número esperado de especies en cada de las parcelas a través de curvas de rarefacción y extrapolación-interpolación. Este método, descrito en Chao, et al. [35], usa la muestra y una curva de completitud elaborada con el doble del tamaño de la muestra de referencia más pequeña a comparar, con un intervalo de confianza al 95% obtenido por un remuestreo 100 pseudoréplicas de bootstrap. Estas curvas fueron realizadas a través del paquete de R iNEXT [36] siguiendo los parámetros establecidos por Chao, et al. [35] y Colwell, et al. [37].
Para determinar cuáles son los taxones de mayor importancia para las áreas de muestreo, datos como como riqueza, abundancia, frecuencia, dominancia de las especies y sus respectivos valores relativos se calcularon para establecer el índice de valor de importancia relativa, tanto para familias como para especies, basados en las fórmulas propuestas por Rangel and Velásquez [38]. Para ello se agruparon los individuos en tres clases altimétricas y diamétricas, incluyendo: I) Indivíduos de 1 a 5 m II) Indivíduos de 5,1 a 10 m III) Indivíduos ≥ a 10,1 m. Para el caso de la estructura diamétrica, las clases según el diámetro a la altura al pecho (DAP) fueron: I) Individuos de 1 a 16 cm II) Individuos de 16,1 a 22 cm III) Individuos ≥ a 22,1 cm. Una vez establecidas las clases, los datos fueron sometidos a una prueba de normalidad mediante el Test de Shapiro-Wilk, con el fin de determinar si existían diferencias significativas al interior de las clases diamétricas y altimétricas al interior de cada localidad, se realizó un ANOVA de una vía. En este orden, una prueba estadística Tukey fue desarrollada para determinar en qué clases se hallaron las diferencias. Todos los análisis estadísticos fueron realizados en programa PAST [39]. En base a los lineamientos propuestos por Mendoza [26], se determinó el hábito de crecimiento predominante dentro de los puntos de muestreo, elaborándose gráficas por cada localidad. Asimismo, se estableció el área basal para cada sitio, teniendo en cuenta el DAP de cada individuo censado.
Para calcular la diversidad alfa y beta de las localidades se emplearon en primer lugar, índices para medir la alfa diversidad (números de "Hill") expresada en el número efectivo de especies [40] a través del paquete de R Entropart [41]. De acuerdo con Jost [40] los números efectivos presentan tres niveles que incluyen: la diversidad del orden cero (0D) o riqueza de especies, la diversidad del orden uno (1D) o exponencial del índice de Shannon, que pondera la diversidad por la abundancia relativa de las especies y la diversidad del orden dos (2D), o inverso del índice de Simpson [42] que toma en cuenta las especies más abundantes. Asimismo, se calculó la disimilitud total en todos los sitios (β BRY ) y, por lo tanto, la diversidad beta, junto con sus componentes de variación equilibrada (β BRY . BAL ) y gradientes de abundancia (β BRY ,G R ) en el paquete de R Betapart [43]. Estos componentes, permiten establecer si las comunidades en el área de estudio se configuraron a través del recambio de especies (βbry.bal) o el anidamiento (βbry.gr).
3 Resultados
Composición florística. Se registraron un total de 690 individuos distribuidos en 75 especies, 68 géneros y 29 familias (Anexo 1 y 2), siendo Bravaisia integerrima (Spreng.) Standl., la especie con mayor dominancia en ambos sitios de muestreo (tabla 1). Las familias más importantes en términos de riqueza florística fueron Fabaceae con 10 especies, seguida de Sapindaceae (6 especies), Apocynaceae (5 especies), Bignoniaceae (5), Malvaceae (4 especies) y Arecaceae (4 especies). A nivel de géneros, Piper y Coccoloba fueron los más dominantes en las franjas de vegetación, ambos con 3 especies. Los géneros restantes se encuentran representados por un solo taxón a excepción de Gustavia. Malvaviscus, Terminalia y Randia todos con 2 especies. En su mayoría las especies presentan un número considerable de individuos a excepción de 25 especies que presentaron un solo registro, como Amphilophium paniculatum (L.) Kunth, Crescentia cujete L., Dilodendron costarricense (Radlk.) AH Gentry y Steyerm., Malvaviscus arboreus Cav., Mimosa pigra L., Paullinia alata (Ruiz y Pav.) G. Don, Ricinus communis L., Samanea Saman (Jacq.) Merr., entre otros.
Tabla 1 Listado de especies de bosques de galería en Montes de María, Sucre-Colombia.

Nota: *Especie que solo se encuentra en Bremen. **Especie que solo se encuentra en El Principio. Las especies sin asterisco se encuentran en ambas localidades.
Estructura de la vegetación. La completitud de especies del área de estudio fue de 89,04%, lo cual significa que el muestreo fue representativo, alcanzando el 93.7% para Bremen y 97.1% para El Principio (figura 2A). Para cada tipo de cobertura se observa que al aumentar el tamaño de la muestra de referencia en términos de individuos (316 para Bremen y 374 para El Principio) al doble (632 Bremen y 748 para El Principio) las estimaciones en la completitud del muestreo difieren poco, lo que significa que, aunque se recolecten más individuos en el área de estudio, el muestreo sigue siendo representativo para Bremen y El principio (figura 2A). Al comparar la riqueza de especies en relación al número de individuos entre las dos localidades se pudo establecer con un intervalo de confianza del 95%, que la riqueza plantas leñosas seguiría siendo superior en Bremen que, en El Principio, aun cuando todas las especies existentes fuesen registradas (figura 2B).
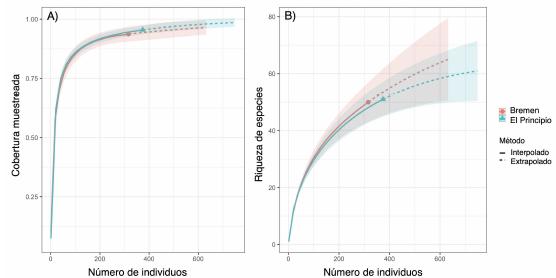
Figura 2 Gráfico de rango-abundancia basado en (A) la cobertura muestreada y (B) la riqueza de las especies de plantas leñosas de Bremen y El Principio.
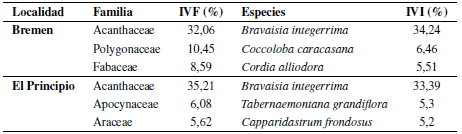
En términos de valor de importancia, en la localidad de Bremen, Acanthaceae presentó el mayor valor por familia (IVF) con un 32,06%, seguido de Polygonaceae con 10,45% y Fabaceae (8,59%). En El Principio la familia con mayor IVF fue Acanthaceae con 35,21%, seguido de Apocynaceae con 6,08% y Araceae (5,62%). A nivel de especie fue B. integerrima el taxón con mayor valor de importancia para Bremen y El Principio con el 34,24% y el 33,39% respectivamente. Coccoloba caracasana Meisn. (6,46%) y Cordia alliodora (Ruiz & Pav.) Oken. (5,51%) también fueron importantes para Bremen; mientras que Tabernaemontana grandiflora Jacq. (5,30%) y Capparidastrum frondosum (Jacq.) Cornejo & Iltis. (5,20%) para El Principio (tabla 2).
Tabla 2 Familias y especies con mayor IVF - IVI en Bremen y El Principio en el bosque seco tropical de los Montes de María, Sucre, Colombia.
El hábito de crecimiento predominante fue el arbóreo en ambas localidades; no obstante, Bremen presento mayores valores en comparación al El Principio (figura 3A). En el caso de los arbustos, estos fueron dominantes en El Principio, al igual que las palmas e hierbas. Para el caso de las lianas el mayor número de individuos estuvo presente en Bremen (figura 3A).
En cuanto a la distribución por clases altimétricas, en Bremen la mayoría de individuos censados se agruparon en la clase II (35%), seguido de la clase III (34,9%) y por último en la clase I (30,1%). En El principio el mayor número de individuos se agrupo en la clase I (39%), seguido de la clase II (34%) y clase III (27%) (figura 3B). Adicionalmente la altura máxima registrada fue de 30 m por la especie Ceiba pentandra (L.) Gaertn. Al comparar la distribución de los individuos por clases altimétricas, a través del ANOVA se pudo observar que no existían diferencias significativas entre las clases altimétricas de dos localidades (f = 0,1752; p = 0,9718).
Con respecto a la distribución de individuos por clases diamétricas (DAP), la localidad de Bremen presentó una tendencia por la case I con el 76,9% y la clase III con el 17,7%. En cuanto a la clase II, se observó un 5,4% de los individuos. Asimismo, en El Principio el comportamiento de los datos es semejante a Bremen en la distribución del número de individuos censados, con un 80,3% y 16% para la clase I y III respectivamente. De igual forma, se observa para la clase II valores del 3,7% (figura 3C). Al comparar la distribución de los individuos entre las 2 localidades mediante el uso de ANOVA, los datos mostraron diferencias estadísticamente significativas (f = 7,477; p =, 0009437) entre clases diamétricas. Según la prueba estadística Tukey la clase I (1-16 cm) fue quien presento variación significativa entre las dos localidades con respecto al resto de clases (figura 3C). Dentro de los dos puntos de muestreo se obtuvo un total de 16,42 m2 de área basal. Bremen presento 7,43 m2, mientras que El Principio 8,99 m2 en 0,1 ha. El resultado del análisis de varianza realizado a las áreas basales por localidades, mostró que no hay diferencias significativas (f = 0,9297;p = 0,4614) entre estas. Por otra parte, según la distribución por clases diamétricas, la clase III agrupó a los individuos con mayor valor de área basal (figura 3D).
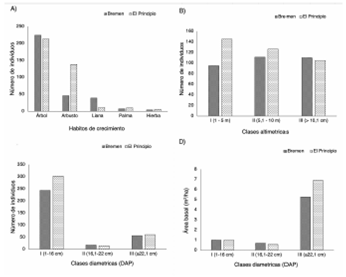
Figura 3 (A) Relación entre el número de individuos y los hábitos de crecimiento; (B) clases altimétricas; (C) clases diamétricas (DAP) y (D) área basal y relación clases diamétricas.
La diversidad entre los dos fragmentos de bosque riparios en los Montes de María, muestra que no existen diferencias significativas entre las dos localidades, ya que El principio presento (0D) 51 especies y Bremen 50. No obstante, para la 1D, El principio presentó dos especies efectivas más que Bremen (22,15 y 20,43 especies efectivas, respectivamente). Asimismo, los resultados de 2D, muestran que El principio tiene 3 especies dominantes efectivas más que Bremen (13,25 y 10 especies dominantes efectivas, respectivamente). Los índices de diversidad beta muestran los siguientes valores: βbry = 0,55, βbry.bal = 0,55 y β BRYGRA = 0,041. En cuanto a la diversidad Gamma (Г), los datos muestran un total de 75 especies entre las dos localidades.
4 Discusión
Florísticamente las áreas evaluadas se encuentran dentro de los rangos de riqueza de especies (21 y 121 especies) establecidos por Gentry [44] para las zonas de vida de bosque seco tropical (tabla 1), donde Fabaceae es considerada la familia con mayor riqueza en diferentes fragmentos de bosque seco a nivel Neotropical [23, 24, 45, 46], producto principalmente de sus múltiples adaptaciones morfológicas, fisiológicas y variados hábitos de crecimiento [44, 47]. Asimismo, un patrón marcado del bosque seco tropical es hallar como grupos más ricos (número de especies) a Sapindaceae, Bignoniaceae y Malvaceae [23, 24, 45, 46]. Cabe resaltar como un resultado diferente en este estudio es la presencia de Arecaceae como uno de las familias más ricas; no obstante, esta familia, aunque no es muy abundante en el bosque seco, sus especies presentan una fuerte asociación a ecosistemas con alta disponibilidad de agua [48], contribuyendo a la estabilidad y regulación de los cuerpos hídricos en las épocas secas. Adicionalmente sus especies ofrecen microhábitats para diferentes grupos de animales [49].
A nivel de géneros se pudieron observar diferencias significativas, entre las áreas muestreadas y otros fragmentos de bosque seco; por ejemplo, Banda, et al. [50] hallaron un patrón en los bosques secos Neotropicales, donde Cynophalla (Capparaceae) es sumamente abundante; empero en el Principio y Bremen, Piper (Piperaceae) y Coccoloba (Polygonaceae) presentaron mayores valores. Coccoloba puede estar asociado a zonas de ribera o ambientes más húmedos, lo cual explica su alta riqueza y abundancia en las áreas de estudio [51]. De igual forma, Piper está principalmente relacionado a zonas con alta pluviosidad y presencia de cuerpos de agua que mantengan la humedad de los suelos [52]; no obstante, también puede ser importante porque estos fragmentos de bosque se encuentran en algún estado de sucesión de la vegetación, y Piper, ha sido una especie indicadora de estos estados en el bosque seco [53]. Según lo anterior la riqueza de estos géneros puede estar asociada a sitios más húmedos y perturbados.
En términos de valor de importancia, la familia Acanthaceae obtuvo los mayores valores en ambas localidades. Este taxón es considerado una de las 15 familias con mayor riqueza en los trópicos, producto principalmente de un amplio rango de adaptaciones ecológicas y formas florales que les han permito adaptarse a diferentes ambientes [54]. Sin embargo, no es común encontrar a Acanthaceae como grupo dominante de áreas ribereñas, sino como especies de sotobosque en ecosistemas primarios [55]; empero es el número elevado de individuos, así como el área basal de B. integérrima, quien propicia los altos valores de importancia de esta familia. Tanto en Bremen como en El Principio el resto de familias tiene valores de IVIF por debajo del 10%; aunque, en Bremen Polygonaceae obtuvo valores ligeramente superiores. Polygonaceae al igual que Acanthaceae ocurre desde bosques tropicales hasta Andinos [56], y son los valores de Coccoloba los que la hacen ser una de los grupos con mayor importancia. En El Principio, Apocynaceae también presento altos valores de IVIF. Especies de esta familia son comunes tanto en áreas con suelos secos como inundables [57], lo que explica sus altos valores de importancia en las áreas de estudio.
A nivel de especie, B. integerrima presentó los mayores valores de importancia. Esta especie fácilmente ocurre en ambientes ribereños, ya que poseen raíces adventicias, las cuales presentan altos niveles de absorción y retención de líquidos, ayudando a mantener gran parte de las condiciones y características en el ecosistema [58, 59]; en otras palabras, esta especie presenta adaptaciones claras a zonas ribereñas. Resultados similares fueron encontrados por Sampedro, et al. [60] tras la evaluación de la vegetación en 6 sectores diferentes en Montes de María, donde esta misma especie presento los valores más altos de IVI en 3 sectores ribereños, lo cual indica su relevancia para los bosques riparios. Asimismo, en Bremen, Coccoloba caracasana y Cordia alliodora, también son importantes en términos de su abundancia. C. caracasana ha sido hallada comúnmente bosques riparios en zonas secas [61, 62] y bosques de galería [62]. En el caso de C. alliodora también presenta gran afinidad con zonas de vida forestales húmedas y muy húmedas [63]. En cuanto a El principio, Tabernaemontana grandiflora también obtuvo altos valores de importancia; sin embargo, a diferencia de las especies anteriores, esta puede hallarse en áreas de bosques secos, húmedos y zonas con vegetación perturbada entre 0 y 1200 m, características compatibles con las áreas de estudio [57], y por lo tanto, explicaría su importancia en las áreas de estudio. Capparidastrum frondosum también presentó gran abundancia en El Principio, y de acuerdo con Mercado-Gómez, et al. [30] esta especie puede tolerar diferentes ambientes tanto secos como húmedos; de hecho, dentro de los bosques secos, se halla principalmente en las zonas riparias [64].
Con respecto al hábito de crecimiento arbóreo fue predominante en ambos fragmentos de bosque. Estas áreas tienen gran suministro de agua, lo cual disminuye la defoliación durante los periodos de sequía, haciendo de las copas más amplias que limitan la radiación lumínica a estratos inferiores como el sotobosque [23], reduciendo el número de individuos con formas de vida arbustiva, liana y palma. Esta relación está claramente marcada en Bremen, sugiriendo que estos bosques se encuentran relativamente en mejor estado de conservación que El principio; no obstante, las concentraciones de lianas en Bremen evidencian algún grado de perturbación, ya que las lianas prosperan tanto en ambientes perturbados de forma antrópica como natural, debido a que la alteración favorece el ingreso de luz y permiten su rápido crecimiento [65]. De acuerdo con Schnitzer and Bongers [65] la perturbación a pequeña escala producto de la caída de los arboles es vital en el incremento de la abundancia de lianas; aunque también el corte y tala selectiva de la flora leñosa incrementa su abundancia. En términos generales, la presencia de este grupo en ambas localidades evidencia bosques perturbados en algún estado de regeneración.
En cuanto a la distribución por clases diamétricas, los datos aquí obtenidos permiten sugerir que la vegetación en ambas localidades, se encuentra en proceso de desarrollo en las etapas de crecimiento y producción vegetal más avanzadas [66], con una drástica disminución en el número de individuos agrupados hacia la clase diamétrica intermedia (II); es decir, hacia individuos que pueden estar en estados juveniles. Estos datos sugieren que estas áreas se han visto alteradas. Lo anterior es soportado por las clases altimétricas (figura 3B) y la distribución del área basal por clases diamétricas, los cuales muestran que los valores se acumularon en la clase superior (III) para ambos sitios, y con esto un patrón estructural de una comunidad perturbada. Los datos obtenidos en el presente estudio, permiten sugerir que las dos localidades aquí analizadas han estado sujetas a diferentes acciones que modifican las condiciones naturales del ecosistema. Un ejemplo claro de esto, es que durante el desarrollo de los muestreos en campo se observó la entrada de ganado en las áreas de estudio, no solo para el consumo de agua de los arroyos, también para el uso de las especies nativas como fuente de alimento. El aumento de actividades agrícolas por parte de nuevas y grandes fincas, ha contribuido a la quema indiscriminada de sus áreas boscosas y la tala de especies para la construcción de viviendas y muebles. Adicionalmente, el sobrepastoreo presente en estas áreas favorece la entrada de especies exóticas, transportadas por el mismo ganado desde zonas agropecuarias circundantes, evitando que se reestablezca la comunidad nativa de estos bosques, sin dejar a un lado la contaminación por materia fecal de los cuerpos de agua, que modifican las condiciones naturales del ecosistema resultando en una vegetación con fuertes variaciones en su densidad, composición y distribución [5, 67, 68].
El análisis de la diversidad alfa a través de números efectivos (0D, 1D, 2D) muestra que no existen diferencias significativas entre ambos sitios. Esto puede deberse a que ambas zonas comparten características semejantes en cuanto al paisaje, constituido principalmente por relieve de lomerío; además, del constante flujo hídrico del ecosistema, en gran parte ofrecido por los reservorios de aguas subterráneas como el acuífero en Bremen y de las corrientes de aguas perennes provenientes principalmente del vertimiento de aguas residuales en arroyos, como el Arroyo grande de Corozal y el Arroyo Mancomoján (para Bremen y El principio respectivamente). Asimismo, en ambas zonas la vegetación ha sufrido alteraciones similares en su composición, densidad y distribución de las especies, producto de la destrucción de bosques primarios a causa de la expansión de las fronteras agrícolas, siendo evidente la delimitación en las áreas de vegetación por zonas de cultivo y potrero [24]. Los resultados anteriores son soportados por la diversidad beta, la cual muestra que ambos fragmentos de bosques riparios corresponden a una misma comunidad, producto de un proceso de recambio espacial de especies, el cual puede ser el producto de la proximidad geográfica entre sitios [18,45].
Los resultados del presente estudio, muestran que estructuralmente los bosques de riparios en estas áreas se encuentran alterados, como una consecuencia de la expansión agrícola y ganadera. No obstante, se deben abordar análisis más profundos para determinar cuáles actividades han propiciado la actual estructura ecológica de estas comunidades, las cuales han generado la pérdida de especies potenciales y necesarias para el mantenimiento del ecosistema. Según lo anterior, son necesarias prontas estrategias para llevar a cabo procesos de restauración ecológica y así mejorar el estado de estos fragmentos antes de ser sugeridos como corredores biológicos en los Montes de María.














