1 Introducción
El buchón de agua (Eichhornia crassipes), también conocido como jacinto de agua, es nativo de Suramérica, principalmente en la región ecuatorial. Esta especie de planta es macrófito vascular flotante de agua dulce, se considera como maleza acuática y se desarrolla en zonas tranquilas o con ligero movimiento, como zanjas, canales, presas, arroyos, ríos y pantanos [1]. Sus tallos y hojas tienen forma de sacos llenos de aire, que le permiten suspenderse permanentemente en la superficie del agua. Presenta una reproducción tanto sexual como asexual, origina frutos en forma de cápsula, de manera que se multiplica y se prolifera extremadamente rápido [2]. Esta reproducción sencilla se efectua por división de los estolones, durante una estación favorable del año, originando naturalmente una red vegetal capaz de colonizar en poco tiempo una gran superficie acuática [3].
Generalmente, tiene un gran contenido de agua, superior al 90% [4]. Por otra parte, la base seca presenta alrededor de un 25% de contenido de celulosa, 35% de hemicelulosa, 10% de lignina, 25% de cenizas y 5% de otros compuestos, los cuales pueden tratarse de lípidos [5]. El alto valor de las cenizas está dado a la propiedad de esta planta para retirar sustancias de las masas de agua, como metales pesados [4].
Debido a la composición y a la disposición del jacinto de agua en superficies acuáticas, provoca evapotranspiración tres o cuatro veces superior a lo normal, consumiendo el cuerpo de agua y causando putrefacción, bloqueando la luz e impidiendo el desarrollo del fitoplancton. Además, absorbe el oxígeno que producen las plantas sumergidas y altera la química del agua, permitiendo el crecimiento de flora cianobacterial, entre ellas la Microcystis aeruginosa, una bacteria tóxica que produce varias neurotoxinas. Por tanto, dificulta la fotosíntesis dentro del ecosistema, envenenando así el agua y convirtiéndola en no potable. Esto hace que la planta esté considerada dentro de las 100 especies más invasivas del mundo por la Unión Internacional para la Conservación Natural (UINC), convirtiendo a esta especie en un problema ambiental.
Al retirar la planta de los efluentes se crearía una biomasa residual, la cual ha inducido al desarrollo de una gran cantidad de estudios alternativos, con el fin de valorizarla, aprovechando al mismo tiempo su alto contenido de celulosa, hemicelulosa y lignina, además de generar multiples productos (enzimas como celulasa, β-glucosidasa, xilanasa, xantogenato de celulosa, ácido levulínico, ácido shikímico, biogás, biohidrógeno, biopolímero, biobutanol, biofertilizantes, polímeros superabsorbentes, fibra de carbono, xilitol y bioetanol).
Dentro de los cuantiosos estudios con la planta, destaca su aplicación en tratamientos de aguas residuales. En la fitorremediación, la utilización de plantas acuáticas ha sido desarrollada como un tratamiento secundario o terciario alternativo de aguas residuales, y ha demostrado su eficiencia en la remoción de sustancias orgánicas, así como nutrientes y metales pesados, por medio de la biosorción, a través de vías de absorciones metabólicas o mediadas metabólicamente, para recuperar medios acuáticos contaminados con metales pesados como Cadmio (Cd), Zinc (Zn), Cromo (Cr), Plomo (Pb) y Cobre (Cu), comprobándose eficiencias de remoción de hasta 97% en los metales pesados y hasta el 98% en sólidos suspendidos [4].
Un uso interesante de la fitorremediación con jacinto de agua ha sido demostrado en la producción pecuaria. Esta planta acuática es capaz de eliminar un gran número de contaminantes presentes en las aguas residuales de los criaderos de cerdos y en el tratamiento de estiércol del ganado lechero, y de patos. Asimismo, en combinación con la lenteja de agua, puede disminuir hasta el 79% el nitrógeno total y el 69% del fósforo total del lactosuero, principal contaminante de la industria láctea [6].
También se ha pensado el uso de biomasa seca y molida para la elaboración de filtros biológicos y a la vez tratar las aguas contaminadas, aprovechando sus propiedades de manipulación hidrófila o hidrófoba, elasticidad, capacidad de absorción de agua, capacidad de adsorción o intercambio iónico, resistencia a los ataques microbiológicos y resistencia térmica. Puede ser modificada generalmente, mediante tratamientos físicos o químicos. Se ha observado que las raíces secas y molidas pueden eliminar alrededor del 70% de Zn, Cd, U, Pb [7].
A diferencia de lo anterior, el contenido considerable de polímeros de polisacáridos (principalmente celulosa), puede hacer que el jacinto de agua sea un buen candidato para la fabricación de bioetanol, como se describirá a continuación.
2 Producción de bioetanol, a partir de jacinto de agua
Actualmente, sólo el 1% del bioetanol se obtiene de la biomasa lignocelulósica, como biocombustible de segunda generación, donde los residuos forestales y agrícolas, más fracciones orgánicas de los residuos municipales, resultan ser las materias primas preferidas para la síntesis, al estar ampliamente disponibles como productos secundarios y como material de desecho, por lo que no es necesario enfrentarse al dilema de "alimento o combustible [8].
El jacinto de agua entra en esta tipología, principalmente debido a que esta planta está compuesta en su gran mayoría por celulosa y hemicelulosa. Sin embargo, el proceso de producción de etanol presenta niveles de complejidad mucho más altos, que los procesos para la producción de biocombustibles de primera generación. Comparando con la materia prima que contiene sucrosa, que puede ser asimilada directamente, y la biomasa almidonada, que es digerible después de un solo paso de hidrólisis, la biomasa lignocelulósica necesita un preacondicionamiento más extenso, para permitir la fermentación del etanol, debido a su estructura rígida. Además, la optimización, el diseño y la disposición del proceso desempeñan un papel importante en la maximización de los rendimientos en la obtención de etanol y en los sistemas de alta productividad [8].
La bioconversión del jacinto de agua es posible por los altos niveles de celulosa y hemicelulosa en la masa seca, lo que permite obtener mayores concentraciones de azúcares fermentables, que pueden convertirse en etanol por acción microbiológica, luego de que estos sean hidrolizados por técnicas químicas o enzimáticas. Entre los microorganismos empleados con mayor frecuencia se encuentran las levaduras, donde Saccharomyces cerevisiae, Saccharomyces uvarum y Candida utilis exhiben una mayor productividad [4].
La Figura 1 resume las distintas etapas de pre-tratamiento y fermentación para la biomasa ligno-celulósica. Combinan procesos individuales como: hidrólisis y fermentación separadas (SHF), hidrólisis y fermentación simultáneas (SSF), hidrolisis y cofer-mentación simultáneas (SSCF), bioprocesamiento consolidado (CBP) y bioprocesamiento integrado (IBP) [8].
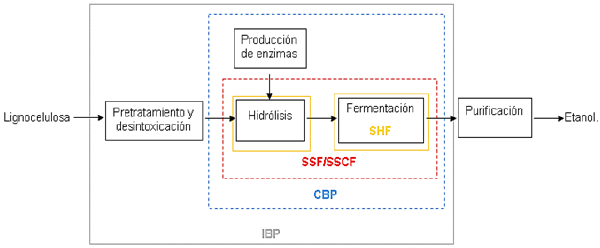
Figure 1 Diferentes estrategias de fermentacion y proceso general para la sintesis de etanol lignocelulosica [8].
En el proceso SHF, los índices más altos de hidrólisis enzimática se reportan a temperaturas que están por encima de los niveles óptimos de fermentación para microorganismos productores de etanol. Sin embargo, existen rendimientos muy bajos, debido a los efectos inhibidores de los productos de la sacarificación enzimática [8].
Por otra parte, en el proceso de SSF, se combinan la hidrólisis y la conversión de azúcares en un solo reactor, permitiendo obtener mayores rendimientos de etanol, con tiempos de reacción reducidos al aumentar las tasas de hidrólisis, puesto que la fermentación simultánea de la glucosa reduce la concentración de azúcares en el medio de fermentación y se reduce la inhibición de los productos de la celulosa [8].
En el proceso SSCF es posible cultivar cepas etanológicas que sean termoestables, con el fin de superar las diferencias de temperatura y los co-cultivos de especies fermentadoras de pentosas y hexosas, que permitan la conversión de todos los azúcares presentes. Sin embargo, respecto a las condiciones del proceso, deben ser compatibles [8].
De esta manera, en el proceso CBP se reducen costos al introducir la producción de enzimas por parte de ciertas bacterias y hongos celulíticos, con el fin de eliminar la necesidad de tener que producir o comprar celulasas por separado. Sin embargo, el proceso se enfrenta a bajos rendimientos de etanol y a largos periodos de fermentación, que reducen su eficiencia global [8].
Por último, en el proceso IBP la integración in situ de la deslignificación microbiana, en combinación con la producción interna de enzimas y la coutilización de productos secundarios, resulta ser una opción favorable para la producción rentable de etanol lignocelulósico, pero se necesita un mayor desarrollo para alcanzar la experiencia técnica [8].
2.1 Pretratamiento del Jacinto de agua
Desde el punto de vista energético y químico, el pretratamiento debe ser eficiente y se deben considerar varios criterios, como preservar la fracción de hemicelulosa, evitar la degradación o la pérdida de celulosa, así como la formación de compuestos que inhiban el crecimiento de los microorganismos en la fermentación y minimizar los costos del proceso. La generación de lignina de alto valor añadido, también puede ser un parámetro de comparación entre los distintos tipos de pretratamiento con el costo de las fases posteriores de recuperación del producto [9].
Entre los pretratamientos fisicoquímicos más exitosos se incluyen tratamientos termoquímicos como la explosión de vapor, donde el jacinto de agua debe ser tratado con vapor saturado a alta presión y, luego, la presión debe ser reducida rápidamente, haciendo que los materiales sufran una descompresión explosiva. El proceso tiene que iniciarse a una temperatura entre 160 °C y 260 °C, a una presión entre 0,69 MPa y 4,83 MPa, durante varios segundos, hasta unos pocos minutos, antes de que el material quede expuesto a la presión atmosférica. Los procesos causan la degradación de la hemicelulosa y la transformación de la lignina a alta temperatura, aumentando así el potencial de hidrólisis de la celulosa [10].
De igual manera, el pretratamiento alcalino también ha sido empleado, a partir de la saponificación de los enlaces éster intermoleculares, que entrecruzan las hemicelulosas del xilano y otros componentes, como, por ejemplo, la lignina. La porosidad de los materiales lignocelulósicos puede aumentar con la eliminación de los enlaces cruzados. Por ejemplo, algunos estudios han demostrado que el tratamiento con NaOH diluido (0.5%) causa hinchazón, lo que da lugar a un aumento en la superficie interna, disminución del grado de polimerización y cristalinidad, separación de los vínculos estructurales entre la lignina y los carbohidratos y perturbación de su estructura [5].
Tener una comprensión fundamental de las diversas tecnologías de pretratamiento puede ayudar a encontrar el mejor método/combinación para una determinada materia prima de biomasa [11]. Por lo tanto, es sumamente importante que se desarrolle un método de pretratamiento eficiente, rentable y respetuoso con el medio ambiente.
Adicionalmente, se ha evaluado la posibilidad de utilizar pretratamientos con enzimas degradantes de lignina, las cuales intervienen principalmente bajo reacciones oxidativas. Estas suelen ser producidas por Phanerochaete chrysosporium, Pleurotus ostreaus, Ceriporia lacerata, Pycnoporus cinnarbarinus, Cyathus stercolerus, C. subvermispora [12]. El objetivo principal del pretratamiento enzimático es hidrolizar la hemicelulosa y deslignificar.
En primer lugar, varias enzimas auxiliares atacan a la hemicelulosa, como la glucuronidasa, la acetilesterasa, la feruloilesterasa, la xilanasa, la NL-xilosidasa, la galactomanasa y la glucomananasa [13]. Posteriormente, la lignina peroxidasa degradan el componente de lignina no fenólica, mientras que la peroxidasa de manganeso degrada las unidades tanto fenólica como no fenólica [14]. Por otra parte, las lacasas (enzimas que contienen cobre) actúan sinérgicamente con las peroxidasas, lo que da como resultado una degradación completa de la lignina, debido a la oxidación de las unidades fenólicas de esta [15].
3 Hidrólisis
Posterior al pretratamiento de remoción de lignina y otros compuestos indeseables, la hidrólisis convierte la celulosa y/o hemicelulosa a sacáridos simples, a través de un tratamiento químico o enzimático. El jacinto de agua, al poseer distintas estructuras de celulosa cristalina, presenta uno de los mayores inconvenientes en este paso del proceso. Aunque la hemicelulosa es fácilmente hidrolizable, su carbohidrato principal, la xilosa, es difícil de fermentar en alcohol. Estudios de algunos autores indican que se necesita utilizar diferentes ácidos para producir xilosa, arabinosa, glucosa y ácido acético, mediante la ruptura de los enlaces β -1,4 de la glucosa o los monómeros de xilosa o grupos acetilos [13].
El azúcar fermentable total disponible mediante hidrólisis ácida puede ser del 90% del valor teórico del azúcar presente. El proceso de dilución de los ácidos debe llevarse a cabo a temperaturas de 120 °C a 200 °C y presiones entre 103 kPa y 517 kPa, con tiempos de reacción en el rango de 30 minutos a 2 horas, mediante procesos continuos [13].
Los procesos de ácido concentrado (60%) pueden tener éxito, para producir mayores rendimientos de azúcar, mayores al 90%, tanto para los azúcares de xilosa como de glucosa. Este proceso implica típicamente el uso de temperaturas suaves y presiones moderadas, creadas por el bombeo de materiales de un recipiente a otro, para una hidrólisis efectiva [13].
No obstante, los procesos de hidrólisis ácida tienen varias desventajas, debido a la formación de compuestos no deseados, como el furfural, el hidroximetilfurfural, 5-hidroximetilfurfural, ácido acético, ácido fórmico, ácido levulínico, etc., que inhiben la fermentación, debido a que en las reacciones químicas se generan sustancias toxicas que inhiben a las células y, por consiguiente, afectan al crecimiento especifico de células y el rendimiento de masa por ATP [5]. Así mismo, la eliminación de estos compuestos causa costos adicionales. El uso de la cal para neutralizar el ácido tiene la desventaja de una pérdida significativa de azúcar en forma de yeso. Estos procesos podrían ser reemplazados por separaciones cromatográficas muy económicas con reciclaje de ácido. Por lo tanto, para muchos autores, este método es de bajo rendimiento y además generan muchos subproductos perjudiciales para el ambiente [13].
En contraposición, se utilizan bases tales como el hidróxido de sodio al 5% en peso o 10% en peso. Se esterilizan con diferentes tiempos de 30 a 60 minutos, y luego se neutraliza con agua. Sin embargo, aunque no genera subproductos tóxicos, se ha demostrado que tiene una producción menor que la hidrólisis ácida, ya que la sustancia alcalina conlleva a un hinchamiento que no necesariamente implica hidrólisis o modificación en su composición química [5].
Por otra parte, autores como Teixeira et al. reportan el uso de celulasas como alternativa de hidrólisis, las cuales se clasifican en tres grandes grupos, según su ubicación en el sustrato de celulosa: (i) endoglucanasas (EnG), que rompen los enlaces internos de la fibra de celulosa, (ii) exoglucanasas (ExG), que actúan en la región externa de la celulosa y (iii) β-glucosidasas (BG), que hidrolizan oligosacáridos solubles en glucosa [4]. Sin embargo, varios estudios indican que es importante y necesario optimizar un proceso previo de pretratamiento, que permita mayor facilidad de hidrólisis de los materiales lignocelulósicos, para producir un alto rendimiento de glucosa [17].
Por otra parte, varias investigaciones han evaluado los efectos de las diferentes condiciones del proceso de pretratamiento biológico, como el contenido de humedad inicial (CMI), el tamaño del material, la adición del cofactor Mn2+, para la degradación de la lignina, y melaza, para incrementar la producción de bioetanol al aumentar la concentración de glucosa. Los resultados demostraron que la elección de un contenido de humedad inicial (CMI) del 70% puede proporcionar un aumento del rendimiento de la glucosa hasta el 17% y el uso de material con tamaño de partícula fino un 20%. La adición de melaza en una concentración del 2% permite alcanzar rendimientos alrededor del 44% y el uso cofactor Mn2+ al 0.5% puede aumentarlo significativamente hasta un 67%, durante 16 días de incubación [17].
La hidrólisis enzimática para muestras de celulosa pretratadas con un cóctel de enzimas comercial, con buena empleabilidad en el proceso de sacarificación, denominado Celluclast, producida por Novozymes, ha reportado rendimientos superiores al 80% en la liberación de azúcares reductores [4]. De la misma manera, se ha estudiado la hidrólisis de la paja de trigo, utilizando una mezcla de enzimas que contiene lacasa de Trametes versicolor, Celluclast 1.5 L, Novozyme 188, observándose un rendimiento máximo de etanol de 13 g/L, así como el rendimiento de azúcares monoméricos de 0.56 g/g del sustrato [18].
Actualmente, se está investigando el desarrollo tecnológico de la obtención de etanol ligno-celulósico, mediante enzimas de bajo costo, a través de la selección de ciertos microorganismos que pueden producirlas, tales como el hongo filamentoso Trichoderma reesei, Aspergillus niger o levaduras de los géneros Trichosporium y Cryptococcus, junto con bacterias de los géneros Bacillus, Pseudomonas y Cellulomonas, debido a que su uso resulta en una degradación de holocelulosa y lignina entre un 45% a 80% [13].
Las cepas recombinantes de Saccharomyces cere-visiae pueden ser genéticamente modificadas para llevar a cabo la sacarificación y fermentación simultáneas (SSF), para producir endoglucanasa ex-tracelular y β-glucosidasa, que fermentan la celulosa y la hemicelulosa a azúcares de 6 y 5 carbonos, de donde se deriva la posterior fermentación a etanol [13] [19] [20]. Por lo tanto, el pretratamiento biológico con varios microorganismos puede ir seguido de una hidrólisis eficaz para mejorar la producción deseada del alcohol [21].
3.1 Recuperación de azúcar
La biomasa del jacinto de agua puede ser un elemento clave para la producción de azúcares fermentables y sostener bioproductos como el bioetanol, pues la disponibilidad de diferentes tipos de azúcares (glucosa, xilosa, galactosa, arabinosa, manosa, celobiosa y lactosa) hace posible el uso de varios tipos de enzimas y microrganismos para la degradación de la estructura lignocelulósica [22].
Por ejemplo, en un estudio con jacinto de agua y lechuga de agua tratadas con el hongo de la podredumbre blanca Phanerochaete chrysosporium, se demostró que el primero fue más susceptible a la biodegradación de la hemicelulosa y la lignina, donde la descomposición de la hemicelulosa incrementó el contenido de azúcares extraíbles de la biomasa hasta el 70% [23]. Esto quiere decir, que la hidrólisis enzimática es necesaria para la recuperación de azúcares, permitiendo que los carbohidratos queden accesibles para la bioconversión a etanol.
Otras investigaciones reportan la combinación de pretratamientos químico-biológicos de jacinto de agua para mejorar la producción de bioetanol [24]. Se ha indicado que el pretratamiento microbiano, combinado con ácido diluido, suele ser el método más eficaz, a la hora de obtener una mayor extracción de celulosa (-39%), generando la mayor producción de azúcares reductores (-0.43 g/g). Adicionalmente, gracias a los análisis de microscopía electrónica de barrido y de espectroscopía infrarroja por transformada de Fourier, se indicó que el tejido básico del jacinto de agua fue significativamente destruido. En cuanto a la producción de bioetanol, alcanzaron una concentración de 1.40 g/L después de la fermentación, lo que podría proporcionar una forma extremadamente prometedora para la utilización del jacinto de agua [24].
Por otro lado, algunos estudios indican que la producción de bioetanol, a partir de jacintos de agua tratados con NaOH/H2O2 a 25 °C, aumentan la producción de azúcares reductores (∼0.22 g/g seco) y disminuyen la cristalinidad de la celulosa (∼ 12.18%), en comparación con muestras no tratadas (∼0.05 g/g seco y ∼22.80%) [24].
4 Fermentación
Para la producción de biocarburantes como el bioetanol, los azúcares simples que se obtienen de las fases anteriores son transformados, gracias a la acción de determinados microorganismos. La más común es la levadura natural Saccharomyces cerevisiae, que presenta una actividad óptima a temperaturas entre 32 °C y 35 °C a un pH ácido entre 3 y 5. Esta levadura acumula el bioetanol en su crecimiento, tolerando concentraciones de hasta 11%, bajo condiciones normales [4]. Por lo tanto, se ha buscado utilizar otros microrganismos que, además de permitir un mejor aprovechamiento de la biomasa celulósica, tengan una mayor tolerancia al alcohol.
Bajo la premisa anterior, en revisiones anteriores se ha hablado que se han utilizado Zymomonas mobilis, Scheffersomyces stipitis, Candida shehatae, Clostridium thermocellum, Trichoderma reesei, Pichia stipitis, Candida tropicalis y Kluyveromyces marxianu, donde se ha observado que el rendimiento de la producción de etanol a partir del jacinto de agua es de 0,12 g/g de etanol, inferior al de la paja de arroz 0,18 g/g de etanol y al de la paja de trigo 0,2 g/g de etanol [22]. Otros microorganismos utilizados en el proceso de fermentación son Escherichia coli, Candida brassicae, Pachysolen tannophilus y Mucor indicus. Además, los científicos también han descubierto que la levadura Bret-tanomyces clausenii actúa sobre la Celobiosa y puede utilizarse en la sacarificación y fermentación simultáneas (SSF) de la celulosa al etanol [25].
Así mismo, se indica que el utilizar Kluyveromyces marxianu (K213) en vez de Saccharomyces cerevisiae, puede incrementar la producción de etanol hasta 1.78 veces más [24].
4.1 Estrategias de proceso
Son varias las estrategias que se han planteado para la obtención de bioetanol, a partir de material lignocelulósico, teniendo en cuenta las diferentes fases de proceso. Entre ellas, se destacan las siguientes:
Hidrólisis y fermentación separadas: el material lignocelulósico primero se descompone en azúcares monoméricos, mediante sacarificación química o enzimática y después se fermenta para convertirse en etanol [25]. La principal ventaja de este proceso es que ambas etapas pueden funcionar en sus condiciones específicas de reacción normalizada. No obstante, la principal limitación es la inhibición de la actividad de la celulasa, por los azúcares liberados en la fase de hidrólisis [25].
Hidrólisis y fermentación simultáneas: la biomasa lignocelulósica se sacarifica y fermenta simultáneamente en un solo reactor [25]. En esta estrategia, las enzimas se utilizan hasta niveles máximos, de manera que la concentración de azúcares solubles no alcanza el nivel de inhibición de los microorganismos fermentadores, haciendo que la producción total de etanol sea mejor que en los procesos por separado. Así mismo, las unidades de glucosa y celobiosa no inhiben las actividades de la celulasa, debido a la acción inmediata de la fermentación simultánea [25]. La principal limitación es que la temperatura óptima requerida para la actividad de la celulasa es generalmente más alta que la temperatura apropiada requerida para la actividad de la levadura y de numerosas cepas de fermentación bacteriana de biocombustibles [25].
Sacarificación y fermentación simultáneas no isotérmicas: en este método, la hidrólisis enzimática se lleva a cabo a la temperatura óptima y, después de la inoculación de los medios, la temperatura se fija en un valor óptimo para los microorganismos, utilizando dos reactores separados, que trabajan simultáneamente en modo continuo, con el fin de que la glucosa formada como resultado de la hidrólisis sea absorbida instantáneamente por los microorganismos para la fermentación, para mitigar los efectos inhibitorios vistos en la hidrólisis y fermentación separadas [25]. Para tal propósito, una porción de biomasa celulósica pretratada se traslada a un reactor de hidrólisis enzimática a la temperatura óptima (∼50 °C). Luego, el efluente hidrolizado pasa a un biorreactor, donde se lleva a la temperatura óptima para los microorganismos productores de alcohol (30 °C). Se ha comprobado que la actividad de la celulasa aumentaría hasta dos o tres veces cuando la temperatura de hidrólisis es de 50 °C en lugar de 30 °C y la necesidad de enzimas totales también se reduce entre el 30% y 40%, en comparación con las condiciones empleadas en la fermentación y sacarificación simultáneas [25].
Sacarificación y cofermentación simultáneas: este es un proceso en cascada, que implica la asimilación microbiana de los azúcares liberados por el pretratamiento e hidrólisis simultánea de material lignocelulósico y tiene el potencial de reducir el costo total de la producción de alcohol, ya que los azúcares de la pentosa de la hemicelulosa también se fermentan a etanol, reduciendo además el efecto inhibidor de la xilosa, gracias a una adaptación de la levadura y desintoxicación biológica gradual [25, 26]. Así, se permite un mejor aprovechamiento de la mayoría de azucares presentes en la materia prima. Al tiempo que se mantiene la concentración de glucosa lo más baja posible, se produce un aumento de la relación xilosa/glucosa, que es necesaria para el proceso de cofermentación de la hexosa y la pentosa [25]. Sin embargo, los microrganismos fermentadores de pentosas aún no están ampliamente desarrollados para una aplicación a escala comercial [26].
Conversión microbiana directa/bioprocesamiento consolidado: se llevan a cabo simultáneamente diferentes acciones con los microorganismos empleados, entre ellas, la producción de enzimas, la sacarificación/hidrólisis enzimática y luego la fermentación de los azúcares resultantes en bioetanol o en cualquier otro producto valioso [26]. Se han empleado varios tipos silvestres de bacterias, hongos y levaduras manipulados genéticamente [25]. Lo que sucede es que la biomasa lignocelulósica se hidroliza para obtener azúcares fermentables, con la ayuda de la conversión de los azúcares celulósicos y hemicelulósicos a etanol por un único microrganismo o una mezcla de estos, sin aditivos de preparados enzimáticos comerciales [26]. Por lo tanto, es una técnica eficiente y económicamente viable de interés. Los principales obstáculos que dificultan la aplicación práctica de la tecnología de biotransfor-mación son el costo de producción de las enzimas y la baja eficiencia. Además, debido a la heterogeneidad y la variabilidad de composición de la biomasa lignocelulósica, la misma enzima puede no ser eficiente para todos los azúcares y, por lo tanto, un cóctel de enzimas multifuncionales puede resultar más eficiente [25].
4.2 Fermentación alcohólica
Se han investigado métodos de fermentación y los microorganismos relacionados, con dos plantas acuáticas típicas de flotación libre: el jacinto de agua y la lechuga de agua, para su utilización en la producción de etanol [27]. Se encontró que, a excepción de la arabinosa, ambas presentaban similitudes en el contenido de azúcar, con algunas pequeñas diferencias en el contenido de almidón (ligeramente superior en la lechuga de agua) y la celulosa y hemicelulosa (mayor en el jacinto de agua). Al utilizar una cepa tradicional como Saccharomyces cerevisiae se han observado producciones de etanol alrededor de 15 g/L.
Sin embargo, un estudio con una cepa recombinante, Escherichia coli (KO11), presentó incrementos de hasta 13% en la fermentación, al permitir trabajar en modo de sacarificación y fermentación simultáneas, más eficaz que si se hace de forma separada [27]. Por otra parte, investigaciones con Pichia stipitis, aplicadas a una biomasa de jacinto de agua pretratada con ácido diluido, para aprovechar al máximo el contenido hemicelulósico, mostraron que el 73% de la xilosa se convertía en etanol [30]. Otras alternativas proponen el uso de bacterias termotolerantes como la Clostridium thermocellum, las cuales pueden producir bioetanol a una temperatura de 44 °C, lo cual puede compaginar con los procesos de sacarificación enzimática [4].
Independiente de los microorganismos a utilizar, el proceso se definirá por la cantidad que se quiera producir y la estrategia de la metodología a aplicar. Con base a lo anterior, se presentan diferentes modalidades de fermentación a saber:
Fermentación por lotes: los microorganismos tienen que funcionar a un nivel alto de sustrato en la fase inicial de los experimentos. Sin embargo, al final tienen que trabajar a altas concentraciones de productos. Este proceso requiere una serie de recipientes y, en este modo, el proceso se controla fácilmente. No obstante, proporciona rendimientos más bajos después de operaciones exhaustivas. Adicionalmente, este tipo de procesos requieren una compleja tarea preliminar que incurre en altos costos de mano de obra, debido al inicio y cierre irregular de las operaciones. Con relación a estos inconvenientes innatos y a los menores rendimientos, el mercado comercial cree en el cambio hacia otras técnicas de fermentación [25].
Fermentación por lotes con alimentación limitada: los microorganismos proporcionan mejores rendimientos de metabolitos, en comparación con el modo por lotes convencional. A medida que la densidad de masa celular aumenta en la mezcla, la productividad específica del etanol disminuye. Sin embargo, la velocidad de alimentación es limitada y, por lo tanto, la densidad de masa celular no aumenta en exceso. En este caso, la concentración de masa celular se mantiene en un nivel específico, que proporcione la mayor productividad del etanol [25]. Bajo este tipo de proceso, por ejemplo, si se considera la sacarificación y fermentación simultáneas, el enfoque sería superar la inhibición de levaduras como Saccharomyces cerevisiae, debida a las altas concentraciones de azúcar, que resultan de la hidrólisis enzimática [25].
Fermentación continua: este proceso da como resultado una alta producción de etanol, en comparación con el modo por lotes [25]. Las operaciones continuas son generalmente fáciles de controlar y no son tan laboriosas como las de tipo discontinuo [25]. El método continuo elimina el gasto de tiempo en limpieza, recarga, ajuste de los medios y esterilización. En la fase exponencial, se logra una alta concentración celular de microbios dentro del fermentador, lo que da una mayor producción en un corto tiempo de procesamiento, casi 4 a 6 horas menos que el gastado en la fermentación por lotes. Funciona a una tasa de dilución menor, pero proporciona una máxima productividad. Como resultado, ahorra una gran cantidad de mano de obra y se reducen los gastos, ya que se logra una producción específica con una planta más pequeña [25].
Fermentación de estado sólido: es el proceso por el cual los microorganismos nutren una humedad insuficiente para apoyar el crecimiento microbiano, dentro del sustrato sólido insoluble. Las condiciones son principalmente apropiadas para el crecimiento de microbios, es decir, bacterias, levaduras y hongos filamentosos en sustratos sólidos, que aumentan las posibilidades de utilizarlos en bioprocesos [25]. Los principales factores para el éxito son la idoneidad de los sustratos seleccionados y su adecuado tamaño de partícula fino, que tiene una mejor superficie expuesta y así se mejora la accesibilidad de los microorganismos para su nutrición. Otras ventajas de este proceso son la disminución de los riesgos de contaminación bacteriana, ya que no hay agua libre; produciéndose enzimas más concentradas, que pueden extraerse con una pequeña cantidad de agua, por lo tanto, da lugar a una reducción de la generación de efluentes, un menor espacio y un mínimo requerimiento de energía, una formación estable del producto y una minúscula privación de proteínas [25] No obstante, el crecimiento microbiano se ve obstaculizado por la restricción del área de contacto del sustrato y la dificultad de transferencia de calor, así como por algunos otros factores como la humedad inicial, la aireación, el pH, la temperatura, la suplementación de nutrientes, el tamaño del inóculo, la extracción del producto final y la purificación, para lograr una alta eficiencia de los procesos [25].
5 Destilación
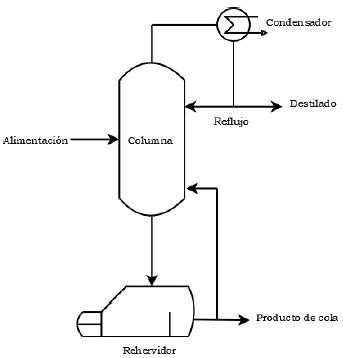
La destilación es un proceso natural, que consiste en la variación de la temperatura para separar una mezcla de vapor o líquido, en uno o más componentes que se encuentran juntos, a una pureza deseada, por la aplicación o remoción de calor [29]. Representa más del 40% de la energía utilizada en la industria química y sigue siendo el método de separación más utilizado a escala industrial (con más de 40.000 columnas en funcionamiento). Básicamente, casi todos los productos del mercado contienen productos químicos que antes pasaron por una columna de destilación [30].
En general, el montaje para destilación continua (Figura 2) se constituye por tres equipos integrados: (i) una columna de platos o empacada, donde se alimenta el líquido a destilar, que se pone en contacto con el vapor generado dentro del sistema, el cual lleva el compuesto a concentrar, (ii) un rehervidor en el fondo, calentado por un generador de vapor o caldera, el cual hierve el líquido a destilar con una corriente de salida para el producto de cola y (iii) un condensador en la arte superior, que permite convertir el vapor destilado a fase líquida, con la ayuda de un intercambiador de calor enfriado por agua o por un refrigerante [31].
La destilación continua con etapas y con reflujo puede considerarse, de forma simplificada, como un proceso en el cual se lleva a cabo una serie de evaporaciones y condensaciones. Estos fenómenos se llevan a cabo en los platos o charolas de la columna de destilación. Para ello, el líquido de cada etapa fluye por gravedad a la etapa inferior y el vapor de cada etapa lo hace hacia arriba, a la etapa superior [31]. El principio de funcionamiento de la columna es poner en contacto un vapor con un líquido más rico en el componente más volátil que el correspondiente al equilibrio.
Al mezclarse íntimamente, el vapor tenderá a ponerse en equilibrio con el líquido, condensándose parte del componente menos volátil y evaporándose el más volátil. Mediante la repetición de esos contactos a contracorriente, el vapor se irá enriqueciendo y el líquido empobreciendo (en el componente más volátil) hasta alcanzar las composiciones del destilado y del residuo respectivamente [31].
En la actualidad, la producción de alcohol se lleva a cabo con tecnologías de gran eficiencia y estabilidad, independiente de la materia prima empleada y la finalidad de la producción. El empleo de columnas al vacío, con transferencia de energía, hace que el proceso de destilación sea cada vez más estable, por lo tanto, más eficiente. La operación en múltiple efecto de las columnas de destilación y rectificación permite una reducción significativa del consumo de energía, dado que los condensadores y rehervidores pueden ser integrados térmicamente [34].
Para trabajos con jacinto de agua, se reporta un estudio que revela la obtención de bioetanol, donde las plantas fueron sometidas a un pretratamiento físico, se hidrolizaron con el microorganismo Trichoderma Arzzianun y se fermentaron con Saccharomyces cere-visiae. Por medio de un sistema de destilación de laboratorio, se logró determinar un máximo de 16 °G de alcohol [35].
6 Perspectivas de la obtención de bioetanol, a partir de jacinto acuático
El jacinto de agua es una de las plantas más problemáticas en todo el mundo debido a su crecimiento incontrolable en los cuerpos de agua [36]. Por esta razón, su desarrollo en investigación como parte de una solución de tecnologías ecológicas y eficientes para los problemas medio ambientales, generados por la industria y otros sectores, es necesario. Como se indicó anteriormente puede usarse para generar un gran número de productos útiles a partir de su biomasa, entre ellos el bioetanol.
Por esta razón, el avance en el proceso de hidrólisis enzimática que permite la extracción de azúcares a partir de microrganismos tales como hongos, bacterias y levaduras de tipo aeróbico, anaeróbico, mesófilos o termófilos que convierten los polisacáridos a etanol, por medio de complejos celulíticos, a través de la fermentación, es importante explorarlo.
Como se expuso en este trabajo, existen diferentes procesos individuales con microorganismos capaces de catalizar cada uno de los tres pasos necesarios para la conversión de la biomasa lignocelulósica en etanol: remoción de la lignina, hidrólisis de la hemicelulosa y celulosa y fermentación de la glucosa y/o xilosa en etanol. Por lo tanto, se debe considerar, al menos en principio, que existe un proceso totalmente microbiano en laguna de las fases.
Los procesos microbianos basados en cultivos mixtos abiertos son de gran interés, debido a su menor costo y mayor flexibilidad en comparación con los procesos tradicionales de cultivo puro [37]. Por ejemplo, la aplicación de estos consorcios en procesos como la digestión anaeróbica de materiales orgánicos a metano, un proceso industrial conocido [38], permite producir sustancias de interés como hidrógeno [39], etanol [40], plásticos biodegradables [41, 42, 43], o sales de ácidos carboxílicos, que luego se convierten químicamente en combustibles de hidrocarburos [44]. Debido a su gran versatilidad, presenta ventajas de costo evidentes, en comparación con los procesos existentes para la producción de etanol lignocelulósico, dado a que es un proceso a presión atmosférica, temperatura cercana al ambiente y no adiciona productos químicos o enzimas extra.
Por otra parte, el uso de microorganismos modificados genéticamente podría representar una alternativa a mejorar los procesos, y que se puedan trabajar a presión ambiente y temperaturas relativamente bajas, teniendo en una sola cepa microbiana lo necesario para la conversión de materiales ligno-celulósicos en bioetanol, en todas las etapas previas a la destilación, aprovechando al máximo los compuestos de la biomasa.
En la actualidad, se busca un proceso integrado (de una sola etapa o consolidado) que utilice biomasa lignocelulósica sin tratar como materia prima y la convierta selectivamente a etanol como producto principal. Podría obtenerse utilizando dos enfoques alternativos: el uso del cultivo mixto abierto, en el que coexisten muchos microorganismos diferentes de origen natural, que llevan a cabo los distintos pasos, o el uso de un cultivo puro de un microorganismo modificado genéticamente, que sea capaz de llevar a cabo todas las etapas del proceso requeridos. Sin embargo, cualquiera de los dos enfoques aún necesita de tiempo e investigación para poder convertirse en realidad [21].
6.1 Cultivo mixto abierto
Los principales retos que existen para superar este enfoque son:
Aumentar las tasas de hidrólisis de la biomasa lignocelulósica, hasta competir con las que se consiguen a través de los procesos químicos, físicos o enzimáticos.
Controlar la fermentación anaeróbica de azúcares (principalmente glucosa y xilosa) a etanol, mitigando la aparición de otros productos diferentes, es decir, otros alcoholes, ácidos grasos volátiles hidrógeno o metano.
Proveer la coexistencia de microorganismos que favorecen la hidrólisis de lignina y celulosa y los productores de etanol, en el mismo recipiente. Esto puede ser posible o no, dependiendo de las condiciones de funcionamiento del proceso y de la tasa de crecimiento de los distintos microorganismos.
De la misma manera, algunas perspectivas de investigación que se pueden abordar respecto a lo anterior son:
Estudios de enriquecimiento: la hidrólisis microbiana de la lignina suele considerarse difícil y lenta, donde la adaptación de los microorganismos al sustrato, puede limitar la tasa de hidrólisis. Una vez que los cultivos mixtos se hayan adaptado a un sustrato lignocelulósico y hayan sintetizado las enzimas necesarias para su hidrólisis, el ritmo de ésta debería ser más rápido [21]. Por lo tanto, es importante seleccionar aquellas cepas con mejor capacidad adaptativa (proceso lento) y luego transferirlas a un reactor, con una alimentación continua o semicontinua del sustrato (proceso rápido). Al haber sido aclimatadas previamente, deberían ser capaces de proporcionar buenas tasas de degradación del sustrato [21, 45].
Reducción del tamaño de las partículas: varios autores confían que la reducción del tamaño de partícula de la materia prima proporcione mayores tasas de hidrólisis. Sin embargo, las pruebas cuantitativas de este efecto han sido bastante limitadas, especialmente en lo que respecta a la producción de etanol, requiriendo una mayor cantidad de estudios de laboratorio, dirigidos específicamente a explorar y cuantificar el posible aumento de dichas tasas [21].
Configuración del reactor y parámetros del proceso: se sabe que el reactor utilizado para el proceso integrado puede influir en el resultado final, dependiendo de la configuración, por ejemplo, si se utiliza un flujo continuo con o sin reciclaje de biomasa o reactor discontinuo secuencial, entre otros, o si hay variación en los parámetros del proceso, por ejemplo, la temperatura, el pH, el tiempo de retención hidráulica, el tiempo de retención de sólidos, la duración del ciclo y la longitud de la alimentación. Así, la elección de estos parámetros puede afectar tanto a la tasa de hidrólisis, como a la distribución de productos de la fermentación de azúcares. En principio, se espera que esta sea mayor en un reactor discontinuo secuencial, debido a la mayor concentración de sustrato al inicio del ciclo. Sin embargo, aún no se han reportado pruebas experimentales, en el contexto de hidrólisis de biomasa lignocelulósica [21], aunque se puede correlacionar con investigaciones experimentales en la fermentación de azúcares, donde se han observado resultados positivos [16, 46].
En cuanto a las especies seleccionadas dentro del cultivo mixto, responsables de diferentes etapas de la conversión de la biomasa lignocelulósica en etanol, estudios reportan rendimientos de etanol por encima del 67%, a partir de biomasas como paja de trigo, utilizando un consorcio microbiano compuesto por tres cepas naturales: Trichoderma reesei, Saccharomyces cerevisiae y Scheffersomyces stipitis. En este caso, el hongo Trichoderma reesei se encarga de la hidrólisis de la celulosa y la hemicelulosa, mientras que las levaduras fueron responsables de la producción de etanol a partir de la glucosa (Saccharomyces cerevisiae) o de las pentosas (Scheffersomyces stipitis). Esto ha sido posible bajo el empleo de reactores que permitan la coexistencia mutua de las especies, teniendo en cuenta las condiciones aeróbicas, microaerófilas y anaeróbicas que ellas necesitan, como por ejemplo reactores de membrana de biofilm [48].
Con base en lo anterior, el enfoque de cultivos mixtos abiertos puede ser prometedor para el jacinto de agua. Sin embargo, es necesario llevar a cabo un mayor número de pruebas experimentales a nivel de laboratorio, con el fin de conocer y analizar los resultados que puedan obtenerse.
6.2 Microorganismos modificados genéticamente
Actualmente, el planteamiento de utilizar un único microorganismo modificado genéticamente para convertir la biomasa lignocelulósica en etanol es hipotético. La ingeniería metabólica para la producción de bioetanol se ha centrado en el uso de materias primas pretratadas química o físicamente, donde la lignina ha sido hidrolizada y la hemicelulosa y celulosa están disponibles para el ataque microbiano. Hasta el momento, el principal éxito de la ingeniería genética ha llegado hasta el desarrollo de microorganismos capaces de convertir múltiples azúcares en etanol con altos rendimientos [47].
Autores han reportado más éxito en el aumento del rendimiento de etanol en microorganismos que son naturalmente capaces de hidrolizar la celulosa, pero incluso en este caso, los rendimientos son en la mayoría, muy bajos [46], en especial cuando se tiene celulosa cristalina. Sin embargo, en la literatura se reportan importantes oportunidades de investigación en este campo, como:
Introducción de la capacidad de hidrólisis de lignina en microorganismos que son naturalmente capaces de hidrolizar celulosa, o, como contrapropuesta, introducir la capacidad de hidrólisis de la celulosa en microorganismos que son naturalmente capaces de hidrolizar lignina.
Mejoramiento de la capacidad de hidrólisis de la celulosa cristalina con microorganismos que son productores nativos de etanol.
Aumento del rendimiento de etanol para los microorganismos que naturalmente hidrolizan la celulosa.
Finalmente, ya sea mediante aplicación de cultivos mixtos abiertos de microorganismos existentes o uso de un cultivo puro de un microorganismo modificado genéticamente, las investigaciones a futuro se deben enfocar en obtener un proceso consolidado que convierta cualquier tipo de biomasa lignocelulósica no tratada en etanol. Los principales retos a superar son: incrementar las tasas de hidrólisis de lignina y celulosa y el control de la fermentación anaeróbica de los azúcares a etanol.
7 Conclusiones
La presente revisión presenta de manera sucinta el potencial del jacinto de agua para la producción de bioetanol, ya que con esto se están resolviendo los problemas referentes a la disposición final de biomasas acuáticas que generan serios problemas ambientales. A través de este documento, se muestran las limitaciones en cada una de las etapas de pretratamiento y fermentación para este tipo de biomasa y se hace especial énfasis en el pretratamiento para remoción de los contenidos de lignina y, aunque la hidrólisis ácida puede provocar la formación de compuestos indeseables, es hasta el momento la única capaz de recuperar cerca del 90% del valor teórico del azúcar presente en esta biomasa. Por su parte, la fermentación puede llevarse a cabo con Kluyveromyces marxianu (K213) con el objeto de incrementar la producción de etanol hasta 1.78 veces más comparado con S. Cerevisiae. De igual manera, se revisaron las estrategias de procesos combinados, pero pese a que se han realizado algunos estudios aún falta por explorar un proceso totalmente microbiano en alguna de las fases, ya sea utilizando un cultivo mixto o un cultivo puro de un microorganismo modificado genéticamente.