1 Introducción
Los recursos vegetales tienen una gran relevancia en la ganadería, debido a que históricamente diferentes especies vegetales son usadas como alimento animal. La identificación y conocimiento de los beneficios nutricionales de las plantas en la salud animal ha incrementado su popularidad y consumo [1]. En los países tropicales, diversas especies vegetales, leguminosas, árboles forrajeros y arbustos, entre otros, son usados como fuentes alimenticias alternativas para los animales. Sin embargo, no todas las especies se pueden utilizar en todo su potencial nutritivo debido a la presencia de factores antinutricionales que limitan su inclusión en la alimentación animal. Evolutivamente las plantas adquirieron la capacidad de sintetizar compuestos orgánicos que les permiten realizar todos los procesos bioquímicos de crecimiento, desarrollo y reproducción sin inconvenientes [2] y, además interactuar ecológicamente con el ambiente y defenderse de patógenos como bacterias, hongos, insectos o herbívoros [3].
Como productos del metabolismo secundario de las plantas se conocen más de 1200 compuestos químicos, entre los cuales se han reportado cerca de 8000 polifenoles, 270 aminoácidos no-proteicos, 32 cianógenos, 10 000 alcaloides y varias saponinas y esteroides totales. Los efectos perjudiciales o beneficiosos de esos metabolitos secundarios en la producción animal dependen de varios aspectos, en su mayoría estrechamente interrelacionados: el tipo específico de sustancia química y su concentración; composición y tipo de dieta; especie, categoría, adaptabilidad y manejo animal, entre otros [4]. Algunos metabolitos actúan principalmente en la digestión y absorción de proteínas y carbohidratos, utilización de minerales y en la biodisponibilidad de vitaminas [5, 6, 7].
En producción animal, esos compuestos químicos son categorizados como factores antinutricionales (FAN) cuando su presencia o acción disminuye el valor nutritivo del alimento que los contiene, pero se consideran compuestos no nutritivos o factores nutricionalmente bioactivos cuando en determinadas dosis, tienen efectos beneficiosos en la digestión de la dieta, la salud y la productividad de los animales [8,9, 10].
Los compuestos anticalidad o factores antinutricionales más estudiados son los taninos condensados, fenoles, alcaloides, oligosacáridos y saponinas porque pueden producir una reacción violenta e inmediata, en la mayoría de los casos tienen un efecto sutil que se manifiesta con la ingestión prolongada. Se puede destacar la disminución del consumo y la eficiencia digestiva, lo que repercute negativamente en el crecimiento y productividad del animal. No obstante, en algunos casos la presencia de estas sustancias podría ser beneficiosa, especialmente en los rumiantes [4, 11].
Algunos de esos factores como los termolábiles, son inactivados o destruidos por prácticas como cocción, escaldado, tostado y extrusión; mientras que procesos como germinación, remojo, fermentación, cocción y/o escaldado, eliminan los factores termoestables y conllevan a un aumento en la digestibilidad y mejoramiento de las propiedades organolépticas del producto [10]. En semillas de Mucuna, por ejemplo, los tratamientos hidrotérmicos, el tostado y la germinación fueron efectivos en la reducción de algunos factores antinutricionales debido a la degradación térmica y química de los compuestos, no obstante moléculas como los taninos no fueron degradados por esas vías [12, 13].
Los taninos son un grupo heterogéneo de compuestos polifenólicos hidrosolubles de alto peso molecular (500-20000 Da) [14, 15], con una amplia distribución en el reino vegetal y especialmente entre las leguminosas [2]. Su síntesis está sujeta a regulación genética, varía entre familias, géneros, especies e individuos, y depende del efecto de factores climáticos (temperatura, humedad, radiación solar, régimen de vientos), edáficos (composición, calidad, déficit de nutrientes), grado de madurez de los tejidos o la exposición a fitopatógenos o herbívoros [16].
Por su estructura y reactividad hacia los agentes hidrolíticos se clasifican en: taninos hidrolizables y condensados. Los primeros o galotaninos son fácilmente hidrolizables por ácidos o enzimas. Los taninos condensados (proantocianidinas) son polímeros flavonoides, no susceptibles a hidrólisis, pero pueden ser degradados por oxidación con ácidos fuertes para producir antocianidinas. Existen reportes sobre su degradación en los procesos de fermentación anaeróbica [3, 11, 17, 18].
Los taninos, tanto hidrolizables como condensados, son insolubles en solventes no polares y solubles en solventes polares como agua y alcoholes [19, 20], aunque la solubilidad de los condensados disminuye a medida que se incrementa el grado de polimerización [21]. La principal propiedad química de los taninos es su capacidad de formar complejos con las proteínas y, en menor extensión, con polisacáridos, iones metálicos, aminoácidos, ácidos nucleicos, etc. [10, 22]. La formación de estos complejos se debe al gran número de grupos hidroxilo-fenólicos que poseen los taninos que les permite establecer múltiples uniones con otros sustratos [23]. Los complejos según Kumar y Singh [24] se pueden formar a través de uniones débiles como puentes de hidrógeno e interacciones hidrófobas, o por uniones más fuertes como uniones iónicas reversibles o enlaces covalentes irreversibles.
Entre los efectos nutricionales dañinos de los taninos se pueden mencionar menor aceptabilidad del alimento, pérdida de peso, poco crecimiento, menor retención de nitrógeno, disminución en la energía metabolizable, la absorción de hierro y la digestibilidad de la materia seca, debido a que estos compuestos cuando se encuentran en altas concentraciones pueden formar complejos con las proteínas, fibra y minerales [25, 26], lo cual resulta en el deterioro de la conversión en animales monogástricos, inhibición de las enzimas digestivas y formación de complejos con las membranas de la mucosa intestinal. No obstante, la presencia de algunas de estas sustancias puede ser beneficiosa para los rumiantes [27].
Otra de las moléculas estudiadas son las saponinas, glucósidos de alto peso molecular en que la unidad de glucosa, galactosa, ácido glucurónico, xilosa, ramnosa o mentilpentosa, está unida por un enlace glicosídico a un grupo aglicona hidrofóbico (sapogenina), que puede ser de naturaleza triterpenoide o esferoidal [28]. Estos compuestos rebajan la tensión superficial y forman una espuma estable en solución acuosa similar a los jabones, de ahí el nombre de saponinas. Se encuentran en plantas leguminosas, escrofulariáceas, cariofiláceas, etc. [29], y se producen en diferentes partes de las plantas como raíces, tubérculos, corteza, hojas, semillas y frutos [30].
La diversidad y complejidad de las estructuras de las saponinas se debe a la variabilidad de la estructura aglicona, la naturaleza de las cadenas laterales y la posición de enlace de éstas a la aglicona [30]. La mayoría de las plantas que contienen saponinas no tienen un único compuesto sino una mezcla compleja, lo que influye directamente en su actividad biológica [31]. Se conoce un amplio rango de efectos biológicos de estos compuestos, aunque la mayoría se pueden atribuir a su acción sobre los esteroles de las membranas, particularmente por la formación de micelas entre saponinas y colesterol [32] u otras interacciones más complejas con las membranas biológicas que afectan sus principales propiedades, entre ellas la permeabilidad [28].
Los reportes sobre afectación del comportamiento y metabolismo del animal se deben a hemólisis de eritrocitos, reducción de colesterol sanguíneo y hepático, depresión de la tasa de crecimiento, inhibición de la actividad del músculo liso, inhibición enzimática y reducción en la absorción de nutrientes [33]. El abundante lavado en agua permite disminuir su efecto, aunque se pierden elementos nutritivos [3]. Las saponinas se hidrolizan por la flora ruminal y cecal, por lo que los rumiantes, al igual que los conejos, son poco sensibles a niveles altos de saponinas en la dieta. En cambio, en porcino, y sobre todo en aves, se observa un efecto negativo de las saponinas en el consumo de pienso [34]. Los principales beneficios estudiados de las saponinas son la disminución del olor de las excretas, reducción en la prevalencia de artritis, mejora el desempeño de los animales [35] e inhibe el crecimiento in vitro de Escherichia coli [36].
Artocarpus altilis (árbol del pan) podría utilizarse como nuevo alimento animal, si se mejora la biodisponibilidad y calidad de los nutrientes mientras se degradan los factores antinutricionales presentes en esta planta a través de fermentación en estado sólido. En este estudio se propuso: i) Evaluar la fermentación en estado sólido de la harina de frutos de Artocarpus altilis y el efecto de cuatro componentes en la producción de taninos y saponinas como factores antinutricionales.
2 Metodología
Los ensayos fueron realizados en el laboratorio de Farmacognosia perteneciente a la Universidad Federal de Minas Gerais, Brasil y se evaluó el efecto de cuatro variables en la producción de taninos y saponinas como factores antinutricionales durante la fermentación de harina de Artocarpus altilis.
En el primer ensayo se evaluó el efecto del tiempo de fermentación y la adición de diferentes concentraciones de urea en la producción de esos factores antinutricionales (HFP-FES). Se realizó un diseño experimental completamente aleatorizado con arreglo factorial (4 x 4) en el cual el primer factor consistió en 4 niveles de urea (0, 0.5, 1.0,1.5%) y el segundo factor en 4 tiempos de fermentación (0, 12, 24 y 48 h) con 3 repeticiones. La presencia/ausencia y la cantidad de cada uno de esos compuestos fue determinada y cuantificada a las 0, 12, 24 y 48h.
En el segundo ensayo se evaluó el efecto de la adición de VITAFER y carbonato de calcio solos o en combinación, a diferentes concentraciones en la presencia/ausencia de taninos y saponinas y la cantidad producida. El experimento se realizó tipo factorial (6 x 2) y 3 repeticiones por tratamiento, el factor A consistió en 3 niveles de carbonato de calcio (0, 0.3 y 0.6%) más 3 niveles de VITAFERT (0, 2.5 y 5%) y el factor B consistió en 2 tiempos de fermentación (0 y 48 h). Se utilizó un diseño completamente aleatorizado.
En cada uno de los ensayos se realizó un tamizaje fitoquímico a las diferentes variantes de fermentación de la harina, según la metodología descrita por Miranda y Cuellar [37] en el laboratorio de Farmacognosia perteneciente a la Universidad Federal de Minas Gerais, Brasil, para determinar de forma cualitativa la presencia de taninos y saponinas. Se utilizó un sistema de cruces para especificar la presencia o ausencia de los metabolitos secundarios en cada una de las muestras. En todos los análisis se siguieron los criterios de:
+ + + abundante; ++ moderado; + presencia; ausencia.
La cuantificación de taninos condensados totales se determinó por triplicado con el método de la vainillina - HCL, propuesto por Price et al. [38]. La absorbancia fue leída a 720 nm en un espectrofotómetro UV-VIS. Se preparó una curva de calibración de (+) catequina y el contenido de taninos se expresó en porcentaje (%) de MS.
El contenido de saponinas se determinó por el método de la vainillina-ácido sulfúrico sugerido por Hiai et al. [39]. La absorbancia fue leída a 374 nm. Se preparó una curva de calibración, con la utilización de Ginseng como estándar de referencia.
El preparado microbiano VITAFERT se desarrolló bajo la metodología propuesta por Elías, A., Herrera, F. R. [40].
3 Resultados y discusión
Artocarpus altilis es una especie de interés como alimento animal debido a la cantidad de proteínas, carbohidratos, vitaminas y minerales que contiene. En Colombia, la especie es cultivada en cuatro municipios del departamento del Magdalena para satisfacer parte de las necesidades de alimentación de la población. Sin embargo, su utilidad podría aumentar ya que se considera una opción para sustituir los granos y/o cereales cuyos costos son elevados [41].
Antes de utilizar una especie vegetal como alimento animal, es fundamental identificar y cuantificar los compuestos antinutricionales producidos por ellas [42], como taninos, alcaloides, glucósidos cianogénicos y saponinas [43], con el fin de identificar los posibles efectos benéficos o perjudiciales para los animales que los van a consumir como alimento [42]. Los factores antinutricionales en su estado natural y en altas cantidades tienen efectos adversos sobre el aprovechamiento de nutrientes, o sobre la salud. Para Artocarpus altilis, los resultados del tamizaje fitoquímico realizado a las variantes de fermentación en estado sólido de la harina de sus frutos, se muestran en la tabla 1. La harina sin fermentación y fermentada usando diferentes concentraciones de urea presentan cualitativamente baja cantidad de taninos condensados totales y saponinas.
Tabla 1 Factores antinutricionales en la harina de Artocarpus altilis sin fermentar (HFP) y fermentada con la adición de urea (HFP-FES).

Nota: (+ + +) Alto, (++) Moderado, (+) bajo, (-) Ausencia
La cantidad de taninos y saponinas presentes en la harina de frutos de Artocarpus altilis fue de 3.92 y 0.33 g.100gMS-1, respectivamente (tabla 2); resultados similares fueron obtenidos por Leyva [44] quien cuantificó 4,24 g.100gMS-1 de taninos y 0,33 g.100gMS-1 de saponinas en la harina sin fermentar de frutos de la misma especie.
Como se observa en los resultados, la harina de frutos de Artocarpus altilis posee un alto contenido de taninos condensados totales lo que permite compararla con un sorgo rico en taninos [45] capaz de reducir el consumo de alimento y la velocidad de crecimiento de las aves y los cerdos cuando se incluye en niveles que superan el 20% de la dieta; estas concentraciones de taninos son aceptables por los conejos que son capaces de soportar altas concentraciones en sus dietas [34]. A pesar de que se han utilizado métodos mecánicos, físicos, químicos, biológicos y biotecnológicos para disminuir o remover las sustancias antinutritivas o factores antinutricionales en plantas [46], se ha encontrado que la presencia de taninos no se puede eliminar o reducir utilizando esas metodologías, por lo que para la harina de los frutos de Artocarpus altilis se evaluó la fermentación en estado sólido como alternativa no solo para disminuir la cantidad de taninos, sino para incrementar la fracción soluble del alimento, la cantidad y calidad de las proteínas expresadas en su valor biológico, e incrementar el contenido de vitaminas hidrosolubles [47].
La cantidad de taninos y saponinas presentes 48h después de la fermentación de la harina de Artocarpus altilis se muestra en la tabla 2. Los resultados indican que el tiempo tiene una influencia positiva en la producción de estos compuestos, cuantificándose una disminución de 0,47 y 0,09 g.100g MS-1 de taninos y saponinas respectivamente, con respecto a la 0h (a = 0.05; p < 0,05), mientras que la urea a diferentes concentraciones mantiene estable la cantidad de estos dos factores antinutricionales.
Tabla 2 Efecto del tiempo de fermentación y niveles crecientes de urea en la producción de taninos y saponinas de la harina de Artocarpus altilis.
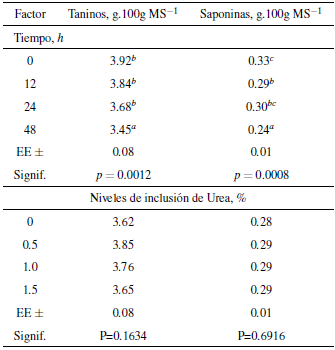
Nota: a b ' c Letras distintas indican diferencias significativas p < 0,05 según Duncan [48].
El tamizaje fitoquímico realizado a la fermentación en estado sólido de la harina de los frutos de Artocarpus altilis usando vitafer y carbonado de calcio muestra baja presencia de taninos y saponinas (Tabla 3). Al cuantificar los dos factores antinutricionales se observan efectos estadísticamente significativos en la producción. Al adicionar solo carbonato de calcio se aumenta la cantidad de taninos. Sin embargo, la combinación de vitafer y carbonato de calcio, tiene un efecto positivo en la cantidad de taninos cuantificados. Comparando los resultados obtenidos se puede evidenciar una mayor disminución (0,46 g.100gMS-1) de taninos al adicionar vitafer (5%) y carbonato de calcio (0,6%) que dejando solo el tiempo como variable (0,15 g.100gMS-1). Respecto a cantidad de saponinas la disminución es similar (Tabla 4, p < 0,05). Resultados similares fueron obtenidos por Makkar [49] realizando un tratamiento con álcalis con el cual redujo el contenido de taninos. Admassu y Kumar [50], observaron una reducción de 27% en el contenido de taninos en Phaseolus vulgaris L. sometidos a una hidratación con bicarbonato de sodio durante 12 horas, mientras que este mismo tratamiento más cocción disminuyó un 68% este antinutriente. En este estudio, la disminución en mayor grado de la concentración de taninos, pudo deberse a la presencia de calcio, que se encuentra dentro del grupo de activadores metálicos de las enzimas y participa directamente en la catálisis con un cambio de valencia en el proceso de óxido-reducción y la hidroxilación del anillo bencénico de los aminoácidos aromáticos, provocando una mayor oxidación de los taninos.
Tabla 3 Factores antinutricionales en la harina del fruto de Artocarpus altilis en fermentación en estado sólido con niveles de vitafer y carbonato de calcio (BS).

Nota: (+ + +) Alto, (++) Moderado, (+) bajo, (-) no presencia.
Tabla 4 Efecto de niveles crecientes de vitafer, carbonato de calcio y el tiempo de fermentación en la concentración de taninos del fruto de Artocarpus altilis.
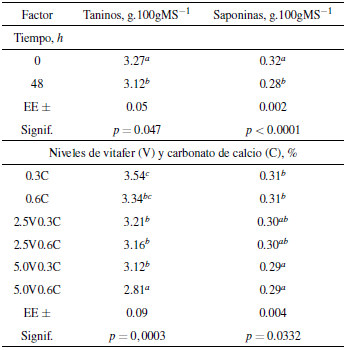
Nota: a,b,c letras distintas indican diferencias significativas P<0,05 según Duncan [48].
Conclusión
La fermentación en estado sólido incluyendo vitafer y carbonato de calcio mostró ser un proceso efectivo con el cual se disminuye la concentración de taninos y saponinas presentes en la harina de frutos de Artocarpus altilis. Con la reducción obtenida por la fermentación en estado sólido propuesta en este estudio, se espera ofrecer un alimento con niveles adecuados de taninos en la dieta que protejan parte del nitrógeno y favorezcan su utilización en el tracto posterior, con modificación en las rutas de excreción del nitrógeno, además de un alimento rico en nutrientes que favorezca el desarrollo y crecimiento animal.














