Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Hacia la Promoción de la Salud
Print version ISSN 0121-7577
Hacia promoc. Salud vol.17 no.1 Manizales Jan./July 2012
BREAST CANCER AND PHYSICAL EXERCISE: REVIEW
CÂNCER DE MAMA E EXERCÍCIO FISICO: REVISÃO
José Antonio de Paz Fernández**
* Licenciado en Ciencias de la Actividad Física y el Deporte, Magíster en Fisiología del Ejercicio, Doctorando en Ciencias de la Actividad Física. Docente de planta Universidad Pedagógica Nacional de Colombia, Laboratorio de Fisiología del Ejercicio. Bogotá, Colombia. Correo electrónico: jairofdz@pedagogica.edu.co
** Licenciado en Medicina y Cirugía, Especialista en Biología y Medicina Aplicada al Deporte. Docente Universidad de León, Facultad de Ciencias de la Actividad Física y el Deporte, Laboratorio de Ciencias Biomédicas. León, España. Correo electrónico: japazf@unileon.es
La prescripción de actividad física para las sobrevivientes de cáncer de mama depende de la evidencia que se pueda obtener del impacto fisiológico, psicológico y biológico del ejercicio físico sobre la disminución del riesgo recidiva. Objetivos: el propósito de este artículo es revisar los diferentes estudios publicados sobre el impacto del ejercicio en pacientes con cáncer de mama, que finalizaron el tratamiento de quimio y/o radioterapia con el fin de identificar la intensidad, frecuencia, tiempo de intervención, duración de las sesiones, tipo de trabajo realizado y las diferentes variables evaluadas. Método: se desarrolló una revisión de los estudios experimentales publicados sobre este tema desde 1995, se incluyeron 27 estudios y se examinó frecuencia, intensidad, duración de las sesiones, tiempo de intervención y efectos de la actividad física sobre las variables de control utilizadas. Resultados: siete estudios (58%) desarrollaron el programa de ejercicio durante un período de 24 semanas, seis (50%) platearon realizaron 3 sesiones por semana, en cinco (41%) la duración de las sesiones eran de 30 minutos, tres (25%) implementaron una intensidad 50-80% de la FC máx. Seis estudios (50%) evaluaron el IMC, el porcentaje de masa grasa y la calidad de vida, cinco (41%) evaluaron el VO2 máx., y dos (16%) utilizaron marcadores tumorales. Conclusiones: no se pudo establecer cuál es la intensidad, volumen, frecuencia y tiempo de duración que tiene un mejor impacto fisiológico en pacientes sobrevivientes al cáncer de mama. De igual forma, no se estableció el impacto de la actividad física sobre los biomarcadores.
Actividad física, ejercicio, neoplasias de la mama, calidad de vida, sobrevivientes. (Fuente: DeCS, BIREME).
The prescription of physical activity for breast cancer survivors depends on the evidence that can be obtained as well as on the physiological, psychological and biological impact that physical activity may have in the reduction of relapse risk. Objectives: the purpose of this article is to review the different studies that have been published on the effect of exercise in breast cancer patients who had finished their radiation therapy and chemotherapy treatment to identify the intensity, frequency, duration of the exercise program, duration of the exercise sessions, type of physical activity and the different variables evaluated. Methods: a review of the experimental studies on this subject published from 1995 was conducted, 27 studies were included and the duration, frequency, intensity, duration of exercise sessions, intervention time and effects were examined. Results: seven studies (58%) conducted 24 week exercise programs, six studies (50%) proposed 3 exercise sessions per week, the exercise sessions of five (41%) studies lasted 30 minutes and the intensity of three studies (25%) was 50-80% of the MHR. Six studies (50%) evaluated the BMI, the body fat percentage and the quality of life, five studies (41%) evaluated the VO2 max., and two studies (16%) used tumor markers. Conclusions: the intensity, volume, frequency and duration with the best physiological impact on breast cancer survivors could not be determined. Likewise, the impact of physical activity on tumor markers was not established.
Physical activity, exercise, sport; fitness, breast cancer, breast neoplasm, quality of life, survivors. (Source: MeSH, NLM).
A prescrição de atividade física para as sobreviventes ao câncer de mama depende da evidencia que se pode obter do impacto fisiológico, psicológico e biológico do exercício físico sobre a diminuição do risco recidiva. Objetivos: O propósito deste artigo é revisar os diferentes estudos publicados sobre o impacto do exercício em pacientes com câncer de mama, que finalizaram o tratamento de quimioterapia e/ou radioterapia com o fim de identificar a intensidade, frequência, tempo de intervenção, duração das sessões, tipo de trabalho realizado e as diferentes variáveis avaliadas. Método: se desenvolveu uma revisão dos estudos experimentais publicados sobre este tema desde 1995, incluíram se 27 estudos e se examinou com frequência, intensidade, duração das sessões, tempo de intervenção e efeitos da atividade física sobre as variáveis de controle utilizadas. Resultados: Sete estudos (58%) desenvolveram o programa de exercício durante um período de 24 semanas, seis (50%) estabeleceram, realizaram 3 sessões por semana, em cinco (41%) a duração das sessões eram de 30 minutos, três (25%) implementaram uma intensidade 50-80% da FC Max. Seis estudos (50%) avaliaram o IMC, a porcentagem de massa grassa e a qualidade de vida, cinco (41%) avaliaram o VO2 máx., e dois (16%) utilizaram marcadores tumorais. Conclusões: Não se pôde estabelecer qual é a intensidade, volumem frequência e tempo de duração que tem um melhor impacto fisiológico em pacientes sobreviventes ao câncer de mama. De igual forma, não se estabeleceu o impacto da atividade física sobre os biomarcadores.
Atividade física, exercício, câncer de mama, neoplasias mamárias, sobrevivientes. (Fonte: DeCS, BIREME).
El cáncer de mama es una de las neoplasias malignas más frecuente en la mujer. Es el segundo cáncer más habitual y el más común: 4,7 millones de diagnosis y 502.000 muertes anuales en el mundo (1), de las cuales más de la mitad de los casos ocurren en países industrializados. Los datos más recientes de la Agencia Internacional de Investigaciones sobre el Cáncer (IARC) con relación a la morbilidad mundial del cáncer de mama corresponden al 2002; en ese año, el IARC calcula que se diagnosticaron aproximadamente 1'150.000 nuevos casos y hubo aproximadamente 411.000 defunciones por esta causa (2).
Este incremento en la morbimortalidad en las mujeres condujo a la búsqueda no sólo de las posibles causas sino también de mecanismos de prevención, y de esta manera surge la actividad física como un factor asociado a la disminución del riesgo de cáncer de mama. La idea de la relación actividad física y cáncer no es nueva; en 1922 aparecen los primeros estudios epidemiológicos que indican el papel que juega como factor potencial para modificar el riesgo del cáncer de mama en sus tasas de recidiva y mortalidad (3) y en la prevención (4); sin embargo, existen algunos estudios que indican la ausencia de beneficio (5) o incremento en el riesgo (6).
En la actualidad existe suficiente evidencia epidemiológica y experimental del rol que juega la actividad física como mecanismo de prevención primario en la reducción del riesgo de cáncer de mama. (7-9). Revisiones sistemáticas y meta-análisis (9-12) realizadas en los últimos 10 años, ratifican esta relación a partir del análisis de estudios de cohorte, de caso control y no controlados, que incluyeron investigaciones desarrolladas durante y/o después de finalizadas las sesiones de quimio y/o radioterapia, y encontraron en las mujeres que realizaban AF un rango de riesgo estimado de 0,3-1,6 y un porcentaje de reducción de riesgo entre el 30-40% (6, 4, 11, 13-17), y del 40-80% (18-21).
De la misma forma, identificaron el impacto de la AF sobre los efectos secundarios del tratamiento, como: el deterioro físico, la fatiga, el trastorno psicosocial y fisiológico y los cambios morfológicos y biológicos.
Sin embargo, la relación actividad física y cáncer de mama es compleja y la inconsistencia en los resultados de la asociación puede ser debida en muchos casos a las limitaciones metodológicas, la forma de evaluar los niveles de actividad física en las pacientes, el control de los efectos de la modificación, la complejidad y multiplicidad de los mecanismos biológicos y la dificultad metodológica para su captura y seguimiento (22).
Se desarrolló una revisión de las diferentes publicaciones que sobre el tema se han publicado en los últimos quince años, a partir de una búsqueda sistemática que identificó los estudios que cumplían los criterios de elegibilidad. Para la selección de los estudios se establecieron los siguientes criterios: tipos de estudio, tipo de procedimientos, tipo de participantes, tipo de intervención, tipos de medidas de desenlace. Se incluyeron únicamente los ensayos controlados aleatorios y no aleatorios de ejercicio físico, posteriores al tratamiento de quimioterapia y radioterapia, excluyéndose a priori los estudios epidemiológicos y clínicos cuyos programas de actividad física se desarrollaron durante la fases de quimioterapia y radioterapia. Se incluyeron ensayos con diagnóstico de cáncer de mama de cualquier tipo de estadio, al igual que todas las formas de ejercicio, tipos de duración, intensidad y frecuencia. Se utilizaron varias estrategias de indagación; se realizaron búsquedas manuales en las revistas especializadas y búsquedas en el registro especializado de ensayos controlados del grupo Cochrane de Cáncer de Mama (Cochrane Breast Cancer Specialised Register, 16 de julio de 2004) y en las bases de datos electrónicas de Medline, PubMed, Proquest, Hinari, SportDiscus, EMBASE, Cancer Lit, CINAHL, PsychINFO, PEDro y Ovid, y las páginas Web de la OPS, OMS, CDC de Atlanta y CELAFISCS de Brasil. Igualmente, se revisaron tesis doctorales o disertaciones de ensayos clínicos. Además, se buscaron las listas de referencia de todos los estudios potencialmente relevantes y entramos en contacto con expertos y autores de estudios anteriores para identificar los artículos relevantes. Se determinaron las palabras clave con las cuales se realizaron diferentes combinaciones para extender el espectro de búsqueda: "Actividad física" (ejercicio, actividad física, deporte, fitness) y cáncer de mama (neoplasia mamario). La estrategia de búsqueda en las bases electrónicas se realizó acorde a la metodología de búsqueda sensible para ensayos controlados y aleatorios planteada por Dickersin (1994) y Simes (2004). Las listas obtenidas fueron combinadas usando el software bibliográfico EndNote y los duplicados fueron suprimidos, dando un total de 318 títulos los cuales fueron repasados por el equipo de expertos. Varios títulos adicionales fueron sugeridos y otros fueron suprimidos. De esta búsqueda exhaustiva de bibliografía, se identificaron y analizaron 313 referencias posiblemente pertinentes según el título y el resumen, de estas se excluyeron 286, recuperándose 27 para mayor evaluación, de las cuales, se seleccionaron 18 como adecuadas para su inclusión en el estudio. Los artículos se revisaron y evaluaron a través de una matriz de análisis para ponderar su calidad científica (23-30) quedando incluidos los estudios que tuvieron una ponderación superior a 7,0 puntos.
Los estudios fueron analizados a partir de las siguientes variables: tipo de población, tipo de cáncer, intensidad, duración y frecuencia del ejercicio, duración de la intervención, tiempo de intervención después de finalizado el tratamiento, variables evaluadas, métodos utilizados para la evaluación de las variables y resultados de la intervención sobre las variables.
Un total de doce estudios experimentales de ejercicio físico en mujeres con cáncer de mama fueron incluidos para el análisis y se presentan en la Tabla 1.
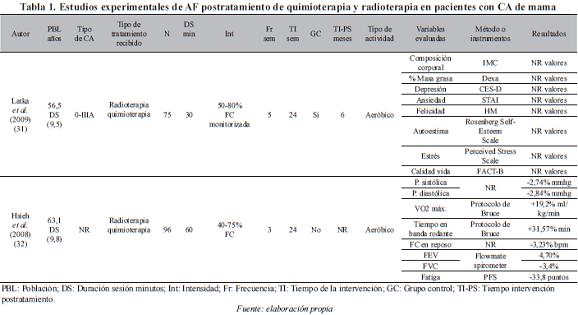
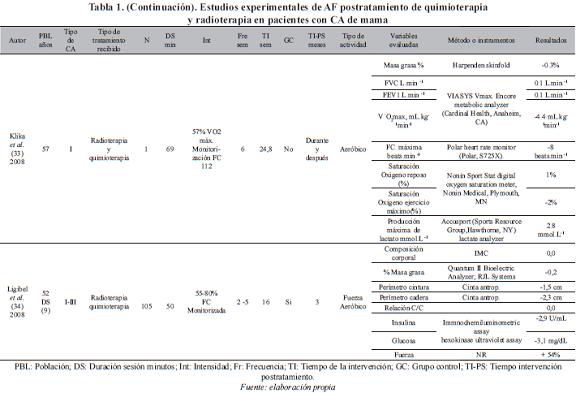
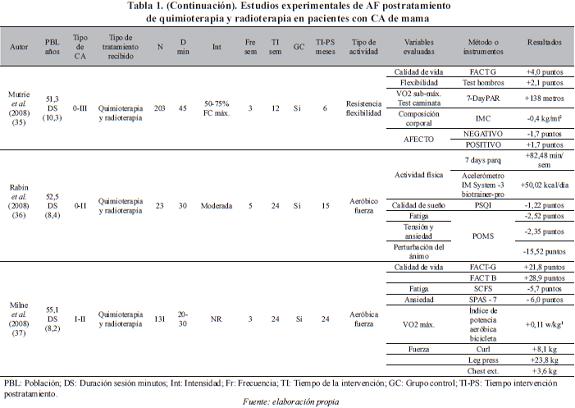
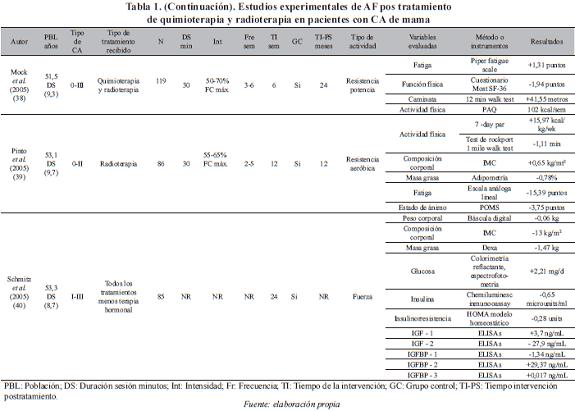
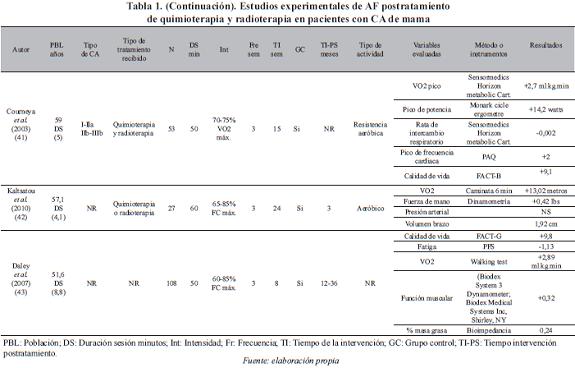
Población. La edad de las pacientes incluida en los diferentes estudios, presenta gran dispersión en los rangos de edad considerados. De 18 años en adelante (36, 37, 43), entre los 50-60 años (32, 33, 35, 39, 40, 42), entre 30-69 años (38), entre 50-69 años (34, 41), y entre 35-79 años (31). El número de participantes en los estudios varía de 1 a 203.
Tipo de cáncer. En cuanto al tipo de cáncer, existe igualmente diversidad. Seis estudios (31, 34, 35, 38, 40, 41) incluyeron mujeres con cáncer del estadio 0 al III, tres (36, 37, 39) con estadios I y II, tres (32, 42, 43) no reportan, y un estudio (33) estadio I.
Tipo de terapia coadyuvante que recibieron las pacientes. En once estudios (31-38, 40-42) las pacientes recibieron quimioterapia y radioterapia, en un estudio (39) sólo radioterapia, y un estudio (43) no reporta el tipo de terapia.
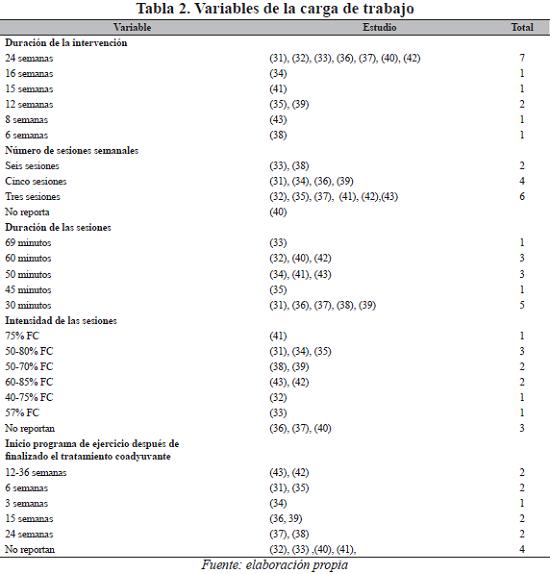
Frente a las variables relacionadas con el ejercicio utilizadas en cada uno de los estudios, el 58% lo desarrolló en 24 semanas, el 50% programó tres sesiones por semana, el 41% implementó las sesiones de treinta minutos y el 25% propuso el trabajo a una intensidad comprendida entre el 50-80% de la frecuencia cardiaca. La distribución detallada de los estudios se presenta en la Tabla 2.
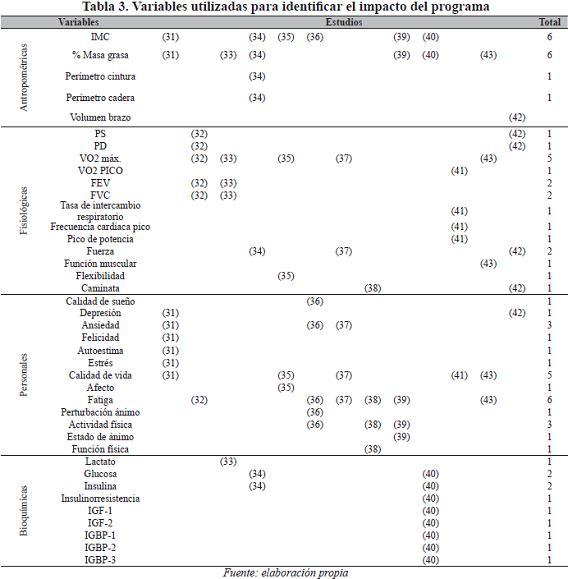
En cuatro estudios el programa de ejercicio se desarrolla in situ, con supervisión de personal especializado (32, 33, 41, 43), en tres (36, 38, 39) el programa se lleva a cabo en el hogar, y en cinco (31, 34, 35, 37, 40) el programa tiene componentes tanto in situ como en el hogar. Las variables utilizadas para identificar el impacto del programa fueron diversas y se presentan en la Tabla 3.
El cáncer de mama es una enfermedad compleja, multifactorial, donde se interrelacionan factores genéticos medioambientales y hormonales, por ello es necesario que los estudios sobre ejercicio físico y cáncer de mama logren un mayor control sobre cada una de las variables que pueden incidir en los resultados.
La gran diferencia en la edad de las pacientes incluida en los estudios puede variar los resultados, debido a que las respuestas de adaptación al ejercicio están asociadas a la edad y, por lo tanto, hay una reducida capacidad de adaptación de las pacientes adultas mayores. Frente a las características ligadas al tipo de tumor, es importante resaltar que el cáncer de mama tiene características biológicas heterogéneas y, por lo tanto, las asociaciones del factor de riesgo pueden ser diferentes de acuerdo a las características del tumor, incluyendo el estatus del receptor del estrógeno (ER) y el receptor de la progesterona (PR) (44, 45). El 80% de las mujeres con diagnóstico de tumor en etapa I tienen un promedio de supervivencia superior a 5 años, mientras que sólo el 25% de las mujeres con diagnóstico de tumores en etapa II-IV presentan expectativas de vida superiores a los 5 años (46).
Dentro de los estudios no se realizaron observaciones que permitieran establecer si el estadio del cáncer podría tener alguna relación con los resultados observados en el impacto del ejercicio.
Frente a los parámetros fundamentales del ejercicio, como son: el período de exposición, momento crítico de la exposición, intensidad, frecuencia y duración de la actividad física necesaria para disminuir el riesgo del cáncer de mama, se encuentran divergencias entre los estudios, lo cual conduciría a pensar que cualquier nivel de actividad puede tener un efecto protector, por lo tanto, no se pude definir cuál es la dosis-respuesta más apropiada. Está demostrado que la formación de adaptaciones homeostáticas funcionales en el proceso de entrenamiento está vinculada con un determinado dinamismo de la sensibilidad de las respuestas a los estímulos adecuados, los cuales dependen de cada uno de los factores mencionados anteriormente. La magnitud de las cargas de trabajo físico influye de manera diferente sobre la estabilidad, sensibilidad y velocidad de respuesta (47). El principio de eficacidad del estímulo de la carga comprende que la carga debe sobrepasar un umbral determinado para que pueda existir un aumento en la capacidad funcional y cada una de ellas tiene umbrales diferentes, lo cual indica que no cualquier actividad puede provocar un efecto. La carga implica no solamente la intensidad sino también una duración de aplicación suficiente; sin embargo, hasta el momento es imposible establecer una relación general entre estos dos componentes.
La duración total de los programas varía de 6 a 24 semanas (Tabla 2) y en todos se presentan resultados positivos en las diferentes variables utilizadas para verificar su impacto. Aquí es importante mencionar el estudio de Dalas (48), en el cual, al cabo de 50 días de entrenamiento aeróbico en sujetos sedentarios, se mejoró el consumo máximo de oxígeno en un 33%. El consumo máximo de oxígeno se incrementa de un 10% a un 20% después de 2-3 meses de entrenamiento, a razón de tres sesiones por semana, con duraciones de 30 minutos por sesión (49).
Los estudios de mayor duración revisados (31-33, 36, 37, 40) no realizaron evaluaciones periódicas que permitieran observar en el tiempo, la evolución de las variables utilizadas e identificar el momento donde se logra el mayor desarrollo y su estabilización, razón por la cual, no se puede establecer cual es el tiempo de exposición adecuado. Por otra parte, no se pueden comparar los resultados entre un estudio y otro debido a la variedad de los instrumentos y métodos utilizados en la evaluación de las varibles. Por ejemplo, en caso de la potencia aeróbica se utilizaron pruebas directas con ergoespirometría y pruebas de campo como el test de la milla. Esta diversidad metodológica utilizada para evaluar la actividad física total no permite determinar el impacto real del ejercicio.
De igual manera, el número de sesiones por semana presenta gran dispersión, varía de 3 a 6. En sujetos sedentarios el aumento de la frecuencia no está asociado necesariamente con mejores resultados para el caso de la potencia aeróbica. En estudios realizados en este tipo de población se identificó que tres sesiones tienen un mejor efecto que cinco (50) para lograr o mantener adaptaciones. Se cree que la magnitud y el tipo de adaptaciones asociadas al entrenamiento aeróbico están más relacionadas con la intensidad del ejercicio que con la frecuencia. Sin embargo, otros autores plantean que la frecuencia de entrenamiento tiene mayor efecto que la duración (51). Las sesiones cotidianas cortas tienen el mismo efecto que sesiones largas dos o tres veces por semana (49), lo cual es aplicable para el caso de la fuerza, la flexibilidad y la composición corporal, debido a que los resultados se mejoran en proporción al aumento del número de sesiones. En el caso de la fuerza, por ejemplo, un estímulo cotidiano puede mejorar la fuerza del 1% al 4%. Ningún estudio exploró el comportamiento de sus variables a partir de un incremento progresivo del número de sesiones o realizó una comparación entre grupos con frecuencias de ejercicio diferentes. Es decir, no queda claro cuál es el número de sesiones de entrenamiento más apropiado y que conduzca a mejores resultados para este tipo de población.
La duración de las sesiones, al igual que los otros factores, presenta gran variedad, que va desde los 30 hasta los 69 minutos de actividad física por sesión. Esta variación ratifica las mismas controversias que existen en torno a este tema. Ninguno de los estudios realizó comparaciones entre la duración de las sesiones y su impacto en los resultados. Un entrenamiento de dos horas por semana puede incrementar el consumo máximo de oxígeno en 0,4 litros min¹. Si incrementamos a cuatro horas de entrenamiento el aumento del consumo máximo de oxígeno, no será el doble, pero puede ser de 0,5-0,6 litros min¹, es decir, no existe una relación lineal entre la cantidad de entrenamiento y el efecto producido (49).
Un estudio llevado a cabo en Noruega realizó un seguimiento durante 14 años a 351 mujeres que desarrollaron cáncer de mama (59) y encontraron que las mujeres que efectuaron por lo menos 4 horas semanales de actividad física presentaron tasas más bajas (37%) de cáncer de mama, que las mujeres sedentarias. Las mujeres que realizaron estas actividades por siete o más horas a la semana, tenían una reducción más grande del riesgo, o un riesgo más bajo del 18%, que las que participaron en actividades recreacionales moderadas o vigorosas de 1 hora a la semana.
El volumen total del ejercicio (frecuencia y duración de las sesiones) tiene un impacto en el mantenimiento del balance energético, modificando los efectos nocivos de los adipocitos en el metabolismo del estrógeno y reducción en los niveles de la hormona esteroides, razón por la cual se podría pensar que se obtienen mejores beneficios a nivel del balance energético con mayores volúmenes de trabajo.
Frente a la intensidad del ejercicio, los diferentes estudios, como lo observamos en la Tabla 2, presentan rangos de intensidad que van desde ejercicio de baja intensidad (50-60% de la frecuencia cardiaca) hasta alta intensidad (70-85% de la frecuencia cardiaca), y es bien conocido y documentado que las adaptaciones producidas por trabajos al 60% de la frecuencia cardiaca son muy diferentes de las causadas por intensidades cercanas a la frecuencia máxima. En el caso del cáncer de mama, por ejemplo, el ejercicio intenso y la pérdida del peso conducen a un cambio en el metabolismo del estrógeno (52) que, debido a su estructura química híbrida (en parte catecolamina, en parte esteroide) ejercen funciones mediadoras cruciales en el hipotálamo y la pituitaria.
Altos niveles de actividad física pueden reducir el riesgo del cáncer de mama a través de la vía de señalización de la insulina y la insulina factor de crecimiento. El ejercicio reduce la circulación de insulina y glucosa, lo cual puede afectar los niveles de IGF-1 & FBP (53), que podría dar lugar a disminución de biodisponibilidad de IGF-I, lo que reduce el riesgo de cáncer de mama (18). Igualmente, se ha demostrado que elevados niveles de actividad física están asociados a niveles inferiores de marcadores de inflamación (30, 53, 54).
Los cambios en el sistema inmune son dependientes de la intensidad, duración, y la frecuencia de la actividad física. Actualmente, es confuso saber qué alteraciones darán lugar a efectos perjudiciales o protectores. La función inmune se ve comprometida generalmente por los niveles extremos de la actividad física (14), las actividades de alta intensidad dan lugar a la al inmunosupresión, evidenciada por una reducción en la leucocitosis y deterioro general de las células del sistema inmune; por el contrario, la actividad física moderada y regular mejora el sistema inmunológico provocando la liberación de citocinas, las cuales regulan la interacción de anticuerpos y células T inmunes amplificando de esta forma la reactividad inmunológica.
El ejercicio, especialmente de alta intensidad, reduce los niveles hormonales circulatorios endógenos de estrógenos, al igual que la exposición cumulativa por alteraciones en la función menstrual y especialmente cuando se combina con la reducción del consumo de energía. Los niveles moderados de actividad física se han asociado a concentraciones más bajas del estrógeno circulante, aunque la evidencia ha sido contraria. La evidencia en mujeres atletas indica que éstas presentan un aumento en los niveles de estrógenos a través de la vía de hidroxilación de C-2, disminuyendo la hidroxilación de C-16-a, lo que puede ser un mecanismo a través del cual la actividad física reduce el riesgo de cáncer de mama en personas activas (55).
El ejercicio intenso incrementa el umbral de secreción de ACTH y cortisol, mientras que el ejercicio aeróbico disminuye las concentraciones plasmáticas de estos glucocorticoides que tienen un efecto inmunomodulatorio (56). Ejercicios con intensidades superiores al 30% del consumo máximo de oxígeno aumentan las concentraciones plasmáticas de adrenalina y noradrenalina; la liberación de beta-endorfinas se eleva después de un ejercicio prolongado intenso.
Los ejemplos presentados nos demuestran la especificidad que tiene la intensidad del ejercicio sobre la regulación de algunos de los aspectos que tienen incidencia en el cáncer de mama y las adaptaciones fisiológicas.
En resumen, no es posible establecer una intensidad general del ejercicio que se pueda aplicar de forma generalizada, pues ésta varía no solamente de un individuo al otro, sino también de acuerdo a la edad.
Otro factor importante que se debe resaltar por la incidencia que puede tener en los resultados, es el monitoreo y seguimiento del programa de ejercicio. En los estudios donde el total de las sesiones de ejercicio son controladas y monitoreadas directamente por el grupo de expertos, se garantiza que los pacientes realicen las actividades acorde a la duración, intensidad y frecuencia programadas; por el contrario, cuando el seguimiento se realiza en forma indirecta, esto dificulta conocer realmente la intensidad, frecuencia y duración del ejercicio realizado durante las sesiones de entrenamiento.
De igual forma, el tipo de actividad desarrollado tiene una incidencia fundamental debido a que los efectos de una actividad física continua no son iguales a los de una intermitente.
Otro de los problemas cruciales sobre los que no se pudo profundizar, fue sobre el impacto que tiene el ejercicio físico en los marcadores tumorales asociados al cáncer de mama [ErbB-2, P53 FOSFOPROTEINA, proliferación celular (Ki67), BRCA1, PCNA, receptores hormonales ER/PR, Bcl-2, DDB2 proteína, P27 PROTEÍNA, SKP2, IGF1, IGF2, IGFBP1-3, Estradiol] y de esta forma plantear las posibles vías y mecanismos biológicos de acción. Sólo un estudio (40) aborda el impacto del ejercicio sobre la IGF1-2 y IGFBP1-3, lo que hace necesario multiplicar este tipo de estudios hacia los diferentes marcadores con el fin de identificar sobre cuál de ellos el ejercicio físico tiene un mayor impacto.
Es importante que los futuros estudios permitan identificar la dosis-respuesta y comprender mejor el papel del ejercicio físico en las pacientes sobrevivientes de cáncer de mama. Para ello, los estudios deben presentar diseños metodológicos rigurosos que examinen diversos tipos del ejercicio (baja, moderada y alta intensidad), lo cual permitirá entender mejor el papel del ejercicio físico, puesto que los mecanismos biológicos que subyacen en la asociación de actividad física y reducción del riesgo de cáncer de mama están en relación con su duración, frecuencia, intensidad, y tiempo de exposición. Por otra parte, se debe incorporar el avance que se ha logrado en los métodos de evaluación de la actividad, la definición de los biomarcadores apropiados y la incorporación de nuevas tecnologías como los microarrays que permiten examinar los cambios de expresión de genes y proteínas en respuesta a la actividad física. Incrementar los estudios con modelos animales, pues estos nos permiten de forma más directa identificar cómo la actividad física influye en los mecanismos biológicos de acuerdo a las características del tumor y al tipo de tratamiento coadyuvante recibido.
Igualmente, se deben implementar evaluaciones intermedias que permitan observar la evolución de las respuestas.
1. Marxfelda H, Staedtlerb F, Harleman J. Characterisation of two rat mammary tumour models for breast cancer research by gene expression profiling. Exp Toxicol Pathol 2006;58:133-43. [ Links ]
2. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108. [ Links ]
3. McTiernan A, Kooperberg C, White E, et al. Women's health initiative cohort study. Recreational physical activity and the risk of breast cancer in postmenopausal women: the Women's Health Initiative Cohort Study. JAMA 2003;290(10):1331-6. [ Links ]
4. Lee IM. Physical activity and cancer prevention – data from epidemiologic studies. Med Sci Sports Exerc 2003;35(11):1823-7. [ Links ]
5. Moore DB, Folsom AR, Mink PJ, Hong CP, Anderson KE, Kushi LH. Physical activity and incidence of postmenopausal breast cancer. Epidemiology 2000;11:292-6. [ Links ]
6. Bardia A, Hartmann LC, Vachon CM, et al. Recreational physical activity and risk of postmenopausal breast cancer based on hormone receptor status. Arch Intern Med 2006;166:2478-83. [ Links ]
7. Lahmann PH, Friedenreich C, Schuit AJ, Salvini S, Allen NE, Key TJ, et al. Physical activity and breast cancer risk the European prospective investigation into cancer and nutrition. Cancer Epidemiol Biomarkers Prev 2007;16(1):36-42. [ Links ]
8. Hoffman-Goetz L, Apter D, Demark-Wahnefried W, Goran MI, McTiernan A, Reichman ME. Possible mechanisms mediating an association between physical activity and breast cancer. Cancer 1998;83(Suppl 3):621-8. [ Links ]
9. McNeely ML, Campbell KL, Rowe BH, Klassen TP, Mackey JR, Courneya KS. Effects of exercise on breast cancer patients and survivors: a systematic review and meta-analysis. CMAJ 2006;175(1):34-41. [ Links ]
10. Bicego D, Brown K, Ruddick M, Storey D, Wong C, Harris SR. Effects of exercise on quality of life in women living with breast cancer: A systematic review. The Breast Journal 2009;15(1):45-51. [ Links ]
11. Schwartz AL. Physical activity. Semin Oncol Nurs 2008;24(3):164-70. [ Links ]
12. Markes M, Brockow T, Resch K. Ejercicio para mujeres que reciben tratamiento adyuvante para el cáncer de mama. Biblioteca Cochrane Plus 2007;4:1-33. [ Links ]
13. McTiernan A. Behavioral risk factor en breast cancer: can risk be modifie? Oncologist 2003;8(4):326-34. [ Links ]
14. Gammon MD, John EM, Britton JA. Recreational and occupational physical activities and risk of breast cancer. J Natl Cancer Inst 1998 Jan 21;90(2):100-17. [ Links ]
15. Margolis KL, Mucci L, Braaten T, Kumle M, Lagerros YT, Adami HO, et al. Physical activity in different periods of life and the risk of breast cancer: The Norwegian-Swedish women's lifestyle and health cohort study. Cancer. Epidemiol Biomarkers Prev 2005;14(1):27-32. [ Links ]
16. Friedenre C, Cust A. Physical activity and breast cancer risk: Impact of timing, type and dose of activity and population sub-group effects review article. Br J Sports Med 2006;42:636-47. [ Links ]
17. Thune I, Furberg AS. Physical activity and cancer risk: dose-response and cancer, all sites and site-specific. Med Sci Sports Exerc 2001;33(Suppl 6):S530-50 [ Links ]
18. Adams SA, Matthews CE, Hebert JR,Moore CG .,Cunningham JE., Shu X_O., et al. Association of physical activity with hormone receptor status: the Shanghai Breast Cancer Study. Cancer Epidemiol Biomarkers Prev 2006;15:1170-8. [ Links ]
19. Monninkhof E, Elias S, Vlems F, Schuit A, Voskuil D, Van Leeuwen F. Physical activity and breast cancer: a systematic review. Epidemiology 2007;18(1):137-57. [ Links ]
20. Friedenreich CM, Cust AE. Physical activity and breast cancer risk: impact of timing, type and dose of activity and population subgroup effects. Br J Sports Med 2008;42:636-47. [ Links ]
21. Mutrie N, Campbell AM, Whyte F, McConnachie A, Emslie C, Lee L, et al. Benefits of supervised group exercise programme for women being treated for early stage breast cancer: Pragmatic randomised controlled trial. BMJ 2007;334:517-24. [ Links ]
22. Friedenreich C. Physical activity and cancer prevention: from observational to intervention research. Cancer Epidemiology, Biomarkers & Prevention 2001;10:287-301. [ Links ]
23. Westby M, Clarke M, Hopewell S, Ram F. Masking reviewers at the study inclusion stage in a systematic review of health care interventions (Protocol for a Cochrane Review). The Cochrane Library (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000019/pdf) [Acceso 2009 Feb 21] [ Links ].
24. Ghersi D, Dickersin K. Impact of shared scientific or ethical review of multicentre clinical research on the quality of clinical research and the clinical research process (Protocol for a Cochrane Review). The Cochrane Library, (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000017.pub2/pdf) [Acceso 2009 Feb 21] [ Links ].
25. Clarke M, Stewart L, Tierney J, Williamson P. Individual patient data meta-analyses compared with meta-analyses based on aggregate data (Protocol for a Cochrane Review). The Cochrane Library, (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000007/pdf) [Acceso 2009 Feb 21] [ Links ].
26. Vist GE, Hagen KB, Devereaux PJ, Dianne Jackowski, Oxman AD. Outcomes of patients who participate in randomized controlled trials versus those of similar patients who do not participate (Protocol for a Cochrane Review). The Cochrane Library (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000009/pdf) [Acceso 2009 Feb 21] [ Links ].
27. Villanueva EV, Wasiak J. N-of-1 trials for making therapy decisions (Protocol for a Cochrane Review). The Cochrane Library, (http://www.update-software.com) [Acceso 2009 Feb 21] [ Links ].
28. Olsen KL, Hopewell S, Dickersin K, Clarke M, Oxman AD. Publication bias in clinical trials (Protocol for a Cochrane Review). The Cochrane Library (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000006/pdf) [Acceso 2009 Feb 21] [ Links ].
29. McDonald S, Crumley E, Eisinga A, Villanueva E. Search strategies to identify reports of randomized trials in MEDLINE (Protocol for a Cochrane Review). The Cochrane Library (http://onlinelibrary.wiley.com/doi/10.1002/14651858.MR000018.pub2/pdf) [Acceso 2009 Feb 21] [ Links ].
30. Slattery ML, Edwards S, Murtaugh MA, Swenney C, Herrick J, Byers T, et al. Physical activity and breast cancer risk among women in the southwestern United States. Ann Epidemiol 2007;17:342-53. [ Links ]
31. Latka RN, Alvarez-Reeves M, Cadmus L, Irwin ML. Adherence to a randomized controlled trial of aerobic exercise in breast cancer survivors: the Yale exercise and survivorship study. J Cancer Surviv 2009;3:148-57. [ Links ]
32. Hsieh CC, Sprod LK, Hydock DS, Carter SD, Hayward R, Schneider CM. Effects of a supervised exercise intervention on recovery from treatment regimens in breast cancer survivors. Oncol Nurs Forum 2008;35(6):909-15. [ Links ]
33. Klika RJ, Callahan KE, Golik KS. Exercise Capacity of a Breast Cancer Survivor: A Case Study. Med Sci Sports Exerc 2008;40(10):1711-6. [ Links ]
34. Ligibel JA, Campbell N, Partridge A, Chen WY, Salinardi T, Chen H, et al. Impact of a mixed strength and endurance exercise intervention on insulin levels in breast cancer survivors. J Clin Oncol 2008;26:907-12. [ Links ]
35. Campbell A, Mutrie N, White F, McGuire F, Kearney N. A pilot study of a supervised group exercise programme as a rehabilitation treatment for women with breast cancer receiving adjuvant treatment. Eur J Oncol Nurs 2005;9:56-63. [ Links ]
36. Rabin C, Bernardine B, Dunsiger S, Nash J, Trask P. Exercise and relaxation intervention for breast cancer survivors: feasibility, acceptability and effects. Psychooncology 2008;18(3):258-66. [ Links ]
37. Milne HM, Wallman KE, Gordon S, Courneya KS. Effects of a combined aerobic and resistance exercise program in breast cancer survivors: a randomized controlled trial. Breast Cancer Res Treat 2008;108:279-88. [ Links ]
38. Mock V, Frangakis C, Davidson N, Ropka M, Pickectt M, Poniatowski B, et al. Exercise manages fatigue during breast cancer treatment: A randomized controlled trial. Psychooncology 2005;14:464-77. [ Links ]
39. Pinto BM, Frierson GM, Rabin C, Trunzo JJ, Marcus BH. Home-based physical activity intervention for breast cancer patients. Am J Clin Oncol 2005;23:3577-87. [ Links ]
40. Schmitz KH, Ahmed R, Hannan P, Yee D. Safety and efficacy of weight training in recent breast cancer survivors to alter body composition, insulin, and insulin-like growth factor axis proteins. Cancer Epidemiol Biomarkers Prev 2005;14:1672-80. [ Links ]
41. Courneya KS, Mackey JR, Bell GJ, Jones LW, Field CJ, Fairey AS. Randomized controlled trial of exercise training in postmenopausal breast cancer survivors: Cardiopulmonary and quality of life outcomes. J Clin Oncol 2003;21:1660-8. [ Links ]
42. Kaltsatou A, Mameletzi D, Douka S. Physical and psychological benefits of a 24-week traditional dance program in breast cancer survivors. J Bodyw Mov Ther 2011;15:(2):162-167. [ Links ]
43. Daley AJ, Crank H, Saxton JM, Mutrie N, Coleman R, Roalfe A. Randomized trial of exercise therapy in women treated for breast. Cancer. J Clin Oncol 2007;25:1713-21. [ Links ]
44. Zhang SM HS, Hunter DJ, Giovannucci EL, Colditz GA, Willett WC. Folate intake and risk of breast cancer characterized by hormone receptor status. Epidemiol Biomarkers Prev 2005;14:2004-8. [ Links ]
45. Potter JD, Cerhan JR, Sellers TA, et al. Progesterone and estrogen receptors and mammary neoplasia in the Iowa Women's Health Study: how many kinds of breast cancer are there? Cancer Epidemiol Biomarkers Prev 1995;4:319-26. [ Links ]
46. Isasi CR, Moadel RM, Blaufox MD. A meta-analysis of FDG-PET for the evaluation of breast cancer recurrence and metastases. Breast Cancer Research and Treatment 2005;90:105-112. [ Links ]
47. Mishchenco V, Monogarov V. Fisiología de Deportista: Bases científicas de la preparación, fatiga y recuperación de los sistemas funcionales del organismo de los deportistas de alto nivel. Barcelona, España: Paidotribo; 2000. [ Links ]
48. Saltin B, Blomqvist G, Mitchell J, Johnson RJ, Wildenthal K, Chapman C. Response to exercise after bed rest and after training. Circulation 1968;38(Suppl 5):1-78. [ Links ]
49. Astrand P-O, Rodhal K, Lacour J-R, Duizabo D. Précis de Physiologie de l'exercice musculaire. Paris: Masson; 1994. [ Links ]
50. Busso T, Benoit H, Bonnefoy R, Feasson L, Lacour J. Effects of training frequency on the dynamics of performance response to a single training bout. J Appl Physiol 2002;92(2):572-80. [ Links ]
51. Weineck J. Manuel D'entrainement. Paris: Vigot; 1990. [ Links ]
52. Timmer EC, De Creé C, Belgium Z. Effect of energy deficiency on estrogen metabolist in female athletes. Med Sci Sports Exerc 2007;39(7):1090-7. [ Links ]
53. McTiernan A, Ulrich C, Slate S, Potter J. Physical activity and cancer etiology: associations and mechanisms. Cancer Causes and Control 1998;9:487-509. [ Links ]
54. McTiernan A, Kooperberg C, White E. Recreational physical activity and the risk of breast cancer in postmenopausal women: The women's health initiative cohort study. JAMA 2003;290(10):1331-6. [ Links ]
55. Woolf-May K. Exercise Prescription: Physiological foundations. A guide for health, sport and exercise professionals. Boston: Masson; 2008. [ Links ]
56. Hoffman-Goetz L. Exercise, natural immunity, and tumor metastasis. Med Sci Sports Exerc 1994 Feb;26(2):157-63. [ Links ]













