Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.13 n.2 Bogotá jun. 2006
GUÍA ACADÉMICA
Ruth Eraso G1 , Mónica Velásquez M2, Clara Malagón G3, María del Pilar Gómez M4, Carlos Olmos O5, Jorge Donado G6.
1 Pediatra Reumatóloga. Hospital Pablo Tobón Uribe; Profesora Auxiliar de Reumatología Pediátrica, Facultad de Medicina, Universidad de Antioquia, Medellín.
2 Pediatra Reumatóloga. Hospital San Vicente de Paúl; Clínica Cayre. Medellín, Bogotá.
3 Pediatra Reumatóloga. Clínica del Niño Jorge Bejarano, Clínica Infantil Colsubsidio, Bogotá.
4 Pediatra Reumatóloga. Clínica Rafael Uribe Uribe. Profesora de Pediatría, Universidad Libre, Santiago de Cali.
5 Pediatra Reumatólogo, Inmunólogo. Fundación CardioInfantil y Clínica CAYRE. Profesor de Pediatría de la Universidad del Rosario y la Universidad de La Sabana, Bogotá.
6 Internista Epidemiólogo Clínico del Hospital Pablo Tobón Uribe y Profesor Asociado de la Universidad Pontificia Bolivariana, Medellín.
Resumen
A partir del beneficio observado en adultos con artritis reumatoide tratados con antagonistas del factor de necrosis tumoral, ha habido un interés creciente en expandir su utilización a los niños. Sin embargo, diversas condiciones propias de la reumatología pediátrica determinan que la evidencia disponible sea escasa o de un bajo nivel de calidad. Fruto de la revisión crítica de la literatura y de una reunión de consenso, se presenta una Guía de Práctica Clínica, cuyo propósito es ofrecer recomendaciones que orienten el uso racional de estos medicamentos.
Palabras clave: reumatología pediátrica, niños, artritis idiopática juvenil, artritis reumatoide juvenil, antagonistas del factor de necrosis tumoral, etanercept, infliximab, adalimumab, eficacia, indicaciones, seguridad, efectos adversos.
Summary
From benefits observed in adults suffering rheumatoid arthritis treated with antagonists of tumoral necrosis factor, there was a growing interest about its use in children. However several conditions pertaining to pediatric rheumatology determine that available evidence be poor or of low quality. As a result of a critical review of the literature and after a consensus meeting a Practical Clinical Guide is presented: its purpose consist in offering recommendations for the rational use of these medications.
Key Words: pediatric rheumatology, children, juvenile idiopathic arthritis, juvenile rheumatoid arthritis, tumor necrosis factor antagonists, etanercept, infliximab, adalimumab, efficacy, indications, doses, security, adverse effects.
Introducción
Las artritis crónicas son la categoría más común de enfermedades reumáticas inflamatorias en la infancia y representan una causa importante de discapacidad a corto y largo plazo. Incluyen un grupo heterogéneo de patologías con pronóstico y severidad variables, cuya clasificación ha sido controversial. La clasificación más reciente es la propuesta por la Asociación Internacional de Ligas contra el Reumatismo (ILAR), que sugiere el término Artritis Idiopática Juvenil (AIJ) para agrupar a las artropatías de la infancia de causa desconocida1. Esta clasificación incluye, además de los subtipos pertenecientes a la clasificación de Artritis Reumatoide Juvenil (ARJ), los pacientes con artritis psoriática y aquellos correspondientes a las espondiloartropatías seronegativas que bajo este sistema de clasificación se incluyen en la categoría de artritis-entesitis. Las diferentes enfermedades incluidas bajo el término de AIJ comparten, además de la sinovitis, la manifestación clínica de uveítis.
El tratamiento farmacológico ideal de la AIJ debería contrarrestar el proceso inflamatorio que es el responsable del daño estructural y de las manifestaciones sistémicas; con nulos o mínimos efectos adversos. En este sentido, la introducción de la terapia biológica ha representado un gran avance ya que se modula de manera más específica el proceso inflamatorio; sin embargo, en la medida en que su uso se ha extendido han aparecido eventos adversos serios y aún no se conocen con certeza sus efectos a largo plazo.
A partir del auge que ha generado el uso de los fármacos antagonistas del factor de necrosis tumoral (antiTNF) en adultos, ha surgido un interés creciente en extender su uso a los niños; sin embargo, diversas circunstancias propias de la reumatología pediátrica determinan que la evidencia disponible respecto a su uso sea escasa o de un bajo nivel de calidad. Esta situación hace imprescindible disponer de unos parámetros que permitan orientar el uso de estos medicamentos en los pacientes con AIJ, logrando que se beneficien aquellos en quienes realmente están indicados, evitando la exposición innecesaria de otros pacientes a efectos adversos potencialmente severos, con el alto costo económico que esto implica.
Se presenta una guía de práctica clínica (GPC) basada en la evidencia, sobre el uso de terapia antiTNF en AIJ y uveítis.
Guía de Práctica Clínica sobre el uso de terapia antifactor de necrosis tumoral en Artritis Idiopática Juvenil
¿Cuál es la justificación y propósito de la guía?
El tratamiento de la AIJ es complejo y en los pacientes refractarios a los esquemas convencionales, está poco estandarizado; además implica un alto costo en términos de consumo de recursos de salud, complicaciones y secuelas.
El propósito de esta GPC es ofrecer recomendaciones sobre el uso de agentes antiTNF, respecto a: eficacia, indicaciones, seguridad y costos de los medicamentos disponibles en Colombia.
¿Cuál es el objetivo de la guía?
Se pretende ofrecer recomendaciones sobre el uso racional de agentes antiTNF en pacientes con AIJ, teniendo como desenlaces: inducción de remisión, impacto en la morbilidad y efectos adversos. Dichas recomendaciones deben aplicarse a pacientes en edad pediátrica, refractarios a los esquemas convencionales de tratamiento, en quienes se espera que el uso de estos medicamentos tenga un impacto favorable en la morbimortalidad de la enfermedad y en la calidad de vida, con un perfil adecuado de seguridad.
Se espera a través de su implementación, propender por una práctica clínica más uniforme que beneficie a los pacientes en quienes realmente esté indicado el uso de los agentes antiTNF, haciendo un uso oportuno y racional de estos.
¿A quién va dirigida la guía?
A pediatras reumatólogos y a internistas reumatólogos con experiencia en el tratamiento de niños, quienes laboren en un nivel de atención apropiado para el cuidado de los pacientes y para la vigilancia de efectos adversos relacionados con el uso de los medicamentos.
Metodología para el desarrollo de la guía de práctica clínica basada en la evidencia
Con base en el objetivo planteado, la Asociación Colombiana de Reumatología hizo una convocatoria para participar en el desarrollo de la GPC a los cinco pediatras reumatólogos que para el momento de la elaboración del consenso se encontraban ejerciendo en el país y a un epidemiólogo clínico para asesorar el proceso. Se seleccionaron los diversos tópicos de interés sobre el tema y se hizo una búsqueda de la literatura a través de las bases de datos de Medlline, Embase, Cochrane, Lilacs, CCTR, y de listas de referencias, a partir del año 2000. Los términos usados para la búsqueda en las bases de datos fueron los términos MeSH: rheumatology, rheumatics diseases, juvenile rheumatoid arthritis, juvenile idiopathic artritis, etanercept, infliximab, adalimumab. Los artículos más relevantes fueron revisados con asesoría del epidemiólogo, para evaluar la calidad de la evidencia con base en las guías de apreciación crítica de la literatura de JAMA y hacer una categorización de ésta, con base en la clasificación del centro de Oxford de Medicina Basada en la Evidencia(2) (Tabla 1). No se incluyeron abstracts en el análisis; cuando la información de alguno de ellos fue considerada muy importante, se contactó directamente a los autores para conseguir la mayor cantidad de información adicional posible. Los artículos seleccionados se distribuyeron entre todos los participantes. En vista de que algunos de los aspectos que era necesario incluir en la guía carecían de una adecuada evidencia se convocó a una reunión presencial de los participantes para discutir estos temas y tomar decisiones en consenso. Posteriormente se redactó este documento que resume las conclusiones obtenidas del proceso.

Se recibió apoyo logístico de la industria farmacéutica, pero estas entidades no participaron en ningún aspecto de la programación ni ejecución de la GPC.
¿Cuándo se debe hacer nueva revisión de la guía?
Debido a los estudios que hay en curso y a lo relativamente nuevo de la terapia antiTNF en niños, el consenso recomienda revisar esta guía nuevamente a la luz de la evidencia que se generará, en un período no mayor a dos años.
AIJ: categorías oligoarticular, poliarticular y sistémica
Etanercept
a. Eficacia
En adultos el etanercept (ETN) ha demostrado en estudios aleatorizados controlados (EAC), eficacia en el tratamiento de la AR activa refractaria a otros fármacos modificadores de la enfermedad (DMARDS)(3, 4). En niños su uso está aprobado por la FDA (de las siglas en inglés “Food and Drug Administration”) para el tratamiento de la AIJ de curso poliarticular. Algunos estudios abiertos demostraron resultados favorables del uso del ETN en niños con ARJ o AIJ de curso poliarticular(5-9) (Nivel de evidencia 2b. Grado de recomendación B).
En un EAC, el ETN demostró eficacia en pacientes con ARJ de cualquier tipo de inicio (oligoarticular, poliarticular o sistémico) y curso poliarticular con enfermedad activa, a pesar de tratamiento con antinflamatorios no esteroideos (AINES) y metotrexate (MTX), a una dosis de al menos 10 mgs/m2/semana10 (Nivel de evidencia 1b. Grado de recomendación A). En la Tabla 2 se presenta el análisis de los desenlaces principales para determinar la eficacia del ETN en este estudio10 y se comparan con los del Infliximab (IFX)(11).
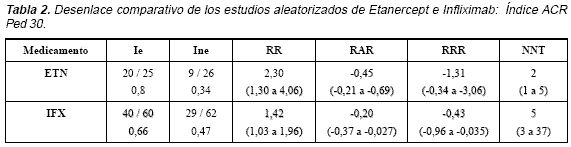
La respuesta al tratamiento se determinó con base en un índice de mejoría denominado ACR Ped 30 (de las siglas en inglés “American College Rheumatology Pediatric 30”), Tabla 3.

En el 72% de los pacientes con ETN (dieciocho pacientes) se observó una disminución del índice del 50% (ACR Ped 50), comparado con el 23% (seis pacientes) del grupo placebo que lograron el mismo índice. Los pacientes que recibieron ETN presentaron un menor número de exacerbaciones que los pacientes en placebo (81% y 28% respectivamente)(10), (Nivel de evidencia 1b. Grado de recomendación A).
En una fase abierta extendida de este estudio, en el momento del análisis, 48 de los 58 pacientes (83%) continuaban en tratamiento y 43 de ellos (74%) habían completado dos años de seguimiento. De estos 43 pacientes, 81% cumplían el ACR Ped 30 y 79% y 67% de los pacientes lograban un ACR 50 y 70 respectivamente. De los 32 pacientes que recibieron prednisona durante la fase de extensión, 26 (81%) pudieron disminuir la dosis a menos de 5 mg/día12 (Nivel de evidencia 2b. Grado de recomendación B).
b. Dosis
La dosis utilizada en los estudios referenciados es de 0,4 mg/kg/dosis, subcutánea, dos veces a la semana. semana. En un estudio abierto retrospectivo, en ocho pacientes con respuesta inadecuada a la dosis estándar, se utilizaron dosis mayores de 0,8 mg/kg, con dosis máximas de 25 mg s.c., dos veces por semana(13). Se observó una respuesta favorable en sólo dos pacientes, por lo cual los autores concluyen que en pacientes refractarios a dosis estándar el aumento en la dosis puede no ofrecer beneficio adicional; sin embargo, el tamaño tan pequeño de la muestra y la metodología del estudio impiden afirmar esta conclusión (Nivel de evidencia 4. Grado de recomendación C).
No hay estudios en niños que evalúen la efectividad del medicamento aplicado en monodosis semanal.
c. Eficacia por tipos o categorías
Existe evidencia que indica que el ETN puede ser menos efectivo en AIJ sistémica que en los otros subtipos de AIJ. En el EAC(10), se incluyeron veintidós pacientes con la forma sistémica, quienes no presentaban enfermedad sistémica activa en el momento de ingreso al estudio; 77% de ellos (diecisiete pacientes) se clasificaron como respondedores al terminar la fase abierta y pasaron a la fase aleatorizada. Durante ésta, la frecuencia de exacerbación de la enfermedad fue del 88% (siete de ocho pacientes) en el grupo placebo y de 44% (cuatro de nueve pacientes) en el grupo que recibió ETN, en contraste con el 18% de otros tipos de ARJ que presentaron exacerbación durante el tratamiento con ETN (Nivel de evidencia 1b. Grado de recomendación A). En el seguimiento abierto a largo plazo, de los 48 pacientes incluidos en el momento de la evaluación, 12 eran de la forma sistémica; de estos solo el 47% había logrado un índice ACR Ped 70, comparado con el 62% de los pacientes de los otros subtipos(12) (Nivel de evidencia 2b. Grado de recomendación B).
En un estudio abierto, prospectivo, multicéntrico, se analizó la eficacia del medicamento en 22 pacientes de forma comparativa con 39 pacientes de los otros subtipos y se encontró que los pacientes con la forma sistémica era menos probable que respondieran(8) (Nivel de evidencia 2b. Grado de recomendación B). Un estudio evaluó la eficacia del ETN en una cohorte de 82 pacientes, por medio de un cuestionario estandarizado(14). Se observó una respuesta buena o excelente en el 46% de los pacientes, mientras que el 54% tuvieron una respuesta regular o pobre. Una tercera parte de los pacientes descontinuaron el tratamiento, principalmente por falta de eficacia(14) (Nivel de evidencia 4. Grado de recomendación C).
El aspecto de la seguridad es un tema de preocupación en esta forma de enfermedad ya que los pacientes tienen propensión a desarrollar el síndrome de activación de macrófago (SAM), una forma de síndrome hemofagocítico potencialmente fatal que con frecuencia es disparado por medicamentos(15). El ETN ha sido descrito como tratamiento de esta condición en un reporte(16), mientras que en otro caso, el medicamento se asoció al desarrollo del síndrome(17) (Nivel de evidencia 4. Grado de recomendación C).
d. Costos
Un estudio incluyó el análisis de costos relacionados con el uso de ETN(18). El objetivo fue determinar de manera retrospectiva, durante un año, los costos de adicionar ETN a la terapia previa de 31 pacientes con AIJ, cuya enfermedad era refractaria al tratamiento convencional. Se determinó que los costos directos aumentaron durante los primeros tres meses luego de la introducción del medicamento, pero disminuyeron durante el seguimiento. La mediana estimada de los costos directos por paciente, se incrementó en US$ 4.200, mientras que los costos indirectos se redujeron en un 50%. La mediana estimada del costo total por paciente se incrementó en aproximadamente US$ 2.700 por año que equivale a un 10%. En este estudio no se hizo un análisis de costo-efectividad(18) (Nivel de evidencia 4. Grado de recomendación C).
Infliximab
a. Eficacia
Al igual que con ETN, en adultos hay evidencia proveniente de EAC sobre la eficacia de este medicamento en artritis reumatoide(19). La aprobación por la FDA para uso en pacientes con AIJ está en trámite, mientras que ya está aprobado para pacientes con enfermedad de Crohn.
En algunos estudios no controlados se ha demostrado el efecto benéfico de su uso en niños con ARJ o AIJ de curso poliarticular(7, 20) (Nivel de evidencia 2b. Grado de recomendación C).
En un EAC, el (IFX) asociado a MTX demostró eficacia en pacientes con ARJ de cualquier tipo de inicio (oligoarticular, poliarticular o sistémico) y curso poliarticular, con enfermedad activa a pesar de tratamiento con MTX (10-15 mg/m2/semana), asociado o no a AINES y a dosis bajas de esteroides(11) (Nivel de evidencia 1b. Grado de recomendación A). En la Tabla 2 se presenta el análisis de los desenlaces principales para determinar la eficacia del IFX en el estudio aleatorizado(11) y se comparan con los del ETN(10).
La respuesta al tratamiento se determinó con base en el índice ACR Ped 30 a la semana 14. De los pacientes asignados a IFX 3mg/kg + MTX, el 65% (39/60) tuvieron una respuesta favorable, comparada con el 48% (29/61) de los que recibieron placebo + MTX (p = 0,0549). Esta diferencia, aunque estuvo cerca, no alcanzó a ser estadísticamente significativa; sin embargo, cuando se modificó el índice ACR Ped 30, sustituyendo la VSG por la proteína C reactiva, se alcanzó una diferencia que sí fue significativa entre ambos grupos. Del grupo que recibió IFX + MTX, el 67% (40/60) lograron un ACR Ped 30, comparado con el 48% (29/61) del grupo placebo + MTX (p = 0,0350).
En la segunda fase, los pacientes que recibían placebo + MTX fueron asignados a IFX 6 mg/kg, mientras que el otro grupo continuó recibiendo IFX 3 mg/kg. En los pacientes que recibieron IFX 6 mg/kg, el porcentaje de pacientes que logró el ACR Ped 30 (utilizando VSG o PCR) aumentó desde 48% a la semana 14 hasta 77% a la semana 28.
b. Dosis
En los estudios no controlados(7, 20) se ha utilizado una dosis de IFX de 3 mg/kg a las semanas 0, 2, 6 y luego cada ocho semanas.
En el EAC(11) se compararon dosis de 3 y 6 mg/kg en el mismo esquema de intervalos mencionado. En este estudio no se observó diferencia en cuanto a eficacia entre ambas dosis pero se presentaron más eventos adversos en los pacientes que recibieron la dosis de 3 mg/Kg.
c. Eficacia por tipos o categorías
En el EAC, los efectos benéficos son aplicables a pacientes con ARJ de curso poliarticular y cualquier tipo de inicio. Sin embargo, de los pacientes con el subtipo sistémico sólo se admitieron aquellos que no tuvieran manifestaciones sistémicas durante un año previo al ingreso al estudio; por lo tanto, los resultados no pueden generalizarse para todos los pacientes de este subtipo(11).
No hay estudios que evalúen la eficacia de IFX según el subtipo de AIJ.
d. Costos
No hay estudios sobre análisis de costos relacionados con el uso de IFX.
Adalimumab
Actualmente se está desarrollando un EAC, doble ciego, en el que se compara la eficacia del Adalimumab (ADM) como monoterapia (87 pacientes) con respecto a la combinación: ADM-MTX (84 pacientes) y al placebo. El informe preliminar sólo da información sobre la fase abierta (16 semanas), al final de la cual el 88% de los pacientes que recibía ADM asociado a MTX logró una respuesta ACR30, comparativamente con el 67% de mejoría en los pacientes con monoterapia. Estos pacientes fueron aleatorizados para recibir placebo o continuar el mismo esquema terapéutico(21). La información de la fase ciega del estudio aún no está disponible.
Conclusiones
1. ETN e IFX han demostrado en estudios aleatorizados, controlados, eficacia en el tratamiento de las categorías oligoarticular, poliarticular y sistémica de la AIJ (ARJ en la clasificación del Colegio Americano de Reumatología –ACR–).
Los efectos benéficos son aplicables a las formas de curso poliarticular, con una menor efectividad en la forma sistémica.
No hay EAC que hagan comparación entre los medicamentos antiTNF.
2. Aún no hay datos disponibles sobre la eficacia de Adalimumab ya que solo se posee información de la fase abierta del EAC.
3. Las dosis recomendadas de los medicamentos son:
Etanercept: 0,4 mg/kg/dosis, subcutánea, dos veces a la semana. Dosis máxima de 25 mg/dosis.
Infliximab: 3 a 6 mg/kg a las semanas 0, 2, 6 y posteriormente, cada ocho semanas.
Indicaciones definidas por el consenso
Los medicamentos antiTNF están indicados en pacientes con AIJ en las categorías oligoarticular, poliarticular y sistémica con las siguientes características:
1. Pacientes con AIJ de inicio oligo o poliarticular y curso poliarticular que reciben tratamiento adecuado con MTX y al menos otro DMARD, durante un período de tiempo mínimo de seis meses, de los cuales, el MTX debe ser administrado por vía parenteral al menos por tres meses, a dosis de 15 mg/m2/sem.
2. Pacientes con AIJ de inicio sistémico y curso poliarticular, que reciben tratamiento adecuado con MTX, durante un período de tiempo mínimo de seis meses, de los cuales, al menos tres meses debe ser administrado por vía parenteral, a dosis de 15 mg/m2/sem.
Quienes presenten enfermedad activa definida así:
Cinco o más articulaciones inflamadas y tres o más articulaciones con limitación del movimiento y dolor, sensibilidad o ambos.
O en quienes:
• se obtenga el control de la enfermedad solo con dosis altas de esteroides (>0,25 mg/kg/día), con efectos adversos inaceptables.
• sufran reacciones adversas a MTX u otro DMARD que impidan su uso de manera absoluta o a las dosis terapéuticas óptimas mencionadas.
Los pacientes candidatos a recibir terapia antiTNF deben tener sustrato óseo, es decir que no se encuentren en fase de anquilosis o con contracturas articulares severas e irreversibles.
Evaluación de la respuesta al tratamiento
Aplicación previa al inicio del tratamiento y posteriormente de forma periódica del índice ACR Ped 30 para determinar la respuesta terapéutica (Tabla 3).
Si el paciente no presenta esta respuesta al tercer mes de tratamiento, se considera fracaso terapéutico.
Agentes antiTNF en artritis relacionada con entesitis (Espondiloartropatías juveniles)
Eficacia
En adultos el ETN está aprobado para el tratamiento de la espondilitis anquilosante (EA) activa y severa, en Estados Unidos y Europa; y el IFX para esta misma indicación, en Europa, con base en varios EAC(22-24) (Nivel de evidencia 1b, grado de recomendación A).
En niños los estudios son escasos y en su mayoría son informes de casos y resúmenes en congresos. La serie más grande es la reportada por Horneff y col. quienes evaluaron de forma prospectiva y según criterios ACR Ped 30, cuarenta pacientes tratados con ETN 0,4 mg/kg/dosis (dosis máxima de 25 mg). Se encontró que luego de un promedio de seguimiento de catorce meses, 87% de los pacientes estaban libres de rigidez matinal, 69% no tenían articulaciones dolorosas, 87% mostraron una PCR inferior a 6 mg/l y 78%, una VSG inferior a 15 mm/h; en dieciséis pacientes (40%) se alcanzó remisión clínica(25) (Nivel de evidencia 4. Grado de recomendación C).
En otra serie, ocho niños en su mayoría mexicanos (88%), con artritis-entesitis refractarias, tratados con etanercept bisemanal, experimentaron una reducción en el conteo de articulaciones activas a los dos meses, la cual se mantuvo por dos años en siete sujetos, mientras que la entesitis se resolvió en todos los pacientes a los dos meses(26) (Nivel de evidencia 4. Grado de recomendación C).
Con IFX se han publicado dos reportes de casos. Un adolescente de diecisiete años, con EA refractaria, quien con una única infusión de IFX tuvo mejoría sostenida hasta la semana 14(27); y un niño de catorce años con espondilodiscitis, entesitis vertebral y sacroiliitis quien recibió IFX a dosis de 3 mg/kg y en quien se hizo seguimiento radiológico con resonancia magnética. A la quinta infusión del medicamento se observó una considerable resolución de la entesitis y solo cambios residuales confinados a L3/L4(28) (Nivel de evidencia 4. Grado de recomendación C).
Dosis
La dosis utilizada de ETN es de 0,4 mg/kg/dosis (dosis máxima de 25 mg).
En los dos informes de IFX, se ha utilizado a dosis de 3 mg/kg/dosis.
Costos
No hay estudios sobre costos en esta categoría de AIJ.
Conclusiones
1. Los resultados disponibles muestran en seguimientos prospectivos de series de casos un beneficio con el uso de terapia antiTNF. Por tratarse del grupo pediátrico en la mayoría de los reportes se ha utilizado ETN, mientras que con IFX los reportes son más escasos y con un menor número de pacientes.
2. No hay EAC con ninguno de los dos medicamentos en el grupo pediátrico.
3. No hay estudios que determinen la eficacia comparativa de ETN frente a IFX.
4. Aún no hay información disponible sobre adalimumab.
5. Las dosis utilizadas de ETN e IFX son extrapoladas del uso en las otras categorías de AIJ.
Consideraciones
El consenso internacional sobre el uso de agentes antiTNF en adultos con EA en el 2003 propone una serie de definiciones sobre los siguientes aspectos: selección de los pacientes que deben recibir tratamiento, parámetros de seguimiento y criterios de respuesta(29). Incluye pacientes con diagnóstico de EA que cumplan los criterios de Nueva York; este parámetro no sería aplicable al grupo pediátrico ya que la afección axial ocurre usualmente de cinco a diez años después de la afección periférica.
Para propósitos de la GPC, se definió incluir a los pacientes con artritis-entesitis de acuerdo con los criterios de clasificación de la ILAR(1).
Indicaciones definidas por el consenso
Serían candidatos para el inicio de terapia antiTNF los pacientes que cumplan los criterios de diagnóstico de artritis-entesitis de acuerdo con la clasificación de ILAR, quienes presenten:
Enfermedad refractaria definida como falla en el tratamiento con AINES durante mínimo tres meses, con al menos el uso de dos AINES, con dosis adecuada por kilo de peso.
El requisito de falla en el tratamiento con AINES es requerido en cualquiera de las tres presentaciones de la enfermedad: artritis periférica, entesitis o afección axial, con las siguientes especificaciones:
• Pacientes con artritis periférica refractaria a sulfasalazina (SSZ) (a menos que haya contraindicación o intolerancia) durante al menos cuatro meses a una dosis máxima de 50 mg/kg/día y refractaria al menos a dos infiltraciones de esteroides intrarticulares.
• Pacientes con entesitis refractaria a SSZ (a menos que haya contraindicación o intolerancia) durante al menos cuatro meses a una dosis máxima de 50 mg/kg/día y refractaria al menos a dos infiltraciones de esteroides locales.
Pacientes con afección axial sintomática desde el inicio o durante la evolución, no requieren tratamiento previo, adicional a los AINES.
Evaluación de la respuesta al tratamiento
En cuanto al seguimiento de la actividad de la enfermedad, en niños no se ha validado el BASDAI que es el índice aceptado en la población adulta, por lo que se propone evaluación periódica con los criterios del ACR Ped 30 (Tabla 3).
A la luz de la literatura actual aún no hay acuerdo sobre cuándo considerar falla terapéutica ni hasta cuándo continuar el medicamento.
Agentes antiTNF en artritis psoriática
Eficacia
La eficacia de los antiTNF en artritis psoriática (APs) ha sido comprobada en adultos en un estudio aleatorizado controlado, utilizando ETN y en estudios abiertos con IFX(30, 31). Estos medicamentos se han considerado apropiados en pacientes con enfermedad moderada a severa quienes no responden adecuadamente a AINES y MTX o que presentan efectos colaterales con estos. Los síntomas articulares pueden mejorar en el primer mes de tratamiento mientras que las manifestaciones cutáneas pueden tardar hasta seis meses.
La experiencia con antiTNF en APs en niños es muy limitada; en algunos estudios de AIJ se han incluido pacientes con APs ya que esta patología corresponde a una de las categorías de la clasificación de la ILAR. En el registro alemán sobre pacientes con AIJ tratados con ETN, el 6% de 191 pacientes correspondían a APs; la respuesta terapéutica en ellos fue similar a la de los pacientes con AIJ poliarticular(32) (Nivel de evidencia 4. Grado de recomendación C).
En un informe finlandés de 26 pacientes con AIJ que incluyó tres pacientes con APs, en tratamiento con IFX se observó una mejoría en el número de articulaciones inflamadas y en los reactantes de fase aguda(33) (Nivel de evidencia 4. Grado de recomendación C).
Ninguno de estos estudios da información sobre la afección axial.
Dosis
La dosis utilizada de ETN es de 0,4 mg/kg/dosis (dosis máxima de 25 mg).
En los informes de IFX, se utilizó a una dosis de 3 mg/kg/dosis.
Costos
No hay estudios sobre costos en esta categoría de AIJ.
Conclusiones
1. Los medicamentos antiTNF han demostrado ser una buena alternativa en pacientes adultos con APs refractaria.
2. Respecto a su uso en niños, la escasez y el bajo nivel de evidencia de los estudios dificulta dar recomendaciones.
Indicaciones definidas por el consenso
A pesar del bajo nivel de evidencia, los antiTNF pudieran estar indicados en casos individuales de pacientes con APs poliarticular, refractaria a tratamiento con AINES y MTX o en quienes presenten efectos adversos a estos medicamentos.
Agentes antiTNF en uveítis
Eficacia
El uso de la terapia antiTNF se ha propuesto en casos de uveítis refractaria desde el año 2000(34). En uveítis crónica resistente, asociada a ARJ y en uveítis idiopática, el ETN demostró seguridad y eficacia en disminuir las complicaciones intraoculares en 63% de los ojos evaluados. Se observó exacerbación de la uveítis en un ojo (7%) y cinco ojos (31%) no mostraron cambios. A los seis meses de seguimiento tres de catorce ojos estaban en remisión (21%), en cinco ojos había mejorado significativamente la celularidad (36%) y en cinco no hubo cambios (31%)(35). En un reporte posterior a los dos años de seguimiento(36) el efecto benéfico se mantuvo en la mayoría de los pacientes (Nivel de evidencia 4. Grado de recomendación C).
Saurenmann y col. compararon quince niños tratados con ETN y once tratados con IFX, de los cuales veintidós tenían uveítis activa al momento de inicio de la terapia. Se observó un porcentaje de respuesta moderado a bueno en el 53,3% del grupo de ETN frente a 92,3% en el grupo de IFX (p = 0,07)(37) (Nivel de evidencia 4. Grado de recomendación C).
Otro punto de discusión es si la terapia antiTNF puede producir reactivación o inducción de inflamación ocular. Existen resultados variables que pueden ser explicados por la heterogeneidad de los diferentes tipos de uveítis y por la inexistencia de estudios controlados. Un estudio retrospectivo evaluó dieciséis pacientes, incluyendo niños y adultos (7-78 años) quienes recibieron ETN (n = 14) o IFX (n = 2) por enfermedad inflamatoria ocular o por afección articular, con el fin de determinar el efecto de la terapia antiTNF en la inflamación ocular. Se observaron nueve casos de uveítis y siete de escleritis. Aunque los doce pacientes con sinovitis activa tuvieron mejoría de los síntomas articulares, solo seis de dieciséis pacientes (38%) con inflamación ocular mejoraron y cinco pacientes desarrollaron afección ocular mientras recibían el antiTNF(38) (Nivel de evidencia 4. Grado de recomendación C).
Además en la serie de Saurenmann descrita, en seis pacientes tratados para artritis quienes tenían uveítis quiescente previa al inicio de antiTNF, se observó que tres experimentaron una recaída de la uveítis en el grupo de ETN(37) (Nivel de evidencia 4. Grado de recomendación C).
Dosis
La dosis utilizada de ETN es de 0,4 mg/kg/dosis (dosis máxima de 25 mg).
Las dosis de IFX son variables, hasta dosis tan altas como 10 mg/kg/dosis.
Costos
No hay estudios sobre costos en uveítis.
Conclusiones
1. Los resultados disponibles son series de casos que muestran un beneficio de la terapia antiTNF en casos seleccionados de uveítis refractaria, con una tendencia a obtener mejores resultados con IFX.
2. La dosis de ETN es extrapolada de AIJ (0,4 mg/kg/dosis. Máxima dosis de 25 mg). No hay consenso sobre la dosis de IFX que se debe utilizar.
3. No hay evidencia concluyente que permita afirmar que el ETN sea un posible inductor de novo o de recaídas de uveítis.
Indicaciones definidas por el consenso
1. Se propone incluir los pacientes con uveítis idiopática o secundaria a cualquier enfermedad reumatológica como AIJ, Behcet, sarcoidosis, etc.
2. Serían candidatos para el inicio de terapia anti TNF los pacientes con uveítis refractaria al tratamiento con esteroides tópicos y sistémicos y que hayan recibido MTX o ciclosporina como inmunosupresor durante al menos tres meses.
El seguimiento debe realizarse por el reumatólogo en conjunto con el oftalmólogo. En los trabajos publicados hay diferentes criterios de seguimiento y respuesta:
• Reducción del número de células de la cámara anterior y cuerpo vítreo.
• Mejoría en la agudeza visual.
• Mejoría en la presión intraocular.
• Más del 50% de disminución de la dosis de esteroides locales y/o sistémicos.
• Más del 50% en la reducción de otros medicamentos inmunosupresores.
• No hay acuerdo sobre hasta cuándo continuar el medicamento.
Seguridad y eventos adversos de la terapia antiTNF en niños
Los EAC con ETN e IFX, no demostraron diferencias significativas en la frecuencia de eventos adversos con respecto al placebo, por lo cual en general se han considerado medicamentos seguros y bien tolerados(10, 11); sin embargo, otros estudios abiertos o de seguimiento “postmarketing” han reportado eventos adversos severos (EAS) que obligan a mantener una vigilancia clínica estrecha de los pacientes.
Con ETN, se han descrito frecuencias de eventos adversos en el 11,1%39; el 16,7%(32) y el 37,5%(11, 13) de los pacientes; con IFX, la frecuencia de eventos adversos supera el 90%, aunque como se mencionó, sin diferencia significativa con el placebo(11).
La frecuencia de EAS tiene un rango de frecuencia muy amplio para ambos medicamentos; con el uso de ETN han sido reportados desde el 3,59%(32) hasta el 20%(8) y con IFX, entre un 8% con dosis de 6 mg/kg y un 35% con dosis de 3 mg/k(7, 11).
La reacción adversa más común reportada con el uso de ETN en la mayoría de los estudios es la reacción en el sitio de inyección que se ha descrito hasta en un 39% de los pacientes(5, 8, 10). Las reacciones asociadas a la infusión del IFX se presentan entre el 21,4%(7) y el 35% de los pacientes(11); sin embargo, si se considera el porcentaje de reacciones respecto al número total de las infusiones, se encuentran datos que son similares a lo reportado en adultos: con frecuencias de 4,2% con dosis de 6 mg/k y 9,1% con dosis de 3 mg/kg. Datos extrapolados de enfermedad de Crohn muestran reacciones agudas en el 6,1% de las infusiones, 1% graves(40) y reacciones tardías (luego de 24 horas) en el 0,6% de las infusiones(41). Las reacciones principales son erupción cutánea, edema y escalofríos.
El uso de antipiréticos, antihistamínicos y esteroides durante la reacción reducen la severidad de estas y aunque algunos grupos recomiendan su uso profiláctico(41), esto es aún un punto de controversia.
Se considera que cerca del 29% de todos los efectos adversos son procesos infecciosos en su mayoría de intensidad leve a moderada(32). Las infecciones más comúnmente reportadas son del tracto respiratorio superior: faringitis, otitis, síntomas catarrales; conjuntivitis, infección cutánea, e infecciones gastrointestinales, entre otras, al igual que infecciones virales como herpes labial, zoster y varicela(10, 12, 32, 39). Las infecciones severas se observan en alrededor del 10% de los pacientes que reciben ETN10 frente a 5,1% de los que reciben IFX(11); sin embargo, estas frecuencias son difíciles de comparar por las diferencias en los diseños de los estudios.
En estudios en AIJ no se han reportado infecciones oportunistas.
Es importante considerar las recomendaciones sobre vacunación en el paciente con enfermedades reumáticas como parte de las medidas dirigidas a disminuir la frecuencia y severidad de las complicaciones infecciosas(42).
Dentro de otros efectos adversos menos frecuentes se ha descrito leucopenia y/o trombocitopenia en el 1,2%(32) y pancitopenia en el 3,3%(8) de niños con ETN. No hay informes de estos efectos con IFX.
En adultos se han descrito enfermedades autoinmunes y desmielinizantes como LES, vasculitis, mielitis transversa, neuritis óptica y esclerosis múltiple(43), mientras que en niños los informes son muy escasos. Existen reportes de enfermedad desmielinizante con convulsiones(32), enfermedad desmielinizante del lóbulo temporal y ANAS positivos(44) y tres casos de neuritis óptica(8, 45). En cuanto a enfermedades autoinmunes no se encontraron informes de LES; sólo un paciente que desarrolló vasculitis cutánea luego de tratamiento con ETN(8) y un caso de alopecia autoinmune con antiDNA positivo en una niña en tratamiento con IFX(7).
Respecto a la positividad de anticuerpos, un estudio encontró ANAS en el 45,5% luego de iniciarse tratamiento con ETN, sin relación con manifestaciones clínicas(5).
No hay referencias de linfoma en niños; solamente se ha descrito el caso de una paciente de diecinueve años que desarrolló carcinoma de tiroides luego de nueve meses de tratamiento con ETN, sin poder definir una relación de causalidad(32).
Varios estudios en adultos de diferentes poblaciones han descrito un riesgo aumentado de infección por Mycobacterium tuberculosis en pacientes que reciben terapia antiTNF(46-48). Este riesgo es atribuible a la interferencia de los antiTNF en los mecanismos de defensa contra el bacilo tuberculoso y difiere según el tipo de medicamento, siendo mayor por diversos mecanismos con los anticuerpos monoclonales (IFX, ADM) que con los receptores solubles del TNF (ETN)(49, 50). La información sobre tuberculosis (TB) y su relación con los agentes antiTNF en niños es muy escasa. En los EAC de ETN e IFX no se han reportado casos(10, 11). En el estudio más prolongado de seguimiento a dos años de pacientes en tratamiento con ETN, tampoco se ha descrito esta complicación(12).
En vista de que el IFX se ha utilizado por menos tiempo que el ETN en AIJ, no hay reportes sobre efectos adversos a largo plazo y la mayoría de la información disponible proviene de la experiencia con el medicamento en niños con enfermedad de Crohn.
Con ETN existe un reporte de caso de monoartritis TB en una niña, durante el tratamiento para AIJ sistémica(51). Con IFX se reporta una niña con AIJ, quien recibió altas dosis (20 mg/kg/mes por cuatro meses) luego de haber recibido varios DMARD entre ellos ETN, quien presentó edema subcutáneo de la muñeca en el que se demostró Mycobacterium tuberculosis por PCR(52). A pesar de que los datos anteriores sugieren que el riesgo de TB en niños en tratamiento con agentes antiTNF es bajo, es probable que en la medida en que el uso de los medicamentos se expanda y el seguimiento sea más prolongado, aumenten los casos reportados, por lo cual se recomienda tener una estrategia de enfoque dirigido a detectar la infección previamente al inicio del tratamiento, incluyendo identificación de personas de alto riesgo, prueba de tuberculina y radiografía de tórax(53).
Identificación y tratamiento de tuberculosis latente
Aquellos niños candidatos a recibir terapia antiTNF deben ser evaluados en forma rutinaria para descartar TB latente, comenzando por un interrogatorio dirigido. La prueba de tuberculina es el tamizaje estándar para TB en poblaciones de alto riesgo y su interpretación debe ser guiada por las recomendaciones de la Academia Americana de Pediatría(53) (Tabla 4). Los pacientes cuya tuberculina sea positiva o con historia de exposición a TB deben ser evaluados para descartar o confirmar TB latente o activa. Los niños asintomáticos con tuberculina positiva y estudios radiológicos normales deben ser tratados como TB latente con nueve meses de Isoniazida diaria.

No hay consenso sobre la duración del tratamiento antiTB previo al inicio de los agentes antiTNF; las recomendaciones de expertos varían, desde el inicio simultáneo hasta esperar a la terminación del tratamiento antiTB, por lo cual la decisión debe hacerse de manera individual(54)
Referencias
1. Petty RE, Southwood TR, Manners P, et al. International League of Associations for Rheumatology. Classification of Juvenile Idiopathic Arthritis: Second Revision, Edmonton, 2001. J Rheumatol 2004; 31: 390-392. [ Links ]
2. Guyatt GH, Sackett DL, Cook DJ. Users’ guides to the medical literature. II. How to use an article about therapy or prevention. B. What were the results and will they help me in caring for my patients? Evidence-Based Medicine Working Group. JAMA 1994; 271: 59-63. [ Links ]
3. Moreland LW, Schiff MH, Baumgartner SW, Tindall EA, Fleischmann RM, Bulpitt KJ, et al. Etanercept therapy in rheumatoid arthritis. A randomized, controlled trial. Ann Intern Med 1999; 130: 478-486. [ Links ]
4. Klareskog L, Van Der HD, De Jager JP, Gough A, Kalden J, Malaise M, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363: 675-681. [ Links ]
5. Kietz DA, Pepmueller PH, Moore TL. Clinical response to etanercept in polyarticular course juvenile rheumatoid arthritis. J Rheumatol 2001; 28: 360-362. [ Links ]
6. Kietz DA, Pepmueller PH, Moore TL. Therapeutic use of etanercept in polyarticular course juvenile idiopathic arthritis over a two year period. Ann Rheum Dis 2002; 61: 171-173. [ Links ]
7. Lahdenne P, Honkanen L. Infliximab or etanercept in the treatment of children with juvenile idiopathic arthritis: an open label study. Ann Rheum Dis 2003; 62: 245-247. [ Links ]
8. Quartier P, Taupin P, Bourdeaut F. Efficacy of etanercept for the treatment of juvenile idiopathic arthritis according to the onset of type. Arthritis Rheum 2003; 48: 1093-1101. [ Links ]
9. Schmeling H. A combination of etanercept and methotrexate for the treatment of refractory juvenile idiopathic arthritis: a pilot study. Ann Rheum Dis 2001; 60: 410-412. [ Links ]
10. Lovell DJ, Giannini EH, Reiff A, et al. Etanercept in children with polyarticular JRA. Pediatric Rheumatology Collaborative Study Group. N Engl J Med 2000; 342: 763-769. [ Links ]
11. Ruperto N, Lovell DJ, Cuttica R, Wilkinson N, Espada G, Martini A, et al. From Pediatric Rheumatology International Trials Organization (PRINTO) and Pediatric Rheumatology Collaborative Study Group (PRCSG). Randomized trial of Infliximab plus Methotrexate for the treatment of polyarticular juvenile rheumatoid arthritis. Annual European Congress of Rheumatology EULAR 2005 Ann Rheum Dis 2005; 64 (suppl III): 511. [ Links ]
12. Lovell D, Gianinni EH, Reiff A, Jones OY, et al. Long-term efficacy and safety of etanercept in children with Polyarticular-course Juvenile Rheumatoid Arthritis. Arthritis and Rheumatism 2003; 48: 218-226. [ Links ]
13. Takei S, Groh D, Shaham B, et al. Safety and efficacy of high dose etanercept in the treament of Juvenile Rheumatoid Arthritis. J Rheum 2001; 28: 1677-1680. [ Links ]
14. Kimura Y, Pinho P, Walco G, Higgins G, Hummell D, Reiff A, et al. Etanercept Treatment in Patients with Refractory Systemic Onset Juvenile Rheumatoid Arthritis. J Rheumatol 2005; 32: 935-942. [ Links ]
15. Stephan JL, Kone-Paut I, Galambrun C, Mouy R, Bader-Meunier B, Prieur AM. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients. Rheumatology Oxford 2001; 40: 1285-1292. [ Links ]
16. Prahalad S, Bove KE, Dickens D, Lovell DJ, Grom AA. Etanercept in the treatment of macrophage activation syndrome. J Rheumatol 2001; 28: 2120-2124. [ Links ]
17. Ramana TV, Schneider R. Macrophage activation syndrome following initiation of etanercept in a child with systemic onset juvenile rheumatoid arthritis. J Rheumatol 2003; 30: 401-403. [ Links ]
18. Haapasaari J, Kautiainen H, Isomäki H, Hakala M. Etanercept does not essentially increase the total costs of the treatment of refractory juvenile idiopathic arthritis. J Rheumatol 2004; 31: 2286-2289. [ Links ]
19. Lipsky PE, van der Heijde DM, St Clair EW, Furst DE, Breedveld FC, Kalden JR, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med 2000; 343: 1594-1602. [ Links ]
20. Gerloni V, Pontikaki I, Gattinara M, Desiati F, Lupi E, Lurati A, et al. Efficacy of repeated intravenous infusions of anti-tumor necrosis factor-monoclonal antibody, infliximab, in persistently active, refractory juvenile idiopathic arthritis. Results of an open-label prospective study. Arthritis Rheum 2005; 52: 548-553. [ Links ]
21. Lovell DJ, Ruperto N, Goodman S, Reiff A, Martini A, Giannini E. Preliminary data from the study of Adalimumab in children with juvenile idiopathic arthritis. Arthritis Rheum 2004; 50 (suppl): S436. [ Links ]
22. Braun J, Brandt J, Listing J, et al. Treatment of active ankilosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359: 1158-1193. [ Links ]
23. Braun J, Brandt J, Listing J, et al. Long term efficacy and safety of infliximab in the treatment of ankilosing spondylitis. Arthritis Rheum 2003; 48: 2224-2233. [ Links ]
24. Emery P, Sibilia J, Sieper J, et al. Outcomes of a multicentre randomised clinical trial of etanercept to treat ankylosing spondylitis. Ann Rheum Dis 2004; 63: 1594-1600. [ Links ]
25. Horneff G, Schmeling H, Moebius D, et al. Efficacy of etanercept in active refractory juvenile spondylarthropathy. Prospective open study of 40 patients. Arthritis Rheum 2004; 50 (suppl): S91. [ Links ]
26. Henrickson M and Reiff A. Prolonged efficacy of etanercept in refractory enthesitis-related arthritis. J Rheumatol 2004; 31: 2055-2061. [ Links ]
27. Horneff G and Burgos R. TNF ? antagonist for the treatment of juvenile onset spondyloarthitides. Clin Exp Rheumatol 2002; 20: (suppl):137-142. [ Links ]
28. Lim A, Gaffney K and Marshall T. Juvenile onset spondylodiscitis: magnetic resonance imaging changes with infliximab. Rheumatology 2004; 43: 1456-1458. [ Links ]
29. Braun J, Pham T, Sieper J, et al. International ASAS consensus statement for the use of anti-tumor necrosis factor agents in patients with ankylosing spondylitis. Ann Rheum Dis 2003; 817-824. [ Links ]
30. Mease PJ, Goffe BS, Metz J, Van Der Stoep A, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomized trial. Lancet 2000; 356: 385-390. [ Links ]
31. Van Den Bosch F, Kruithof E, Baeten D, De Keyser F, Mielants H, Veys EM. Effects of a loading dose regimen of three infusions of chimeric monoclonal antibody to tumor necrosis factor (infliximab) in spondyloarthropathy: an open label study. Ann Rheum Dis 2000; 59: 428-433. [ Links ]
32. Horneff G, Scmeling H, Biedermann, et al. The German etanercept registry for treatment of juvenile idiopathic arthritis. Ann Rheum Dis 2004; 63: 1638-1644. [ Links ]
33. Honkanen V, Tynjala P, Vahasalo P, et al. Infliximab in juvenile arthritis: 1 year follow-up. Arthritis Rheum 2002; 46 (suppl): S480. [ Links ]
34. Reiff A, Takei S, Sadeghi S, et al. Prospective study of etanercept (enbrel) in children with chronic treatment refractory uveitis. Arthritis Rheum 2000; 43 (suppl): S381. [ Links ]
35. Reiff A, Takei S, Sadeghi S, et al. Etanercept therapy in children with treatment-resistant uveitis. Arthritis Rheum 2001; 44: 1411-1415. [ Links ]
36. Reiff A. Long-term outcome of etanercept therapy in children with treatment refractory uveitis. Arthritis Rheum 2003; 48: 2079-2080. [ Links ]
37. Saurenmann R, Rose J, Tyrell P, et al. The effect of anti TNF treatment in children with uveitis. Arthritis Rheum 2004; 50 (suppl): S92. [ Links ]
38. Smith J, Levinson R, Holland G, et al. Differential efficacy of tumor necrosis factor inhibition in the management of inflammatory eye disease and associated rheumatic disease. Arthritis Rheum 2002; 45: 252-257. [ Links ]
39. Gianini E, Lovell D, Ilowite N, et al. Safety outcomes from a phase IV pediatric registry: etanercept therapy in children and adolescents with juvenile rheumatoid arthritis (JRA). Arthritis Rheum 2004; 50 (suppl): S90- S91. [ Links ]
40. Cheifetz A, Smedley M, Martin S, et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol 2003; 98: 1315-1324. [ Links ]
41. Crandall W and Mackner L. Infusion reactions to infliximab in children and adolescents: frequency, outcome and a predictive model. Aliment Pharmacol Ther 2003; 17: 75-84. [ Links ]
42. Guarnizo P, Eraso R, Ramírez LA. Inmunización en pacientes con enfermedades reumáticas. Revista Colombiana de Reumatología 2006; 13: 65-75. [ Links ]
43. De Bandt M, Sibila J, Le Loet X, et al. Systemic lupus erythematosus induced by anti-tumor necrosis factor alpha theraphy: A French Nacional survey. Arthritis Res Ther 2005; 7: 545-551. [ Links ]
44. Kunzmann S, Warmuth M and Girschick H. Cerebral demyelination in association with TNF inhibition therapy in a 5 year old girl with aseptic meningitis as the first symptom of Still’s disease. Scand J Rheumatol 2005; 34: 76-78. [ Links ]
45. Tauber T, Daniel D, Barash J, et al. Optic neuritis associated with etanercept therapy in two patients with extended oligoarticular juvenile idiopathic arthritis. Rheumatology (Oxford). 2005; 44: 405-406. [ Links ]
46. Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer D. Granulomatous infectious diseases associated with tumor necrosis factor antagonists. Clin Infect Dis 2004; 38: 1261-1265. [ Links ]
47. Askling J, Fored M, Brandt L, Baecklund E, et al. Risk and case characteristics of tuberculosis in rheumatoid arthritis associated with tumor necrosis factor antagonists in Sweden. Arthritis Rheum 2005; 52: 1986-1992. [ Links ]
48. Gómez-Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD. Behalf of the BIOBADASER Group. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk: a multicenter active-surveillance report. Arthritis Rheum 2003; 48: 2122-2127. [ Links ]
49. Scallon B, Cai A, Solowski N, et al. Binding and functional comparisons of two types of TNF antagonists. J Pharmacol Exp Ther 2002; 301: 418-426. [ Links ]
50. Dinarello Ch. Differences between anti-TNF?? monoclonal antibodies and soluble TNF receptors in host defense impairment. J Rheumatol 2005; 32 Suppl 74: 40-47. [ Links ]
51. Myers A, Clark J, Foster H. Tuberculosis and treatment with etanercept. N Engl J Med 2002; 346: 623-626. [ Links ]
52. Armbrust W, Kamphuis S, et al. Tuberculosis in a nine-year-old girl treated with infliximab for systemic juvenile idiopathic arthritis. Rheumatology 2004; 43: 527-529. [ Links ]
53. Saiman Lisa, et al. Pediatric Tuberculosis Collaborative Group-American Academy of Pediatrics. Targeted tuberculin skin testing and treatment of latent tuberculosis infection in children and adolescents. Pediatrics 2004; 114 (Suppl): 1175-1201. [ Links ]
54. Furst DE, Breedveld FC, Kalden JR, Smolen JS, Burmester GR, et al. Updated consensus statement on biological agents, specifically tumour necrosis factor (TNF) blocking agents and interleukin-1 receptor antagonist (IL-1ra), for the treatment of rheumatic diseases, 2004. Ann Rheum Dis 2004; 63 (Suppl II): ii2-ii12. [ Links ]














