Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.13 no.3 Bogotá July/Sept. 2006
INVESTIGACIÓN ORIGINAL
Prevalencia de falla ovárica y factores de riesgo en pacientes con Lupus Eritematoso Sistémico tratadas con ciclofosfamida intravenosa
Prevalence of ovarian failure and risk factor in patients with systemic lupus erythematosus
Mónica Patricia Velásquez Méndez1, Francisco Alejandro Ramírez Ruiz2, Gloria María Vásquez Duque1, Luis Alberto Ramírez Gómez1
1 Sección de Reumatología Hospital Universitario San Vicente de Paúl. Universidad de Antioquia. Medellín.
2 Residente de Radiología CES. Medellín.
Resumen
Introducción: la falla ovárica prematura es una consecuencia del manejo a largo plazo con ciclofosfamida, su prevalencia en pacientes con LES ha sido informada entre el 11 y el 59%, dependiendo de la ruta y dosis de administración. Estudios sobre la toxicidad gonadal con el régimen propuesto por el NIH son escasos en la literatura, por lo cual se realizó este estudio para determinar la prevalencia y los factores de riesgo asociados al desarrollo de falla ovárica en una población latinoamericana.
Métodos: se tomaron 56 pacientes con LES tratadas con bolos de CFM mensuales, menores de 40 años y con menstruación normal al momento de iniciar la terapia y se compararon con respecto a la frecuencia de amenorrea con 43 pacientes con LES sin tratamiento con ciclofosfamida como grupo control. Posteriormente estudiamos en el grupo de CYC, las diferencias entre aquellas que hicieron amenorrea y las que continuaron con ciclos regulares. Este es un estudio descriptivo de corte transversal. Se aplicó chi-cuadrado, test exacto de Fisher y Mann-Withney según estuviese indicado. P menor de 0,05 se consideró significativo.
Resultados: el 16,1% de los pacientes con CYC desarrollaron falla ovárica frente al 4,3% del grupo control.
Con respecto al grupo que recibió CYC, se encontró un promedio de edad mayor en el grupo que desarrolló amenorrea que en aquellas con ciclos regulares, 35,2 frente a 26,7 años (p= 0,003), determinándose como punto de corte de riesgo ser mayor de 28 años al inicio de la CFM. La evolución de la enfermedad fue mayor en el grupo de amenorrea en comparación con las que continuaban con menstruación normal con una p= 0,003 (10,2 frente a 4,4 años).
No se encontró diferencia en la dosis acumulativa, duración de la terapia o perfil inmunológico de las pacientes.
Conclusión: la prevalencia de falla ovárica en mujeres colombianas tiende a presentarse a una edad más temprana y con mayor tiempo de evolución de la enfermedad a pesar de dosis acumuladas inferiores a las informadas en la literatura planteando una mayor labilidad al efecto tóxico de la CFM.
Palabras clave: ciclofosfamida, falla ovárica temprana, amenorrea, lupus eritematoso sistémico.
Summary
Background: premature ovarian failure is a cyclophosphamide (CYC) treatment adverse effect. The report of prevalence is among 11% and 59%, the variability depend on the route and dosage of CYC. There are few studies about gonadal toxicity with NHI CYC treatment protocol. We decided to establish the prevalence and risk factors associated with premature ovarian failure in a group of Latin-American lupus patients.
Methods: 56 SLE patients under 40 years treated with intravenous CYC, with regular menstrual cycle at the beginning of the treatment, were compared with respect to the frequency of amenorrhea with 43 SLE patients without treatment with CYC as a control group. After that, we studied in the CYC group the differences between those who made amenorrhea and those that continued with regular cycles.
This is a cross sectional and descriptive study. The data were analyzed by chi-square, Fisher’s exact test and Mann-Withney when it was necessary. P < 0.05 was considered significant.
Results: 16.1% of SLE patients under intravenous CYC treatment get premature ovarian failure vs. 4.3% in the control group.
With respect to CYC group, the mean age in the amenorrhea group was higher than the age in patients with regular menstrual cycles 35.2 vs. 26.7 years (p=0.03). We found than patients older than 28 years have a mayor risk for amenorrhea induced by intravenous CYC.
The mean disease duration was higher in the amenorrhea group than in the regular menstrual cycle patients, p= 0.003 (10.2 vs. 4.4 years).
No significant differences were observed in cumulative dosage, treatment duration or immunologic findings between groups.
Conclusion: the prevalence of ovarian failure in Colombian women tends to appear at an early age and with a greater time of evolution of the disease in spite of inferior accumulated doses than those that are informed in the Literature, suggesting a mayor susceptibility to toxic effect of CYC.
Key words: cyclophosphamide, premature ovarian failure, amenorrhea, systemic lupus erythematosus.
Introducción
La terapia agresiva con ciclofosfamida ha mejorado la respuesta del compromiso de órganos blanco en Lupus Eritematoso sistémico (LES). Estudios prospectivos han mostrado la superioridad de la ciclofosfamida en controlar la enfermedad renal sobre azatioprina o prednisolona1,2. Bolos intermitentes de ciclofosfamida mostraron ser tan efectivos como la dosis oral pero con menos efectos tóxicos en modelos murinos de nefritis lúpica y posteriormente fue probado en humanos en estudios controlados por el National Institute Health (NIH)3.
Además se demostró que en los pacientes tratados con cursos largos de ciclofosfamida la frecuencia de exacerbación fue más baja comparado con cursos cortos y un menor número progresaba a insuficiencia renal terminal4. En el compromiso de otros órganos también se ha estudiado el papel de la ciclofosfamida aunque no tan ampliamente como en nefritis lúpica. En hemorragia alveolar ha sido usada con una evidencia preliminar de un efecto benéfico en la sobrevida5. Un estudio prospectivo no controlado mostró mejoría en neumonitis intersticial en un pequeño número de pacientes con LES y otras enfermedades del tejido conectivo6. Recuperación o estabilización de lupus neuropsiquiátrico incluyendo mielitis transversa ha sido reportada7. También ha sido descrita mejoría en trombocitopenias refractarias y neuritis óptica, entre otros1.
La ciclofosfamida es administrada con esteroides ya sea oral (1 a 3 mg/kg) o intravenosa (0,5 a 1 g/m2 de superficie corporal). Aunque no hay clara evidencia de que los regímenes difieran en su eficacia clínica en el LES, la ciclofosfamida oral ha sido reemplazada por la terapia con bolos en la práctica clínica dados sus efectos tóxicos menores.
Los efectos adversos bien documentados de la ciclofosfamida incluyen alopecia, intolerancia gástrica, mucositis, supresión de la médula ósea, cistitis, infecciones oportunistas y malignidad8.
La toxicidad ovárica es uno de los principales efectos adversos en mujeres premenopáusicas en edad fértil, no solo por la fertilidad sino por el aumento de riesgos de osteoporosis y enfermedad cardiovascular secundaria a la menopausia precoz.
La falla ovárica es reportada en la literatura con rango que va de un 11 a un 59%9-13. Esta variación depende de varios factores como la diferencia entre las dosis y la vía de administración; las prevalencias más altas se relacionan con ciclofosfamida oral. Estudios sobre toxicidad gonadal con el régimen estándar del NIH son muy escasos en la literatura con el problema agregado de no usar grupo control, tener muestras muy pequeñas y la mayoría de reportes con esquemas diferentes. Adicionalmente pocos informes exploran la actividad de la enfermedad con la frecuencia de la amenorrea y las variables serológicas del LES.
Por todo lo anterior consideramos importante evaluar la prevalencia de falla ovárica temprana en pacientes que reciben ciclofosfamida en bolos intravenosos y además evaluar en nuestra población otras variables reportadas como son la relación con la edad, la dosis acumulada, el perfil inmunológico y la actividad de la enfermedad.
Materiales y métodos
Este es un estudio clínico descriptivo de corte transversal realizado del primero de enero a diciembre de 2003. La población en estudio consiste en pacientes de género femenino con diagnóstico de Lupus Eritematoso Sistémico (LES) según los criterios del Colegio Americano de Reumatología14, atendidos en el servicio de consulta externa del Hospital Universitario San Vicente de Paúl (HUSVP) y que estuvieran recibiendo tratamiento con ciclofosfamida en esquema de bolos mensuales, que al momento del inicio de este fueran menores de 40 años y tuvieran ciclos menstruales normales (Grupo A) elegidas de forma consecutiva.
Se excluyeron mujeres en quienes la menopausia ocurrió antes del inicio de la ciclofosfamida, mujeres con amenorrea secundaria: ooforectomía, histerectomía, irradiación pélvica. Pacientes que recibieran terapia hormonal diferente a anticonceptivos orales y danazol. Además pacientes con insuficiencia renal crónica.
Para el análisis se consideró falla ovárica como ausencia de ciclos menstruales por más de 12 meses (amenorrea sostenida).
El esquema de CFM consistía en bolos mensuales intravenosos de dosis entre 0,5 y 1 gramo titulada de acuerdo al conteo de leucocitos durante seis meses y luego bolos trimestrales.
Además se tomó un grupo control de mujeres con diagnóstico de LES quienes no habían recibido en ningún momento manejo inmunosupresor con ciclofosfamida pareado de acuerdo a edad con el grupo de pacientes (Grupo B).
Se revisaron las historias clínicas y las pacientes haciendo una entrevista sobre sus condiciones ginecológicas actuales. Se recolectaron diferentes variables demográficas, clínicas e inmunológicas mediante un cuestionario diseñado para este fin. Se evaluó la actividad de la enfermedad mediante el índice de SLEDAI en el momento de inicio de la terapia y en el caso de los controles al momento de diagnóstico de LES. De la historia clínica se obtuvo la dosis total de CFM, el tiempo de terapia con esta y el número de bolos recibidos al igual que la dosis de cada uno de estos.
Análisis estadístico
Se realizó chi-cuadrado y test exacto de Fisher para variables de distribución normal cuando fuera pertinente y Mann-Withney cuando las variables no tuviesen esa distribución. El grupo control solo se utilizó para la comparación de la prevalencia de amenorrea, y luego las comparaciones se hacen en el grupo de pacientes (A) entre las que presentaban amenorrea y no-amenorrea.
Resultados
Se incluyeron 56 pacientes tratadas con esquema mensual con ciclofosfamida que cumplieron los criterios de inclusión al estudio (grupo A) y 43 mujeres con diagnóstico de lupus que nunca recibieron terapia inmunosupresora con CFM (grupo B).
De las 56 pacientes tratadas con CFM, 9 (16,1%) desarrollaron falla ovárica mientras en el grupo B 2 (4,6%) la desarrollaron. Los grupos A y B fueron similares en edad, raza, duración de la enfermedad, uso de anticonceptivos orales y número de gestaciones. La única variable diferente es el puntaje de SLEDAI que se encontró más elevado en el grupo que recibía CFM (Tabla 1).
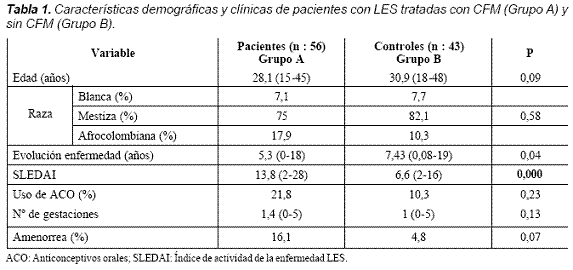
Dentro de las variables de laboratorio medidas, pruebas inmunológicas, no se encontraron diferencias significativas entre los dos grupos excepto para anticardiolipina (ACL) Ig G que se encontró positiva en el 52,3% de los pacientes del grupo A (Tabla 2).
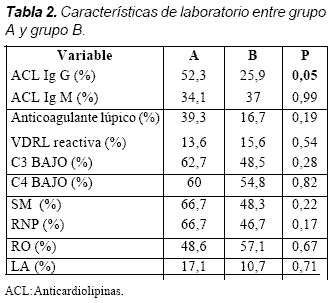
En 32 (62,4%) de los 56 pacientes del grupo A el compromiso renal solo, fue la principal indicación de la terapia con CFM seguido de 7 (12,5%) con compromiso de sistema nervioso central. El promedio de edad fue significativamente mayor en el grupo que desarrolló amenorrea contra las que continuaban con ciclos menstruales normales, 35,2 años y 26,7 (p= 0,03) al igual que la evolución de la enfermedad más larga, 10,2 años y 4,4 años (p= 0,0003) respectivamente. La raza, actividad de la enfermedad (SLEDAI), uso de anticonceptivos orales y número de gestaciones totales y gestaciones posteriores a ciclofosfamida no fueron estadísticamente diferentes entre los dos grupos; sin embargo, no hubo embarazos posteriores a la terapia con CFM en el grupo que se encontraba en amenorrea (Tabla 3).
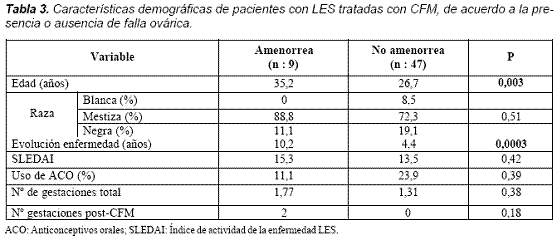
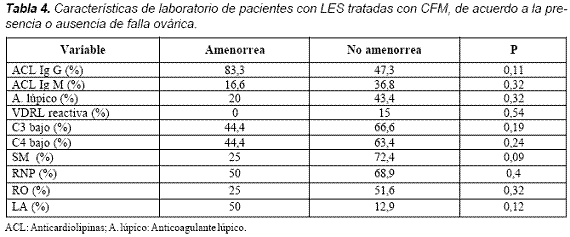
Con respecto a las variables de laboratorio no encontramos diferencias estadísticamente significativas entre las pacientes con falla ovárica temprana y sin ella (Tabla 4).
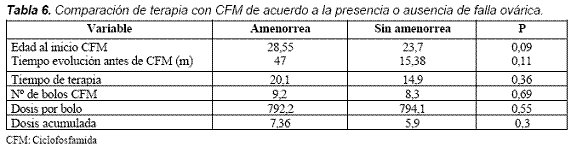
Al evaluar la terapia, el promedio de edad de inicio de la CFM fue ligeramente mayor en el grupo que se encontraba en amenorrea sostenida (28,5 frente a 23,7 años) pero no significativo (p= 0,09); sin embargo, al estratificar la edad del inicio de la terapia antes o después de los 28 años de edad sí se encontraron diferencias entre los dos grupos (p= 0,019) (Tabla 5).

La dosis acumulada de CFM fue mayor en el grupo de falla ovárica que en el de menstruación normal: 7,36 gr y 5,9 gr respectivamente (p= 0,3). Ni el número de bolos ni la dosis por bolo o duración de la terapia fueron diferentes entre los dos grupos (Tabla 6).
Discusión
La toxicidad ovárica es uno de los principales efectos adversos en mujeres premenopáusicas en edad fértil. Los primeros reportes en la literatura que hacen alusión a la toxicidad gonadal por ciclofosfamida fueron descritos en pacientes con cáncer y en pacientes que recibían inmunosupresión postransplante15. Los informes en enfermedades reumatológicas datan de 1968 en artritis reumatoide en manejo con ciclofosfamida oral, reportando una frecuencia de amenorrea de 50 a 70%16. El primer estudio representativo en LES fue realizado en 1993 por Boumpas y col, un estudio retrospectivo controlado de 39 pacientes premenopáusicas tratadas con bolos de CFM reportando una prevalencia de 51% de amenorrea prolongada, con una frecuencia aumentada en mayores de 31 años y en las que recibían 15 o más bolos9. Posteriormente se han realizado escasos estudios, entre ellos el de Mc Dermott y col con una prevalencia de falla ovárica prematura de 41% y encontraron, por análisis de regresión logística, que una mayor edad al inicio de la ciclofosfamida, un periodo más largo de tratamiento y el grado de supresión de la médula ósea determinado por el conteo de neutrófilos previo a cada pulso de CFM representaban un riesgo aumentado para el desarrollo de falla ovárica prematura10.
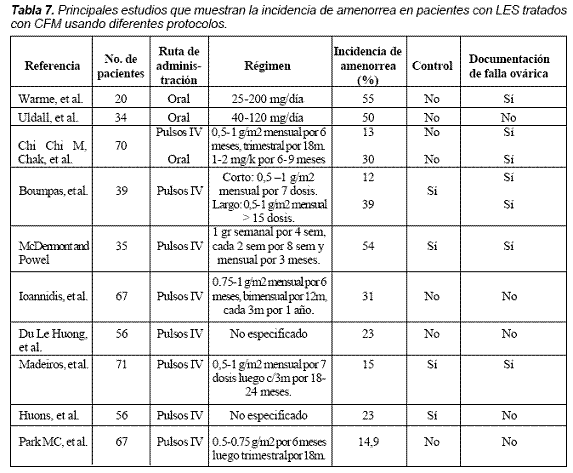
En general ha sido informada una prevalencia de falla ovárica entre el 11 y el 59%9-13; en nuestra serie se encontró que el 16,1% de las mujeres tratadas con CFM desarrollaron amenorrea sostenida por más de 12 meses; estos porcentajes varían de acuerdo a la edad de las pacientes estudiadas, la definición de falla ovárica (algunos autores incluyen pacientes con amenorrea de cuatro meses) y los diferentes protocolos utilizados (Tabla 7). En este estudio la baja frecuencia puede depender del hecho de que escogimos la definición de amenorrea sostenida, 12 meses, por su mayor correlación con falla ovárica definitiva.
Dentro de los factores de riesgo relacionados se han descrito tradicionalmente en la literatura la edad de inicio del tratamiento con CFM y la dosis acumulada de esta.
En China un estudio de 70 pacientes premenopáusicas mostró que el grupo de amenorrea fue significativamente de mayor edad que el de no-amenorrea (35 frente a 28,2 años)11 y hubo un incremento lineal con el aumento de la dosis acumulada de ciclofosfamida. Ioannidis y col. en el 2002 mostraron que el riesgo de amenorrea sostenida depende de la edad de la paciente y de la dosis acumulada, y a pesar de que la dosis exacta que puede ser bien tolerada no ha sido documentada, encuentran dosis acumulada D50 8 g /m2, D90 12 g/m2. Con dosis de 5 g /m2uno de tres la presenta, siendo menos común en menores de 32 años pero su toxicidad puede tener consecuencias más severas; y más recientemente Park y colaboradores reportan dosis acumulada de CFM de 9,37 gr frente a 8,4 gr como factor de riesgo para amenorrea prolongada y amenorrea transitoria17.
En nuestros pacientes es llamativo el hallazgo de una edad menor de aparición de la falla ovárica encontrándose que el 41.1 % de las mujeres mayores de 28 años (p= 0,019) presentaban amenorrea, mientras en la mayoría de las series se encuentra como punto de corte la edad mayor a 33-35 años al momento de inicio de la CFM. Además la dosis acumulativa de CFM no mostró significancia estadística (p= 0,3) probablemente porque las dosis máximas alcanzadas fueron menores que las reportadas en la literatura (promedio de 7,36 gramos en el grupo de amenorrea). Medeiros y col. encontraron en una población latinoamericana que los pacientes que recibían una dosis acumulativa mayor de 10 gr tenían mayor riesgo de desarrollar falla ovárica que los que recibían dosis inferiores (RR 3,2 IC95%: 1,02 – 10; P= 0,03)18.
Lo anterior nos lleva a sugerir que nuestros pacientes son más sensibles a la CFM, pues la falla ovárica aparece a una edad más temprana que lo reportado en la literatura, a pesar de dosis por bolo y acumulada menor que la utilizada por otros autores.
Otros factores adicionales de riesgo descritos han sido duración del LES mayor de cinco años, la presencia de antiRo y anti u1RNP12. Nosotros encontramos una duración de la enfermedad significativamente mayor en el grupo de amenorrea (10,2 frente a 4,4 años P= 0,0003), y aunque el tiempo de evolución antes del inicio de la CFM no mostró diferencias estadísticas sí hubo una tendencia a ser mayor en el grupo que entraba en amenorrea (47 frente a 15,3 meses P= 0,11), pero en cuanto a las variables de laboratorio no encontramos diferencias con respecto a perfil inmunológico; al contrario, hubo una mayor positividad de Ro y RNP en el grupo que continuaba con menstruación normal (Tabla 4). El SLEDAI18 y más recientemente el SLICC17 al inicio de la terapia se han implicado como factores de riesgo; sin embargo, esto no es consistente entre todos los autores y en nuestros datos el SLEDAI fue similar entre los dos grupos.
La amenorrea en LES se ha asociado con la terapia citotóxica, la actividad de la enfermedad, el uso de esteroides y, adicionalmente, la posibilidad de un proceso autoinmune dirigido contra el tejido ovárico se ha sugerido como una causa de estos disturbios. Se han encontrado anticuerpos contra el cuerpo lúteo en el 22% de mujeres con LES, aunque no ha podido establecerse una relación con amenorrea19,20.
La ciclofosfamida lleva a falla ovárica por muerte folicular por daño de las células de la granulosa que son de rápida división21; en el hombre también tiene efecto sobre la espermatogénesis transitoria o permanente, pero el mecanismo es menos claro, se ha implicado un daño en las células germinales con actividad mitótica incrementada21.
El mecanismo de inducción ha sido estudiado en modelos animales; una inyección de 100 mg/kg de CFM disminuye el número de folículos pequeños en los ratones en cerca del 63%, además dos horas después de la inyección hay un entrecruzamiento del DNA en las células granulosas, se cree que tenga un posible efecto disminuyendo la producción de progesterona por estas células, pudiendo tener un efecto secundario sobre los oocitos a través de cambios entre las uniones intercelulares22,23. El efecto más importante se da sobre el “pool” de folículos en crecimiento, los cuales son más sensibles y parecen ser más vulnerables a los efectos citotóxicos de la ciclofosfamida, más que los folículos pequeños, el daño de los anteriores lleva a una disminución en el nivel de estradiol, produciéndose una retroalimentación positiva de FSH y LH lo cual desarrolla una nueva cohorte de folículos primordiales y aumenta su sensibilidad a los efectos citotóxicos por eso la exposición continua a la ciclofosfamida contribuye al efecto tóxico. Estos eventos llevan a una depleción de los folículos ováricos21.
Estos efectos son más comunes en mujeres mayores ya que el número de folículos disminuye en la última década antes de la menopausia por lo que estas pacientes hacen una depleción más rápida de su reserva. El resultado de estos cambios es un hipogonadismo hipergonadotrófico y subsiguiente amenorrea con disfunción ovárica e infertilidad21.
Todo esto ha llevado a la búsqueda de identificar el grupo de pacientes en mayor riesgo de desarrollar falla ovárica e investigar sobre nuevas estrategias en busca de proteger el ovario, entre las cuales se ha estudiado principalmente el uso de anticonceptivos orales (ACO), que se han descrito como factor protector, por lo cual es difícil de evaluar en nuestra serie dado que la proporción de pacientes que planifican en dicha serie es muy baja; sin embargo, aunque no significativo, el uso de ACO fue ligeramente mayor en el grupo que continuaba con sus ciclos menstruales normales (23,9 frente a 11,1%).
Otras de las estrategias utilizadas son los análogos de hormona liberadora de gonadotropina (GnRH) y se ha avanzado sobre técnicas de criopreservación de embriones y oocitos, entre otras21, 24, 25, 26.
En resumen, este estudio investiga la prevalencia de falla ovárica en una población colombiana de LES que recibe tratamiento con ciclofosfamida en bolos mensuales, encontrando una prevalencia global de 16,1% que aumenta en el grupo entre 28 y 34 años a 33,3% (Tabla 8). En conclusión se encontraron como factores de riesgo un mayor tiempo de evolución de la enfermedad y el ser mayor de 28 años en el momento de iniciar la terapia con CFM, lo que es más temprano de lo informado por otros investigadores, señalando una mayor labilidad de nuestras pacientes a este efecto tóxico.
Referencias
1. Takada K, Illei G, Boumpas D. Cyclophosphamide for the treatment of systemic lupus erythematosus. Lupus 2001; 10: 154-161. [ Links ]
2. Austin H, Klippel J, Balow J. Therapy of lupus nephritis: controlled trial of prednisona and cytotoxic drugs. New Engl J Med 1986; 314: 614-619. [ Links ]
3. Steinberg A, Decker J. A double-blind controlled trial comparing cyclophosphamide, azathioprine and placebo in the treatment of lupus glomerulonephritis. Arthritis Rheum 1974; 17: 923-937. [ Links ]
4. Boumpas D, Austin H, Vaughn EM, Klippel JH, Steinberg AD, Yarboro CH, et al. Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet 1992; 340: 741-745. [ Links ]
5. Zamora MR, Warner ML, Turder R, Schwarz MI. Diffuse alveolar hemorrhage and systemic lupus erythematosus: clinical presentation, histology, survival and outcome. Medicine 1997; 76: 192-202. [ Links ]
6. Schnabel A, Reuter M, Gross WL. Intravenous pulse cyclophosphamide in the treatment of interstitial lung disease due to collagen vascular diseases. Arthritis Rheum 1998; 41: 1215-1220. [ Links ]
7. Neuwelt CM, Lacks S, Kaye BR, Ellman JB, Borenstein DG. Role of intravenous cyclophosphamide in the treatment of severe neuropsychiatric systemic lupus erythematosus. Am J Med 1995; 9: 832-841. [ Links ]
8. Stein M. Immunoregulatory drugs in Ruddy S, Harris ED, Sledge CB. Textbook of Rheumatology, 6th ed. Saunders Co, Philadelphia 2001; 879-898. [ Links ]
9. Boumpas D, Austin H, Vaughan EM, Yarboro CH, Klippel JH, Balow JE. Risk for sustained amenorrhea in patients with systemic lupus erythematosus receiving intermittent pulse cyclophosphamide therapy. Ann Intern Med 1993; 119: 366-369. [ Links ]
10. McDermott, Powell R. Incidence of ovarian failure in systemic lupus erythematosus after treatment with pulse cyclophosphamide. Ann Rheum Dis 1996; 55: 224-229. [ Links ]
11. Mok CC, Lau CS, Katsifis GE. Risk factors for ovarian failure in patients with systemic lupus erythematosus receiving cyclophosphamide therapy. Arthritis Rheum 1998; 41: 831-837. [ Links ]
12. Ioannidis JP, Katsifis GE, Tzioufas AG, Moutsopoulos HM. Predictors of sustained amenorrhea from pulsed intravenous cyclophosphamide in premenopausal women with systemic lupus erythematosus. J Rheumatol 2002; 29: 2129-2135. [ Links ]
13. Huong du L, Amoura Z, Duhaut P, Sbai A, Costedoat N, Wechsler B, et al. Risk of ovarian failure and fertility after intravenous cyclophosphamide. A study in 84 patients. J Rheumatol 2002; 29: 2571-2576. [ Links ]
14. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25: 1271-1277. [ Links ]
15. Koyama H, Wada T, Nishizawa Y, Iwanaga T, Auki Y. Cyclophosphamide induced ovarian failure and its therapeutic significance in patients with breast cancer. Cancer 1977; 39: 1403-1409. [ Links ]
16. Warne G, Fairley F, Hobbs JB, Martin FI. Cyclophosphamide induced ovarian failure. N Engl J Med 1973; 289: 1159-1162. [ Links ]
17. Park MC, Park YB, Jung SY, Choi KH, Lee SK. Risk of ovarian failure and pregnancy outcome in patients with lupus nephritis treated with intravenous cyclophosphamide pulse therapy. Lupus 2004; 13: 569-574. [ Links ]
18. Madeiros MM, Silveira V, Menezes AP, Carvalho RC. Risk factors for ovarian failure in patients with systemic lupus erythematosus. Braz J Med Biol Res 2001; 34: 1561-1568. [ Links ]
19. Buyon J, Wallace D. The use of exogenous estrogens, endocrine system, and urogenital tract in Dubois‘ Lupus erythematosus. 6th ed. Lippincott Williams & Wilkin Co. 2001: 821-841. [ Links ]
20. Pasoto SG, Viana VS, Mendonca BB, Yoshinari NH, Bonfa E. Anti-Corpus luteum antibody: a novel serological marker for ovarian dysfunction in systemic lupus erythematosus? J Rheumatol 1999; 26: 1087-1093. [ Links ]
21. Slater CA, Liang MH, McCune JW, Christman GM, Laufer MR. Preserving ovarian function in patients receiving cyclophosphamide. Lupus 1999; 8: 3-10. [ Links ]
22. Ataya K, Valeriote F. Effect of cyclophosphamide on the immature rat ovary. Cancer Res 1989; 49: 1660-1664. [ Links ]
23. Meirow D, Lewis H, Nugent D, Epstein M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Hum Reprod 1999; 14: 1903-1907. [ Links ]
24. Blumenfeld Z, Shapiro D, Shtinberg M, Avivi I, Mahir M. Preservation of fertility and ovarian function and minimizing gonadotoxicity in young women with systemic lupus erythematosus treated by chemotherapy. Lupus 2000; 9: 401-405. [ Links ]
25. Pendse S, Ginsburg E, Singh A. Strategies for preservation of ovarian and testicular function after immunosuppression. Am J Kidney Dis 2004; 43: 772-781. [ Links ]
26. Katsifis G, Tzioufas AG. Ovarian failure in systemic lupus erythematosus patients treated with pulsed intravenous cyclophosphamide. Lupus 2004; 13: 673-678. [ Links ]