Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.13 n.3 Bogotá jul./sep. 2006
INVESTIGACIÓN ORIGINAL
Manifestaciones renales y neuropsiquiátricas en pacientes con lupus eritematoso sistémico y anticuerpos anti-P ribosomal
Renal and neuropsychiatric manifestations in patients with systemic lupus erythematosus and ribosomal P protein autoantibodies
Gerardo Quintana1, Cilia Rojas1, José Félix Restrepo1, Andrés Fernández1, José Martínez1, Federico Rondón1, Álvaro Sánchez1, Antonio Iglesias1
1 Unidad de Reumatología, Universidad Nacional de Colombia. Bogotá, Colombia.
Resumen
Los auto anticuerpos contra la proteína P ribosomal (anti-P ribosomales) se presentan en aproximadamente el 15% de los pacientes con lupus eritematoso sistémico (LES). Estos anticuerpos fueron inicialmente asociados con psicosis lúpica y enfermedad neuropsiquiátrica. Posteriormente se reconoció su asociación con alto riesgo de compromiso renal y hepático.
Objetivos: evaluar la coexistencia serológica y clínica de anticuerpos anti-P ribosomal y anti-DNA en pacientes con LES con compromiso renal y neuropsiquiátrico.
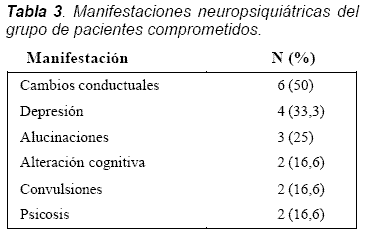
Materiales y métodos: casos: 12 pacientes con lupus neuropsiquiátrico (cambios conductuales 6, depresión 4, alucinaciones 3, alteración cognitiva 2, convulsiones 2 y psicosis 2). Controles: 13 pacientes con actividad por LES sin evidencia de manifestaciones neuropsiquiátricas. Todos los pacientes estuvieron activos para el tiempo de la evaluación. Los anticuerpos anti-P ribosomal fueron determinados por ELISA y los anti-dcDNA por el método de Crithidia luciliae. La función renal fue valorada por medición de creatinina y el compromiso renal con uroanálisis.
Resultados: la edad media fue de 39 años, 2 hombres / 23 mujeres. Ocho casos (66,6%) y seis (46,1%) controles tenían compromiso renal. El 20% de los pacientes fueron positivos para anti-P ribosomal (5/25 pacientes: 2 controles y 3 casos). El 36% de los pacientes tenían anticuerpos anti-dsDNA (30,7% controles y 41,6% casos). La presencia de anticuerpo P ribosomal estuvo asociada con anti-dcDNA (p = 0,002) y con nefritis lúpica (p = 0,046), pero no hubo asociación entre el anti-P ribosomal y las manifestaciones neuropsiquiátricas (p = 0,645).
Conclusiones: la presencia de anticuerpos anti-P ribosomal está asociada con anti-dcDNA y nefritis lúpica. Este estudio no encontró asociación estadísticamente significante entre anti-P ribosomal y manifestaciones neuropsiquiátricas del LES.
Palabras clave: lupus eritematoso sistémico, anti-P ribosomal, anti-DNA, nefritis lúpica, LES neuropsiquiátrico, actividad lúpica.
Summary
The ribosomal P protein autoantibodies are present in approximately 15% of patients with Systemic Lupus Erythematosus (SLE). These antibodies were initially associated with lupus psychosis and neuropsychiatric diseases. Posteriorly, they were associated to a higher risk of renal and liver involvement in patients with SLE.
Objective: to evaluate the serologic and clinic coexistence of ribosomal P protein autoantibodies and anti-dsDNA in patients with SLE with renal and neuropsychiatric manifestations.
Materials and Methods: cases: 12 patients with neuropsychiatric and renal involvement (behavior changes 6, depression 4, hallucinations 3, cognitive impairment 2, seizures 2 and psychosis 2). Controls: 13 patients with active SLE, without evidence of neuropsychiatric manifestations. SLE was active in all patients during the process of evaluations. The anti-ribosomal P protein antibodies were determined by ELISA and the dsDNA antibodies by Crithidia luciliae´s immunofluorescence test. The renal function was evaluated by serum creatinin and urinalyses.
Results: the median age was 39 years, 2 men/23 women. 8 cases (66.6%) and 7 controls (53.8 %) have renal involvement. 20% of patients were positive for anti P-ribosomal antibodies (5/25 patients: 2 controls and 3 cases). 36% of patients have anti dsDNA antibodies (30.7% controls and 41.6% cases). The presence of anti-ribosomal P protein antibodies was associated with anti dsDNA antibodies (p = 0.002) and with lupus nephritis (p = 0.046), but no association between ribosomal P protein autoantibodies and neuropsychiatric manifestations was found (p = 0.645).
Conclusions: the P-ribosomal antibodies are associated with anti-dsDNA and lupus nephritis. This study did not show statistically significant associations between ribosomal P protein autoantibodies and neuropsychiatric manifestations in patients with SLE.
Key words: Systemic Lupus Erythematosus, anti-ribosomal P protein antibodies, anti-dsDNA, Lupus nephritis, neuropsychiatric lupus, lupus activity.
Introducción
Las fosfo-proteínas ribosomales ricas en alanina (proteínas “P”) P0, P1 y P2 de 38, 19 y 17 kilo Daltons respectivamente, se localizan en las subunidades 60s del ribosoma eucariótico y son el principal blanco de los anticuerpos anti-P ribosomal1, 2. Estos anticuerpos reconocen un número de epítopes, incluyendo un antígeno lineal determinante de 22 aminoácidos en el grupo carboxilo terminal común a estas tres proteínas ribosomales.
Los anticuerpos se encuentran casi exclusivamente en 13 a 20% de pacientes caucásicos con LES y en más del 36% en pacientes chinos con la enfermedad3, 4. El epítope ribosomal, reactivo al anti-P ribosomal, se ha encontrado en las células del neuroblastoma humano y, en menor grado, en fibroblastos humanos5, además, Yoshio et al.6 han mostrado que estos autoanticuerpos pueden ligarse a la superficie de las células endoteliales. Existe evidencia de que los anticuerpos anti-DNA de doble cadena (dcDNA) algunas veces pueden tener reactividad cruzada con el anti-P ribosomal7. Sun et al.8 informaron que el grupo C hidrófobo terminal de la región ribosomal de las proteínas son esenciales para su reactividad cruzada con el anti-dcDNA. Los anticuerpos pueden ser detectados por inmuno-fluorescencia, y Bonfa et al.9 usaron radioinmunoensayo cuantitativo. Otros métodos incluyen ELISA e inmunoblotting de proteínas de ribosomas purificadas. La prueba de ELISA que usa purificado de humano tiende a ser muy sensible (97%)10.
La asociación entre el anti-P ribosomal y psicosis por LES se informó por primera vez por Bonfa et al.9. Ellos encontraron que 18 de 20 pacientes (90%) con psicosis por LES, tenían anti-P ribosomal. Estas observaciones fueron reproducidas por Schneebaum et al.11, pero refutadas en los estudios de Teh et al.12 e Inverson13. Estas diferencias se han atribuido a diferencias metodológicas y en el informe y análisis de resultados. Un número de estudios posteriormente han apoyado la asociación entre los anticuerpos anti-P ribosomal y manifestaciones neuropsiquiátricas por lupus14-17; por ejemplo Tzioufas et al.16 encontraron que 11 de 28 (39,3%) pacientes con LES y manifestaciones neurológicas (psiquiátrico 71%, epilepsia 75%) tenían anticuerpos anti-P. No obstante, en vista de los informes contradictorios anteriores, la controversia acerca de la asociación de anticuerpos con manifestaciones neuropsiquiátricas por lupus permanece vigente. Los recientes estudios han apoyado la asociación entre los anticuerpos y lupus activos y/o con nefritis17, 18, generalmente acompañados por anti-dsDNA, observando que la actividad por nefritis está estrechamente relacionada con estos autoanticuerpos. Otros estudios han encontrado una mayor probabilidad de manifestaciones cutáneas19 y compromiso hepático, y se ha informado evidencia de que los anti-P ribosomales son patogénicos para los hepatocitos20, 21.
El objetivo de este trabajo es evaluar la coexistencia serológica y clínica de anticuerpos anti-P ribosomal y anti-dcDNA en pacientes con LES con compromiso renal y neuropsiquiátrico, utilizando la prueba de ELISA para determinar los títulos de anti-P ribosomal y el método de Crithidia luciliae para los anti-dcDNA.
Materiales y métodos
Pacientes
Un total de 25 pacientes fueron incluidos, quienes cumplieron con los criterios de la American College of Rheumatology (ACR) de 198222, modificada en 199723, para la clasificación de LES, y que fueron vistos en la Unidad de Reumatología de la Universidad Nacional de Colombia, en sus diferentes sitios de atención (Clínica San Pedro Claver y Carlos Lleras Restrepo) durante el período de septiembre de 2003 y diciembre de 2004. Los pacientes fueron asignados a dos grupos; el primero completó 12 pacientes consecutivos no seleccionados con LES neuropsiquiátrico (cambios conductuales 6, depresión 4, alucinaciones 3, alteración cognitiva 2, convulsiones 2 y psicosis 2), que fueron determinados a partir de la clasificación propuesta por la ACR de manifestaciones neuropsiquiátricas en LES y siguiendo las recomendaciones específicas para tal evaluación diagnóstica24. Tras una evaluación clínica y por laboratorio se descartaron otras causas de compromiso neurológico, tales como alteraciones metabólicas, infecciosas, hipertensión arterial no controlada o tumorales. El segundo, con 13 pacientes con actividad por LES sin evidencia de manifestaciones neuropsiquiátricas. Todos los pacientes estuvieron activos para el tiempo de la evaluación y fueron valorados a través del índice SLEDAI25. A todos los pacientes incluidos se les realizó una toma de muestra sanguínea para determinaciones serológicas, cuadro hemático y química sanguínea, uroanálisis, se sometieron a una cuidadosa evaluación física y se realizó consentimiento informado. Las muestras para serología, que no fueron procesadas inmediatamente, se congelaron a -20° centígrados. La nefritis se definió como proteinuria persistente mayor de 0,5 gramos en un período de 24 horas, la presencia de cilindros celulares, y/o creatinina sérica elevada (elevación superior al 30 % de los niveles habituales). En todos los casos la nefritis fue atribuida al LES si ninguna otra causa fue aparente. Los pacientes recibieron dosis de esteroides acorde a la actividad de su enfermedad y virtualmente todos los pacientes recibieron dosis de mantenimiento con cloroquina (250 mg al día) o hidroxicloroquina (200 – 400 mg al día).
Evaluaciones serológicas
Los anticuerpos antinucleares (ANA) y los anti-dcDNA fueron detectados por procedimiento de inmunofluorescencia indirecta usando células de HEp-2 y substrato de Crithidia luciliae, respectivamente. Los títulos de ANA mayores de 1:160 y títulos de anti-dcDNA mayores de 1:20 fueron considerados positivos.
Evaluación de anticuerpos anti-P ribosomal
Los anticuerpos anti-P ribosomal fueron determinados por ELISA (Enzyme-Linked Immunosorbent Assay) QUANTA-Lite Ribosome P para una detección semicuantitativa de los anticuerpos en suero humano. La técnica ELISA empleada en esta prueba es sensible, específica y objetiva. Brevemente,
1. Todos los reactivos deben estar a temperatura ambiente (20-26-c) antes de empezar el ensayo.
2. Se agregan 100 µL de los controles prediluidos Ribosoma P ELISA Positivo Débil, Ribosoma P ELISA Positivo Fuerte, ELISA Negativo y las muestras prediluidas a los pocillos. Posteriormente se cubren los pocillos para incubar durante 30 minutos a temperatura ambiente en una superficie plana. El tiempo de incubación empieza después de la adición de la última muestra.
3. Lavado: se aspira el contenido de cada pocillo. Luego se agrega 200-300 µL de solución de lavado a todos pocillos y se aspira. Se repite esta secuencia dos veces más para un total de tres lavados. Luego se debe invertir la placa y golpearla suavemente en material absorbente para eliminar cualquier fluido residual tras el último lavado. Es importante que cada pocillo esté completamente vacío después de cada paso de lavado y mantener la misma secuencia para la aspiración que la usada para la adición de muestras.
4. Se agrega 100 µL de Conjugado IgG HRP (Ácido Sulfúrico 0,344M) a cada pocillo, pipetiando de la forma más aséptica posible y siguiendo buenas técnicas de laboratorio, para incubar los pocillos durante 30 minutos como en el paso 2. Luego se procede al lavado, según se describió en el paso 3.
5. Se agrega 100 µL de Cromógeno TMB a cada pocillo y se incuba por 30 minutos en oscuridad a temperatura ambiente. Luego se añade 100 µL de Solución de parada a cada pocillo, manteniendo la misma secuencia y temporalización que la efectuada en la adición del Cromógeno. Se agita suavemente la placa para mezclar bien los pocillos.
6. Se hace la lectura (OD) de cada pocillo a 450 nm en un plazo máximo de una hora.
Las muestras pueden clasificarse con un valor negativo (< 20 U), positivo débil (20 – 39 U), positivo moderado (40 – 80 U) y positivo fuerte (> 80 U).
Análisis estadístico
El análisis estadístico fue realizado usando el paquete STATA 8,0, se usó la prueba exacta de Fisher’s y el chi-2 para determinar la fuerza de asociación entre las variables de interés (anti-P ribosomal, anti-dcDNA, nefritis lúpica y manifestaciones neuropsiquiátricas), teniendo en cuenta el número de casos en las tablas de contingencias elaboradas para el análisis de los datos. Un valor de P menor de 0,05 se consideró como significante.
Resultados
En total fueron evaluados 25 pacientes: 12 en el grupo de LES neuropsiquiátrico y 13 sin esta manifestación. La edad media fue de 39 años, en el grupo total la distribución por sexo fue 2 hombres/23 mujeres. El compromiso renal fue similar en ambos grupos, con una distribución de ocho (66,6%) casos y seis (46,1%) controles. Del grupo total, 20% (prevalencia) de los pacientes fueron positivos para anti-P ribosomal (5/25 pacientes); de estos, dos eran del grupo sin LES neuropsiquiátrico y tres pertenecían a los pacientes con manifestaciones neuropsiquiátricas. El 36% de los pacientes tenían anticuerpos anti-dcDNA, de los cuales la mayoría eran del grupo casos (41,6% casos y 30,7% controles). El SLEDAI general para los dos grupos fue de 12,12, y en el grupo de LES neuropsiquiátrico fue de 15,33, mientras que en el grupo control fue de 9,1 (Tablas 1 y 2). Las manifestaciones neuropsiquiátricas más frecuentes dentro de los pacientes del grupo correspondiente fueron cambios conductuales, depresión y alucinaciones (Tabla 3).
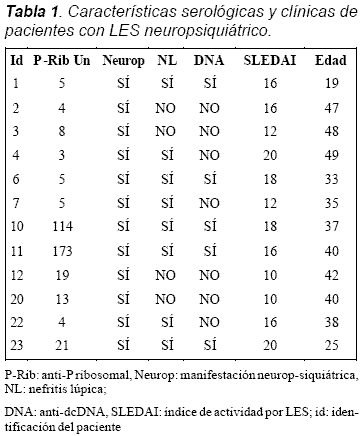
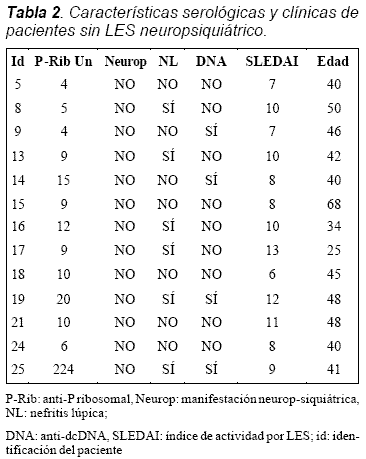
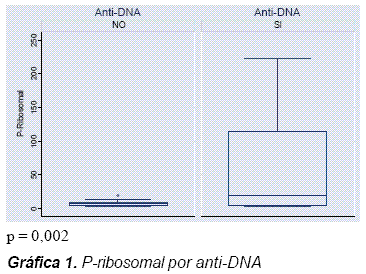
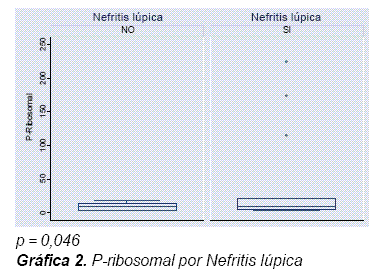
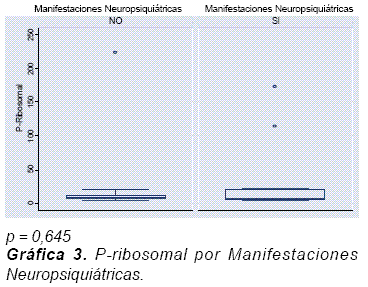
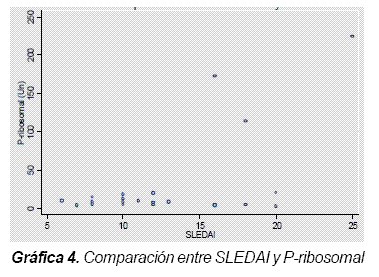
La presencia de anticuerpo P ribosomal tuvo una alta correlación con el anti-dcDNA (p = 0,002) (Gráfica 1), igualmente para nefritis lúpica la asociación estadística resultó positiva con un valor de p = 0,046 (Gráfica 2), mientras que el presente estudio no mostró asociación entre el anti-P ribosomal y las manifestaciones neuropsiquiátricas (p = 0,645) (Gráfica 3). También llamó la atención la relación entre los niveles de P ribosomal y el índice de SLEDAI (Gráfica 4).
Discusión
Muchos estudios han encontrado alta especificidad de los anti-P ribosomales para el LES19, 26, 27 con una extremada baja prevalencia en los pacientes con otro tipo de enfermedades28, 29. Así, estos anticuerpos son considerados como marcadores diagnósticos para LES cuando se encuentran en el suero de los pacientes, a pesar de sus niveles fluctuantes, que parecen estar acordes con el nivel de actividad de la enfermedad16, 30, 31, pero no hay claridad si estos anticuerpos están asociados con mayor severidad de la enfermedad. La prevalencia de anti-P ribosomal en el estudio fue del 20%, similar a otras publicaciones3, 4. Aunque la edad no era un desenlace a medir, no se observó alguna relación entre la edad y la positividad a los anti-P ribosomal como lo han mostrado informes previos32, 33.
No se observó asociación estadística significante entre anti-P ribosomal y manifestaciones neuropsiquiátricas, si bien los primeros informes fueron más contundentes con tal asociación, más recientemente y de manera repetida esta observación ha venido perdiendo peso como bien lo señalan Gerli et al. en un reciente estudio prospectivo34. Estas diferencias pueden ser atribuidas a varias explicaciones. En primer lugar, las diferencias étnicas de las poblaciones objeto de estudio; los diferentes métodos usados para medir los anticuerpos; la variedad en el rigor con la cual se hacen las valoraciones de las manifestaciones neuropsiquiátricas, y la ocurrencia heterogénea en diferentes poblaciones de autoanticuerpos diferentes al anti-P ribosomal que pueden afectar la función neuronal de los pacientes con LES35. En nuestro estudio, a pesar de mostrar diferencias a favor de la asociación del anti P ribosomal y manifestación renal, su valor p (p = 0,046) se encuentra muy cercano al límite del valor aceptado, por lo cual se debe tomar con precaución, máxime cuando el tamaño de la muestra fue tan reducido dada la poca frecuencia de casos, según los criterios de inclusión.
Se pudo determinar una fuerte asociación entre los anticuerpos anti-P ribosomal con el anti-dsDNA, mas no así con la nefritis lúpica; esta observación ya ha sido informada en muchos estudios, lo que sugiere varias posibilidades: la presencia de dos anticuerpos es más nefritogénica que cuando sólo existe uno, pero se debe tener en cuenta también que la coexistencia y su nefritogenicidad no es perfecta, ya que pueden presentarse ambos anticuerpos, sin ninguna manifestación, sugiriendo que sus mecanismos patogénicos son heterogéneos. Como se describió en un estudio, algunos anti-dcDNA se unen a la membrana, pero no penetran la célula (en cultivo); otros penetran y migran al núcleo, y una tercera variedad penetra la membrana celular y residen en el citoplasma incluso después de 24 horas36. De manera llamativa, los anti-P ribosomal de forma consistente se unen y penetran las células y son capaces de inhibir la síntesis de la proteína21, 37. Los anti-dcDNA también son muy eficaces en inhibir la traducción in vitro38, 39. Estas propiedades conjuntamente sostenidas del anti-dcDNA y anti-P ribosomal pueden responder en parte por su patogenicidad in vivo.
Finalmente, uno de los desafíos más interesantes será definir cuáles son los factores cuya presencia determina el desarrollo de las diferentes manifestaciones asociadas al anticuerpo P ribosomal. Se puede pensar en muchas posibilidades pero sólo continuando el cuidadoso estudio clínico de estos pacientes, se clarificarán los elementos que determinan la expresión de la enfermedad en los pacientes con los anticuerpos anti-P ribosomales.
Declaración de conflicto de intereses
Declaramos que no existe ningún conflicto de intereses relacionados con los resultados del presente estudio.
Fuente de financiación
Este trabajo fue financiado a través de fondos suministrados por la División Nacional de Investigación (DINAIN), sede Bogotá de la Universidad Nacional de Colombia, por medio de convocatoria para apoyo financiero a trabajos de investigación de 2004.
Referencias
1. Francoeur AM, Peebles CL, Heckman KJ, Lee JC, Tan EM. Identification of ribosomal protein autoantigens. J Immunol 1985; 135: 2378-2384. [ Links ]
2. Elkon KB, Parnassa AP, Foster CL. Lupus autoantibodies target ribosomal P proteins. J Exp Med 1985; 162: 459-471. [ Links ]
3. Arnett FC, Reveille JD, Moutsopoulos HM, Georgescu L, Elkon KB. Ribosomal P autoantibodies in systemic lupus erythematosus. Frequencies in different ethnic groups and clinical and immunogenetic associations. Arthritis Rheum 1996; 39: 1833-1839. [ Links ]
4. Teh LS, Doherty DG and Williams BD. HLA-DRB genes and antiribosomal P antibodies in systemic lupus erythematosus. Br J Rheumatol 1994; 33: 1125-1126. [ Links ]
5. Koren E, Reichlin MW, Koscec M, Fugate RD, Reichlin M. Autoantibodies to the ribosomal P proteins react with a plasma membrane target on human cells. J Clin Invest 1992; 89: 1236-1241. [ Links ]
6. Yoshio T, Masuyama J, Kano S. Antiribosomal P0 protein antibodies react with the surface of human umbilical vein endothelial cells. J Rheumatol 1996; 23: 1311-1312. [ Links ]
7. Takeda K, Rayno K, Wolfson-Reichlin M, Reichlin M. Heterogeneity of anti-dsDNA antibodies in their crossreaction with ribosomal P protein. J Autoimmun 1996; 13: 423-428. [ Links ]
8. Sun KH, Hong CC, Tang SJ, Sun GH, Liu WT, Han SH, et al. Anti-dsDNA autoantibody cross-reacts with the C-terminal hydrophobic cluster region containing phenylalanines in the acidic ribosomal phosphoprotein P1 to exert a cytostatic effect on the cells. Biochem Biophys Res Commun 1999; 263: 334-339. [ Links ]
9. Bonfa E, Golombek SJ, Kaufman LD, Skelly S, Weissbach H, Brot N, et al. Association between lupus psychosis and anti-ribosomal P protein antibodies. N Engl J Med 1987; 317: 265-271. [ Links ]
10. Rayno K, Reichlin M. Evaluation of assays for the detection of autoantibodies to ribosomal P protein. Clin Immunol 2000; 95: 99-103. [ Links ]
11. Schneebaum AB, Singleton JD, West SG, Blodgett JK, Allen LG, Cheronis JC, et al. Association of psychiatric manifestations with antibodies to ribosomal P protein in systemic lupus erythematosus. Am J Med 1991; 90: 54-62. [ Links ]
12. Teh LS and Isenberg DA. Antiribosomal P protein antibodies in systemic lupus erythematosus. A reappraisal. Arthritis Rheum 1994; 37: 307-315. [ Links ]
13. Iverson GL. Are antibodies to ribosomal P proteins a clinically useful predictor of neuropsychiatric manifestations in patients with systemic lupus erythematosus. Lupus 1996; 5: 634-635. [ Links ]
14. West SG, Wener MH, Kotzin BL. Neuropsychiatric lupus erythematosus: a 10 yr prospective study on the value of diagnostic tests. Am J Med 1995; 99: 153-163. [ Links ]
15. Mathy JP, Baum R, Toh BH. Autoantibody to ribosomes and systemic lupus erythematosus. Clin Exp Immunol 1980; 41: 73-80. [ Links ]
16. Tzioufas AG, Tzortzakis NG, Panou-Pomonis E, Boki KA, Sakarellos-Daitsiotis M, Sakarellos C, et al. The clinical relevance of antibodies to ribosomal-P common epitope in two targeted systemic lupus erythematosus populations: a large cohort of consecutive patients with active central nervous system involvement. Ann Rheum Dis 2000; 59: 99-104. [ Links ]
17. Caponi L, Pegoraro S, Di Bartolo V, Rovero P, Revoltella R, Bombardieri S. Autoantibodies directed against ribosomal P proteins: use of a multiple antigen peptide as the coating agent in ELISA. J Immunol Meth 1995; 179: 193-202. [ Links ]
18. Denburg SD, Behmann SA, Carbotte RM, Denburg JA. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Relationship of lymphocyte antibody specificities to clinical disease. Arthritis Rheum 1994; 37: 369-375. [ Links ]
19. Van Dam A, Nossent H, De Jong J, Meilof J, Ter Borg EJ, Swaak T, et al. Diagnostic value of antibodies against ribosomal phosphoproteins. A cross sectional and longitudinal study. J Rheumatol 1991; 18: 1026-1034. [ Links ]
20. Arnett FC, Reichlin M. Lupus hepatitis, an under recognized disease feature associated with autoantibodies to ribosomal P. Am J Med 1995; 99: 465-472. [ Links ]
21. Koscec M, Koren E, Wolfson-Reichlin M, Fugate RD, Trieu E, Targoff I , et al. Autoantibodies to ribosomal P proteins penetrate into live hepatocytes and cause cellular dysfunction in culture. J Immunol 1997; 159: 2033-2041. [ Links ]
22. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25: 1271-1277. [ Links ]
23. Hochberg MC. Updating the Americam College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997; 40: 1725. [ Links ]
24. ACR ad hoc Committee on Neuropsychiatric Lupus Nomenclature. The American College of Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes. Arthritis Rheum 1999; 42: 599-608. [ Links ]
25. Bombardier C, Gladman D, Urowitz MB. Derivation of the SLEDAI. A disease activity index for lupus patients. Arthritis Rheum 1992; 35: 630-640. [ Links ]
26 Bonfa E, Weissbach H, Brot N, Elkon KB. Ribosomal P protein autoantibodies. In: Peter JB, Shoenfeld Y, Eds. Autoantibodies. Amsterdam: Elsevier; 1996; 721-726. [ Links ]
27 Bonfa E, Elkon KB. Clinical and serological associations of the anti ribosomal P in systemic lupus erythematosus. Arthritis Rheum 1986; 29: 981-985. [ Links ]
28. Johanet C, André C, Sibilia J, Baquey A, Oksman F, San Marco M, et al. Signification clinique des anticorps antiribosomes. Rev Méd Interne 2000; 21: 510-516. [ Links ]
29. Ghirardello A, Doria A, Zampieri S, Gerli R, Rapizzi E, Gambari PF. Antiribosomal P protein antibodies detected by immunoblotting in patients with connective tissue diseases: their specificity for systemic lupus erythematosus and association with anticardiolipin antibodies. Ann Rheum Dis 2000; 59: 975-981. [ Links ]
30. Sato T, Uchiumi T, Ozawa T, Kikuchi M, Nakano M, Kominami R, et al. Autoantibodies against ribosomal proteins found with high frequency in patients with systemic lupus erythematosus with active disease. J Rheumatol 1991; 18: 1681-1684. [ Links ]
31. Elkon KB, Bonfa E, Weissbach H, Brot N. Antiribosomal antibodies in SLE, infection, and following deliberate immunization. Adv Exp Med Biol 1994; 347: 81-92. [ Links ]
32. Press J, Palayew K, Laxer RM, Elkon K, Eddy A, Rakoff D, et al. Antiribosomal P antibodies in pediatric patients with systemic lupus erythematosus and psychosis. Arthritis Rheum 1996; 39: 671-676. [ Links ]
33. Reichlin M, Broyles TF, Hubscher O, James J, Lehman TA, Palermo R, et al. Prevalence of autoantibodies to ribosomal P proteins in juvenile-onset systemic lupus erythematosus compared with the adult disease. Arthritis Rheum 1999; 42: 69-75. [ Links ]
34. Gerli R, Caponi L, Tincani A, Scorza R, Sabbadini G, Danieli M, et al. Clinical and serological associations of ribosomal P autoantibodies in systemic lupus erythematosus: prospective evaluation in a large cohort of Italian patients. Rheumatology 2002; 41: 1357-1366. [ Links ]
35. Reichlin M. Ribosomal P antibodies and CNS lupus. Lu pus 2003; 12: 916-918. [ Links ]
36. Reichlin M. Autoantibodies to ubiquitous intracellular antigens interact with living cells, Immunologist 1998; 6: 76-78. [ Links ]
37. Stacey DW, Skelly S, Watson T, Elkon K, Weissbach H, Brot N. The inhibition of protein synthesis by IgG containing anti-ribosome P autoantibodies from systemic lupus erythematosus patients. Arch Biochem Biophys 1988; 267: 398-403. [ Links ]
38. Alberdi F, Dadone J, Ryazanov A, Isenberg DA, Ravirajan C, Reichlin M. Cross-reaction of lupus anti-dsDNA antibodies with protein translation factor EF-2, Clin Immunol 2001; 98: 293-300. [ Links ]
39. Tsuzaka K, Winkler TH, Kalden JR, Reichlin M. Autoantibodies to double-stranded (ds)DNA immunoprecipitate 18S ribosomal RNA by virtue of their interaction with ribosomal protein S1 and suppress in vitro protein synthesis. Clin Exp Immunol 1996; 106: 504-508. [ Links ]














