Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.13 no.4 Bogotá Oct./Dec. 2006
ACTUALIZACIÓN
Nefropatía lúpica. Presentación clínica, clasificación y tratamiento
Lupus nephritis. Clinical presentation, classification and treatment
Luis Alonso González Naranjo1, Gloria María Vásquez Duque1, Oscar Uribe Uribe1, Luis Alberto Ramírez Gómez1
1 Sección de Reumatología, Hospital Universitario San Vicente de Paul, Universidad de Antioquia. Medellín, Colombia.
Resumen
La nefritis lúpica (NL) es una causa importante de morbilidad y mortalidad en pacientes con lupus eritematoso sistémico (LES). De igual manera, el compromiso renal es común en el LES, presentándose hasta en un 60% de los adultos afectados durante el curso de la enfermedad. Recientemente, se realizaron modificaciones a la clasificación de la glomerulonefritis lúpica; en esta clasificación, se propuso que tanto las formas clase I como II correspondían a un compromiso puramente mesangial (I, depósitos inmunes en el mesangio sin hipercelularidad mesangial; II, depósitos inmunes e hipercelularidad mesangial); la clase III corresponde a una glomerulonefritis focal (compromiso de < 50% del número total de glomérulos) con subdivisiones que incluyen tanto lesiones activas como escleróticas; la clase IV corresponde a una glomerulonefritis difusa (compromiso = 50% del número total de glomérulos) ya sea con compromiso segmentario (clase IV-S) o global (clase IV-G) y además con subdivisiones tanto para lesiones activas como para lesiones escleróticas; la clase V es la glomerulonefritis membranosa y la clase VI son aquellas formas que se presentan con lesiones escleróticas avanzadas. Se debe hacer énfasis en que las combinaciones de glomerulonefritis membranosa y proliferativa se deberían reportar individualmente, así como es importante describir las lesiones tubulointersticiales y vasculares; por lo tanto, una de las ventajas de esta clasificación es que aporta una descripción inequívoca de las diferentes lesiones y clases de NL, lo cual permite una mejor estandarización y da una base para estudios clínicopatológicos. De otra parte, a pesar del desarrollo de nuevas modalidades terapéuticas en NL, la ciclofosfamida continúa siendo el tratamiento inicial ideal para formas severas de NL como las proliferativas o membranoproliferativas. Sin embargo, el tratamiento ideal sigue siendo cuestionado debido a los efectos adversos asociados con la administración de ciclofosfamida como la amenorrea sostenida, infertilidad, aumento en la susceptibilidad a la infección, la mielosupresión, cistitis hemorrágica y las neoplasias. Debido a los efectos adversos asociados con la ciclofosfamida, nuevas alternativas terapéuticas para la NL han venido surgiendo, las cuales también son de utilidad en el manejo de los pacientes refractarios a la terapia estándar con citotóxicos y también para quienes recaen. Para la enfermedad refractaria, se han considerado nuevos inmunosupresores e inmunomoduladores, dosis inmunoablativas de ciclofosfamida, aféresis, modificadores de la respuesta biológica.
Palabras clave: nefropatía lúpica, lupus eritematoso sistémico, tratamiento.
Summary
Lupus nephritis (LN) is a major cause of morbility and mortality in patients with systemic lupus erythematosus (SLE). Similarly, kidney involvement is common in SLE, occurring in up to 60% of affected adults during the course of their disease. Recently, the classification of glomerulonephritis in SLE has been modified; in this classification, it was proposed that class I and II be used for purely mesangial involvement (I, mesangial immune deposits without mesangial hypercellularity; II, mesangial immune deposits with mesangial hypercellularity); class III for focal glomerulonephritis (involving < 50% of total number of glomeruli) with subdivisions for active and sclerotic lesions; class IV for diffuse glomerulonephritis (involving = 50% of total number of glomeruli) either with segmental (class IV-S) or global (class IV-G) involvement, and also with subdivions for active and sclerotic lesions; class V for membranous glomerulonephritis; and class VI for advanced sclerotic lesions. It is important that combinations of membranous and proliferative glomerulonephritis should be reported individually in the diagnosis line, as well as the diagnosis should also include notations for any concomitant vascular or tubolointersticial lesions, therefore, one of the main advantages of this classification is that it provides a clear and unequivocal description of the various lesions and classes of lupus nephritis, allowing a better standardization and giving a basis for further clinicopathologic studies. Otherwise, despite the development of new modalities of treatment in LN, cyclophosphamide remains the preferred initial treatment for severe forms of LN like proliferative and membranous glomerulonephritis associated with both, lesions of class III or class IV; nevertheless, the optimal treatment remains challenging because of the adverse effects associated with cyclophosphamide like sustained amenorrhea, infertility, increased susceptibility to infection, bone marrow suppression, hemorrhagic cystitis, and malignancy. Finally, due to these adverse effects new alternative approaches to the treatment of LN are desirable and also for some patients who fail to achieve remission with standar cytotoxic therapy and for who relapse when therapy is reduced. For refractory disease, new immunosuppressive and immunomodulating agents, immunoablative high dose of cyclophosphamide, apheresis and the biological response modifiers can be consider.
Key words: lupus nephropathy, systemic lupus erythematosus, treatment.
Introducción
Una de las más serias complicaciones del LES es la enfermedad renal. Aproximadamente dos tercios de los pacientes tienen compromiso renal en algún momento de su enfermedad. La presentación varía desde una proteinuria leve asintomática hasta una glomerulonefritis rápidamente progresiva, con insuficiencia renal. La NL es un predictor de pobre pronóstico; de hecho, la enfermedad renal grave influye en la morbilidad y mortalidad de manera directa e indirecta a través de las complicaciones derivadas del manejo inmunosupresor1-3. La mortalidad es mayor en pacientes con NL que en aquellos que no la presentan4, 5; en una cohorte europea de 1000 pacientes lúpicos se encontró una sobrevida a 10 años menor en pacientes que presentaron NL al inicio del estudio que en aquellos que no la presentaron (88% frente a 94% de los pacientes sin NL, p = 0,045)5. Un 5% a 22% de los pacientes con NL progresan a enfermedad renal terminal requiriendo finalmente hemodiálisis o transplante6, 7. El pronóstico puede mejorar dramáticamente con tratamiento, el cual es potencialmente tóxico, prolongado, complejo y a veces difícil de llevar a cabo1-3.
Definición del compromiso renal en LES
La mayoría de pacientes lúpicos tienen evidencia histológica de daño renal, aunque muchos de ellos no presentan hallazgos clínicos sugestivos de compromiso renal (nefritis silente), como: sedimento urinario anormal (hematuria, cilindros celulares), proteinuria persistente (>0,5 gramos/día), valores elevados de creatinina sérica, hipocomplementemia y títulos altos de anticuerpos anti DNA de doble cadena (anti DNA-ds)1. En pacientes con NL silente, las lesiones histológicas son por lo general leves (cambios mínimos o mesangiales), pero también se han demostrado lesiones más severas y de mal pronóstico (glomerulonefritis proliferativa difusa). Por lo tanto, mientras el compromiso clínico renal se presenta entre un 40% y un 75% de los pacientes con LES, el compromiso histológico renal puede presentarse en casi todos los pacientes8, 9.
Wallace y Dubois, establecieron los siguientes criterios para determinar NL, con una sensibilidad mayor del 95%. Al menos uno de los siguientes debe estar presente10:
1. Biopsia renal que demuestre glomerulonefritis mesangial clase IIb, proliferativa focal, proliferativa difusa o membranosa.
2. Una disminución del 30% en la depuración de creatinina en un período de un año en un paciente con lupus activo.
3. Proteinuria mayor de 1 gramo en orina de 24 horas.
De igual manera, al menos tres de los siguientes durante un período de seguimiento de 12 meses, permiten hacer un diagnóstico de NL10:
1. Albúmina sérica menor de 3 g/dl.
2. Proteinuria sostenida de 2+ a 4+.
3. Cuerpos ovales grasos o cilindros granulosos, hialinos o eritrocitarios en orina.
4. Hematuria persistente (más de cinco eritrocitos por campo de alto poder en orina). Por cada uno de los criterios mencionado se deben excluir otras causas.
En los criterios del ACR, la enfermedad renal se establece si hay proteinuria persistente (>0,5g/d o >3+) o cilindros celulares de cualquier tipo11, 12.
Epidemiología
La prevalencia del compromiso renal en LES varía entre 29% y 65% en diferentes series1, y en nuestro medio es del 52,5%13, 14. Igualmente, la prevalencia de NL difiere según los grupos de edad y el curso de la enfermedad, siendo más frecuente en adultos jóvenes (39%) y más rara en mayores de 50 años (22%)15. Entre un 20 y un 50% de los pacientes con LES se dan hallazgos anormales de la función renal o en el uroanálisis en la enfermedad temprana, mientras que un 60% de los adultos y un 80% de los niños desarrollan compromiso renal clínico en enfermedad de mayor evolución2, 12, 16. En mayores de 50 años menos del 5% tienen NL al inicio de la enfermedad15.
Con respecto a los resultados obtenidos por el Grupo Latinoamericano de Estudio del Lupus (GLADEL), se encontró enfermedad renal significativamente más frecuente en mestizos y afro-latinoamericanos que en blancos; la falla renal aguda o crónica y la hipertensión arterial fueron más frecuentes en mestizos que en blancos y los afro-latinoamericanos tuvieron una frecuencia significativamente mayor de síndrome nefrótico en comparación con la población blanca17.
En un estudio multicéntrico y transversal, se realizó una comparación entre 107 pacientes latinoamericanos (colombianos y mexicanos), encontrándose compromiso renal y síndrome nefrótico significativamente mayor en hombres (58% y 31%) que en mujeres (44% y 22%) (p=0,004) (p= 0,04) respectivamente, mientras que la falla renal crónica se presentó en el 11% de los hombres y en el 9% de las mujeres con LES (p= 0,5)18.
En el Hospital Universitario San Vicente de Paul, la sección de reumatología de la Universidad de Antioquia realizó un estudio retrospectivo con 76 pacientes lúpicos; en este grupo se observó que la NL fue una manifestación temprana de la enfermedad, presentándose en el 86,8% al momento del diagnóstico o durante el primer año de seguimiento del LES, mientras que el 10,5% presentaron NL entre uno y cinco años luego del diagnóstico de LES y sólo el 2,7% luego del quinto año del diagnóstico19.
Anaya y cols.20, en un estudio transversal, compararon las características clínicas de 39 pacientes con NL con las de 100 pacientes con LES sin NL. Al igual que en el estudio realizado por el grupo de reumatología de la Universidad de Antioquia (GRUA), la NL fue una manifestación temprana, presentándose en 30 pacientes (77%) en el primer año luego del diagnóstico de LES, mientras que seis (15%) casos presentaron NL al segundo año, dos (5%) al tercer año y uno (3%) al quinto año de la enfermedad. El síndrome nefrótico se presentó en el 38% de los pacientes y la proteinuria en el 92%. Los pacientes con NL presentaron una mayor prevalencia de hipertensión arterial (60% frente a 10%, OR = 13,7, IC 95%: 5-37, p = 0,00001) y dislipidemia (30% frente a 7%, OR = 8,1 IC 95%: 2,5 – 27, P = 0,0006) al inicio de la enfermedad que aquellos sin nefropatía23, 24.
Importancia de la raza
La raza es un factor de riesgo independiente para el desarrollo de falla renal progresiva debido a NL proliferativa difusa. Los afro-americanos tienen mayor riesgo de desarrollar insuficiencia renal, hipertensión, fibrosis intersticial, mayores índices de cronicidad, hipocomplementemia y una respuesta más pobre a ciclofosfamida21. El pronóstico entre los pacientes con nefritis lúpica se ilustró en los estudios reportados por el Glomerular Disease Collaborative Network (GDCN) y el Instituto Nacional de Salud (NIH.) En ambos centros el riesgo de enfermedad renal terminal fue significativamente mayor para los afro-americanos, a pesar del tratamiento intensivo con esteroides y pulsos de ciclofosfamida. Factores genéticos pudieran predisponer a los afro-americanos a formas más agresivas y refractarias a la inmunosupresión. Igualmente, su condición socioeconómica tiene un impacto en la severidad de la enfermedad ya que limita sus posibilidades de acceder a los cuidados de la salud21.
Manifestaciones clínicas de la nefritis lúpica
Las manifestaciones renales del LES son tan variadas como las manifestaciones extrarrenales de la enfermedad. Las manifestaciones clínicas se correlacionan con la severidad del compromiso glomerular; sin embargo, algunos pacientes pueden presentar enfermedad severa debido a compromiso vascular, sea por vasculitis o síndrome antifosfolípido.
La enfermedad renal es la forma de presentación inicial del LES en el 3% al 6% de los casos22-24. De acuerdo con la literatura, la NL se diagnostica en los primeros cinco años del LES, mientras que su inicio es poco frecuente después de 10 años de evolución del LES25.
Klippel26 describió cinco tipos clínicos de NL: silente, nefritis activa crónica, nefritis rápidamente progresiva (fulminante), síndrome nefrótico e insuficiencia renal progresiva en pacientes con uroanálisis normal en varias ocasiones. En el último grupo es probable que los factores responsables de la insuficiencia renal sean la glomeruloesclerosis, la hipertensión arterial y los medicamentos como antiinflamatorios no esteroideos (AINES)1.
Los pacientes lúpicos tienen una alta incidencia de disfunción tubular renal, la cual se caracteriza por una acidosis tubular renal proximal o distal, particularmente en aquellos que presentan síndrome de Sjogren27. Entre las manifestaciones sugestivas de disfunción tubular renal están los defectos en la capacidad para concentrar la orina, acidosis con anión gap normal, hipokalemia y síndrome de Fanconi (acidosis tubular renal proximal tipo 2)3.
Los pacientes con NL pueden presentar complicaciones asociadas con anticuerpos antifosfolípidos como: trombosis de la vena renal, de la arteria renal, de los capilares glomerulares con o sin falla renal y una microangiopatía trombótica3.
Presentación clínica de la NL. Un 20 a 50% de los pacientes con LES presentan hallazgos anormales en el uroanálisis o en la función renal en el curso temprano de la enfermedad, mientras que un 60% de los adultos y 80% de los niños desarrollan enfermedad clínica posteriormente22, 23.
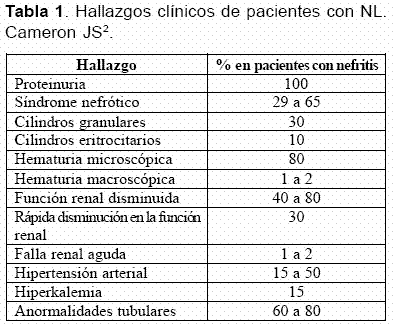
La proteinuria es el hallazgo dominante en la NL y está presente en casi todos los pacientes y con frecuencia progresa a síndrome nefrótico, el cual se presenta entre el 29% y el 65% de los casos de NL (Tabla 1)15-20. La proteinuria en rango nefrótico se presenta en dos tercios de los pacientes con glomerulonefritis membranosa, en 50% con glomerulonefritis proliferativa difusa, en 25% a 30% con glomerulonefritis proliferativa focal y es extremadamente rara en NL mesangial; en este caso, si hay proteinuria en rango nefrótico se debe pensar en la presencia concomitante de una enfermedad de cambios mínimos3.
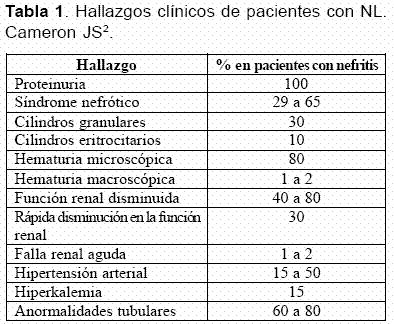
En el estudio realizado por el grupo de reumatología de la Universidad de Antioquia (GRUA), la NL proliferativa difusa fue la más frecuente (55,9%), seguida por la NL membranosa (20,3%); el síndrome nefrótico se encontró en el 84,6% de los casos de nefropatía membranosa, 63,6% de nefritis proliferativa difusa, en el 40% de nefritis proliferativa focal y en el 20% de nefritis mesangial19.
La hematuria microscópica persistente es frecuente y se puede encontrar entre un 32% y un 80%, y nunca se presenta como una manifestación aislada; la hematuria macroscópica es rara (1 a 2%) y se ha descrito en lupus pediátrico. Algunos autores señalan que la hematuria caracterizada por la presencia de más de 10 eritrocitos por uL se asocia con pobres resultados3, 28. La presencia de cinco leucocitos o eritrocitos (piuria y/o hematuria aislada) en una muestra de orina tomada en la mitad del chorro urinario, especialmente en presencia de trazas de albúmina, es sugestiva de nefritis activa29, 30.
Los cilindros en orina se presentan en un tercio de los pacientes3. En un estudio de 520 pacientes con LES, los cilindros granulares se presentaron en 170 casos (31,5%), los cilindros hialinos en 148 (28,4%), los cilindros eritrocitarios en 39 (7,5%), los cilindros grasos en 32 (6%) y los cuerpos ovales grasos en 23 (4,4%); estos últimos son un hallazgo clásico de nefrosis31. Cuando el daño renal por actividad lúpica progresa, aparecen cilindros hialinos y granulares y posteriormente, eritrocitarios y leucocitarios presentándose de esta manera un sedimento urinario telescopado1.
La hipertensión arterial se presenta en el 15% a 50% de los pacientes con NL. La hipertensión arterial es más común en aquellos que presentan formas más severas de NL (clase IV, 55%). La hipertensión acelerada es rara y la retinopatía es generalmente leve; sin embargo, en presencia de retinopatía se debe descartar compromiso del sistema nervioso central3.
El 50% de los pacientes cursan con una disminución del índice de filtración glomerular y un aumento en los niveles de creatinina sérica. Ocasionalmente, la NL se presenta como una insuficiencia renal aguda, explicable por diferentes causas: nefritis crescéntica severa difusa, trombosis diseminada que compromete los capilares glomerulares, nefritis intersticial aguda severa y trombosis de la vena renal o de la arteria renal en presencia o no de anticuerpos antifosfolípidos3, 32.
Los pacientes con síndrome nefrótico presentan complicaciones derivadas de éste como la hipercolesterolemia, la aterogénesis acelerada y la trombosis de la vena renal3. La trombosis de la vena renal se debe considerar en quienes presentan síndrome nefrótico con anticoagulante lúpico positivo, dolor en flanco asociado a fiebre, embolismo pulmonar e insuficiencia renal aguda y/o NL membranosa; los anticuerpos antifosfolípidos predisponen a trombosis de la vena renal, sin embargo su presencia no es imperiosa33, 34.
Los pacientes con LES usan con frecuencia para el tratamiento de la artritis o del dolor de serosas AINES tradicionales o Cox-2 selectivos, los cuales pueden causar nefropatía o precipitar una falla renal aguda35, 36.
Nefritis silente. Algunos pacientes pueden no tener enfermedad renal clínicamente evidente a pesar de tener evidencia de nefritis en la biopsia renal (nefritis silente). Las lesiones histológicas renales en pacientes con nefritis silente son por lo general leves; sin embargo, pueden presentarse cambios histológicos asociados con un pronóstico pobre. González-Crespo, et al.8 reportaron 18 casos de nefritis silente, y encontraron que las lesiones histológicas leves (clase I y clase II) son las más comunes (83,3%) y la falla renal es rara independiente de los hallazgos histopatológicos. Algunos de estos pacientes pueden presentar únicamente hipertensión arterial. Diversas hipótesis tratan de explicar la presencia de una nefritis silente: la administración previa de esteroides pudiera enmascarar una nefropatía ya presente; los cambios mesangiales o lesiones histológicas leves pudieran representar el compromiso renal más frecuente en el LES8. Así mismo, Zabaleta y cols.9 investigaron la presencia de NL silente en 42 pacientes asintomáticos y encontraron que 41 de ellos tuvieron nefritis silente, y los compararon con 49 pacientes no tratados con NL franca. La NL clase II fue la lesión predominante en los pacientes con nefritis silente y la clase IV fue la lesión predominante en pacientes con NL franca.
Nefritis lúpica y embarazo. Las pacientes con NL tienen un 50% a 60% de probabilidad de exacerbación de la nefritis durante el embarazo o el postparto si se embarazan en presencia de actividad lúpica. Por el contrario, mujeres con un LES bien controlado, que se embarazan después de un período de tres a seis meses de remisión, solo tienen un 7% a 10% de probabilidades de exacerbación de la nefritis. Las exacerbaciones de nefritis durante el embarazo y el postparto son muy severas, con falla renal anúrica, muerte materna o falla renal crónica37.
Las mujeres con NL son propensas a una preeclampsia “superpuesta”; la prevalencia de preeclampsia durante el embarazo en una mujer con LES es mayor que en un embarazo normal (38% frente a 0,5% a 10%). La hipertensión preexistente y los anticuerpos antifosfolípidos son los dos factores más comunes que predisponen a preeclampsia37.
Algunos aspectos pueden ayudar a diferenciar una exacerbación de la NL de la preeclampsia38:
1. Los niveles de C3 y C4 normalmente aumentan durante el embarazo y también en la preeclampsia. En una paciente lúpica con proteinuria y disminución de C3 y C4, lo más probable es una NL activa.
2. Muchos pacientes con una exacerbación de la NL no presentan incrementos en la presión arterial, mientras que la hipertensión arterial se presenta universalmente en las pacientes con preeclampsia.
3. Las exacerbaciones lúpicas renales responden a un incremento en las dosis de prednisona, mientras que la preeclampsia con frecuencia empeora con incrementos en las dosis de prednisona.
Los niveles de anti DNA ds son fuertemente positivos en una exacerbación de NL. Tanto la trombocitopenia, como la hipertensión y la hiperuricemia pueden presentarse en NL y en una preeclampsia, por lo que no son de gran ayuda para diferenciar estas dos entidades39.
Otra entidad que genera confusión entre una preeclampsia y una exacerbación del LES, es el síndrome de HELLP (hemolysis, elevated liver enzymes, low platelets), el cual puede complicar el curso de una preeclampsia en una minoría de pacientes37.
En presencia de NL e hipertensión previa, con o sin anticuerpos antifosfolípidos, el tratamiento preventivo con bajas dosis de aspirina se debe iniciar a las 10 o 14 semanas de embarazo, ya que éste es el momento de inicio de una placentación anormal que posteriormente llevará a preeclampsia37; esta medida preventiva se basa en que hay una alta producción de tromboxano en pacientes con LES, especialmente cuando las anticardiolipinas son positivas y en la segunda mitad del embarazo; la alta relación tromboxano/prostaciclina es importante en la generación de hipertensión durante el embarazo y las bajas dosis de aspirina disminuyen la producción de tromboxano sin afectar la producción de prostaciclina37.
El embarazo está contraindicado en presencia de NL activa, especialmente proliferativa difusa, síndrome nefrótico, hipertensión moderada o severa y valores de creatinina sérica de 2 mg/dl37.
El riesgo de pérdida fetal en embarazos de pacientes con nefritis lúpica varía entre el 8% y el 40%; la prematuridad entre el 13 y 53% y el retardo de crecimiento fetal entre el 10% y el 30%40, 41. La proteinuria (>=0,5 g/24 horas), la hipertensión arterial y la positividad para anticuerpos antifosfolípidos son predictores independientes de pérdida fetal en embarazos de mujeres con NL42.
Nefritis lúpica en niños. Aunque el LES ha sido reportado en niños en los primeros uno a dos años de vida, es raro en menores de cinco años. El pico de presentación del LES en los niños está cerca de la pubertad. El compromiso renal se presenta en la mayoría de los niños con LES. Al momento de diagnóstico del LES, ¾ de los niños pueden tener un compromiso renal que varía desde hallazgos leves en el uroanálisis hasta una disminución significativa de la función renal43-45. La mayoría de los niños con NL tienen proteinuria, mientras que el síndrome nefrótico se ve en uno de dos niños afectados al momento del diagnóstico. La hematuria se presenta entre el 67% y el 100% de los niños afectados en las diferentes series. La hipertensión arterial y una disminución en la función renal se presentan en uno de dos niños afectados al momento del diagnóstico46.
Al igual que en los adultos, los grupos étnicos de pobre pronóstico son los afro-americanos y los hispanos. La sobrevida a 10 años en niños con NL es buena, con un índice de mortalidad a 10 años luego del diagnóstico del 7,5%42.
Papel de la biopsia renal y hallazgos histológicos
A pesar de que más del 95% de los pacientes con LES muestran algún grado de anormalidad a la biopsia renal47-49, no tiene justificación practicarla a todos los pacientes, particularmente en aquellos sin evidencia clínica de compromiso renal50. Así mismo, para algunos autores, en pacientes con LES e insuficiencia renal aguda, títulos altos de anti-DNA ds y sedimento activo, hallazgos relacionados con una glomerulonefritis proliferativa difusa, no se requiere de la confirmación histológica51. Sin embargo, otros grupos consideran que la biopsia renal debe realizarse en todo paciente con anormalidades urinarias y/o reducción en la función renal52. En general, en pacientes con sospecha de NL la biopsia renal puede ser utilizada para: confirmar el diagnóstico, clasificar correctamente la NL, evaluar la actividad de la enfermedad, determinar el pronóstico y el tratamiento apropiado52-55. Algunas recomendaciones e indicaciones para la realización de la biopsia renal se describen en la Tabla 252.

Con respecto al tamaño de la muestra histológica, mientras mayor sea, hay una mayor precisión en establecer la presencia y extensión del compromiso glomerular debido a que éste es característicamente focal. Por ejemplo, si solo un 10% de los glomérulos están comprometidos, existe una probabilidad del 35% de no observar glomérulos anormales en una biopsia que contenga solo 10 glomérulos, mientras que la probabilidad de no encontrar una lesión focal disminuye a un 12% en una biopsia que contenga 20 glomérulos56.
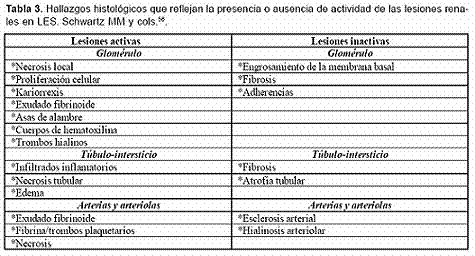
Los hallazgos histológicos muestran tanto lesiones activas, como inactivas3 (Tabla 3).
Patrones de lesión glomerular. Los patrones de lesión glomerular mediada por complejos inmunes están relacionados con el sitio de acumulación de inmunoglobulinas, su especificidad antigénica, su capacidad de fijar y activar el complemento y otras proteasas serinas, y su capacidad de desencadenar una respuesta celular inflamatoria. Estos patrones se dividen en tres grupos57:
1. Patrón mesangial: el acúmulo de complejos inmunes en el mesangio desencadena tanto hipercelularidad mesangial como acúmulo de matriz. Este patrón se observa en la nefropatía por IgA o en la NL mesangial proliferativa.
2. Patrón endotelial: este patrón tiene un componente exudativo caracterizado por acúmulos de leucocitos, lesión de células endoteliales y proliferación endocapilar. Se asocia con destrucción de la pared capilar, grandes o moderados depósitos de complejos inmunes, grados variables de proliferación mesangial y formación de medias lunas. Este patrón se aprecia en glomerulonefritis postinfecciosa, enfermedad anti-membrana basal glomerular y en la glomerulonefritis lúpica proliferativa endocapilar, así como en otras entidades caracterizadas por mecanismos no inmunológicos como en la hipertensión maligna, microangiopatía trombótica inducida por toxinas bacterianas y eventos trombóticos en el síndrome antifosfolípido asociado al LES. Los cambios endocapilares por lo general ocurren en presencia de patología mesangial ya que el mesangio está en continuidad directa con el espacio subendotelial y es accesible a los complejos inmunes circulantes.
3. Patrón epitelial: los anticuerpos y el complemento lesionan el podocito, lo que lleva a lesiones no proliferativas y no exudativas de la pared capilar, como en la NL membranosa o en la glomerulonefritis membranosa idiopática.
Cuándo repetir una biopsia renal: las transformaciones de una clase a otra se pueden presentar en un 50% al repetir la biopsia. Los signos de actividad y cronicidad también pueden variar en el tiempo como consecuencia de la enfermedad o del tratamiento. Algunos autores consideran que una nueva biopsia renal aportaría información útil en tres situaciones53:
1. Mejoría en la función renal con proteinuria persistente. En este caso la biopsia puede ayudar a decidir si descontinuar o no el tratamiento.
2. Síndrome nefrótico persistente o recurrente. En este caso la biopsia es de utilidad para determinar si ha ocurrido o no una transformación y decidir si se debe incrementar o no la inmunosupresión.
3. Lento deterioro de la función renal. La biopsia renal en este caso es útil para determinar si es necesario administrar una terapia más agresiva para revertir la disfunción renal. El deterioro de la función renal puede deberse a una mezcla variable de lesiones crónicas y activas53.
Clasificación de la nefritis lúpica: la primera clasificación de la NL establecida por la Organización Mundial de la Salud (OMS) fue reportada por Pirani y Pollak en Buffalo, Nueva York, en 1974. Esta clasificación se basó solo en lesiones glomerulares. Las lesiones clase I correspondían a biopsias renales que no mostraban lesiones glomerulares por microscopía de luz, fluorescencia o electrónica; las lesiones clase II correspondían a enfermedad puramente mesangial con depósitos inmunes y se subdividió en dos clases según la presencia o ausencia de hipercelularidad mesangial; las lesiones clase III fueron definidas como una glomerulonefritis proliferativa focal, la cual afecta menos del 50% del glomérulo; las lesiones clase IV fueron definidas como glomerulonefritis proliferativa difusa, o sea que afecta más del 50 % del glomérulo; y la nefritis lúpica membranosa se clasificó como clase V57.
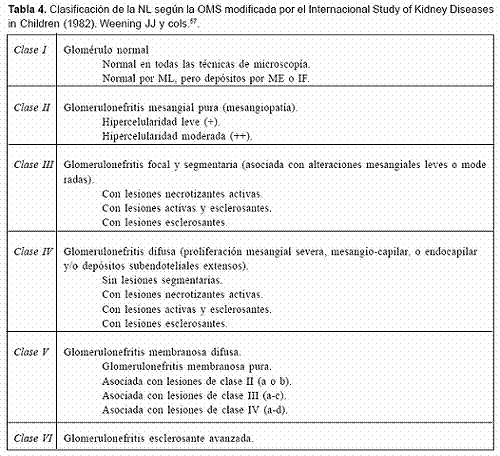
En 1982 la clasificación de la NL según la OMS fue modificada por el Internacional Study of Kidney Diseases in Children57, 58, la cual se describe en la Tabla 4.
Nueva propuesta para la clasificación de la NL
En Nueva York, se propuso una nueva clasificación para la NL, la cual, como las anteriores, se basa exclusivamente en lesiones glomerulares (Tabla 5).
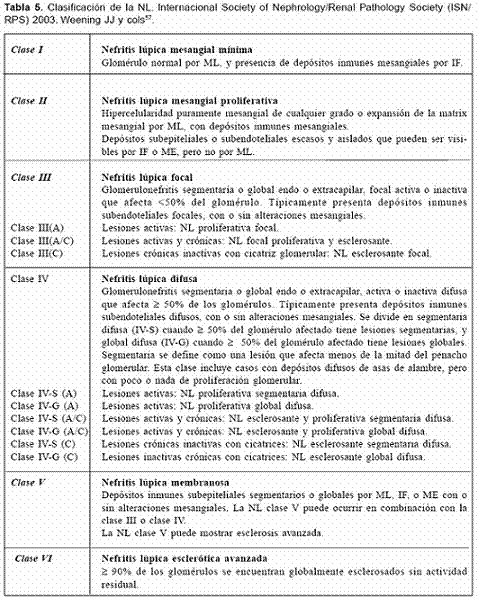
Esta clasificación tiene similitud con la de 1974, pero incluye varias modificaciones con respecto a diferencias cuantitativas y cualitativas entre las lesiones de clase III y de clase IV. No obstante, las recomendaciones hechas son57:
• Un reporte del patólogo de los hallazgos vasculares o tubulointersticiales.
• La biopsia debe incluir al menos 10 glomérulos para el análisis al microscopio de luz con el fin de excluir una lesión focal59.
• Los hallazgos a la microscopía electrónica e inmunofluorescencia deben ser reportados; igualmente, se deben realizar tinciones para los diferentes isotipos de inmunoglobulinas (Igs), IgG, IgM, IgA, cadenas livianas Kapa y lambda y los componentes del complemento, C3 y C1q.
Los depósitos glomerulares de complejos inmunes detectados por inmunofluorescencia casi siempre contienen un predominio de IgG policlonal, así como C3 y la mayoría de las veces C1q, aunque también pueden presentarse depósitos de IgA e IgM en forma variable57, 58.
Las definiciones establecidas para los términos diagnósticos en la nueva clasificación son57:
• Difusa: lesión que compromete = 50% del glomérulo.
• Focal: lesión que compromete < 50% del glomérulo.
• Global: lesión que compromete más de la mitad de los glomérulos.
• Segmentaria: una lesión que compromete menos de la mitad de los glomérulos.
• Hipercelularidad mesangial: por lo menos tres células mesangiales por región mesangial en una sección de un grosor de tres micrones.
• Proliferación endocapilar: hipercelularidad endocapilar debido a un infiltrado de células mesangiales, células endoteliales, y monocitos, lo cual produce una disminución de la luz de los capilares glomerulares.
• Proliferación extracapilar o media luna celular: proliferación celular extracapilar de más de dos capas celulares que ocupan un cuarto o más de la circunferencia de la cápsula glomerular.
• Cariorrexis: presencia de núcleo fragmentado, picnótico y apoptótico.
• Necrosis: lesión caracterizada por fragmentación del núcleo o disrupción de la membrana basal glomerular, a menudo asociada con material rico en fibrina.
• Trombo hialino: material eosinofílico intracapilar de consistencia homogénea compuesto por depósitos inmunes según los hallazgos a la inmunofluorescencia.
• Proporción de glomérulo comprometido: indica el porcentaje de glomérulos totales afectados por la NL, lo cual incluye a los glomérulos esclerosados debido a la NL y excluye a los glomérulos isquémicos debido a una inadecuada perfusión por una patología vascular no lúpica.
NL clase I: se define como una NL mesangial mínima con acúmulo mesangial de complejos inmunes identificados por inmunofluorescencia, o por microscopía electrónica, sin alteraciones en la microscopía de luz. La falta de anormalidades renales en la microscopía de luz, inmunofluorescencia y microscopía electrónica no clasifica más como una clase I y en este aspecto la clasificación cambia con respecto a la establecida por la OMS en 197457.
NL clase II: se define como una NL mesangial proliferativa, la cual se caracteriza por cualquier grado de hipercelularidad mesangial y la presencia de depósitos inmunes mesangiales. En algunos casos de NL clase II pueden detectarse escasos y pequeños depósitos inmunes en la pared capilar. Sin embargo, la presencia de depósitos subendoteliales amerita la designación de NL clase III o IV, según su extensión y distribución. Igualmente, la presencia de cualquier cicatriz glomerular global o segmentaria que sea interpretada como una secuela de una lesión previa, caracterizada por proliferación endocapilar, necrosis o medias lunas, debe ser interpretada como una NL clase III o IV según el número de glomérulos cicatrizados57.
NL clase III: se define como una NL focal en la cual hay compromiso de menos del 50% del glomérulo. Por lo general el glomérulo afectado presenta lesiones proliferativas endocapilares segmentarias o cicatrices glomerulares inactivas, con o sin necrosis de la pared capilar y presencia de medias lunas, así como de depósitos subendoteliales usualmente en una distribución segmentaria. Las lesiones focales del glomérulo pueden acompañarse de alteraciones mesangiales (proliferación mesangial o depósitos inmunes mesangiales)57.
NL clase IV: se define como una NL difusa en la cual hay un compromiso del 50% o más, del glomérulo. En el glomérulo afectado, las lesiones pueden ser segmentarias (si respetan al menos la mitad del penacho glomerular) o globales (si afectan más de la mitad del penacho glomerular). Esta clase se divide en: NL segmentaria difusa (clase IV-S), cuando más del 50% del glomérulo afectado presenta lesiones segmentarias y NL global difusa, cuando más del 50% del glomérulo afectado presenta lesiones globales. La clase IV-S presenta proliferación endocapilar segmentaria con o sin necrosis. La clase IV-G se caracteriza por proliferación mesangiocapilar, extracapilar, endocapilar global y difusa o por la presencia difusa de asas de alambre. Cualquier lesión activa puede presentarse en NL clase IV-G, entre las que se incluyen la presencia de cariorrexis, necrosis de las asas capilares y la formación de medias lunas. En esta categoría también deben incluirse casos en los que se presentan depósitos glomerulares subendoteliales de manera difusa y global, con poca o ninguna proliferación. Tanto en el reporte histológico de la NL clase III como en el de la clase IV se deben describir tanto los parámetros de actividad como los de cronicidad (Tabla 6), el compromiso vascular y tubulointersticial, así como la proporción de glomérulos afectados por lesiones crónicas y activas, por necrosis fibrinoide y por la presencia de medias lunas57.

NL clase V: ésta se define como una NL membranosa con depósitos inmunes subepiteliales y granulares, globales o segmentarios. En la NL clase V, puede presentarse cualquier grado de hipercelularidad mesangial. La presencia de depósitos inmunes subendoteliales dispersos puede ser identificada mediante inmunofluorescencia o microscopía electrónica. Si se detectan depósitos subendoteliales, se debe considerar una forma de NL clase V combinada con NL clase III o clase IV, según su distribución57.
NL Clase VI: se define como una NL esclerosante avanzada y se presenta cuando hay una glomeruloesclerosis global mayor o igual al 90%; no debe haber evidencia de una enfermedad glomerular activa y puede representar un estadio avanzado de las clases III, IV o V57.
Patrones mixtos y transformaciones
Las diferentes clases de NL pueden representar diferentes puntos en la evolución de la enfermedad. La transformación de una clase a otra puede ocurrir de manera espontánea o debido al tratamiento; es difícil determinar la incidencia de transformaciones espontáneas, debido a los pocos estudios sobre biopsias seriadas en pacientes no tratados; sin embargo, esos estudios sugieren que las transformaciones son comunes. Las transformaciones más significativas son aquellas hacia la clase IV. Un cambio espontáneo a formas más severas como lesiones clase III o clase IV, se manifiesta clínicamente por un aumento significativo en la proteinuria o un deterioro súbito en la función renal; la trasformación de una clase III o IV a una clase II se caracteriza por mejoría en la función renal y en el grado de proteinuria; las transformaciones de una clase II a formas más severas como clase III o IV ocurren en menos del 5% de los pacientes con lesiones clase II en la biopsia inicial, lo que confirma que las lesiones clase II son la forma más benigna de NL3, 58.
Índices de actividad y de cronicidad
Un sistema de puntaje de cronicidad y actividad fue desarrollado en el Instituto Nacional de Salud (NIH) (Tabla 6). A cada lesión se le asigna un puntaje de 0 a 3+ (ausente, leve, moderada, severa). El valor de necrosis, cariorrexis y medias lunas celulares se multiplica por un factor de 2. El puntaje máximo para el índice de actividad es de 24 y para el índice de cronicidad es de 1260. Algunos estudios han sugerido que la cuantificación mediante estos índices es de gran utilidad para evaluar el pronóstico en cada paciente; sin embargo, su aplicación es dependiente del observador57, 58, 60. Un alto índice de actividad predice el desarrollo de una enfermedad renal progresiva y un pobre pronóstico58.
Nefritis intersticial. Su incidencia aumenta de un 14% en la NL clase II a un 50% en la NL clase IV61. Los infiltrados contienen linfocitos, células plasmáticas, neutrófilos y macrófagos con lesión tubular, la cual se caracteriza por atrofia y regeneración62. Las lesiones tubulointersticiales pueden ser secundarias a esclerosis e isquemia glomerular, pero en un 50% hay presencia de depósitos extraglomerulares de inmunoglobulinas, lo cual es sugestivo de una lesión tubular por complejos inmunes61. Hallazgos histológicos similares se observan en nefritis intersticial inducida por drogas o necrosis tubular aguda, lo cual es importante tener en cuenta al tomar una decisión terapéutica3.
Lesiones vasculares renales: la enfermedad vascular renal en el LES se divide en dos grupos grandes: lesiones que se acompañan de glomerulonefritis, las cuales son extensiones de una lesión por complejos inmunes hacia los vasos sanguíneos y la presencia de trombos de fibrina y plaquetas como manifestación de un estado hipercoagulable local o sistémico3.
La vasculitis lúpica con necrosis fibrinoide, infiltrados neutrofílicos y cariorrexis es un hallazgo poco usual en la biopsia renal; sin embargo, su prevalencia sería mayor si se considera en la definición de vasculitis hallazgos como necrosis glomerular (capilaritis), cambios fibrinoides y depósitos inmunes en los vasos63. Por otra parte, los trombos de fibrina presentes en los capilares glomerulares pueden ser producidos por los mismos mecanismos inmunopatogénicos que causan inflamación y necrosis del glomérulo64.
Las coagulopatías asociadas con trombosis vascular y glomerular renal en LES son el síndrome antifosfolípido, el síndrome hemolítico urémico y la púrpura trombótica trombocitopénica3.
Algunos autores han clasificado las lesiones vasculares intrarrenales de la NL en cinco grupos63-66:
1. “Vasculopatía lúpica” o cilindros microvasculares de Igs: es la presencia de trombos hialinos que ocluyen la luz de las arteriolas y/o capilares glomerulares; estos trombos hialinos son cromófilos, PAS positivo y característicamente no se acompañan de cambios inflamatorios en la pared vascular y por inmunofluorescencia contienen principalmente Igs y complemento.
2. Microangiopatía trombótica: se caracteriza por la presencia extensa de trombos de fibrina en las arterias y glomérulos; pueden hallarse también eritrocitos fragmentados y leucocitos en la luz vascular.
3. Vasculitis: es la presencia de necrosis fibrinoide de la pared arterial acompañada por un infiltrado de células inflamatorias.
4. Esclerosis vascular inespecífica: son lesiones que se caracterizan por un engrosamiento fibrótico de la íntima y arterioesclerosis. No hay presencia de necrosis, proliferación o trombosis.
5. Depósitos inmunes vasculares: depósitos granulares de Igs y complemento entre las células de músculo liso de la pared vascular. Estos depósitos pueden estar aislados o asociados con una de las lesiones vasculares previas.
Descombes et al. revisaron 169 biopsias renales donde encontraron que las lesiones vasculares más comunes fueron los cambios escleróticos inespecíficos, hallados en el 49,7% de las biopsias; los cilindros vasculares de Igs (“vasculopatía lúpica”) se encontraron en el 24,3% de las biopsias, mientras que la vasculitis y la microangiopatía trombótica fueron raras: 2,4% y 0,6% respectivamente65.
Correlación clínico-patológica
Los pacientes con NL clase I no tienen evidencia clínica de enfermedad renal y su pronóstico es excelente, a menos que haya una transformación a lesiones renales de mayor severidad3.
Los pacientes con NL clase II tienen mínima evidencia clínica de compromiso renal; un 25% de estos pacientes no presentan anormalidades urinarias; sin embargo, la mitad pueden tener una proteinuria que por lo general es menor de un gramo en orina de 24 horas; rara vez presentan un síndrome nefrótico, lo cual sería sugestivo de una transformación a formas más severas o de la presencia concomitante de una enfermedad de cambios mínimos; de igual manera, pueden presentar hematuria microscópica y en un tercio de los casos puede haber disminución de C3 y C4 y aumento en los títulos de anti DNA; la hipertensión es poco frecuente y cuando está presente es de fácil control; el nivel de creatinina sérica y el índice de filtración glomerular son normales3, 58, 67. Generalmente este tipo de NL es de buen pronóstico52.
Los pacientes con NL clase III presentan evidencia clínica de compromiso renal, caracterizado por hematuria y/o proteinuria aislada o como un síndrome nefrótico o nefrítico; el síndrome nefrótico se presenta entre un 25% y un 30%; la hipertensión arterial y un sedimento urinario activo son comunes y un cuarto de los pacientes pueden tener un aumento en las cifras de creatinina sérica al momento de presentación; hallazgos serológicos de actividad lúpica como la disminución de C3 y C4 y el aumento en los títulos de anti DNA se pueden presentar hasta en un 80%. Los pacientes con un compromiso menos extenso y con menos hallazgos de necrosis preservan la función renal y pueden estar normotensos3, 58, 67.
Los pacientes con NL clase IV usualmente presentan enfermedad sistémica activa y la enfermedad renal con frecuencia domina el cuadro clínico, manifestándose en algunos casos como una glomerulonefritis rápidamente progresiva. El pronóstico es pobre, aún con tratamiento. El complemento se encuentra disminuido y los títulos de anticuerpos anti DNA están elevados; el sedimento urinario es activo (hematuria, cilindros hemáticos y otros cilindros celulares); generalmente todos los pacientes presentan proteinuria y en el 50% hay un síndrome nefrótico; sin embargo en algunas series su frecuencia puede ser aún más alta, hasta un 90%. La hipertensión arterial es común y la insuficiencia renal puede ser evidente hasta en el 82% de los casos3, 58.
La NL clase V, membranosa pura, característicamente se presenta como un síndrome nefrótico; la proteinuria en rango nefrótico se presenta en el 60% a 70% de los pacientes; sin embargo, un 40% de los pacientes pueden tener una proteinuria menor de 3 gramos al día y un 16% a 20% menor de 1 gramo al momento de realizar la biopsia; el complemento sérico puede estar normal y los anticuerpos anti DNA pueden ser negativos; sin embargo, aunque la actividad serológica es por lo general leve, algunos casos presentan hipocomplementemia y títulos altos de anti DNA, especialmente en formas membranoproliferativas, en las cuales también hay deterioro de la función renal; la nefropatía membranosa pura se asocia con bajos índices de deterioro de la función renal. El síndrome nefrótico persistente es un riesgo para eventos cardiovasculares y tromboembólicos58, 52, 67, 68.
La NL clase VI se manifiesta como una insuficiencia renal severa e hipertensión arterial en todos los casos; por lo general no hay actividad lúpica y aunque las lesiones son escleróticas sin actividad, estos pacientes pueden tener hematuria microscópica y bajos niveles de una proteinuria crónica3, 52, 58.
De acuerdo con lo mencionado, la presencia de depósitos inmunes subendoteliales (clase III, o clase IV) se correlaciona con una alta incidencia de proteinuria pesada e insuficiencia renal, independiente de si el patrón de celularidad es focal o difuso. Por su parte, la localización de depósitos inmunes en la zona mesangial (clase II) o subepitelial (clase V) se asocia con bajos índices de deterioro de la función renal58.
Manejo de la nefritis lúpica
El manejo óptimo varía según el tipo de NL; es importante siempre considerar el riesgo-beneficio del tratamiento inmunosupresor, pues quienes presentan una enfermedad renal terminal no se beneficiarán; de igual manera, los pacientes con NL clase I no requieren un manejo específico.
Nefritis mesangial (clase II): no hay estudios controlados sobre el manejo de la NL mesangial. Algunas lesiones mesangiales no requieren tratamiento específico; sin embargo, algunos pacientes que presentan proteinuria mayor de 1 gramo en orina de 24 horas, altos títulos de anti-DNA nativo y bajos niveles de C3 reciben tratamiento con dosis moderadas de glucocorticoides (GCs) (prednisona 20 mg/día) por dos a tres meses seguidos de un descenso gradual según la respuesta clínica1, 35, 69. Sin embargo, altas dosis de prednisona, 1 mg/kg/día, por uno a dos meses seguidos de un descenso gradual, están indicadas en una minoría de pacientes que desarrollan un síndrome nefrótico y compromiso en la función renal. En aquellos que no responden al tratamiento, se recomienda realizar una biopsia renal para establecer si ha ocurrido una transformación a formas más severas y por lo tanto determinar si es necesario un manejo inmunosupresor más intenso, como el establecido para las formas proliferativas1, 35, 69.
Nefritis proliferativa focal o difusa (clases III y IV): ambas se tratan igual, pues tienen pronósticos similares. El manejo inmunosupresor debe ser agresivo, ya que el riesgo de enfermedad renal terminal a 10 años puede ser mayor del 50%. El manejo establecido para la nefritis proliferativa consta de dos fases: una de inducción y otra de mantenimiento. El tratamiento estándar es el protocolo establecido por el Instituto Nacional de Salud (NIH). (Tabla 7)70, 71.

Terapia de inducción: el objetivo es inducir la remisión [estabilización o mejoría en la función renal, sedimento inactivo, proteinuria < 1g/día y normalización (idealmente) del complemento C3 por al menos seis meses]72. El tratamiento inicial utilizado con más frecuencia es prednisona combinada con pulsos venosos mensuales de ciclofosfamida; la ciclofosfamida diaria para administración oral también ha sido utilizada pero con menos frecuencia por la alta toxicidad73-75. La inclusión de ciclofosfamida al manejo se asocia con una mayor preservación de la función renal a largo plazo y con remisiones más estables que lo logrado únicamente con GCs. Los estudios clínicos realizados por los investigadores del NIH demostraron que la terapia de inducción con pulsos mensuales de ciclofosfamida intravenosa (0.75 – 1g/m2) durante seis meses, seguido por pulsos trimestrales era más efectivo que los GCs como único tratamiento y se asoció con menos efectos adversos que el tratamiento con ciclofosfamida oral73, 76, 77. La extensión de los pulsos de ciclofosfamida con pulsos trimestrales por dos años disminuyó el índice de recaídas pero a su vez aumentó el riesgo de falla ovárica, si se compara con el tratamiento que sólo incluye los primeros seis pulsos mensuales76. Sin embargo, este régimen terapéutico se asocia con efectos adversos como: infección, leucopenia, toxicidad gonadal, herpes zoster, cistitis hemorrágica y predisposición a neoplasias75.
Los pulsos intravenosos de metilprednisolona =10 mg/kg/día (1g/día por tres días consecutivos seguidos por un pulso mensual por 12 meses) son menos efectivos que los pulsos venosos mensuales de ciclofosfamida [(0,5 – 1 g/m2) por seis meses consecutivos y luego cada tres meses por dos años más]. Sin embargo, la combinación de estos dos regímenes mostró una tendencia hacia una respuesta renal más rápida y una mayor probabilidad de remisión, por lo cual es una buena alternativa en las formas más agresivas de nefritis lúpica, pero con un mayor riesgo de efectos adversos. La remisión se obtuvo en el 85% de los pacientes que recibieron tanto pulsos de metilprednisolona como de ciclofosfamida, en el 62% de los que recibieron pulsos de ciclofosfamida y sólo en el 29% de quienes recibieron pulsos de metilprednisolona77.
Debido a los efectos adversos y la baja tolerancia a los esquemas que utilizan pulsos de ciclofosfamida a altas dosis, se ha estudiado la eficacia de pulsos venosos de ciclofosfamida a bajas dosis. Entre estos estudios se destacan los del Hospital San Tomás y el estudio de nefritis del Euro-Lupus78, 79.
El régimen utilizado por el grupo del Hospital San Tomás de Londres consistió en pulsos intravenosos semanales de 500 mg de ciclofosfamida [una mediana de tres pulsos semanales por paciente], más GCs como tratamiento inicial; una vez obtenida remisión parcial o completa, los pacientes pasaron a una terapia de mantenimiento con azatioprina, 2mg/kg/día, o con ciclofosfamida oral, 2mg/kg/día; el tratamiento de mantenimiento se inició una a dos semanas luego del último pulso de ciclofosfamida; en este estudio, la terapia con pulsos semanales de ciclofosfamida a bajas dosis como terapia de inducción, seguida por azatioprina fue útil en pacientes con NL proliferativa difusa para preservar la función renal, además en este régimen no se presentó falla ovárica, mientras que cuatro (57%) pacientes tratados con ciclofosfamida oral presentaron falla ovárica80, 81. De igual manera, el grupo del Hospital San Tomás revisó posteriormente la eficacia de los pulsos de ciclofosfamida intravenosa (500 mg) a bajas dosis semanales en pacientes con enfermedades del tejido conectivo, de los cuales 26 tuvieron NL, 22 de ellos NL proliferativa confirmada por biopsia; una vez alcanzada la remisión, se inició terapia de mantenimiento con azatioprina (2 mg/kg/día) si la remisión fue completa, o pulsos mensuales de ciclofosfamida (500 mg) si la remisión fue parcial o no hubo respuesta. La eficacia de los pulsos de ciclofosfamida a bajas dosis fue similar a la de los pulsos mensuales de ciclofosfamida a altas dosis, con buena tolerancia y menos efectos adversos y sin casos de falla ovárica prematura78.
El estudio del Euro-Lupus comparó la eficacia de un régimen de inducción con pulsos ciclofosfamida intravenosa a dosis bajas (seis pulsos de 500 mg cada 15 días) contra otro régimen de pulsos de ciclofosfamida intravenosa a dosis altas (seis pulsos mensuales seguidos por dos pulsos trimestrales); la dosis de ciclofosfamida utilizada en el régimen de dosis altas fue inicialmente de 0,5 g/m2 hasta 1500 mg por pulso según el recuento de leucocitos 14 días luego de cada pulso. Todos los pacientes recibieron tres pulsos iniciales de metilprednisolona (750 mg venosos) seguidos de prednisona oral (0,5 - 1 mg/kg/día) por cuatro semanas y con un posterior descenso gradual de la dosis. En ambos grupos la terapia de mantenimiento se continuó con azatioprina (2 mg/kg/día), la cual se inició dos semanas luego del último pulso de ciclofosfamida. Los resultados obtenidos con el régimen de dosis bajas de ciclofosfamida son similares al de dosis altas con respecto a la probabilidad de lograr remisión renal (71% y 54% respectivamente, pero sin significancia estadística), al número de recaídas renales (27% y 29%, respectivamente); las infecciones severas fueron más frecuentes con dosis altas, pero no hubo significancia estadística. Sin embargo, en este estudio se debe tener en cuenta que el 84% de los pacientes eran blancos, en quienes el pronóstico es más favorable y la severidad clínica e histológica es menor con respecto a otros grupos étnicos (negros e hispanos)79.
También se han utilizado regímenes de inducción con ciclofosfamida oral. Chan y cols. lograron remisión completa en el 77% de los pacientes con nefritis proliferativa y membranosa tratados inicialmente con prednisona y ciclofosfamida oral, seguidos luego por dosis bajas de prednisona y azatioprina. La incidencia de efectos adversos como cistitis hemorrágica y amenorrea permanente posiblemente se relacionan más con la duración del tratamiento que con la vía de administración75. Mok y cols. realizaron un estudio comparativo entre dos regímenes con ciclofosfamida para el manejo de nefritis proliferativa difusa; en el primero los pacientes recibieron seis pulsos mensuales de ciclofosfamida venosa (0,75 - 1g) seguidos de seis pulsos trimestrales y en el segundo recibieron ciclofosfamida oral 50-100 mg/día por seis meses seguidos por azatioprina por otros 18 meses; los resultados de este estudio mostraron una mayor eficacia con ciclofosfamida oral seguida por azatioprina que con los pulsos de ciclofosfamida; sin embargo, la toxicidad fue mayor; se obtuvo remisión ya sea parcial o completa en el 90% de los pacientes tratados con ciclofosfamida oral y en el 73% de los que recibieron ciclofosfamida venosa, mientras que las recaídas se presentaron con ciclofosfamida oral en un 5% y con pulsos de ciclofosfamida venosa en un 14%; sin embargo, las diferencias no fueron estadísticamente significativas82.
El índice de recaídas luego del tratamiento de la nefritis proliferativa difusa con ciclofosfamida varía entre el 10 y el 66% en varios estudios, dependiendo de la severidad de la nefritis, los regímenes terapéuticos utilizados, la duración del seguimiento y la definición utilizada para recaída; además, hasta un 22% de los pacientes con nefritis proliferativa son refractarios a la ciclofosfamida83. Un 45% de los pacientes que logran remisión parcial o completa después de recibir metilprednisolona venosa, ciclofosfamida venosa o la combinación de ambos regímenes, tienen recaídas renales luego de un seguimiento de 117 meses84.
El mofetil micofenolato (MMF) es una alternativa efectiva al tratamiento de inducción con ciclofosfamida. Chan y cols. compararon dos regímenes terapéuticos para nefritis proliferativa. El primer grupo recibió MMF 1 gramo dos veces al día por seis meses y el segundo grupo ciclofosfamida oral 2,5 mg/kg/día por seis meses; ambos grupos recibieron prednisolona 0,8 mg/kg/día, la cual fue disminuida hasta 10 mg/día en seis meses. Para la terapia de mantenimiento, los pacientes tratados con MMF disminuyeron la dosis a 1 gramo diario, mientras que quienes recibieron ciclofosfamida fueron manejados con azatioprina (2,5 mg/kg/día). La duración del estudio fue de 12 meses, luego de lo cual se suspendió el MMF y se inició azatioprina (1 mg/kg/día) y en el segundo grupo la dosis de azatioprina a los 12 meses se disminuyó a 1 mg/kg/día. La remisión completa [proteinuria <0,3 g/24 horas, sedimento urinario normal y un nivel sérico de creatinina estable (<15% de los valores basales)] se logró en el 81% y 76% de los pacientes que recibieron inducción con MMF y ciclofosfamida respectivamente, mientras que la frecuencia de eventos adversos fue mayor con ciclofosfamida85.
En otro estudio, Appel y cols. compararon inducción con MMF contra ciclofosfamida intravenosa; el 21% de los pacientes tratados con MMF tuvieron remisión completa mientras que el 6% de quienes recibieron ciclofosfamida intravenosa lograron remisión completa; este estudio muestra una superioridad del MMF con respecto a la ciclofosfamida intravenosa; sin embargo, los índices de remisión fueron mucho menores que los del grupo de Chan y cols, posiblemente por diferencias raciales, la severidad clínica e histológica de ambos estudios y la ruta de administración (oral frente a intravenosa)86, 87.
Recientemente, Ginzler y cols. realizaron un estudio abierto, aleatorizado durante un período de 24 semanas, en el cual compararon el uso de MMF (dosis inicial de 1 gramo al día seguido de un aumento hasta 3 gramos al día), con pulsos mensuales de ciclofosfamida intravenosa (0,5 gramos/m2 hasta 1 gramo/m2) como tratamiento de inducción para NL activa (clase III, IV, V, o membrano-proliferativa). La remisión completa se obtuvo en el 22,5% de quienes recibieron MMF y en el 5,8% de los tratados con ciclofosfamida (p = 0,005); por otra parte, la remisión parcial se presentó en el 29,6% y en el 24,6%, de los tratados con MMF y ciclofosfamida, respectivamente. En este estudio de 24 semanas, el MMF fue mejor tolerado y más efectivo que la ciclofosfamida en inducir remisión de la NL88. Sin embargo, se debe tener en cuenta que en este estudio se excluyeron pacientes con una depuración de creatinina < 30 ml/min, lo cual excluye pacientes con una enfermedad más severa (por ejemplo, aquellos con una glomerulonefritis rápidamente progresiva o una falla renal aguda severa), quienes podrían tener una respuesta más rápida con ciclofosfamida venosa; debido a que el MMF no ha sido adecuadamente estudiado en los pacientes con glomerulonefritis rápidamente progresiva o falla renal aguda, es preferible utilizar en esta población bolos de ciclofosfamida y corticosteroides. Por otra parte, en pacientes con una nefritis leve a moderada y una función renal preservada, para quienes la fertilidad es de suprema importancia, es razonable el uso de MMF89.
Terapias de mantenimiento: los estudios controlados del NIH, descritos previamente, establecieron que la terapia prolongada con ciclofosfamida intravenosa era la más efectiva para la NL proliferativa (Tabla 7)73, 76, 77; la probabilidad acumulativa de permanecer sin falla renal crónica a 72 meses varió entre un 75% y un 100%; sin embargo, la incidencia de amenorrea en mujeres jóvenes tratadas fue alta (29% a 57%)87, 90.

Debido a la alta toxicidad asociada con una terapia prolongada con pulsos de ciclofosfamida, se han utilizado otros inmunosupresores como la azatioprina y el MMF como terapia de mantenimiento.
Un estudio controlado comparó la eficacia y seguridad de los pulsos trimestrales de ciclofosfamida intravenosa, MMF y azatioprina como terapia de mantenimiento, luego de una terapia de inducción con cuatro a siete pulsos de ciclofosfamida (0,5 - 1 g/m2). La población consistió principalmente de hispanos y afro-americanos, en quienes la nefritis proliferativa es más severa, mientras que sólo el 5% eran blancos; el índice de sobrevida libre de recaídas fue mayor con MMF que con ciclofosfamida (p= 0,02); la probabilidad de permanecer libre de eventos como falla renal crónica y la muerte fue mayor con MMF (89%) y azatioprina (80%) que con pulsos trimestrales de ciclofosfamida (45%). La terapia de mantenimiento con MMF o azatioprina se asociaron con una menor incidencia de infecciones severas (2% en MMF, 2% en azatioprina y 25% en ciclofosfamida venosa) y también una menor incidencia de amenorrea sostenida (6% en MMF, 8% en azatioprina y 32% en ciclofosfamida venosa)91.
La terapia de mantenimiento con azatioprina también ha sido evaluada en el estudio del Euro-Lupus y en una población de pacientes asiáticos, lo cual se asoció con menos efectos secundarios y una eficacia similar a los esquemas tradicionales del NIH79, 85. Actualmente, la terapia de mantenimiento con azatioprina o MMF luego de un manejo de inducción con ciclofosfamida en un régimen secuencial son alternativas eficaces y seguras.
Nefropatía membranosa: hasta el momento no hay recomendaciones sólidas basadas en la evidencia para el menejo de la NL membranosa (NLM); sin embargo, se debe tener en cuenta que estos pacientes cursan con un alto riesgo cardiovascular, debido al síndrome nefrótico. Por lo tanto se requieren medidas terapéuticas como el control de la presión arterial, el manejo de la proteinuria con bloqueadores del receptor de la angiotensina y/o de la enzima convertidora de angiotensina, así como el manejo de la dislipidemia con dieta y estatinas; los pacientes con nefropatía membranosa tienen un alto riesgo de tromboembolismo, especialmente cuando los niveles séricos de albúmina son menores de 2g/dl; la iniciación y la duración de la anticoagulación es un tema controvertido. Algunos clínicos recomiendan anticoagulación profiláctica en todos los pacientes con nefropatía membranosa, mientras que otros sólo la reservan cuando los niveles de albúmina sérica son menores de 2g/dl; sin embargo, no hay datos suficientes para definir el riesgo-beneficio de esta conducta68, 92.
Tratamiento inmunosupresor: los esquemas terapéuticos utilizados provienen de extrapolaciones de estudios realizados en nefropatía membranosa idiopática y en estudios pequeños no controlados en NLM (Tabla 8).

Glucocorticoides: no hay estudios controlados que avalúen los efectos de los GCs en la NLM; sin embargo, muchos pacientes con NLM y proteinuria de alto grado y/o insuficiencia renal progresiva reciben un manejo empírico con GCs, particularmente altas dosis de prednisona en días alternos por dos a cuatro meses.
Azatioprina: la combinación de prednisona y azatioprina puede ser una alternativa terapéutica efectiva. Mok y cols. realizaron un estudio abierto en el que evaluaron el manejo de la NLM con prednisona (0,8 - 1 mg/kg/día por seis a ocho semanas con un desenso posterior hasta 10 mg/día) y azatioprina (1 - 2 mg/kg/día). A los 12 meses el 67% de los pacientes lograron remisión completa y el 22% remisión parcial; las recaídas se presentaron en el 19% de los pacientes, luego de siete años de seguimiento93.
Agentes alquilantes: Maroni y cols. realizaron un estudio retrospectivo en pacientes con NLM; un grupo de pacientes fueron tratados con GCs únicamente, mientras otro grupo fue tratado durante seis meses con un régimen en el cual se alternan cada mes glucocorticoides (1 gramo venoso de metilprednisolona por tres días consecutivos, seguido de prednisona 0,5 mg/kg/día por 27 días los meses 1, 3 y 5) y clorambucil (0,2 mg/kg/día por 30 días los meses 2, 4 y 6). Los pacientes tratados con ciclos alternantes de GCs y clorambucil tuvieron índices más favorables de remisión parcial o completa del síndrome nefrótico (100%) que los pacientes tratados con GCs (50%)94. En otro estudio, Chan y cols. utilizaron un régimen inmunosupresor con prednisona (0,8 mg/kg/día seguido de descenso gradual hasta 10 mg/día como dosis de mantenimiento) y ciclofosfamida oral (2 – 2,5 mg/kg/día) por seis meses, seguida por azatioprina (2 mg/kg/día) como terapia de mantenimiento. A los 12 meses de tratamiento el 55% de los pacientes obtuvieron remisión completa y el 35% remisión parcial95.
Ciclosporina: el tratamiento de la NLM con ciclosporina (2,5 - 5 mg/kg/día) al menos durante 12 meses ha sido efectivo en disminuir la proteinuria y mejorar los parámetros inmunológicos; sin embargo, se requieren estudios controlados para establecer si el manejo de la NLM con ciclosporina mejora el pronóstico y previene la progresión a insuficiencia renal crónica terminal91, 96.
En un estudio controlado prospectivo, la combinación de inmunosupresores (ciclofosfamida o ciclosporina) con prednisona fue más efectiva que la monoterapia con prednisona en inducir remisión renal; en un seguimiento prolongado, las remisiones tienden a ser más duraderas con ciclofosfamida que con ciclosporina97, 98.
Medidas utilizadas para evaluar la eficacia terapéutica
Se han utilizado diferentes medidas para evaluar la eficacia del tratamiento inmunosupresor en NL: remisión, respuesta y recaídas o exacerbaciones.
La respuesta al tratamiento o remisión representan una mezcla de medidas clínicas y de laboratorio (función renal, uroanálisis y proteinuria); en la interpretación de algunos hallazgos de laboratorio, se debe tener en cuenta que la proteinuria o hematuria fija pueden ser por previo daño glomerular irreversible y no por actividad; en este caso, estos hallazgos no deberían atribuirse a una falta de eficacia terapéutica y en tal caso sería útil realizar una biopsia renal99.
Boumpas y Balow establecieron las siguientes definiciones tanto para remisión como para respuesta renal99:
• Remisión: estabilización o mejoría en la función renal, resolución de las anormalidades presentes en el sedimento urinario [ausencia de hematuria (< 5 eritrocitos por campo de alto poder) y de cilindros celulares], proteinuria < 1 gramo al día y normalización (idealmente) del complemento (C3) por lo menos durante seis meses.
• Respuesta: estabilización o mejoría en la función renal, disminución ³ 50% en la hematuria, pero siempre menor de 10 eritrocitos por campo de alto poder y cambios significativos en la proteinuria (disminución ³ 50% si los valores iniciales estaban en un rango nefrótico, pero no menores de 3 gramos al día; £ 1 gramo al día sí los valores iniciales estaban en un rango no nefrótico) por al menos seis meses.
Las definiciones propuestas para establecer una recaída o exacerbación de la actividad en NL son las siguientes99, 100:
• Recaída o exacerbación proteinúrica: incremento mayor de 2 gramos en la proteinuria de 24 horas, duplicación de la proteinuria si ésta es mayor de 3,5 gramos/día luego de una respuesta al tratamiento.
• Recaída o exacerbación nefrítica:
- Leve: aumento en la actividad del sedimento urinario (incremento en la hematuria de = 50% y = 5 eritrocitos por campo de alto poder con o sin reaparición de cilindros celulares).
- Moderada: aumento en la actividad del sedimento urinario como se define en el punto anterior, más un aumento en la proteinuria de mayor o igual a 2 gramos al día o duplicación de la proteinuria si ésta es mayor de 3,5 gramos / día.
- Severa: aumento en la actividad del sedimento urinario como se define en los puntos anteriores y un aumento del 30% en los valores séricos de creatinina en un período menor o igual a seis meses.
Estos valores deben corresponder al promedio de dos o más medidas con al menos un mes de diferencia entre ellas.
Recientemente el subcomité para la enfermedad renal del Colegio Americano de Reumatología estableció unos criterios de respuesta para NL proliferativa y membranosa en estudios clínicos terapéuticos, los cuales deben estar estables por lo menos durante tres meses101:
Los criterios de respuesta para la función renal estimados según la tasa de filtración glomerular (RFG)101:
• Mejoría de la función renal: aumento del 25% en la RFG (asumiendo que la RFG de base es anormalmente baja: < 75 ml/min).
• Función renal estable: si los valores estimados de la RFG son estables.
• Empeoramiento de la función renal: disminución de = 25% de la RFG estimada o presencia de enfermedad renal terminal.
Para establecer los criterios de respuesta para los niveles de proteínas en orina se utilizó la relación proteínas en orina/creatinina en orina. Los niveles de proteínas en orina se miden en una muestra de esta y se calculan en gm/dl y el nivel de creatinina en orina se determina en mg/dl101:
• Mejoría: disminución de por lo menos un 50% de la relación proteínas en orina/cretinina urinaria.
• Respuesta parcial: cumple con los criterios de mejoría, y la relación proteínas en orina/creatinina en orina es de 0,2 – 2,0.
• Respuesta completa: cumple con los criterios de mejoría, y la relación proteínas en orina/creatinina en orina es < 0,2.
• No cambios.
• Empeoramiento: aumento en un 100% de la relación proteínas en orina/creatinina urinaria.
Con respecto al sedimento urinario el comité definió criterios de respuesta que describen tanto la mejoría como el empeoramiento de éste101:
• Mejoría: un cambio de un sedimento urinario activo (> 5 eritrocitos por campo de alto poder, > 5 leucocitos por campo de alto poder y/o ³ 1 cilindro celular) a un sedimento urinario inactivo (£ 5 eritrocitos por campo de alto poder, £ 5 leucocitos por campo de alto poder y ausencia de cilindros celulares).
• Empeoramiento: presencia de un sedimento urinario activo en un paciente cuyo sedimento urinario previo era inactivo, excluyendo otras posibles causas.
Otras terapias
Gammaglobulina intravenosa
La gammaglobulina intravenosa se ha utilizado en NL membranosa y proliferativa refractaria con resultados favorables, caracterizados por una reducción en la proteinuria y en los niveles séricos de creatinina103, 104; el uso de gammaglobulina intravenosa también lleva a un riesgo de desarrollar falla renal aguda, debido a una nefrosis osmótica, la cual ha sido atribuida a la gran cantidad de sucrosa utilizada como preservativo en algunos productos de gammaglobulina con el fin de reducir la agregación de las inmunoglobulinas102-104.
Plasmaféresis
Algunos investigadores han utilizado la plamaféresis con dosis altas de ciclofosfamida y GCs orales con el fin de remover autoanticuerpos y estimular de nuevo las clonas de células B patogénicas, las cuales serían depletadas posteriormente por las acciones citotóxicas de la ciclofosfamida. Sin embargo, en diferentes estudios aleatorizados y controlados no han demostrado la superioridad del esquema consistente en aféresis más ciclofosfamida sobre los pulsos de ciclofosfamida en el manejo de la NL, aunque la adicición de la aféresis se asoció con una remisión más rápida105-107. Se ha reportado de manera anecdótica con algún éxito, el uso de plasmaféresis en glomerulonefritis rápidamente progresiva o formas refractarias de NL al tratamiento estándar; sin embargo, la plasmaféresis se utilizó con otros regímenes terapéuticos agresivos, lo cual hace difícil diferenciar el efecto per se de la plasmaféresis108, 109. Hasta el momento, el uso de plasmaféresis no ha demostrado claros beneficios en el manejo de las formas severas de NL.
Anti CD 20 (Rituximab)
El rituximab (MabThera / Rituxan) es un anticuerpo monoclonal quimérico dirigido contra el receptor CD20 de los linfocitos B, y es el primer anticuerpo monoclonal aprobado para el tratamiento del linfoma no Hodgkin de células B CD20+ refractario110, 111. Las células B, por definición, son la fuente de todas las inmunoglobulinas y por lo tanto tienen un papel importante en la autoinmunidad mediada por anticuerpos y juegan un papel clave en la respuesta contra antígenos tanto directamente, como células presentadoras de antígenos como indirectamente, a través de la activación de otras células presentadoras de antígenos. Debido a que las células B contribuyen a la patogénesis de las enfermedades autoinmunes, la depleción de éstas es un objetivo terapéutico en el manejo de estas entidades112-114. El receptor CD20 se expresa en la superficie de las células pre-B y en las células B maduras, mientras que las células madres, las células pro-B y las células plasmáticas no lo expresan. Rituximab produce una depleción de los subtipos de células B, que expresan el receptor CD20115. En el LES se ha utilizado en el manejo de enfermedad severa y refractaria al manejo inmunosupresor; en nefritis lúpica, el índice de remisión entre los pacientes reportados y tratados con rituximab es del 80%116-119. La depleción completa de células B periféricas puede durar entre tres y ocho meses luego de cuatro infusiones semanales de 375 mg/m2 de rituximab; los niveles totales de inmunoglobulinas y de anticuerpos protectores se preservan, mientras que los títulos de anti-DNA de doble cadena disminuyen, independiente de la respuesta clínica; es difícil establecer una apropiada evaluación de la eficacia del rituximab, ya que hay una gran heterogeneidad clínica en los diversos estudios, diferencias en las dosis y uso de terapias concomitantes, como ciclofosfamida en el 35% de los pacientes, así como el uso de GCs a dosis altas116, 120. Por otra parte, el desarrollo de anticuerpos antiquiméricos humanos (AAQH) neutralizantes pueden ser un problema en los pacientes con LES; en un estudio se detectó la presencia de altos títulos de AAQH en el 35% de los pacientes que recibieron tratamiento con rituximab, dos meses luego del tratamiento118. La administración concomitante de ciclofosfamida puede ayudar a reducir la incidencia de AAQH en pacientes con LES activo.
Aún no se han reportado complicaciones infecciosas serias relacionadas con el tratamiento con rituximab en pacientes con LES. Las reacciones que puedan presentarse durante la infusión pueden disminuirse mediante el uso de paracetamol y antihistamínicos como premedicación. Debido a la buena tolerabilidad del rituximab, actualmente ésta es una buena opción terapéutica para el manejo de nefritis lúpica refractaria121.
Tolerización de la célula B (LJP 394)
LJP 394 [abetimus sódico (Riquent)] es un constructo de cuatro epítopes de ADN de cadena doble unidos a una plataforma de polietilenglicol no inmunogénica. Esto lleva a una tolerancia de las células B por los enlaces cruzados de anticuerpos anti DNA de cadena doble en la superficie de las células B lo cual resulta en anergia o apoptosis; el LPJ 394 bloquea los anticuerpos anti DNA de cadena doble y evita el depósito de estos en el tejido renal. Aunque este agente es bien tolerado y disminuye los títulos de anticuerpos anti DNA de cadena doble en el LES, su eficacia clínica no ha sido probada y su uso como terapia de inducción o de mantenimiento apenas se está estudiando121-123.
LymphoStat B (Anti-BlyS ab)
El lymphoStat B (Belimumab) es un anticuerpo monoclonal humanizado dirigido contra el estimulador de los linfocitos B (BlyS); su mecanismo de acción es la inactivación e inhibición del estimulador inmune natural de los linfocitos B (BlyS); se han encontrado altos niveles de BlyS en el 20 a 40% de los pacientes con LES, artritis reumatoide y síndrome de Sjogren. En un estudio de fase I en 57 pacientes estables con LES, se encontró una reducción en las células B periféricas, pero no hubo un cambio en la actividad lúpica124, 125.
Bloqueo de coestimuladores
Anticuerpo monoclonal contra el CD40 ligando: el CD40 se encuentra en linfocitos B, células endoteliales y en células presentadoras de antígeno. Este interactúa con el CD40 ligando expresado en los linfocitos T CD4 ayudadores activos; la interacción entre CD40-CD40 ligando lleva a la proliferación y diferenciación de linfocitos B y es necesaria para la producción de anticuerpos y de citoquinas; por lo tanto el bloqueo de la vía CD40-CD40 ligando disminuye la producción de anticuerpos mediada por linfocitos T. En dos estudios de fase II con anti CD40 ligando no se encontraron resultados favorables, en uno de ellos no se demostró su eficacia en comparación con el placebo y otro estudio fue terminado prematuramente por la alta incidencia de eventos tromboembólicos122.
CTLA4-Ig (Abatacept): este agente biológico es una proteína de fusión derivada del dominio externo del antígeno 4 de los linfocitos T citotóxicos (CTLA4) y de la porción Fc de la IgG1. El CTLA-4, expresado en las células T activadas, es un receptor de alta afinidad por CD 80 y CD 86, los cuales se expresan en células presentadoras de antígeno y en células B. El CTLA4-Ig interfiere con la interacción de CD86 y CD80 en los linfocitos B con la molécula estimuladora CD28 en los linfocitos T y de esta manera inhibe la producción de anticuerpos71. En lupus múrido el CLA4-Ig mejora la proteinuria y prolonga la sobrevida; sin embargo, no hay estudios controlados en lupus humanos reportados hasta ahora122.
Inhibición del factor de necrosis tumoral
Los niveles de TNF a se correlacionan con actividad de la enfermedad en el LES126, 127. En un estudio piloto de seis pacientes con LES, cuatro de ellos tuvieron glomerulonefritis con pobre respuesta a ciclofosfamida, azatioprina o ciclosporina A, y se encontró que el infliximab (cuatro dosis de 300 mgs) fue efectivo en disminuir la proteinuria en estos pacientes128. Sin embargo, hubo un incremento en los títulos de anti DNA de doble cadena y de anticardiolipinas, lo cual generó cierto temor121.
Transplante autólogo de célula madre hematopoyética e inmunoablación
Esta forma de tratamiento se ha utilizado en pacientes con LES severo y refractario a la inmunosupresión y consiste en remover células madres hematopoyéticas antes de dar una dosis de ciclofosfamida inductora de aplasia (200 mg/kg) y globulina antitimocito o rituximab, lo cual es seguido por el transplante autólogo de célula madre117, 122, 125.
El Grupo Europeo para el Transplante de Medula Ósea (EBMT) y la Liga Europea contra el Reumatismo (EULAR) encontraron que el 66% de los pacientes entraban en remisión (SLEDAI <3) a los seis meses, 32% de los cuales presentaron recaídas posteriormente, mientras que la mortalidad fue del 12%122.
Conclusión
La NL es una de las más graves manifestaciones del LES, cuya presentación varía desde una proteinuria leve asintomática hasta una forma severa de glomerulonefritis rápidamente progresiva, siendo la NL proliferativa clase III o clase IV las formas más severas de presentación y que requieren un manejo inmunosupresor más agresivo con ciclofosfamida logrando un mejor control de la enfermedad, pero con una mayor toxicidad, por lo cual han surgido nuevas alternativas terapéuticas como MMF, el cual ha mostrado una eficacia comparable a la de la ciclofosfamida en terapias de inducción y de mantenimiento, con una menor toxicidad. La NL es un predictor de pobre pronóstico, y una causa importante de morbi-mortalidad tanto de manera directa como indirecta a través de las complicaciones derivadas del tratamiento inmunosupresor.
Referencias
1. Wallace DJ, Hahn BH, Klippel JH. Clinical and laboratory features of lupus nephritis. In: Dubois´Lupus Erythematosus, 4th Ed, edited by Wallace DJ, Hahn BH, Philadelpia, Lippincott Williams & Wilkins, 2002; 1077-1091. [ Links ]
2. Cameron JS. Lupus nephritis. J Am Soc Nephrol 1999; 10: 413-424. [ Links ]
3. Cameron JS. Clinical manifestations of lupus nephritis. In: Rheumatology and the kidney, edited by Adu D, Emery P, Madaio M, New York, Oxford University Press, 2001;17-32. [ Links ]
4. Cervera R, Khamastha MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al. Morbidity and mortality in systemic lupus erythematosus during a 5-year period. A multicenter prospective study of 1000 patients. Medicine 1999; 78: 148-166. [ Links ]
5. Cervera R, Khamastha MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al. Morbidity and mortality in systemic lupus erythematosus during a 10-year period. A comparison of early and late manifestations in a cohort of 1000 patients. Medicine 2003; 82: 299-308. [ Links ]
6. Wallace DJ, Podell TE, Weiner JM, et al. Lupus nephritis: experience with 230 patients in a private practice from 1950 to 1980. Am J Med 1982; 72: 209-220. [ Links ]
7. Mojcik CF, Klippel JH. End-stage renal disease and systemic lupus erythematosus. Am J Med 1996; 101: 100-107. [ Links ]
8. González-Crespo MR, López-Fernández JI, Usera G, Poveda MJ, Gómez-Reino JJ. Outcome of silent lupus nephritis. Semin Artritis Rheum 1996; 26: 468-476. [ Links ]
9. Zabaleta- Lanz M, Vargas-Arenas RE, Tápanes F, Daboin I, Atahualpa Pinto J, Bianco NE. Silent nephritis in systemic lupus erythematosus. Lupus 2003; 12: 26-30. [ Links ]
10. Wallace DJ, Podell T, Weiner JM, et al. Lupus nephritis. Experience with 230 patients in a private practice from 1950 to 1980. Am J Med 1982; 72: 209-220. [ Links ]
11. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25: 1271-1277. [ Links ]
12. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus [letter]. Arthritis Rheum 1997; 40: 1725. [ Links ]
13. Petri M. Epiemiology of systemic lupus erythematosus. Baillieres Clin Rheumatol 2002; 16: 847-858. [ Links ]
14. Cerón C, Molina J, Zambrano F. Nefropatía lúpica. Estudio de 156 casos. Latreia 1989; 2: 214-221. [ Links ]
15. Cervera R, Khamashta MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al. Systemic lupus erythematosus: clinical and immunologic patterns of disease expression in a cohort of 1000 patients. Medicine 1993; 72: 113-124. [ Links ]
16. Appel GB, D’Agati V. Renal involvement in systemic lupus erythematosus, mixed connective tissue disease, Sjogren’s syndrome, and rheumatoid arthritis. In Jennette CJ, Olson L, Schwartz MM, Silva F (eds): Pathology of the kidney, 5th ed. Philadelphia, Lippincott-Raven, 1998; 541-624. [ Links ]
17. Pons-Estel BA, Catoggio LJ, Cardiel MH, Soriano ER, Gentiletti S, et al. On behalf of the Grupo Latinoamericano de Estudio del Lupus (GLADEL). Medicine 2004; 83: 1-17. [ Links ]
18. Molina JF, Drenkard C, Molina J, Cardiel M, et al. Systemic Lupus Erythematosus: A study of 107 Latin American patients. Medicine 1996; 75: 124-129. [ Links ]
19. Senior JM, Pinto LF, Uribe O, De la Cruz OF, Ramírez LA. Nefropatía lúpica: correlación clinico-patológica y respuesta al tratamiento con pulsos de ciclofosfamida. Rev Col Reumatol 1994; 1: 19-27. [ Links ]
20. Anaya JM, Uribe M, Pérez A, Sánchez JF, Pinto LF, Molina JF, Londoño MC, Cadavid ME, Matute G. Clinical and immunological factors associated with lupus nephritis in patients from northwestern Colombia. Biomédica 2003; 23: 293-300. [ Links ]
21. Austin HA, Balow JE. Natural History and treatment of lupus nephritis. Semin Nephrol 1999; 19: 2-11. [ Links ]
22. Estes D, Christian CL. The natural history of systemic lupus erythematosus by prospective analysis. Medicine (Baltimore) 1971; 50: 85-95. [ Links ]
23. Harvey A, Shulman LE, Tumulty AP, et al. Systemic lupus erythematosus: review of the literature and clinical analysis of 138 cases. Medicine 1954; 33: 291-337. [ Links ]
24. Cairns SA, Acheson EJ, Corbett CL, et al. The delayed appearance of an antinuclear facto and the diagnosis of systemic lupus erythematosus in glomerulonephritis. Postgrad Med J 1979; 55: 723-727. [ Links ]
25. Nossent JC, Bronsveld W, Swaak AJ. Systemic lupus erythematosus. Observations on clinical renal involvement and follow up of renal function: Dutch experience with 110 patients studied prospectively. Ann Rheum Dis 1989; 48: 810-816. [ Links ]
26. Klippel JH. How to alter the course of lupus nephritis. J Musculoskeletal Dis 1988; 5: 29-43. [ Links ]
27. Kozeny GA, Barr W, Bansal VK et al. Occurrence of renal tubular dysfunction in lupus nephritis. Arch Intern Med 1987; 147: 891-895. [ Links ]
28. Leaker B, Fairley KF, Dowling J, Kincaid-Smith P. Lupus nephritis: clinical and pathological correlation. Q J Med 1987; 62: 163-179. [ Links ]
29. Rahman P, Gladman DD, Urowitz MB. Significance of isolated pyuria in SLE. Arthritis Rheum 1998; S282 (abstract). [ Links ]
30. Rahman P, Gladman DD, Urowitz MB. Significance of isolated hematuria in SLE. Arthritis Rheum 1998; S281 (abstract). [ Links ]
31. Dubois EL, ed. Lupus erythematosus. A review of the current status of discoid and systemic lupus erythematosus and their variants. 2nd ed. Rev. Los Angeles: USC Press, 1976. [ Links ]
32. Phadke K, Trachtman H, Nicastri A, Chen CK, Tejani A. Acute renal failure as the initial manifestation of systemic lupus erythematosus in children. J Pediatr 1984; 105: 38-41. [ Links ]
33. Kant KS, Pollak VE, Weiss MA, et al. Glomerular thrombosis in systemic lupus erythematosus: prevalence and significance. Medicine 1981; 60: 71-86. [ Links ]
34. Mintz G, Acevedo Vásquez E, Gutiérrez E, Aspinoza G, et al. Renal vein trombosis and inferior vena cava trombosis in systemic lupus erythematosus: frequency and risk factor. Arthritis Rheum 1984; 27: 539-544. [ Links ]
35. Esdaile JM. How to manage patients with lupus nephritis. Baillieres Clin Rheumatol 2002; 16: 195-210. [ Links ]
36. Ostensen M, Villager PM. Nonsteroidal anti-inflammatory drugs in systemic lupus erythematosus. Lupus 2001; 10: 135-139. [ Links ]
37. Kitridou RC. The mother in systemic lupus erythematosus. In: Dubois´Lupus Erythematosus, 4th Ed, edited by Wallace DJ, Hahn BH, Philadelpia, Lippincott Williams & Wilkins 2002; 986-1021. [ Links ]
38. Petri M. Pregnancy in SLE. Bailliere´s Clin Rheumatol 1998; 12: 449-476. [ Links ]
39. Erkan D, Sammaritano L. New insights into pregnancy-related complications in systemic lupus erythematosus. Curr Rheumatol Rep 2003; 5: 357-363. [ Links ]
40. Packham DK, Lam SS, Nicholls K, Fairley KF, Kindcaid-Smith PS. Lupus nephritis and pregnancy. Q J Med 1992; 83: 315-324. [ Links ]
41. Julkunen H, Kaaja R, Palosuo T, Gronhagen-Riska C, Teramo K. Pregnancy in lupus nephropaty. Acta Ostet Gynecol Scand 1993; 72: 258-263. [ Links ]
42. Moroni G, Quaglini S, Banfi G, et al. Pregnancy in Lupus nephritis. Am J Kidney Dis 2002; 40: 713-720. [ Links ]
43. Gloor JM. Lupus nephritis in children. Lupus 1998; 7: 639-643. [ Links ]
44. Glidden RS, Mantzouranis EC, Borel Y. Systemic lupus erythematosus in childhood: clinical manifestations and improved survival in fifty-five patients. Clin Immunol Immunopathol 1983; 29: 196-210. [ Links ]
45. Platt JF, et al. Systemic lupus erythematosus in the first two decades of life. Am J Kidney Dis 1982; 2(Suppl 1): 212-222. [ Links ]
46. Cameron JS. Lupus nephritis in childhood and adolescence. Pediatr Nephrol 1994; 8: 230-249. [ Links ]
47. Lewis EJ, Schwartz MM, Korbet SM. Lupus nephritis. Oxford University Press, New York, 1999. [ Links ]
48. Meyer O, Kahnn MF. Lupus erythémateux systémique. En: Maladies et Syndromes Systémiques. Kahn MF, Peltier AP, Meyer O, Piette JC, eds. Médecine-Sciences Flammarion, Paris, 2000; 131-368. [ Links ]
49. Golbus J, McCune J. Lupus. Classification, prognosis, immunopathogenesis and treatment. Rheum Dis Clin NA 1994; 20: 213-237. [ Links ]
50. Grande JP, Balow JE. Renal biopsy in lupus nephritis. Lupus 1998; 7: 611-617. [ Links ]
51. Rose BD, Appel GB. Treatment of lupus nephritis-I. Uptodate 2000; 8(1). [ Links ]
52. Grande JP, Balow JE. Renal biopsy in lupus nephritis. Lupus 1988; 7: 611-617. [ Links ]
53. Ponticelli C, Moroni G. Renal biopsy in lupus nephritis-what for, when and how often? Nephrol Dial Transplant 1998; 13: 2452-2454. [ Links ]
54. Esdaile JM et al. The benefit of early treatment with immunosupressive agents in lupus nephritis. J Rheumatol 1994; 21: 2046-2051. [ Links ]
55. Esdaile JM. Current role of renal biopsy in patients with SLE. Bailliere´s Clin Rheumatol 1998; 12: 433-448. [ Links ]
56. Schwartz MM. Lupus nephritis: histology. In: Rheumatology and the kidney, edited by Adu D, Emery P, Madaio M, New York, Oxford University Press, 2001; 33-47. [ Links ]
57. Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, et al. On behalf of the International Society of Nephrology and Renal Pathology Society Working Group on the Classification of Lupus Nephritis. The classification of glomerulonephritis in systemic lupus erythematosus revisited. Kidney Int 2004; 65: 521-530. [ Links ]
58. Kashgarian M. LupusNephritis: pathology, pathogenesis, clinical correlations, and prognosis. In: Dubois´Lupus Erythematosus, 4th Ed, edited by Wallace DJ, Hahn BH, Philadelpia, Lippincott Williams & Wilkins 2002; 1062-1076. [ Links ]
59. Corwin HL, Schwartz MM, Lewis E. The importance of sample size in the interpretation of the renal biopsy. Am J Nephrol 1988; 8: 85-93. [ Links ]
60. Austin HA, Muenz LR, Joyce KM, et al. Diffuse proliferative lupus nephritis: identification of specific pathologic features affecting renal outcome. Kidney Int 1984; 25: 689-695. [ Links ]
61. Park MH, D’Agati V, Appel GB, Pirani CL. Tubulointerstitial disease in lupus nephritis: relationship to immnune deposits, interstitial inflammation, glomerular changes, renal function, and prognosis. Nephron, 1986; 309-319. [ Links ]
62. Schwartz MM, Fennell JS, Lewis EJ. Pathologic changes in the renal tubule in systemic lupus erythematosis. Hum Pathol 1982; 534-547. [ Links ]
63. Appel GB, Pirani CL, D’Agati V. Renal vascular complications of systemic lupus erythematosus. J Am Soc Neprol 1994; 1499-1515. [ Links ]
64. Baldwin DS, Gluck MC, Lowestein J, Gallo GR. Clinical course as related to the morphologic forms and their transitions. Am J Med 1977; 62: 12-30. [ Links ]
65. Descombes D, Droz D, Drouet L, Grunfeld JP, Lesavre P. Renal vascular lesions in lupus nephritis. Medicine 1997; 76: 355-368. [ Links ]
66. Schwartz MM. Lupus vasculitis; Contrib Neprhol 1992; 99: 35-45. [ Links ]
67. Edworthy SM. Clinical manifestations of systemic lupus erythematosus. In: Harris ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, eds. Kelley’s Texbook of Rheumatology. 7th ed. Philadelphia: Elsevier Science 2005; 1201-1224. [ Links ]
68. Austin HA, Illei GG. Membranous lupus nephritis. Lupus 2005; 14: 65-71. [ Links ]
69. Tam LS, EK Li, FM Lai, Chan YK, Szeto CC. Mesangial lupus nephritis in Chinese is associated with a high rate of transformation to higher grade nephritis. Lupus 2003; 12: 665-671. [ Links ]
70. Balow JE, Boumpas DT, Austin HA. Lupus nephritis. In: Brady HR, Wilcox CS, eds. Therapy in nephrology and hypertension. A companion to Brenner and Rector´s. The Kidney.Philadelphia, WB Saunders, 1999; 130-137. [ Links ]
71. Austin HA, Balow JA. Tratment of lupus nephritis. Sem Nephrol 2000; 20: 265-276. [ Links ]
72. Boumpa DT, Balow JE. Outcome criteria for lupus nephritis trials: a critical overview. Lupus 1998; 7: 622-629. [ Links ]
73. Austin HA, Klippel JH, Balow JE, et al. Therapy of lupus nephritis. Controlled trial of prednisone and cytotoxic drugs. N Engl Med 1986; 314: 614-619. [ Links ]
74. Steinberg AD, Steinberg SC. Long-term preservation of renal function in patients with lupus nephritis receiving treatment that includes cyclophosphamide versus those treated with prednisone only. Arthritis Rheum 1991; 34: 945-950. [ Links ]
75. Chan TM. Lupus nephritis: induction therapy. Lupus 2005; 14: s27-s32. [ Links ]
76. Boumpas DT, Austin HA, Vaughn EM, et al. Controlled trial of pulse of methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet 1992; 340: 741-745. [ Links ]
77. Gourley MF, Austin HA, Scott D, et al. Methylprednisolone and cyclophosphamide, alone or in combination, in patients with lupus nephritis. Ann Intern Med 1996; 125: 549-557. [ Links ]
78. Martín-Suárez I, D´Cruz D, Mansoor M, Fernandes AP, Khamashta MA, Hughes GA. Immunosuppressive treatment in severe connective tissue diseases: effects of low dose intravenous cyclophosphamide. Ann Rheum Dis 1997; 56: 481-487. [ Links ]
79. Houssiau FA, Vasconcelos C, D´Cruz D, Sebastiani GD, et al. Immunosuppressive therapy in lupus nephritis: The Euro-Lupus nephritis trial, a randomized trial of low-dose versus high dose intravenous cyclophosphamide. Arthtitis Rheum 2002; 46: 2121-2131. [ Links ]
80. Hannahs Hahn B. Management of systemic lupus erythematosus. In: Harris ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, eds. Kelley’s Texbook of Rheumatology. 7th ed. Philadelphia: Elsevier Science 2005; 1125-1147. [ Links ]
81. D´Cruz D, Cuadrado MJ, Mujic F, Tungekar MF, Taub N, Lloyd M, Khamasta MA, Hughes GR. Immunosuppressive therapy in lupus nephritis. Clin Exp Rheumatol 1997; 15: 275-282. [ Links ]
82. Mok CC, Ho CTK, Siu YP, Chan KW, et al. Treatment of diffuse proliferative lupus glomerulonephritis: a comparison of two cyclophosphamide-containing regimens. Am J Kidney Dis 2001; 38: 256-264. [ Links ]
83. Mok CC, Wong RWS, Lai KN. Treatment of severe proliferative lupus nephritis: the current state. Ann Rheum Dis 62: 799-804. [ Links ]
84. Illei GG, Takada K, Parkin D. Renal flares are common in patients with severe proliferative lupus nephritis treated with immunosuppressive therapy: long-term followup of a cohort of 145 patients participating in randomized controlled studies. Arthritis Rheum 2002; 46: 995-1002. [ Links ]
85. Chan TM, Li FK, Tang CSO, Wong RWS, et al. Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. N Engl J Med 2000; 343: 1156-1162. [ Links ]
86. Appel GB, Ginzler EM, Radhakrishnan J, et al. Multicenter controlled trial of mycophenolate mofetil as induction therapy for severe lupus nephritis [abstract]. J Am Soc Nephrol 2003; 14: 38A. [ Links ]
87. Fine D. Pharmacological therapy of lupus nephritis. JAMA 2005; 293: 3053-3060. [ Links ]
88. Ginzler AM, Dooley MA, Aranow C, Kim MY, Buyon J, et al. Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis. N Engl J Med 2005; 353: 2219-2228. [ Links ]
89. McCune WJ. Mycophenolate mofetil for lupus nephritis. N Engl J Med 2005; 353: 2282-2284. [ Links ]
90. Contreras G, Tozman E, Nahar N, Metz D. Maintenance therapies for proliferative lupus nephritis: mycophenolate mofetil, azathioprine and intravenous cyclophosphamide. Lupus 2005; 14: s33-s38. [ Links ]
91. Contreras G, Pardo V, Leclerq B, et al. Sequential therapies for proliferative lupus nephritis. N Engl J Med 2004; 350: 971-980. [ Links ]
92. Balow JE, Austin III HA. Therapy of membranous nephropathy in systemic lupus erythematosus. Sem Nephrol 2003; 23: 386-391. [ Links ]
93. Mok CC, Ying KY, Lau CS, Yim CW, et al. Treatment of pure membranous lupus nephropathy with prednisolone and azathioprine: an open-label trial. Am J Kidney Dis 2004; 43: 269-276. [ Links ]
94. Moroni G, Maccario M, Banfi G, Quaglini S, Ponticelli C. Treatment of membranous lupus nephritis. Am J Kidney Dis 1998; 31: 681-686. [ Links ]
95. Chan TM, Li FK, Hao WK, Chan KW, Lui SL, Tang S, Lai KN. Treatment of membranous lupus nephritis with nephritic syndrome by sequential immunosuppression. Lupus 1999; 8: 545-551. [ Links ]
96. Hallegua D, Wallace DJ, Metzger AL, Rinaldi RZ, Klinenberg JR. Cyclosporine for lupus membranous nephritis: experience with ten patients and review of the literature. Lupus 2000; 9: 241-251. [ Links ]
97. Austin HA, Vaughan E, Balow JE. Lupus membranous nephropathy: controlles trial of prednisone, pulse cyclophosphamide and cyclosporine. J Am Soc Nephrol 2000; 11 [81A]. [ Links ]
98. Balow JE, Boumpas DT, Austin HAI. Lupus nephritis. In H.R. Brady and C.S Wilcox, eds. Therapy in nephrology and hypertension; Philadelphia: W.B Saunders Company 1998; 130-137. [ Links ]
99. Boumpas DT, Balow JE. Outcome criteria for lupus nephritis trials: a critical overview. Lupus 1998; 7: 622-629. [ Links ]
100. Pando JC, et al. Rates of renal remission and relapse in lupus nephritis treated with bolus cyclophosphamide. Arthritis Rheum 1994; 37: S179 (abstract). [ Links ]
101. Renal disease subcommittee of the American College of Rheumatology Ad Hoc committee on systemic lupus erythematosus response criteria. The American College of Rheumatology response criteria for proliferative and membranous renal disease in systemic lupus erythematosus clinical trials. Arthritis Rheum 2006; 54: 421-432. [ Links ]
102. Rauova L, Lukac J, Levy Y, Rovensky J, Shoenfeld Y. High-dose intravenous immunoglobulins for lupus nephritis-a salvage immunomodulation. Lupus 2001; 10: 209-213. [ Links ]
103. Boletis JN, Loannidis JPA, Boki KA, Moutsopoulos HM. Intravenous immunoglobulin compared with cyclophosphamide for proliferative lupus nephritis. Lancet 1999; 354: 569-570. [ Links ]
104. Levy Y, Sherer Y, George J, et al. Intravenous immunoglobulin treatment of lupus nephritis. Semin Arthritis Rheum 2000; 29: 321-327. [ Links ]
105. Euler HH, Schroeder JO, Harten P, Zeuner RA, Gutschmidt HJ. Treatment-free remission in severe systemic lupus erythematosus following synchronization of plasmapheresis with subsequent pulse cyclophosphamide. Arthritis Rheum 1994; 37: 1784-1794. [ Links ]
106. Wallace DJ, Goldfinger D, Pepkowitz SH, et al. Randomized controlled trial of pulse/synchronization cyclophosphamide/apheresis for proliferative lupus nephritis. J Clin Apheresis 1998; 13: 163-166. [ Links ]
107. Danieli MG, Palmieri C, Salvi A, Refe MC, et al. Synchronized therapy and high-dose cyclophosphamide in proliferative lupus nephritis. J Clin Apheresis 2002; 17: 72 -77. [ Links ]
108. Huang DF, Tsai ST, Wang SR. Recovery of both acute massive pulmonary hemorrhage and acute renal failure in a systemic lupus erythematosus patient with lupus anticoagulant by the combined therapy of plasmapheresis plus cyclophosphamide Transfus Sci 1994; 15: 283-288. [ Links ]
109. Blake JS, Butani L. Rapidly progressive lupus glomerulonephritis and concomitant microangiopathy in an adolescent. Lupus 2002; 11: 533-535. [ Links ]
110. Silverman GJ, Weisman S. Rituximab therapy and autoimmune disorders. Prospects for Anti-B cell therapy. Arthritis Rheum 2003; 48: 1484-1492. [ Links ]
111. Leget GA, Czuczman MS. Use of rituximab, the new FDA-approved antibody. Curr Opin Oncol 1998; 10: 548-551. [ Links ]
112. Looney RJ. Treating human autoimmune diseases by depleting B cells. Ann Rheum Dis 2002; 10: 863-866. [ Links ]
113. Looney RJ. B cells as a therapeutic target in autoimmunes diseases other then rheumatoid arthritis. Rheumatology 2005; 44 (Suppl. 2): ii13-ii17. [ Links ]
114. Silverman GJ, Wisman S. Rituximab therapy and autoimmune disorders: prospects for anti-B-cell therapy. Arthritis Rheum 2003; 48: 1484-1492. [ Links ]
115. Reff ME, Carner K, Chambers KS, Chinn PC, Leonard JE, Raab R, et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20. Blood 1994; 83: 435-445. [ Links ]
116. Sfikakis PP, Boletis JN, Tsokos GC. Rituximab anti-B-cell therapy in systemic lupus erythematosus: pointing to the future. Curr Opin Rheumatol 2005; 17: 550-557. [ Links ]
117. Leandro M, Edwards JC, Ehrenstein MR, Isenberg DA. An open study of B lymphocyte depletion in systemic lupus erythematosus. Arthritis Rheum 2002; 46: 2673-2677. [ Links ]
118. Looney RJ, Anolik JH, Campbell D, et al. B cell depletion as a novel treatment for systemic lupus erythematosus: a phase I/II dose-escalation trial of rituximab. Arthritis Rheum 2004; 50: 2580-2589. [ Links ]
119. Sfikakis PP, Boletis JN, Lionaki S, et al. Remission of proliferative lupus nephritis following B cell depletion therapy is preceded by down-regulation of the T cell costimulatory molecule CD40 ligand: an open-label trial. Arthritis Rheum 2005; 52: 501-513. [ Links ]
120. Chambers SA, Isenberg D. Anti-B cell therapy (Rituximab) in the treatment of autoimmune diseases. Lupus 2005; 14: 210-214. [ Links ]
121. Mok CC. Therapeutic options for resistant lupus nephritis. (In press). Sem Arthritis Rheum 2006. [ Links ]
122. Tahir H, Isenberg DA. Novel therapies in lupus nephritis. Lupus 2005; 14: 77-82. [ Links ]
123. Zandman-Goddard G, Shoenfeld Y. Therapy with biologic agents in SLE. APLAR J Rheumatol 2004; 7: 79-82. [ Links ]
124. Furie R, Stohl W, Ginzler E, et al. Safety, pharmacokinetic and pharmacodynamic results of phase I single and double-dose escalation study of LymphoStat B (human monoclonal antibody to BlyS) in SLE patients. Arthritis Rheum 2003; 48(9): S377. [ Links ]
125. Ginzler EM, Dvorkina O. Newer therapeutic approaches for systemic lupus erythematosus. Rheum Dis Clin N Am 2005; 31: 315-328. [ Links ]
126. Gabay C, Cakir N, Moral F, Roux-Lombard P, Meyer O, Dayer JM, et al. Circulating levels of tumor necrosis factor soluble receptors in systemic lupus erythematosus are significantley higher than other rheumatic diseases and correlate with disease activity. J Rheumatol 1997; 24: 303-308. [ Links ]
127. Malide D, Russo P, Bendayan M. Presence of tumor necrosis factor and interleukin-6 in renal mesangual cells of lupus nephritis patients. Hum Pathol 1995; 26: 558-564. [ Links ]
128. Aringer M, Graninger WB, Steiner G, Smolen JS. Safety and efficacy of tumor necrosis factor alpha blockade in systemic lupus erythematosus: an open-labed study. Arthritis Rheum 2004; 50: 3161-3169. [ Links ]














