Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.14 no.2 Bogotá Apr./June 2007
Artículo de Revisión
Fisiopatología del cartílago y bases para futuras terapias en osteoartritis temprana
Physiopathology of cartilage and base for future therapies in early osteoarthritis
Carlos-Enrique Toro Gutiérrez1, José Félix Restrepo2, Antonio Iglesias Gamarra2, Federico Rondón3
1 Residente Reumatología. Universidad Nacional de Colombia.
2 Profesor Titular de Medicina Interna y Reumatología. Universidad Nacional de Colombia.
3 Profesor Asociado de Medicina Interna y Reumatología. Universidad Nacional de Colombia.
Recibido para publicación: abril 20/2007 Aceptado en forma revisada: mayo 25/2007
Resumen
La osteoartritis es la enfermedad articular más frecuente. Su principal síntoma es el dolor con o sin limitación funcional de la articulación comprometida. El deterioro del cartílago articular es un elemento central en su patogénesis. En la práctica diaria el tratamiento se centra en aliviar el dolor y mejorar la funcionalidad, sin alterar el curso natural de la enfermedad. Durante los últimos años se han realizado avances importantes en el entendimiento de la compleja fisiopatología del cartílago que han permitido explorar nuevas opciones terapéuticas con el objetivo de modificar el curso de la enfermedad, especialmente en su fase temprana.
Palabras clave: osteoartritis, cartílago, tratamiento.
Summary
Osteoarthritis (OA) is the most common arthropathy. It is characterized by pain with or without joint limitation. Degeneration of articular cartilage is an essential feature in its pathogenesis. In daily practice the treatment is directed to relief of pain and to improve joint function without modifying the disease itself. In the past few years, there have been important findings in the general understanding of the cartilage and its central role in the development of OA. New therapeutic options, especially those directed to modify the natural course, are under investigation in early OA.
Key words: osteoarthritis, cartilage, treatment.
La osteoartritis (OA) es la forma más común de artritis que afecta el 60% de hombres y el 70% de mujeres mayores de 65 años. Esta patología causa gran discapacidad y es caracterizada por una destrucción progresiva del cartílago articular, pudiendo incluso comprometer otros componentes de la articulación. La OA puede ser primaria cuando no se conoce su causa o secundaria cuando se asocia a trauma o alguna alteración del desarrollo esquelético. En la forma primaria usualmente compromete manos, rodillas, caderas y pies, aunque puede comprometer virtualmente cualquier articulación. La principal manifestación clínica es dolor y limitación funcional. Radiográficamente se aprecia una disminución del espacio articular con esclerosis ósea subcondral y presencia de osteofitos en los márgenes óseos. Representa un gran impacto económico por la discapacidad laboral que genera. Debido a esto, se requiere con urgencia de una terapia que permita no sólo aliviar el dolor y disminuir la limitación funcional, sino modificar el curso de la enfermedad. De esta manera ha surgido el concepto de DMAOD (Disease Modyfing AntiOsteoarthritis Drug) como analogía de los fármacos modificadores de la artritis reumatoide (DMARDs). Actualmente la búsqueda de nuevas terapias en OA se basa en un mayor conocimiento sobre la compleja fisiopatología del cartílago articular enfocando como principal objetivo al condrocito y su interacción con la matriz extracelular en OA temprana.
El cartílago articular es una estructura altamente especializada, componente fundamental del sistema esquelético en áreas donde se requiere de una arquitectura semisólida para dar forma, fuerza, flexibilidad y resistencia al tejido esquelético. Actúa como un componente intermedio en procesos de crecimiento y reparación ósea, estando presente desde el periodo embrionario en las epífisis, placas de crecimiento primario y secundario, así como en áreas de reparo de fracturas.
A continuación se presenta una revisión cronológica de la investigación realizada sobre cartílago desde su descripción inicial, hasta los avances terapéuticos recientes enfocados hacia OA.
La primera descripción del cartílago ha sido atribuida a Aristóteles (384-322 A. C.) en el siglo IV A. C.1. En este informe se señala al cartílago nasal y auricular como estructuras similares al hueso en las que sólo variaba la cantidad de sus componentes. En este informe no se menciona el cartílago articular, estructura que fue nombrada brevemente por Galeno (130-215) varios siglos después en su trabajo "En la utilidad de varias partes del cuerpo"2. En este trabajo se reconoce por primera vez al cartílago articular identificándolo como una estructura que acompaña al hueso en las articulaciones y que permite una interacción más suave entre los huesos.
Varios siglos después se renovó el interés en el cartílago por el trabajo del médico Avicena (980-1037), quien lo describió como una estructura flexible pero a su vez segunda en dureza luego del hueso3. En este trabajo se propuso que la función del cartílago era amortiguar el daño que en los tejidos blandos podría producir una estructura firme como el hueso.
Posteriormente Andreas Vesalius (1514-1564), considerado como el padre de la anatomía moderna, identificó al cartílago como una estructura carente de inervación y médula4. Havers en el siglo XVII inició el primer estudio que intenta explicar la flexibilidad del cartílago5. En esta ocasión describió estructuras (Partículas) como constituyentes del hueso y el cartílago, deduciendo que la compresibilidad del cartílago dependía de la cantidad de aire contenido en su estructura. Además se consideró que el cartílago se convertía en hueso una vez que el aire había salido de los intersticios y las Partículas. Este concepto fue posteriormente rebatido.
La primera descripción del cartílago osteoartró-sico proviene del reporte de Morgagni6 (1682-1771), profesor de anatomía en Padova, Italia. En este informe se encontró un importante déficit de cartílago en la parte posterior de la cabeza femoral de una mujer llevada a autopsia, encontrando además reemplazo de la morfología normal de la cabeza femoral por una estructura irregular y deprimida.
Luego en el siglo XVIII, el anatomista y cirujano inglés William Hunter (1718-1783) publicó lo que se considera como el primer estudio científico del cartílago articular7. En este estudio se destacaron las diferencias en la textura del cartílago articular respecto de los ligamentos y huesos. Igualmente en este estudio se informó sobre el pericondrio, el cual se identificó como una estructura fina adyacente al cartílago articular y se introdujo el concepto de una Membrana que cubre cada estructura dentro de la articulación.
Joseph Toynbee (1815-1866) realizó grandes aportes al entendimiento del cartílago8. Inicialmen-te realizó claras distinciones entre el cartílago hialino y el fibrocartílago. Posteriormente, basado en estudios en fetos humanos identificó al cartílago como una estructura avascular, incluso desde sus estadios más tempranos.
Joseph Leidy (1823-1891) publicó en 1849 la descripción más detallada del cartílago articular9. En este trabajo se tomaron mediciones del grosor del cartílago de acuerdo al sitio anatómico. Adicional-mente se describió al condrocito y sus variaciones morfológicas de acuerdo a su posición dentro del cartílago, planteando cuestionamientos sobre la forma como se nutre la matriz extracelular, proponiendo como tal a la vasculatura adyacente.
Ecker (1816-1843) publicó en 1843 el primer estudio microscópico acerca del deterioro cartila-ginoso10. En esta investigación se opuso a la hipótesis en la que se planteaba que todo compromiso cartilaginoso era necesariamente secundario a inflamación o infección, proponiendo una diferencia entre el deterioro del cartílago por osteomielitis y el deterioro que se presenta por degeneración. Posteriormente, Ogston (1844-1929) consideró que el cartílago no era una estructura fisiológicamente pasiva sino un tejido activo. Particularmente describió la interfase entre el cartílago y el hueso subyacente, así como la apariencia general del cartílago osteoartrósico incluyendo la formación de osteofitos11.
Años después el estudio de los componentes del cartílago llevaron al reconocimiento de la estructura microfibrilar del cartílago hialino por Tillmann en 1870, y a la purificación del condroítin sulfato por Krukenberg en 1884.
Ya en la primera mitad del siglo XX se realizan otras dos contribuciones importantes. Primero, la identificación de la estructura del cartílago articular por microscopia de luz y su división en tres capas de acuerdo a la orientación de las fibras de colágeno y la distribución de los condrocitos (1925) y segundo, la demostración del ácido hialurónico dentro del cartílago (1939)10.
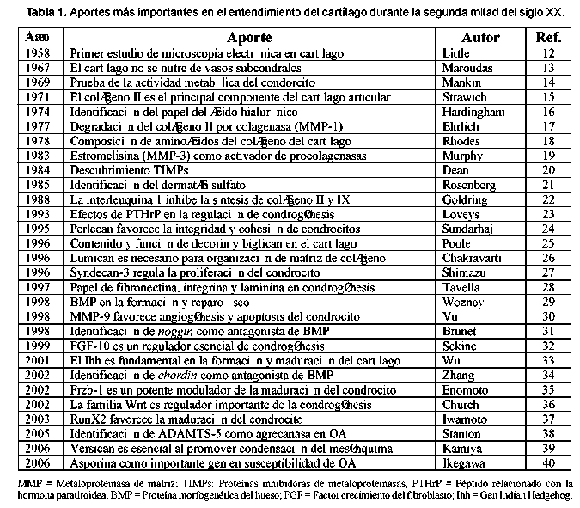
Desde 1950 la investigación en cartílago se ha incrementado y cada vez el conocimiento del cartílago en salud y enfermedad es mayor. Algunos de los aportes más importantes realizados desde entonces se destacan en la Tabla 1.
Nuevas terapias en OA enfocadas al cartílago
El entendimiento de la estructura del cartílago ha permitido trazar nuevos objetivos terapéuticos en enfermedades que tienen en esta estructura a su actor principal. Esto es especialmente importante en OA, enfermedad tradicionalmente frustrante tanto para el paciente como para el médico, en la que el tratamiento actual sólo reduce el dolor y tal vez mejora la función, pero no tiene impacto en la incidencia de la enfermedad ni en su progresión. El uso de analgésicos como antiinflamatorios no esteroideos (AINEs) es una de las conductas más frecuentemente empleadas para reducir el dolor y mejorar la funcionalidad en OA; sin embargo, efectos adversos como toxicidad gástrica y renal limitan su uso41-42. Más recientemente, los inhibidores COX-2 han sido ampliamente utilizados con el objetivo de lograr mejoría sintomática; sin embargo, su beneficio ha sido limitado por el incremento en el riesgo de eventos cardiovasculares que ha llevado al retiro del mercado de algunos productos y la inclusión de advertencias de uso en otros43.
Otras terapias que han sido utilizadas para alivio de dolor con relativo éxito, incluyen el uso intraarticular de corticosteroides44 y ácido hialurónico45. Adicionalmente se encuentran en evaluación antagonistas de receptores de bradiquinina B2 y análogos de capsaicina.
De otra parte, la hidroxicloroquina, medicamento con eficacia comprobada en artritis reumatoide y lupus eritematoso sistémico, ha sido utilizado en pacientes con OA erosiva con éxito de acuerdo a un estudio retrospectivo realizado con ocho pacientes46. Recientemente, la hidroxicloroquina demostró una disminución en la liberación de óxido nitroso al suprimir interleuquina (IL) 1 beta, por lo cual podría ejercer un efecto terapéutico en OA47.
La glucosamina, a pesar de demostrar recientemente una acción inhibitoria sobre MMP-13 in vitro48 y promover la síntesis de cartílago en diferentes modelos animales49-50, no ha demostrado un beneficio consistente en los estudios que han evaluado su efectividad en el tratamiento de OA. El estudio GAIT51 no encontró evidencia concluyente que soporte la eficacia de la glucosamina para mejorar la función, aunque haya sido más efectiva que el celecoxib encuanto alivio de dolor. No obstante, en un estudio más reciente que comparó la glucosamina, el acetaminofén y el placebo en 318 pacientes con OA de rodilla, se encontró a los seis meses de seguimiento una diferencia significativa en índices de funcionalidad y dolor a favor del sulfato de glucosa-mina (1500mg/día), comparado con el placebo52.
En cuanto medidas no farmacológicas la reducción de peso corporal en pacientes obesos parece relacionarse con una reducción en el dolor y mejoría de la funcionalidad en OA de rodilla53; sin embargo, esta reducción de peso no siempre es fácil de lograr.
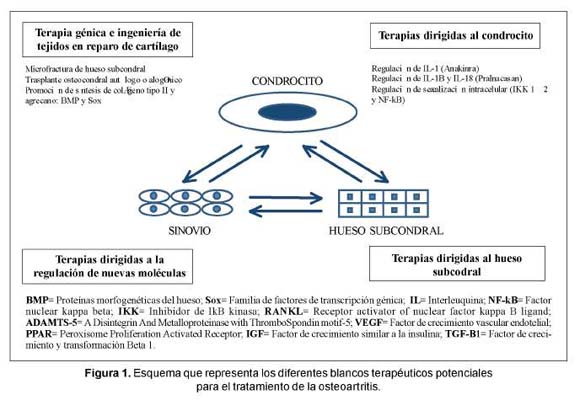
Con el objetivo de encontrar medicamentos que modifiquen el curso natural de la enfermedad se están evaluando diferentes opciones enfocadas al cartílago y especialmente al condrocito. Avances recientes en el entendimiento de la fisiopatología del cartílago y la racionalidad de cada opción terapéutica han sido revisados recientemente (Figura 1)54-55.
Los objetivos terapéuticos actuales en OA se pueden dividir de la siguiente forma:
– Terapias dirigidas al condrocito.
– Terapias dirigidas al hueso subcondral.
– Terapia génica e ingeniería de tejidos en reparo de cartílago.
– Terapias dirigidas a nuevas moléculas.
Terapias en osteoartritis dirigidas al condrocito
Un mejor conocimiento de la fisiopatología del condrocito ha permitido entender el papel de diferentes moléculas que participan en el daño del cartílago articular en OA. La identificación de moléculas proinflamatorias como la IL-1, IL-18 y otras moléculas pequeñas que participan en señalización intracelular ha permitido cambiar el paradigma de la OA como una enfermedad predominantemente degenerativa a una enfermedad con un claro componente inflamatorio en el que la intervención terapéutica de estas moléculas permitiría modificar el curso de la enfermedad.
La IL-1 es una reconocida citoquina proinflama-toria que participa en actividades catabólicas en el condrocito. En estudios animales de artritis crónica, ratones knockout IL-1 presentan menor daño articular y menor inflamación sinovial56. El antagonista del receptor de IL-1 (IL-1Ra) es un antagonista natural de esta molécula. El uso preliminar de anakinra (IL-1Ra) inyectado en OA de rodilla ha demostrado cierta mejoría sintomática pero hasta ahora la evidencia se considera inconclusa57 y dado el carácter crónico de la enfermedad se considera insuficiente el posible uso intraarticular de este producto.
Adicionalmente, estudios en modelos animales han mostrado que el pralnacasan, un inhibidor de la enzima convertidora IL-1b (ICE/caspasa-1), el cual inhibe también la actividad de la IL-18, reduce significativamente el daño articular58.
Existen diferentes moléculas que participan en procesos de señalización intracelular. La importancia de estas moléculas como objetivo terapéutico radica en que diferentes citoquinas catabólicas pueden compartir vías de señalización comunes, por lo que intervenir la molécula apropiada permitiría reducir la inflamación al interferir en la vía final común independiente de la citoquina implicada. Las principales vías de señalización intracelular involucradas en procesos catabólicos en el cartílago son c-Jun N-terminal kinasas (JNKs), p38 mitogenactivada protein kinasa (MAPK), inhibidor de kappa B kinasa (IkB), fosfatidilinositol-3 -kinasa (PI3K) y el factor nuclear kappa B (NF-kB). Hasta ahora el más promisorio inhibidor ha sido desarrollado contra el IkB kinasa (IKK 1 y 2)59, el cual interfiere indirectamente con la translocación del NF-kB al núcleo celular, impidiendo su acción proinflamatoria como factor de transcripción.
Terapias en osteoartritis dirigidas al hueso subcondral
El hueso se considera estrechamente relacionado con el inicio y progresión de la OA. El aumento en el recambio óseo, así como la esclerosis subcondral, son característicos de la OA. De hecho, el trauma es un reconocido factor de riesgo para el desarrollo de OA secundaria. Esta relación entre hueso y cartílago ha motivado el estudio de terapias dirigidas al hueso en OA, como la calcitonina60-61, los estrógenos62 y los bifosfonatos63.
Hasta ahora no se cuenta con resultados conclu-yentes respecto a estas terapias.
Otra posibilidad terapéutica que se ha evaluado es la intervención en el sistema RANK-RANKL, el cual media la diferenciación y actividad de osteo-clastos64. Aunque la inhibición de la expresión de RANKL no bloquea la destrucción del cartílago directamente (en modelos animales), podría tener un efecto beneficioso indirecto a través de la protección del hueso.
ADAMTS-5, una agrecanasa que podría participar en el daño articular luego de un insulto físico o bioquímico, ha sido estudiada recientemente en murinos y su inhibición podría ser otra opción terapéutica a evaluar65.
Terapia génica e ingeniería de tejidos en reparo de cartílago en osteoartritis
Algunos procedimientos actuales destinados a la reparación de cartílago incluyen el lavado articular, el debridamiento de tejidos, la microfractura del hueso subcondral y el trasplante de tejido osteocondral autólogo66 o alogénico, así como finalmente el reemplazo articular total. Estos procedimientos pueden llevar igualmente a la formación de tejido fibroso y degeneración cartilaginosa por lo cual tienen una tasa variable de éxito. La introducción de factores anabólicos pretende corregir en parte la tendencia a la formación de fibrocartílago que sigue este tipo de procedimientos. La capacidad para estimular la síntesis de colágeno tipo II y agrecano por varias moléculas de la familia de proteínas morfogenéticas de hueso (BMPs), en especial de la BMP 2, 7 y 14 han motivado su estudio como una potencial terapia en OA67-69. Igualmente, proteínas del grupo de factores de transcripción génica Sox (particularmente Sox9, Sox 5 y Sox 6), necesarios para la diferenciación y maduración del condrocito, son otra opción en evaluación70.
Terapias en OA dirigidas a nuevas moléculas
El factor de crecimiento vascular endotelial (VEGF) y su receptor son expresados en el cartílago y la inducción de VEGF en condrocitos puede tener un rol en el proceso de angiogénesis y destrucción del cartílago observado en OA. Su antagonista fisiológico endostatina ha sido sugerido como una terapia potencial71 .
Estudios recientes indican que agonistas de PPAR-alfa pueden incrementar la expresión de IL-1Ra, protegiendo a los condrocitos contra la acción de IL-172.
La leptina, adipoquina con elevada expresión en OA, posee la capacidad de aumentar la expresión del factor de crecimiento similar a la insulina (IGF-1) y el factor de crecimiento transformante-beta 1 (TGF-B1)73. Estas últimas moléculas han sido relacionadas en el desarrollo de OA, especialmente con la formación de osteofitos en el caso del TGF-B1. La regulación de esta adipoquina podría ser otra opción terapéutica a evaluar.
Conclusión
La OA es el trastorno articular más frecuente y su impacto económico y social puede semejar incluso el de la enfermedad coronaria. Tradicionalmente ha sido una patología frustrante para el paciente y médico debido a que la terapéutica se ha concentrado en aliviar el dolor sin poder aún incidir definitivamente en el curso de la enfermedad.
El reconocimiento histórico de la estructura del cartílago y el daño articular como el principal responsable en esta enfermedad han permitido, mediante una extensa investigación científica, orientar nuevos esfuerzos terapéuticos con el fin de encontrar medicamentos que modifiquen la incidencia y/o la progresión de la enfermedad. Aunque todavía no existen hallazgos concluyentemente satisfactorios respecto de alguna intervención en particular, el completo entendimiento de los procesos de destrucción del cartílago articular es la base inicial para intentar en un futuro encontrar una terapia efectiva.
Referencias
1. Aristotle. Parts of Animals. Vol. XII, Cambridge, MA: Harvard University Press, 1918. Trans. by E.S. Forster, pp. 167-169. [ Links ]
2. Galen. On the Usefulness of Various Parts of the Body. Ithaca, NY: Cornell University Press, 1968. Trans. By M.T. May, (a) Book 16, ii (1:683); (b) Book 12, ii (1:552); (c) Book 1, 15. (1:87). [ Links ]
3. Avicenna. The Canon of Medicine. New York: A.M. Kelley, 1970. Trans. by O.C. Gruner, Chap. 16, p. 94. [ Links ]
4. Vesalius A. On the Fabric of the Human Body. Cartilage, Its Nature, Function and Differentiation. San Francisco: Norman Publishing, 1998; Volume 1. Trans. by Richardson WF and Carman JB, Chap. 2, pp. 8-11, 39-40. [ Links ]
5. Havers C. Osteologia Nova, or some new observations of the bones, Cartilage. London: S. Smith, 1691. pp. 269-293. [ Links ]
6. Morgagni JB. The Seats and Causes of Diseases Investigated by Anatomy. London: Millar and Cadell, 1769; Vol. 3. Trans. by B. Alexander (original 1761), p. 321. [ Links ]
7. Hunter W. Of the structure and diseases of articulating cartilages. Philos Trans R Soc Lond 1743; 42: 514-521. [ Links ]
8. Toynbee J. Researches, tending to prove the non-vascularity and the peculiar uniform mode of organization and nutrition of certain animal tissues, viz. articular cartilage and the cartilage of the different classes of fibro-cartilage; Philos Trans R Soc Lond 1841; 159-192. (a) 174-178; (b) 164; (c) 170-172. [ Links ]
9. Leidy J. On the intimate structure and history of the articular cartilages. Am J Med Sci 1849; 34: 277e94 (a) 287; (b) 291. [ Links ]
10. Benedek TG. A history of the understanding of cartilage. Osteoarthritis Cartilage 2006; 14: 203-209. [ Links ]
11. Ogston A. On articular cartilage. J Anat Physiol 1875; 10: 49-74 (a) 50; (b) 68; (c) 68-69. [ Links ]
12. Little K, Pimm LH, Trueta J. Osteoarthritis of the hip. An electron microscopic study. J Bone Joint Surg 1958; 40B: 123-131. [ Links ]
13. Maroudas A, Bullough P, Swanson SA, Freman MA. The permeability of cartilage. J Bone Joint Surg 1968; 50B: 166-177. [ Links ]
14. Mankin HJ, Lipiello L. The turnover of adult rabbit articular cartilage. J Bone Joint Surg 1969; 51A: 1591-1600. [ Links ]
15. Strawich E, Nimni ME. Properties of a collagen molecule containing three identical components extracted from bovine articular cartilage. Biochemistry 1971; 10: 3905-3911. [ Links ]
16. Hardingham TE, Muir H. Hyaluronic acid in cartilage and proteoglycan aggregation. Biochem J 1974; 139: 565-581. [ Links ]
17. Ehrlich MG, Mankin HJ, Jones H, Wright R, Crispen C, Vigliani G. Collagenase and collagenase inhibitors in osteoarthritic and normal human cartilage. J Clin Invest 1977; 59: 226-233. [ Links ]
18. Rhodes RK, Miller EJ. Physicochemical characterization and molecular organization of the collagen A and B chains. Biochemistry 1978; 17: 3442-3448. [ Links ]
19. Murphy G, Cawston TE, Galloway WA, Barnes MJ, Bunning RA, Mercer E, et al. Metalloproteinases from rabbit bone culture medium degrade types IV and V collagens, laminin and fibronectin. Biochem J 1981; 199: 807-811. [ Links ]
20. Dean DD, Woessner JF. Extracts of human articular cartilage contain an inhibitor of tissue metalloproteinases. Biochem J 1984; 218: 277-280. [ Links ]
21. Rosenberg LC, Choi HU, Tang L-H, Johnson TL, Pal S, Weber C, et al. Isolation of dermatan sulfate proteoglycans from mature bovine articular cartilage. J Biol Chem 1885; 260: 6304-6313. [ Links ]
22. Goldring MB, Birkhead J, Sandell LJ, Kimura T, Krane SM. Interleukin 1 suppresses expression of cartilage-specific types II and IX collagens and increases types I and III
collagens in human chondrocytes. J Clin Invest 1988; 82: 2026-2037.
23. Loveys LS, Gelb D, Hurwitz SR, Puzas JE, Rosier RN. Effects of parathyroid hormone-related peptide on chick growth plate chondrocytes. J Orthop Res 1993; 11: 884-891. [ Links ]
24. SundarRaj N, Fite D, Ledbetter S, Chakravarti S, Hassell JR. Perlecan is a component of cartilage matrix and promotes chondrocyte attachment. J Cell Sci 1995; 108: 2663-2672. [ Links ]
25. Poole AR, Rosenberg LC, Reiner A, Ionescu M, Bogoch E, Roughley PJ. Contents and distribution of the proteoglycans decorin and biglycan in normal and osteoarthritic human articular cartilage. J Orthop Res 1996; 14: 681-689. [ Links ]
26. Chakravarti S, Magnuson T, Lass JH, Jepsen KJ, LaMantia C, Carroll H. Lumican regulates collagen fibril assembly: skin fragility and corneal opacity in the absence of lumican. J Cell Biol 1998; 141: 1277-1286. [ Links ]
27. Shimazu A, Nah HD, Kirsch T, Koyama E, Leatherman JL, Golden EB, et al. Syndecan-3 and the control of chondrocyte proliferation during endochondral ossification. Exp Cell Res 1996; 229: 126-136. [ Links ]
28. Tavella S, Bellese G, Castagnola P, Martin I, Piccini D, Doliana R, et al. Regulated expression of the fibronectin, laminin, and related integrin receptors during the early chondrocyte differentiation. J Cell Sci 1997; 110: 2261-2270. [ Links ]
29. Wozney JM, Rosen V. Bone morphogenetic protein and bone morphogenetic protein gene family in bone formation and repair. Clin Orthop Res 1998; 346: 26-37. [ Links ]
30. Vu TH, Shipley JM, Bergers G, Berger JE, Helms JA, Hanahan D, et al. MMP-9/gelatinase B is a key regulator of growth plate angiogenesis and apoptosis of hypertrophic chondrocytes. Cell 1998; 93(3): 411-422. [ Links ]
31. Brunet LJ, McMahon JA, McMahon AP, Harland RM. Noggin, cartilage morphogenesis, and joint formation in the mammalian skeleton. Science 1998; 280: 1455-1457. [ Links ]
32. Sekine K, Ohuchi H, Fujiwara M, Yamasaki M, Yoshizawa T, Sato T, et al. Fgf10 is essential for limb and lung formation. Nat Genet 1999; 21: 138-141. [ Links ]
33. Wu QY, Zhang Y, Chen Q. Indian hedgehog is an essential component of mechanotransduction complex to stimulate chondrocyte proliferation. J Biol Chem 2001; 276: 35290-35296. [ Links ]
34. Zhang D, Ferguson CM, O’Keefe RJ, Puzas JE, Rosier RN, Reynolds PR. A role for the BMP antagonist chordin in endo-chondral ossification. J Bone Miner Res 2002; 17: 293-300. [ Links ]
35. Enomoto-Iwamoto M, Kitagaki J, Koyama E, Tamamura Y, Wu C, Kanatani N, et al. The Wnt antagonist Frzb-1 regulates chondrocyte maturation and long bone development during limb skeletogenesis. Dev Biol 2002; 251: 142-156. [ Links ]
36. Church V, Nohno T, Linker C, Marcelle C, Francis-West P. Wnt regulation of chondrocyte differentiation. J Cell Sci 2002; 115: 4809-4818. [ Links ]
37. Iwamoto M, Kitagaki J, Tamamara Y, Gentili C, Koyama E, Enomoto H, et al. Run X2 expression and action in chondrocytes are regulated by retinoid signalling and parathyroid hormone-related peptide (PTHrP). Osteoarthritis Cartilage 2003; 11: 6-15. [ Links ]
38. Stanton H, Rogerson FM, East CJ, Golub SB, Lawlor KE, Meeker CT, et al. ADAMTS5 is the major aggrecanase in mouse cartilage in vivo and in vitro. Nature 2005; 434: 648-652. [ Links ]
39. Kamiya N, Watanabe H, Habuchi H, Takagi H, Shinomura T, Shimizu K, et al. Versican/PG-M regulates chondrogenesis as an extracellular matrix molecule crucial for mesenchymal condensation. J Biol Chem 2006; 281(4): 2390-2400. [ Links ]
40. Ikegawa S. Asporin, a susceptibility gene for osteoarthritis. Clin Calcium 2006; 16(9): 1548-1552. [ Links ]
41. Lanas A. Advances in the adverse effects of NSAIDs in the gastrointestinal tract. Gastroenterol Hepatol 2006; 29 (Suppl 3): 16-22. [ Links ]
42. Knights KM, Tsoutsikos P, Miners JO. Novel mechanisms of nonsteroidal anti-inflammatory drug-induced renal toxicity. Expert Opin Drug Metab Toxicol 2005; 1(3): 399-408. [ Links ]
43. Solomon DH. Selective cyclooxygenase 2 inhibitors and cardiovascular events. Arthritis rheum 2005; 52: 1968-1978. [ Links ]
44. Stitik T P, Kumar A, Foye PM. Corticosteroid injections for osteoarthritis. Am J Phys Med Rehabil 2006; 85: S51-S65. [ Links ]
45. Modawal A, Ferrer M, Choi HK, Castle JA. Hyaluronic acid injections relieve knee pain. J Fam Pract 2005; 54(9): 758-767. [ Links ]
46. Bryant LR, des Rosier KF, Carpenter MT. Hydroxy-chloroquine in the treatment of erosive osteoarthritis. J Rheumatol. 1995; 22(8): 1527-1531. [ Links ]
47. Vuolteenaho K, Kujala P, Moilanen T, Moilanen E. Aurothiomalate and hydroxychloroquine inhibit nitric oxide production in chondrocytes and in human osteoarthritic cartilage. Scand J Rheumatol 2005; 34(6): 475-479. [ Links ]
48. Derfoul A, Miyoshi AD, Freeman DE, Tuan RS. Gluco-samine promotes chondrogenic phenotype in both chondrocytes and mesenchymal stem cells and inhibits MMP-13 expression and matrix degradation. Osteoarthritis Cartilage 2007 Mar 2; [Epub ahead of print]. [ Links ]
49. Varghese S, Theprungsirikul P, Sahani S, Hwang N, Yarema KJ, Elisseeff JH. Glucosamine modulates chondrocyte proliferation, matrix synthesis, and gene expression. Osteoarthritis Cartilage 2007; 15(1): 59-68. [ Links ]
50. Terry DE, Rees-Milton K, Smith P, Carran J, Pezeshki P, Woods C, et al. N-Acylation of glucosamine modulates chondrocyte growth, proteoglycan synthesis, and gene expression. J Rheumatol 2005; 32(9): 1775-1786. [ Links ]
51. Clegg DO, Reda DJ, Harris CL, Klein MA, O’Dell JR, Hooper MM, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med 2006; 354(8): 795-808. [ Links ]
52. Herrero-Beaumont G, Roma JA, Trabado MC, Blanco FJ, Benito P, Martín-Mola E, et al. Glucosamine Sulfate in the Treatment of Knee Osteoarthritis Symptoms A Randomized, Double-Blind, Placebo-Controlled Study Using Acetaminophen as a Side Comparator. Arthritis Rheum 2007; 56: 555-567. [ Links ]
53. Christensen R, Bartels EM, Astrup A, Bliddal H. Effect of weight reduction in obese patients diagnosed with knee osteoarthritis: a systematic review and meta-analysis. Ann Rheum Dis 2007; 66(4): 433-439. [ Links ]
54. Goldring MB. Update on the biology of the chondrocyte and new approaches to treating cartilage diseases. Best Pract Res Clin Rheumatol 2006; 20(5): 1003-1025. [ Links ]
55. Sun BH, Wu CW, Kalunian KC. New Developments in Osteoarthritis. Rheum Dis Clin N Am 2007; 33: 135-148. [ Links ]
56. Glasson S. Identification of targets through histologic evaluation of osteoarthritis in knockout mice. Osteoarthritis Cartilage 2005; 13(Suppl A): S3. [ Links ]
57. Chevalier X, Giraudeau B, Conrozier T, Marliere J, Kiefer P, Goupille P. Safety study of intraarticular injection of interleukin 1 receptor antagonist in patients with painful knee osteoarthritis: a multicenter study. J Rheumatol 2005; 32: 1317-1323. [ Links ]
58. Rudolphi K, Gerwin N, Verzijl N, van der Kraan P, van den Berg W. Pralnacasan, an inhibitor of interleukin-1beta converting enzyme, reduces joint damage in two murine models of osteoarthritis. Osteoarthritis Cartilage 2003; 11: 738-746. [ Links ]
59. McIntyre KW, Shuster DJ, Gillooly KM, Dambach DM, Pattoli MA, Lu P, et al. A highly selective inhibitor of I kappa B kinase, BMS-345541, blocks both joint inflamma-tion and destruction in collagen-induced arthritis in mice. Arthritis rheum 2003; 48: 2652-2659. [ Links ]
60. Papaioannou NA, Triantafillopoulos IK, Khaldi L, Krallis N, Galanos A, Lyritis G P. Effect of calcitonin in early and late stages of experimentally induced osteoarthritis. A histomorphometric study. Osteoarthritis Cartilage 2007; 15(4): 386-395. [ Links ]
61. Bagger YZ, Tanko LB, Alexandersen P, Karsdal MA, Olson M, Mindeholm L, et al. Oral salmon calcitonin induced suppression of urinary collagen type II degradation in postmenopausal women: a new potential treatment of osteoarthritis. Bone 2005; 37: 425-430. [ Links ]
62. Ham KD, Carlson CS. Effects of estrogen replacement therapy on bone turnover in subchondral bone and epiphyseal metaphyseal cancellous bone of ovariectomized cynomolgus monkeys. J Bone Miner Res 2004; 19: 823-829. [ Links ]
63. Bingham CO 3rd, Buckland-Wright JC, Garnero P, Cohen SB, Dougados M, Adami S, et al. Risedronate decreases biochemical markers of cartilage degradation but does not decrease symptoms or slow radiographic progression in patients with medial compartment osteoarthritis of the knee: results of the two-year multinational knee osteoarthritis structural arthritis study. Arthritis Rheum 2006; 54(11): 3494-4507. [ Links ]
64. Komuro H, Olee T, Kuhn K, Quach J, Brinson DC, Shikhman A, et al. The osteoprotegerin/receptor activator of nuclear factor kappaB/receptor activator of nuclear factor kappaB ligand system in cartilage. Arthritis Rheum 2001; 44: 2768-2776. [ Links ]
65. Glasson SS, Askew R, Sheppard B, Carito B, Blanchet T, Ma HL, et al. Deletion of active ADAMTS5 prevents cartilage degradation in a murine model of osteoarthritis. Nature 2005; 434: 644-648. [ Links ]
66. Knutsen G, Engebretsen L, Ludvigsen TC, Drogset JO, Grontvedt T, Solheim E, et al. Autologous chondrocyte implantation compared with microfracture in the knee. A randomized trial J Bone Joint Surg Am 2004; 86: 455-464. [ Links ]
67. Seeherman H, Wozney JM. Delivery of bone morphogenetic proteins for orthopedic tissue regeneration. Cytokine Growth Factor Rev 2005; 16: 329-345. [ Links ]
68. Goldring MB. Are bone morphogenetic proteins effective inducers of cartilage repair? Ex vivo transduction of muscle-derived stem cells. Arthritis Rheum 2006; 54: 387-389. [ Links ]
69. Kuroda R, Usas A, Kubo S, Corsi K, Peng H, Rose T, et al. Cartilage repair using bone morphogenetic protein 4 and muscle-derived stem cells. Arthritis Rheum 2006; 54: 433-442. [ Links ]
70. Ikeda T, Kamekura S, Mabuchi A, Kou I, Seki S, Takato T, et al. The combination of SOX5, SOX6, and SOX9 (the SOX trio) provides signals sufficient for induction of permanent cartilage. Arthritis Rheum 2004; 50: 3561-3573. [ Links ]
71. Pufe T, Kurz B, Petersen W, Varoga D, Mentlein R, Kulow S, et al. The influence of biomechanical parameters on the expression of VEGF and endostatin in the bone and joint system. Ann Anat 2005; 187(5-6): 461-472. [ Links ]
72. Francois M, Richette P, Tsagris L, Fitting C, Lemay C, Benallaoua M, et al. Peroxisome proliferator-activated recep-tor-alfa-activation pathway potentiates interleukin-1 receptor antagonist production in cytokine-treated chondrocytes. Arthritis Rheum 2006; 54(4): 1233-1245. [ Links ]
73. Dumond H, Presle N, Terlain B, Mainard D, Loeuille D, Netter P, et al. Evidence for a key role of leptin in osteoarthritis. Arthritis Rheum 2003; 48: 3118-3129. [ Links ]