Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.35 n.3 Bogotá jul./sep. 2007
Investigación Original
Asociación de actividad lúpica y el riesgo de infección nosocomial en pacientes de un Hospital universitario en Medellín: estudio prospectivo 2001-2004
Risk Factors for Nosocomial Infections in Patients with Systemic Lupus Erythematosus at a Teaching Hospital in Medellin, Colombia. Prospective Study: 2001-2004.
Luis Alberto Ramírez Gómez1, Juan Fernando Velásquez2, Paula Granda2, Carlos Alfonzo Builes3, Fabián Jaimes4
1 Jefe de la Sección de Reumatología. Universidad de Antioquia y Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
2 Residentes de Medicina Interna. Universidad de Antioquia y Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
3 Profesor de endocrinología. Universidad de Antioquia y Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
4 Profesor de Medicina Interna. Universidad de Antioquia y Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
Recibido para publicación: junio 29/2007 Aceptado en forma revisada: agosto 24/2007
Resumen
Factores de riesgo para infección nosocomial en pacientes con lupus eritematoso sistémico en un Hospital universitario en Medellín, Colombia. Estudio prospectivo: 2001-2004
Introducción: los pacientes con lupus eritematoso sistémico (LES) tienen mayor morbilidad y mortalidad que la población general y ello está determinado por la actividad inflamatoria y la frecuencia de infecciones, las cuales participan en la presentación bimodal de la mortalidad de los pacientes con LES. Las infecciones se han asociado con la actividad de la enfermedad y con el uso de inmunosupresores.
Objetivo: determinar los factores asociados con infección nosocomial en pacientes con LES que requirieron tratamiento intrahospitalario. Específicamente buscamos establecer asociación con actividad al ingreso y posterior desarrollo de la infección.
Métodos: es un estudio de cohorte prospectivo y descriptivo cuya población está constituida por pacientes con LES de acuerdo a los criterios del ACR y que se hospitalizaron entre enero de 2001 y diciembre de 2004. Se excluyeron pacientes con infección adquirida en la comunidad o que la manifestaran dentro de las 48 horas siguientes al ingreso, pacientes con neoplasias y HIV. La actividad se cuantificó con la aplicación del SLEDAI y la infección fue definida con base en el aislamiento del germen y según los criterios del CDC de Atlanta, para los casos sin confirmación microbiológica. Se consideraron variables como edad, género, tiempo de diagnóstico, tiempo de estancia, uso de corticoides, ciclofosfamida (CFM), otros inmunosupresores, tipo de infección, agente y causa de mortalidad.
Resultados: ingresaron al estudio 123 pacientes que tuvieron 155 hospitalizaciones, de ellos 106 (82,2%) mujeres, con un promedio de edad de 27,7+-12,6 años (7-73) con tiempo de diagnóstico de 27,8+-49,4 meses (0-300), 56 pacientes (45,5%) con diagnóstico de novo, 25 pacientes estaban en insuficiencia renal crónica (IRC) con 10 de ellos en terapia dialítica. Con respecto al tratamiento 58 (47,1%) no habían recibido corticoides, 36 (29,3%) recibían una dosis menor de 20 mg/d de prednisona y 29 (23,6%) una dosis mayor, 31 (25,2%) habían recibido bolos de CFM y 13 (10,6%) otros inmunosupresores. El promedio y mediana de SLEDAI fueron de 14,7+-9,9 y 14 (IQR 7-20) respectivamente. Presentaron infección nosocomial 38 (30,9%) pacientes, 31 pacientes una infección y 13 pacientes más de una para un total de 69 eventos.
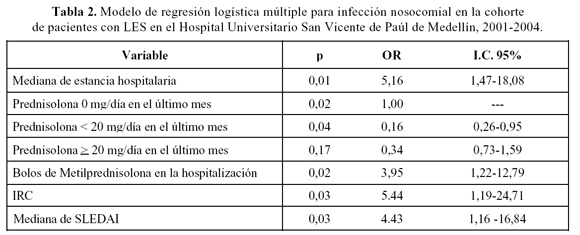
En el análisis univariado se asociaron significativamente con infección intrahospitalaria: diagnóstico de novo, mayor tiempo de internación, uso durante la hospitalización de bolos de metilprednisolona (MPDN) o de CFM, promedio y mediana más altos de SLEDAI. En un modelo de regresión logística múltiple persistieron con significancia: mayor tiempo de internación [OR= 5,16 (IC 95% 1,5-18) p= 0.01], uso de bolos de MPDN [OR 3,95 (IC 95% 1,22-12,8) p= 0,02], mas alta mediana de SLEDAI [OR 4,43 (IC 95%1.16-16,8)p= 0,03], IRC [OR 5,44 (IC 95% 1,19-24,7) p= 0,03] y las dosis menores de 20 mg/d de prednisopna como factor protector [OR 0,16 (IC 95% 0,03-0,95) p= 0,04].
Los pacientes infectados presentaron una mayor mortalidad (p<0,001).
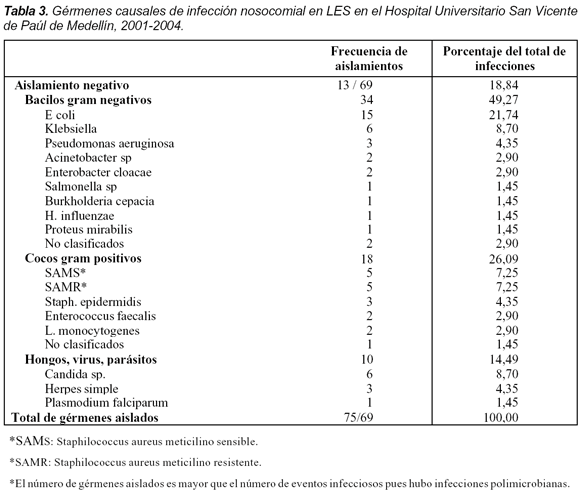
El germen se aisló en 56 ocasiones (81,2%): bacilos gram negativos en 34 (49,3%); cocos gram positivos en 18 (26,1%); hongos, hemoparasitos y virus en 10 (14,5%). La infección se localizó en tracto genitourinario en 26 (37,7%), en sangre 18 (26,1%), 8 (11,6%) en pulmón, entre otros.
Catorce pacientes fallecieron: seis por infección, dos por actividad, infección y actividad en uno, tres de origen cardiovascular y uno desconocido.
Conclusión: en esta población de pacientes lúpicos colombianos casi la tercera parte de los pacientes presentaron infección nosocomial que puede ser severa y causa una mayor mortalidad. La infección se asoció con más alta actividad de la enfermedad, bolos de MPDN, IRC y mayor estancia hospitalaria.
Palabras clave: actividad lúpica, infección nosocomial, SLEDAI, LES.
Summary
Background: systemic lupus erythematosus (SLE) patients have higher rates of morbility and mortality than general population because of inflammatory activity and high infections frequencies. The infections have been associated with activity index of the disease and the use of immunosuppressant drugs.
Objective: to determine the factors associated with nosocomial infections in SLE patients who required in hospital treatment.
Methods: we performed a prospective study of SLE patients who met the ACR criteria and who were hospitalized between January 2001 and December 2004. Exclusion criteria were community acquired infections, onset of infections in the first 48 hours of hospitalization, HIV and patients with neoplasm. The SLE activity was quantified with the SLEDAI index and infection was defined according to microorganism isolated or CDC criteria for those without an isolated microorganism. We studied this variables: age, sex, time from onset of SLE, hospital stay, use of immunosuppressant drugs, type of infection, and cause of death.
Results: one hundred and twenty three patients were included who had 155 hospital admissions, 106 were women (82.2%). Mean age was 27.7 +/- 12.6 years (7-73) with a mean time from diagnostic of 27.8 +/- 49.4 months (0-300), 56 patients (45.5%) had novo diagnosis, 25 patients had chronic renal insufficiency including 10 in hemodialysis. Respect of previous treatment, 58 (47.1%) patients did not have received steroids, 36 (29.3%) have been receiving 20 mg of prednisone or less, and 29 (23.6%) more than 20 mg of prednisone, 31 (25.2%) patients pulses of ciclophosphamide and 13 others immunosuppressant drugs. The SLEDAI median and mean were 14 (IQR 7-20) and 14.7 +/- 9.9 respectively. Nosocomial infection was reported in 38 (30.9%), 31 patients just one episode of infection and 13 more than one, with a total of 69 events.
In univariate analysis was noted that these factors were associated with nosocomial infections: de novo diagnosis, longer hospital stays, use of methylprednisone pulses in hospital or ciclophosphamide, SLEDAI index. In multivariate logistic regression persisted significant factors such as: longer hospital stay [OR= 5.16; (IC 95% 1.5-18) p= 0.01], use of methylprednisone [OR 3.95; (IC 95% 1.22-12.8) p= 0.02], SLEDAI index [OR 4.43; (IC 95% 1.16-16.8) p=0.03], chronic renal insuffiency [OR 5.44; (IC 95% 1.19-24.7) p= 0.03] and 20 mg or less of prednisone [OR 0.16; (IC 95% 0.03-0.95) p= 0.04].
The microorganism was isolated in 81.2% (56 events): baciles gram negative 49.3% (34), coccos gram positives 26.1% (28), fungi, hemoparasites and virus in 14.5% (10). The infections was documented from genitourinary tract in 37.7% (26), blood stream 26.1% (18), respiratory tract 11.6% (8), etc.
Fourteen patients died, six from uncontrolled infections, two for activity illness, one for both infections and illness activity, three from cardiovascular causes and one unknown.
Conclusion: in our SLE Colombian population almost one third of the patients had nosocomial infections that could be severe and cause major mortality. The infections were associated with higher activity of the illness, pulses of methylprednisone, chronic renal insufficiency and longer hospitalized stay.
Key words: lupica activity, nosocomial infection, SLEDAI, LES.
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad crónica, multisistémica y de etiología desconocida que afecta con predominio al género femenino. Los pacientes con LES tienen mayor morbilidad y mortalidad que la población general1,2 y ello está determinado por una combinación de la actividad inflamatoria de su enfermedad y la presencia de infección3,4. La mortalidad en el LES ha sido descrita con una presentación bimodal2,3 y es indudable que la infección juega un papel en las muertes.
En diferentes estudios se ha analizado la relación entre LES e infección, con resultados contradictorios sobre los factores de riesgo5, 6 y coincidencia en el tipo de gérmenes que comprometen a estos pacientes5-17. Se han invocado como factores asociados a la presentación de complicaciones infecciosas en la entidad la actividad inflamatoria de la misma5,6, el uso de medicamentos inmunosupresores como corticoesteroides7,8 o ciclofosfamida9, 10 y otros citotóxicos o inmunomoduladores como azatioprina, ciclosporina, metotrexate, micofenolato mofetil y gammaglobulina I. V. 5,11. Particularmente, la actividad inflamatoria medida por el índice SLEDAI se ha asociado con riesgo de infección en algunos estudios6, pero ha sido descartada en otros5,9. Adicionalmente, no se ha explorado de manera precisa la asociación entre actividad inflamatoria y riesgo de infección nosocomial; a pesar de que esta última puede tener un mayor impacto en morbilidad, mortalidad y costos hospitalarios.
El objetivo de este estudio fue determinar los factores asociados con infección nosocomial en pacientes con diagnóstico de LES, antiguo o nuevo, que requirieron manejo hospitalario en nuestra institución. Específicamente, buscamos establecer la asociación entre el índice de actividad SLEDAI medido al ingreso a la institución y el riesgo posterior de desarrollar infección nosocomial.
Pacientes y métodos
Diseño y población de estudio
Este es un estudio de cohorte prospectivo cuya población está constituida por pacientes con LES, de acuerdo con los criterios de clasificación del American College of Rheumatology _ACR_18,19, que fueron internados en el Hospital Universitario en Medellín, Colombia, entre enero de 2001 y diciembre de 2004. Se excluyeron aquellas personas con LES a quienes se les demostró infección adquirida en la comunidad o que la manifestaran dentro de las primeras 48 horas del ingreso; además, a quienes presentaran cualquier tipo de neoplasia o infección por HIV.
Mediciones
La actividad de la enfermedad fue cuantificada mediante la aplicación del SLEDAI20, para lo cual se estableció promedio y mediana y tal como fue previamente definido por Cook et al. 4, con base en los rangos del índice, se considera la actividad de la siguiente forma: 0 = no activo, 1-5 = leve, 6-10 = moderada, 11-19 = severa, > 20 = muy severa. Como factores potencialmente relacionados con el riesgo de infección también se consideraron género, edad, tiempo de diagnóstico del LES, estancia hospitalaria al momento de la infección nosocomial, uso de corticoesteroides (dosis acumulada del último mes y bolos de metilprednisolona durante la hospitalización), Ciclofosfamida (dosis total acumulada y dosis hospitalaria), el uso de otros medicamentos (azatioprina, ciclosporina, metotrexate, micofenolato mofetil y gammaglobulina intravenosa), la presencia de nefritis como parte del diagnóstico de LES, y el diagnóstico de insuficiencia renal crónica (IRC).
La infección fue definida con base en el aislamiento del germen, y según los criterios del Centro de Control de Enfermedades de los Estados Unidos (CDC) para diagnóstico de infección nosocomial21. Estos criterios, igualmente, suministran definiciones aceptadas para infección incluso en los casos sin confirmación microbiológica. En estos pacientes también se determinó el tipo de compromiso infeccioso, el germen y la causa de mortalidad.
Análisis estadístico
Las variables categóricas se presentan como proporciones, y las variables continuas u ordinales como promedios con desviación estándar o medianas con rangos intercuartílicos, respectivamente. En el análisis exploratorio de los datos se verificó la presencia de valores extremos o las inconsistencias en el registro. Igualmente, se corroboró la utilidad de las medianas como puntos de corte para las variables continuas por medio de un modelo no paramétrico de regresión local ajustada22. Específicamente, la relación lineal entre el índice SLEDAI y el riesgo de infección nosocomial, este último expresado como el log-odds (logaritmo [p/1-p]) de la probabilidad de infección, se exploró por medio de la representación gráfica de esa regresión.
En el análisis univariable se usaron pruebas estadísticas paramétricas o no paramétricas, de acuerdo con la distribución de los datos. La presencia de factores de confusión se evaluó por medio de un modelo de regresión logística múltiple que incluyó todas las variables previamente descritas. Para estos análisis sólo se consideraron la primera hospitalización de los pacientes y el primer episodio infeccioso. Se verificaron como supuestos de la regresión la ausencia de multicolinearidad y de interacción entre variables clínicamente relacionadas como índice SLEDAI, tiempo de diagnóstico de LES y uso de ciclofosfamida. La multicolinearidad se determinó por medio de un factor de inflación de la varianza mayor de 10 y los términos de interacción se evaluaron con una prueba de razón de verosimilitud menor de 0,0523. Para las variables ordinales se emplearon variables sustitutas ("dummy"), en las cuales los valores incrementales se comparan con los valores de referencia de esa misma variable. Los resultados del modelo logístico se presentan con medidas de riesgo relativo indirecto (odds ratio) con sus respectivos intervalos de confianza del 95%. Todo el manejo de datos se hizo con los programas EpiInfo 2002 (CDC, Atlanta, GA, USA) y Stata 8. 2 (Stata Co, College Station, TX, USA).
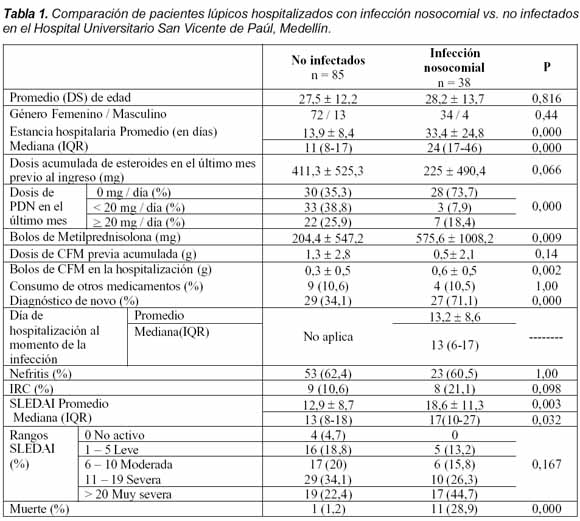
Resultados
Ingresaron al estudio 123 pacientes que tuvieron 155 hospitalizaciones (100 con una, 16 con dos, cinco con tres y dos con cuatro). De ellos, 106 (86,2%) fueron mujeres y 17 (13,8%) hombres, con una edad promedio de 27,7 ± 12,6 años (rango 7-73). Tuvieron diagnóstico de primera vez 56 pacientes (45,5%) y para los 67 pacientes con diagnóstico previo de LES, el tiempo de diagnóstico al momento de la hospitalización fue en promedio de 51,0 ± 57 meses. Ingresaron en falla renal crónica 25 pacientes (20,3%), de los cuales 10 (8,1%) estaban en terapia dialítica. El promedio y mediana de SLEDAI fue de 14,7 ± 9,9 (rango 0-46) y 14 (IQR 7-20), respectivamente. La actividad de la enfermedad fue severa o muy severa en el 76,8% de los pacientes con LES de novo y en el 47,8% de los pacientes con LES previo. De los 123 pacientes, 38 (30,9%) cursaron con infección nosocomial en su primera hospitalización. Teniendo en cuenta todas las 155 hospitalizaciones, 33 pacientes (21,3%) tuvieron al menos una infección, 6 (3,9%) tuvieron dos, 5 (3,2%) tuvieron tres, 1 (0,6%) tuvo cuatro y otro más (0,6%) tuvo cinco infecciones, para un total de 69 episodios de infección. De los 123 pacientes, 58 (47,1%) no consumían prednisolona, 36 (29,3%) la recibían a dosis menores de 20 mg/día o su equivalente, y 29 (23,6%) recibían más de 20mg/día. 31 sujetos (25,2%) habían utilizado previamente ciclofosfamida en bolos mensuales y 13 (10,6%) habían recibido otros medicamentos como azatioprina, metotrexate, micofenolato mofetil y gammaglobulina intravenosa. En la Tabla 1 se muestra la comparación entre los pacientes que presentaron infección intrahospitalaria y los que no, destacándose con significado estadístico el tiempo de estancia hospitalaria (p < 0,0001), la dosis de prednisolona en el último mes (p < 0. 0001), la dosis de bolos de metilprednisolona (p = 0,009), la dosis de bolos de ciclofosfamida (p = 0,002), el diagnóstico de primera vez (p = 0,001), y el promedio y mediana de SLEDAI (p = 0,003 y p = 0,032, respectivamente). Así mismo, la mortalidad fue casi 20 veces mayor en los pacientes con infección nosocomial (p < 0,0001). En el consumo de prednisolona del último mes se aprecia como tres de 36 pacientes (8,3%) que consumían una dosis inferior o igual a 20 mg/d, y 7 de 29 pacientes (24,1%) que usaban dosis mayores de 20mg/d se infectaron, lo que muestra un incremento en la frecuencia de infección de casi tres veces en el grupo de mayor dosis.
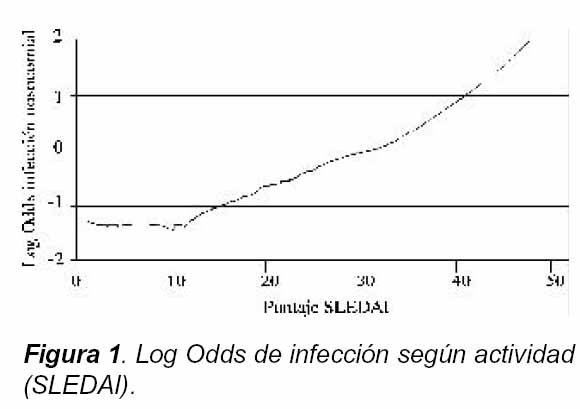
La relación lineal entre el índice SLEDAI al ingreso y el log-odds de infección nosocomial se muestra en la Figura 1.
En el modelo de regresión logística múltiple (Tabla 2) se confirma la asociación entre la mediana global del índice SLEDAI [14] y el mayor riesgo de infección nosocomial [OR: 4,4 (IC 95% 1,2-16,8) p = 0,03]. Otros factores significativamente asociados fueron la mediana de estancia hospitalaria medida en los pacientes no infectados [OR 5,2 (IC 95% 1,5-18,1) p= 0,01], los bolos de metilprednisolona durante la hospitalización [OR: 3,9 (IC 95% 1,2-12,8) p = 0,02], la IRC [OR: 5,4 (IC 95% 1,2-24,7) p = 0,03] y el uso de prednisolona del último mes. No se encontró evidencia de multicolinearidad o interacción entre las variables analizadas en el modelo.
Teniendo en cuenta todas las hospitalizaciones se obtuvieron 69 episodios de infección nosocomial, con aislamiento del germen en 56 ocasiones (81,2%) (Tabla 3). Del total de aislamientos 34 (49,3%) fueron bacilos gram negativos y 18 (26,1%) cocos gram positivos. Hongos, hemoparásitos y virus se consideraron responsables en 10 casos (14,5%) por identificación clínica o de laboratorio y en 13 casos (18,8%) no se pudo identificar el agente causal. Seis pacientes presentaron infección polimicrobiana. Merece relación aparte el caso del paciente con malaria intrahospitalaria por Plasmodium Falciparum. El paciente provenía de un zona no endémica e ingresó por LES activo, no fue transfundido, y trece días después por episodio febril en un extendido de sangre periférica se identifican trofozoitos de Plasmodium Falciparum (14. 000/mm3). Su única posibilidad de trasmisión es por su compañero de cuarto hospitalizado con malaria por el mismo agente. Eventos similares han sucedido en nuestro hospital. Por todo lo anterior la consideramos como infección nosocomial.
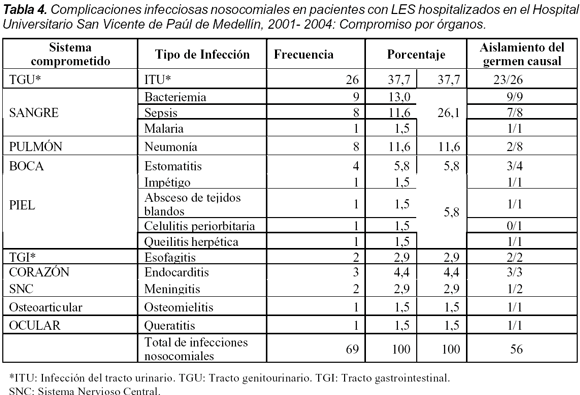
El compromiso por órganos fue más común en el tracto genitourinario con 26 casos (37,7%), seguido de infección del torrente sanguíneo en 18 (26,1%) y pulmonar en ocho (11,6%) (Tabla 4). De los 123 pacientes hospitalizados fallecieron 14 (11,4%) y su causa se discriminó así: directamente por la infección seis, por actividad de la enfermedad dos, infección más actividad uno, de origen vascular tres (ECV, Infarto agudo del miocardio y tromboembolismo pulmonar), uno por hemorragia luego de biopsia renal y otro de causa desconocida. Ocho pacientes murieron durante la hospitalización y seis luego del alta.
Discusión
Los pacientes con LES son hospederos inmunocomprometidos susceptibles a infecciones diversas. Esta situación tiene que ver con defectos, tanto en la inmunidad humoral como celular, propios de la enfermedad24-27. Así mismo, los medicamentos inmunosupresores utilizados para el tratamiento, como corticoesteroides y citotóxicos, aumentan la predisposición a sufrir infecciones5, 7, 10, 28, 29. Sin embargo, no todos los estudios coinciden en la influencia de los inmunosupresores para el desarrollo de infección12, 13, 30 y otros no encuentran asociación con actividad lúpica, que es precisamente el momento en el curso clínico de la enfermedad cuando los defectos inmunes están incrementados30, 31.
Las infecciones son comunes en LES y han sido descritas con una frecuencia que oscila entre 17 y 41% en pacientes ambulatorios u hospitalizados4, 5, 9, 27, 31, 32 lo que demuestra de forma global que los pacientes con LES tienen una alta probabilidad de infectarse y en muchas oportunidades de manera severa14, 33-35.
En nuestra experiencia 46 pacientes, el 29,7% de 155 hospitalizaciones, se complicaron con infección nosocomial en lo que coincidimos con los resultados de Duffy et al. 36) quienes en un estudio durante cinco años encontraron 33,3% de infección en 176 admisiones al hospital pero difieren de lo reportado en niños con LES por Chen et al. 37 que es mucho más baja.
Dentro de los factores asociados con un mayor riesgo de infección nosocomial, encontramos la actividad lúpica medida en promedios y mediana del SLEDAI con significancia estadística tanto en el análisis univariado como en el multivariado, de manera similar a lo encontrado en otros estudios6, 27, 32. Reforzando la anterior asociación está lo encontrado por nosotros en el análisis de Log odds que cuando los pacientes tienen una mediana superior a 14 la posibilidad de infección nosocomial es directamente proporcional. Sin embargo, es importante tener en cuenta la baja comparabilidad de los diferentes estudios dadas las diferencias metodológicas, el tipo de población estudiada, la diferencia en las infecciones y la consideración de las adquiridas en comunidad, entre otros.
En ambos tipos de análisis se mantiene la asociación de infección intrahospitalaria con la estancia y en ello coincidimos parcialmente con Duffy et al. 36 quien encontró relación pero solo en el análisis univariado.
Respecto a los medicamentos, los bolos de metilprednisolona empleados durante la hospitalización confieren un riesgo 3,4 veces mayor de infección que el no haberlos utilizado, de manera similar a lo reportado por Noel et al. 9. Algo diferente ocurrió con los pacientes que crónicamente venían con dosis bajas de prednisolona (< 20mg/d), los cuales presentaron menos infecciones que los que no la usaban o estaban con una dosis superior. No hubo relación a favor del riesgo con la dosis acumulada de prednisolona durante el último mes. Algunos de estos aspectos han sido reseñados por la literatura como el aparente factor protector de bajas dosis de corticoesteroides, como si ellos a dichas dosis corrigieran las alteraciones inmunes que conllevan a inmunosupresión intrínseca en LES, lo cual es llamativo8,36, aunque existen informes contradictorios con estos resultados38.
En cuanto a ciclofosfamida parenteral no encontramos asociación con infección con respecto a la dosis total acumulada pero sí con su uso en forma de bolos dentro de la hospitalización. La ciclofosfamida ha sido señalada en diferentes estudios por su asociación con infección con su empleo intravenoso pero no con el tiempo de utilización10 o con su uso y dosis acumulada9, además existen estudios que no la han asociado31.
A pesar que el número de pacientes con otros inmunosupresores es bajo podemos decir que no encontramos asociación con su uso e infección nosocomial tal como ha sido referido por diferentes autores6, 31, aunque existen informes en contravía de estos hallazgos5, 7, 11.
Nuestros resultados en cuanto a la presencia de nefritis no coinciden con otros estudios que la han asociado con infección en LES5, 6, 9, 36. En nuestro análisis de regresión logística múltiple sí encontramos asociación con la presencia de insuficiencia renal crónica.
En el presente estudio encontramos asociación con infección con las siguientes variables: tiempo más corto de evolución de la enfermedad y diagnóstico de primera vez y tal vez ello dependa del alto número de pacientes con diagnóstico de novo (56 pacientes) y a que nuestro hospital es un centro de referencia y exista un sesgo de selección al recibir pacientes con LES de alta complejidad, lo que se correlaciona con la alta actividad de estos pacientes con diagnóstico de primera vez (SLEDAI: promedio 18,41±10,24 y mediana de 16,5).
En ambos tipos de análisis aparece la estancia hospitalaria con significado estadístico para asociación con infección intrahospitalaria, pero consideramos que este resultado responde a un efecto dual pues fundamentalmente la estancia hospitalaria mayor se asoció con más propensión a infección y adicionalmente como consecuencia de la misma infección, los pacientes complicados con infección tienen una más larga duración de la hospitalización que los que no la presentan, ya que la mediana de estancia hospitalaria de todos los pacientes fue de 14 días y la mediana hasta el momento del diagnóstico de infección nosocomial fue de 13 días.
La posibilidad de morir fue mayor en los pacientes que presentaron infección intrahospitalaria con significado estadístico [p<0,00001 y OR 18,9 (IC 95%: 4,02-88,6)] y ello quizás tenga que ver con la severidad de las infecciones que ocurrieron, la alta actividad de la enfermedad y el uso de potente inmunosupresión empleada para el control de esta última.
Este estudio cuenta con limitantes como es su tamaño de muestra que es posible que no nos permita otras asociaciones importantes sino las características de nuestro centro por ser de referencia; nos enfrenta a lupus con un alto grado de severidad y probablemente no sea un reflejo de las características generales más comunes de la enfermedad; sin embargo, nos alerta sobre una de las complicaciones más temidas como es la infección nosocomial.
Los resultados del presente estudio sugieren que los pacientes con LES activo cuando requieren hospitalizarse con frecuencia se infectan y en muchas ocasiones de forma severa, aumentando su mortalidad. Todo esto obliga a mantener cuidado especial en la dosificación de la inmunosupresión, en especial con corticoesteroides y ciclofosfamida.
Referencias
1. Stahl-Hallegren C, Jonsen A, Nived O, Stuferlt G. Incidence studies of systemic lupus erythematosus in southern Sweden: increasing age, decreasing frequency of renal manifestations and good prognosis. J Rheumatol 2000; 27: 685-691. [ Links ]
2. Björnadal L, Yin L, Granath F, et al. Cardiovascular disease a hazard despite improved prognosis in patients with systemic lupus erythematosus: results from a swedish population based study. J Rheumatol 2004; 31: 713-719. [ Links ]
3. Urowits MB, Bookman AAM, Koehler BE, et al. The bimodal mortality pattern of systemic lupus erythematosus. Am J Med 1976; 60: 221-225. [ Links ]
4. Cook RJ, Gladman DD, Pericak D, Urowitz MB. Prediction of short term mortality in systemic lupus erythematosus with time dependent measures of disease activity. J Rheumatol 2000; 27: 1892-1895. [ Links ]
5. Gladman DD, Hussain F, Ibañez D, Urowitz MB. The nature and outcome of infection in systemic lupus erythematosus. Lupus 2002; 11: 234-239. [ Links ]
6. Zonana-Nacach A, Camargo-Coronel A, Yañez P, et al. Infections in outpatients with systemic lupus erythematosus: a prospective study. Lupus 2001; 10: 505-510. [ Links ]
7. Petri M. Infection in systemic lupus erythematosus. Rheum Dis Clin North Am 1989; 24: 954-963. [ Links ]
8. Stuck AE, Minder CE, Frey FJ. Risk of infection complications in patients taking glucocorticosteroids. Rev Inf Dis 1989; 11: 954-963. [ Links ]
9. Noel V, Lortholary Ocasassus P, et al. Risk factors and prognostic influence of infection in a single cohort of 87 adults with systemic lupus erythematosus. Ann Rheum Dis 2001; 60: 1141-1144. [ Links ]
10. Pryor BD, Bologna Sb, Kahl LE. Risk factors for serious infection during treatment with cyclophosphamide and high-dose corticosterois for systemic lupus erythematosus. Arthritis Rheum 1996; 39: 1475-1482. [ Links ]
11. Kang I, Park SH. Infectious complications in SLE after immunosuppressive therapies. Curr Opin Rheumatol 2003; 15: 528-534. [ Links ]
12. Rubin LA, Urowitz MB, Gladman DD. Mortality in systemic lupus erythematosus: the bimodal pattern revisited. Q J Med 1985; 55: 87-98. [ Links ]
13. Ginzler EM, Diamond HS, Kaplan D, Schlesinger M, Marino CT, Weiner M., et al. Computer analysis of factors influencing frequence of infection in systemic lupus erythematosus. Arthritis Rheum 1978; 21: 37-44. [ Links ]
14. Ramírez LA, Builes CA, Maya C, et al. Lupus eritematoso sistémico en niños. Rev Col Reumatol 1998; 5: 11-17. [ Links ]
15. Hidalgo-Tenorio C, Jiménez Alonso J, Luna J, et al. Urinary tract infections and lupus erythematosus. Ann Rheum Dis 2004; 63: 431-437. [ Links ]
16. Feng PH, Tan TH. Tuberculosis in patiens with systemic lupus erythematosus. Ann Rheum Dis 1982; 41: 11-14. [ Links ]
17. Mancini MI, Vásquez G, Velásquez M, et al. Lupus eritematoso sistémico y tuberculosis. ¿Una asociación que determina mayor severidad? (Presentación de casos). Rev Col Reumatol 2003; 10: 163. [ Links ]
18. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25: 1271-1277. [ Links ]
19. Hochberg MC. Updating the American College of rheumatology revised criteria for the classification of systemic lupus erythematosus (Letter). Arthritis Rheum 1997; 40: 1725. [ Links ]
20. Liang Mh, Socher SA, Larson MG, Schur PH. Reliability and validity of six systems for the clinical assessment of disease activity in systemic lupus erythematosus. Arthritis Rheum 1989; 32: 1107-1118. [ Links ]
21. Garner JS, Jarvis WR, Emori TG, et al. CDC definitions for nosocomial infections. In: Olmsted RN, ed: APIC infections control and applied epidemiology: principles and practice. 1996; A1-A20. [ Links ]
22. Loader C. Local regression and likelihood. New York: Springer-Verlag. 1999; 1-38. [ Links ]
23. F. Hamilton LC. Statistics with Stata. Belmont: Duxbury Thomson Learning. 2003; 166-170. [ Links ]
24. Yen JH, liu HW, Lin SF, et al. Erythrocyte complement receptor type 1 in patients with systemic lupus erythematosus. J Rheumatol 1989; 16: 1320-1325. [ Links ]
25. Frank M, Hamburger M, Lawhey T, et al. Defective reticuloendothelial system. Fc receptor fuction in systemic lupus erythematosus. New Engl J Med 1979; 300: 518-523. [ Links ]
26. Iliopoulus A, Tsokos G. Immunopathogenesis and spectrum infections in systemic lupus erythematosus. Semin Arthritis Rheum 1996; 25: 318-336. [ Links ]
27. Paty JG, Sienknecht CW, Tornes AS, et al. Impaired cell-mediated immunity in systemic lupus erythematosus. A controlled study of 23 untreated patients. Am J Med 1975; 59(6): 769-779. [ Links ]
28. Kahl LE. Herpes zoster infections in systemic lupus erythematosus: Risk factors and outcome. J Rheumatol 1994; 21: 84-86. [ Links ]
29. Suh C-H, Jeong S, Park H-C, et al. Risk factors for infection and role of c-reactive protein in Korean patients with systemic lupus erythematosus. Clin Exp Rheumatol 2001; 19: 191-194. [ Links ]
30. Oh HM, Boey ML, Feng PH. Infections in systemic lupus erythematosus. Singapore Med J 1993; 34: 406-408. [ Links ]
31. Al-Mayouf SM, Al-Juman S, Bahabri S, Al-Eid W. Infections associated with juvenile systemic lupus erythematosus. Clin Exp Rheumatol 2001; 19: 748-750. [ Links ]
32. Petri M, Genovese M. Incidente of and risk factors for hospitalizations in Systemic lupus erythematosus: A prospective study of the Hopkins lupus cohort. J Rheumatol 1992; 19: 1559-1565. [ Links ]
33. Alarcón GS, Mcgwin Jr G, Bastian IM, et al. Systemic lupus erythematosus in three etnic group VII. Predictors of early mortality in the LUMINA cohort. Arthritis Rheum 1999; 45: 191-202. [ Links ]
34. Cervera R, Khamashta MA, Font J, et al. Morbidity and mortality in systemic lupus erythematosus during a 5-year period. A multicenter prospective study of 1000 patients. European working party on systemic lupus erythematosus. Medicine 1999; 78: 167-175. [ Links ]
35. Pons-Estel BA, Catoggio LJ, Cardiel MH, et al. The GLADEL multinational Latin American prospective inception cohort of 1,214 patients with systemic lupus erythematosus. Ethnic and disease heterogeneity among "hispanics". Medicine 2004; 83: 1-17. [ Links ]
36. Duffy Kn, Duffy CM, Gladman DD. Infection and disease activity in systemic lupus erythematosus: A review of hospitalized patients. J Rheumatol 1991; 18: 1180-1184. [ Links ]
37. Chen YS, Yang YH, Lin YT, Chiang BL. Risk of infections in hospitalized children with systemic lupus erythematosus: Clin Rheumatol 2004; 23: 235-238. [ Links ]
38. Juarez M, Misischia DU, Alarcon GS. Infections in systemic connective tissue diseases: Systemic lupus erythematosus, scleroderma, and polymyositis/dermatomyositis. Rheum Dis Clin North Am 2003; 29: 163-184. [ Links ]