Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. v.15 n.2 Bogotá abr./jun. 2008
INVESTIGACIÓN ORIGINAL - GUÍA ACADÉMICA
Guía de tratamiento de la artritis reumatoide temprana en un Hospital Universitario de Colombia
Guideline on treatment of early rheumatoid arthritis in a University Hospital of Colombia
Claudia Mora K.1, Andrés González1, Gerardo Quintana L2.
1Residente de primer año, Servicio de Reumatología. Hospital Militar Central. Bogotá, Colombia.2Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia. Servicio de Reumatología, Hospital Militar Central, Bogotá, Colombia.
Recibido para publicación: enero 15 de 2008. Aceptado en forma revisada: mayo 18 de 2008.
Resumen
La artritis reumatoide es una enfermedad crónica y prevalente que genera importante morbilidad y discapacidad. La literatura reciente evidencia que el abordaje temprano y en algunos casos agresivo de la patología puede cambiar de forma significativa el curso clínico de la enfermedad. El objetivo de este trabajo es establecer recomendaciones dirigidas a orientar el manejo de pacientes con artritis reumatoide temprana basados en la revisión estructurada de la literatura en concordancia con las condiciones actuales del sistema de salud colombiano. Se dan pautas generales en cuanto al abordaje diagnóstico y se definen recomendaciones en los aspectos de tratamiento no farmacológico y tratamiento farmacológico con antiinflamatorios no esteroideos, esteroides, medicamentos modificadores de la enfermedad e inhibidores del factor de necrosis tumoral alfa.
Palabras clave: artritis reumatoide temprana, guía de manejo, tratamiento, medicamentos modificadores de enfermedad, inhibidores del factor de necrosis tumoral.
Summary
Rheumatoid arthritis is a chronic and prevalent disease that generates important morbidity and incapacity. Recent literature suggests the importance of the early treatment in order to change the clinical course of the disease. The objective of this work is to establish directed recommendations to orient the management of patients with early rheumatoid arthritis based on the structured review of literature in agreement with the present conditions of the Colombians health system. General rules about diagnosis will be given as well as recommendations in the aspects of non-pharmacological treatment and use of nonsteroidal anti-inflammatory drugs, steroids, disease-modifying anti-rheumatic drugs and anti-tumor necrosis factor alpha drugs.
Key words: early rheumatoid arthritis, guideline, treatment, disease-modifying anti-rheumatic drugs, anti-tumor necrosis factor alpha drugs.
Introducción
La artritis reumatoide (AR) es la poliartritis inflamatoria más común del adulto afectando el 1% de la población mundial1. Es una artropatía no benigna, inflamatoria y destructiva que sin tratamiento efectivo lleva a discapacidad produciendo limitación parcial en el 80% de los pacientes y limitación total en el 16% después de doce años de enfermedad. La capacidad laboral se restringe en 1/3 de los pacientes en un año y en 40% a los tres años1-5.
Genera disminución en la expectativa de vida de tres a dieciocho años y una carga monetaria importante para el sistema de salud derivada de los costos directos secundarios a la atención de los pacientes y de los indirectos por la incapacidad laboral que ocasiona. El control de la enfermedad y el inicio de rehabilitación temprana disminuyen estos costos en 21%1,2.
La importancia del diagnóstico temprano radica en:
- El daño radiológico, la pérdida de funcionalidad y la pérdida de densidad mineral ósea axial y periférica ocurren en el curso temprano de la enfermedad.
- La duración de la enfermedad es factor predictor de la respuesta a medicamentos modificadores de enfermedad (DMARD) y su inicio temprano ofrece mejor pronóstico. De manera similar se constituye una ventana de oportunidad terapéutica para la mayoría de los grupos farmacológicos en cuanto a su perfil de eficacia y seguridad, incluyendo la terapia biológica, con mayor probabilidad de remisión en los primeros tres meses de enfermedad.
- La discapacidad puede reducirse entre más temprano se inicie el tratamiento y más agresivo sea; una demora en solo tres meses en el inicio de DMARD produce un pobre desenlace a cinco años comparado con el inicio previo de estos medicamentos.
Por estas razones es fundamental reconocer de forma prematura al paciente con enfermedad inflamatoria articular para realizar el diagnóstico temprano de AR y así mismo cumplir los objetivos del tratamiento: aliviar el dolor, controlar la inflamación, preservar la habilidad, mejorar la calidad de vida y prevenir la destrucción articular, permitiendo además la reducción de los costos en el sistema de salud y todos sus componentes (Sociedad, Gobierno, EPS, IPS y paciente).
El objetivo de este estudio fue conducir una revisión estructurada de la literatura para identificar evaluaciones sobre manejo de la Artritis ReumatoideTemprana, con el ánimo de establecer una guía de manejo que sea aplicable y apropiada para el modelo de Salud en un Hospital Universitario en Colombia.
Materiales y métodos
Búsqueda de la bibliografía
Se realizó una búsqueda estructurada de la literatura usando las bases de datos científicas de la literatura: PubMed, Medline, Embase, Cochrane y Lilacs, hasta noviembre de 2007 en los idiomas inglés, francés o español. Fueron incluidas diferentes combinaciones de los siguientes términos de búsqueda: artritis reumatoide, artritis reumatoide temprana, tratamiento, uso de terapia biológica en artritis reumatoide temprana, guías de manejo. Todos los autores realizaron las búsquedas iniciales independientemente y luego se combinaron los resultados de sus búsquedas en una base de datos única y se retiraron los duplicados. Se tuvieron en cuenta trabajos originales, meta-análisis y revisiones de la literatura que fueran realizados en adultos. También se realizaron búsquedas secundarias de los estudios que aparecieran citados en los artículos seleccionados y que revisaran manualmente abstracts de congresos.
Selección de los estudios
Se pidió a los evaluadores que analizaran el tipo de estudio que más se ajustase al diseño adecuado para responder a la guía. Si sobre algún tópico existía un meta-análisis, los evaluadores podían utilizar las conclusiones de este como respuesta, no teniéndose en consideración los ensayos clínicos incluidos en él y revisándose únicamente de manera individual los ensayos clínicos aleatorizados de calidad excelente no incluidos. No obstante, muchas de las preguntas no podían contestarse con ensayos clínicos.
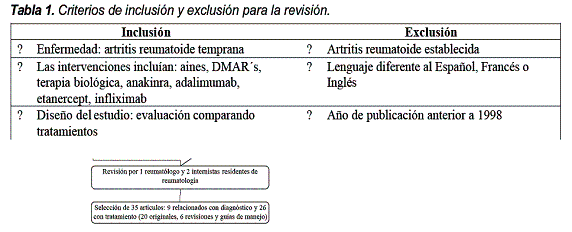
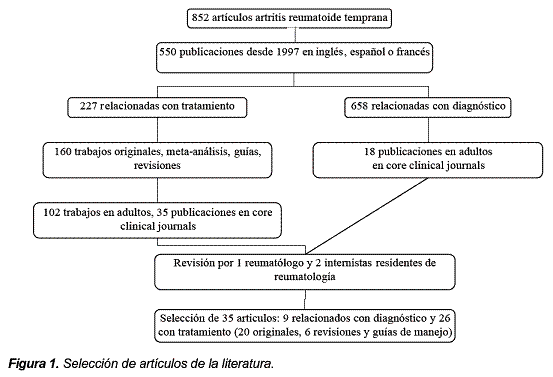
Esta búsqueda inicial produjo 852 resúmenes. Posteriormente se procedió a compilar la lista de resúmenes y manualmente fueron evaluados por uno de los revisores usando los criterios de inclusión y exclusión que son presentados en la Tabla 1.
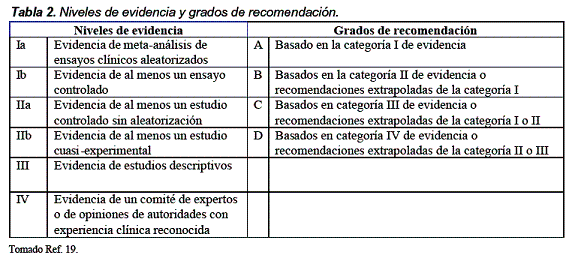
La revisión manual produjo 35 artículos, 9 relacionados con diagnóstico y 26 con el tratamiento. Las etapas de la búsqueda de la literatura son mostradas en la Figura 1. La lectura se hizo siguiendo las recomendaciones establecidas para la lectura crítica de artículos sobre diagnóstico, tratamiento y revisiones de la literatura6-9. Se usó una tabla de evidencia predefinida para extraer datos relevantes de los estudios identificados (Tabla 2). Esta información incluyó país, población, perspectiva del pagador, tiempo de evaluación, metodología, resultados y conclusiones establecidas por los autores. La extracción de datos fue confrontada independientemente.
Definición de artritis reumatoide temprana
En términos generales se considera AR temprana aquella de menos de un año de duración, aunque algunos autores acuñan el término de temprana si los síntomas llevan presentes menos de tres meses y muchos estudios incluyen pacientes con menos de dos años de síntomas.
Diagnóstico
Cuando el médico se enfrenta a un paciente con poliartritis inflamatoria generalmente realiza el diagnóstico de artritis indiferenciada pues menos de la mitad de los pacientes cumplen los criterios clasificatorios del American College of Rheumatology (ACR).
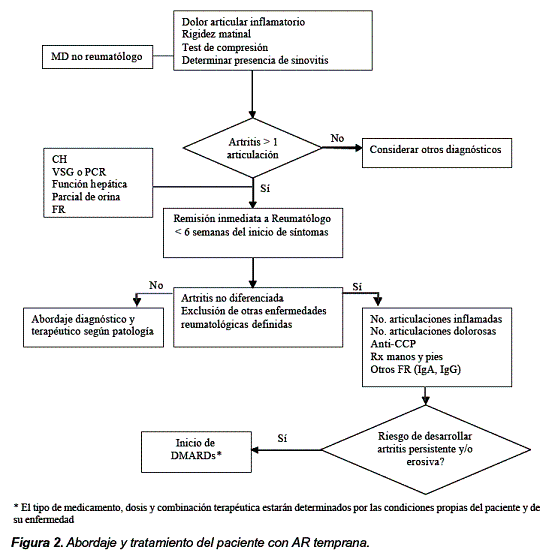
El abordaje (Figura 2) adecuado de estos pacientes incluye primero reconocer la presencia de artritis inflamatoria, luego descartar diagnósticos definitivos de artritis (lupus, artritis psoriásica, espondiloartritis, etc.) y por último estimar el riesgo de desarrollar una artritis persistente y/o erosiva5.
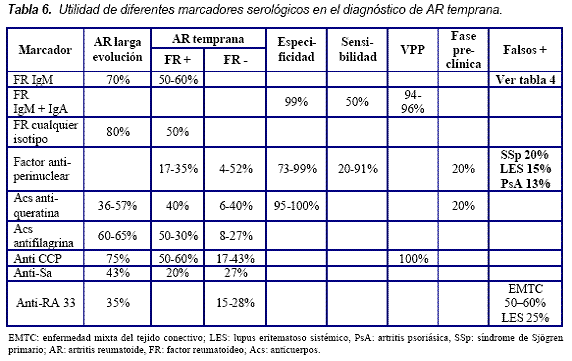
Se consideran pacientes con AR temprana aquellos con poliartritis simétrica y persistente asociada a factor reumatoideo (FR) y/o anticuerpos anti-citrulinas (anti- CCP) positivos5. El FR ha sido la herramienta serológica más importante en el diagnóstico de AR; sin embargo, en enfermedad establecida muestra una sensibilidad de 60% (rango entre 25 y 95%) y una especificidad de 79% (rango entre 31 y 95%). Durante los primeros seis meses de enfermedad menos del 50% de pacientes tienen FR positivo. Desde hace varios años los anti-CCP han demostrado ser una variable fundamental en la AR, no solo por tener una especificidad superior a la del FR sino por su capacidad de predicción de daño radiológico. La medición de anti-CCP ha demostrado ser muy específica en el diagnóstico de AR pero en los estudios iniciales detectaba solo el 48% de pacientes. Para mejorar la sensibilidad se desarrolló la técnica de ELISA II generación (anti-CCP2) que al modificar la estructura peptídica los hace altamente reactivos. Esta técnica tiene una sensibilidad de 68,5% (rango entre 39-94%) y una especificidad de 97 (rango entre 81 y 100%). Los anti-CCP realizados por ELISA de primera generación tienen una especificidad similar al de II generación pero una menor sensibilidad (54%, rango entre 41 y 68%)1. Recientemente se desarrolló un anti-CCP de tercera generación por INOVA que teóricamente ofrece mayor sensibilidad y especificidad que ELISA. Sin embargo, en un estudio reciente los ensayos CCP3 evaluados no fueron significativamente más sensibles que los de segunda generación (68,5%)10.
Se ha descrito la presencia de anticuerpos anticitrulinas en otras enfermedades reumatológicas (síndrome de Sjögren, lupus eritematoso sistémico, infección por hepatitis C, granulomatosis de Wegener, espondilitis anquilosante, artritis psoriásica) en baja frecuencia y con títulos bajos, menos de 60U/mL1.
Se estima que el 13 a 55% de poliartritis no diferenciadas entrarán en remisión espontánea, un tercio definen posteriormente una AR y el resto persiste como indiferenciada o desarrollan otro diagnóstico reumatológico (Tabla 3)11. Por lo tanto es fundamental determinar si nos encontramos frente a una AR, de lo contrario ante la ausencia de tratamiento adecuado incrementará el riesgo de daño permanente y la mortalidad. El uso de DMARD resulta en un score DAS28 (Disease Activity Score) menor cuando se tratan pacientes cuya duración de enfermedad es inferior a tres meses respecto a si el tratamiento se inicia cuando la enfermedad lleva doce meses (mejoría del DAS28 en 2,8 + 1,5 vrs 1,7 + 1,2 respectivamente)12.
De acuerdo con los criterios del ACR, para que un paciente sea clasificado como AR debe tener cuatro de los siete ítems y los síntomas deben cumplirse durante por lo menos seis semanas. Los criterios como poliartritis, nódulos, FR y cambios radiológicos pueden tardar años en evidenciarse y la necesidad de duración de síntomas durante por lo menos seis semanas demoraría aún más el diagnóstico. Además, la sensibilidad y especificidad de estos criterios no es óptima en la AR establecida (Tabla 4)13.
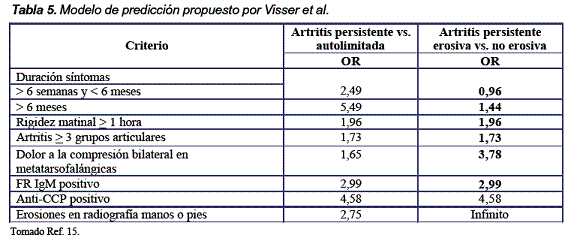
Por las razones ya anotadas, la historia clínica y el examen físico se convierten en la principal herramienta para la sospecha de una AR temprana. Los estudios sugieren que dos características de la historia proveen valor diagnóstico y pronóstico: rigidez matinal y duración de síntomas (Tabla 5).
La rigidez matinal es el tiempo que trascurre hasta la mejoría máxima después de un largo período de inactividad, típicamente compromete los dos lados del cuerpo, mejora con el movimiento y dura más de una hora. La sensibilidad de la rigidez matinal para el diagnóstico de AR temprana es 81% con especificidad de 57% y para la predicción de persistencia de artritis la sensibilidad es 58% y especificidad de 57%. La duración de síntomas mayor a seis semanas también predice la persistencia de artritis con una sensibilidad de 88% y especificidad de 52% y si es mayor a doce semanas la especificidad se incrementa. Igualmente el número de articulaciones inflamadas aumenta la probabilidad de tener una artritis inflamatoria persistente. Las características que no proveen información diagnóstica incluyen edad de inicio, simetría o compromiso de pequeñas articulaciones al inicio de los síntomas, inicio insidioso, historia de tabaquismo, historia familiar14, 15.
Factores que predicen remisión de síntomas incluyen ser hombre y edad mayor 60 años con un odds ratio (OR) para remisión en dos años de 3,9 y 3,2 respectivamente15.
Los pacientes con artritis inflamatoria presentan dolor sin inflamación, inflamación sin dolor, o dificultades en el desarrollo de sus actividades rutinarias sin edema o dolor evidentes. Al examen físico deben detectarse las características que distinguen la presencia o no de sinovitis14:
- Detectar presencia de calor, eritema, dolor a la palpación.
- Evaluar el rango de movimiento, fuerza y función muscular que puede limitarse alrededor de la articulación inflamada.
- Identificar la presencia de contracturas que indican inflamación actual o previa ya que el paciente de forma involuntaria adopta una postura en flexión parcial para disminuir el volumen y dolor articular.
- Eritema palmar o prominencia de venas en el dorso de manos y dedos reflejo de incremento en flujo vascular.
- Test de Compresión positivo o squeeze test que es la presencia de dolor al producir un apretón de manos a nivel del extremo distal y cabeza de metacarpianos o metatarsianos.
La capacidad de identificar sinovitis depende de la habilidad y experiencia del examinador. En un estudio se encontró que el acuerdo sobre la presencia o no de sinovitis en un grupo de reumatólogos alcanzó el 70% y al comparar el examen físico con imágenes como la resonancia magnética (RN) la evaluación clínica tuvo una sensibilidad de 43%, especificidad de 89% y precisión de 71%16:
Por esta razón se propuso utilizar el 'squeeze test' en artriculaciones metacarpofalángicas y metatarsofalángicas ya que tiene una especificidad mayor en la identificación de artritis persistente que el hallazgo de artritis en tres o más articulaciones o artritis simétrica.
Exámenes diagnósticos
El uso de FR para la clasificación temprana de la enfermedad no es útil. Aunque puede estar presente incluso años previos al inicio de los síntomas, aproximadamente un 20% de pacientes que cumplen los criterios de clasificación del ACR son seronegativos. La sensibilidad del FR para pacientes con síntomas de menos de un año oscila entre 17% y 59% siendo aún menor cuando los síntomas llevan menos de doce semanas de duración. Igualmente la especificidad del FR es baja pues tiene múltiples falsos positivos.
Aunque no es muy útil en establecer el diagnóstico, el FR es predictivo de enfermedad persistente y de progresión con daño radiológico en pacientes con artritis inflamatoria con un riesgo relativo de 2,99 para enfermedad erosiva (para FR IgM).
En la Tabla 6 están expuestos los diferentes marcadores serológicos propuestos en el diagnóstico de AR temprana.
Recientemente han sido estudiados otros marcadores bioquímicos buscando definir qué pacientes son proclives a presentar una enfermedad más agresiva y progresiva y por tanto a requerir un tratamiento más agresivo. Se ha descrito que niveles basales elevados de piridolina glucosil-galactosil urinaria (Glc-Gal-PYD), telopéptidos enlaces cruzados C-terminal de colágeno tipo I y II (CTX-I y CTX-II), metaloproteinasa de matriz 3 (MMP-3), proteína oligomérica de matriz de cartílago (COMP), calprotectina y marcadores de actividad osteoclástica como la relación Osteoprotegerina (OPG):RANKL se asocian con mayor riesgo de destrucción articular en el primer año de AR17.
En conclusión, los pacientes que se presentan con artritis de más de una articulación asociada a dolor o rigidez deben ser referidos al reumatólogo idealmente en las primeras seis semanas del inicio de síntomas y el especialista en reumatología debe determinar de forma inmediata si el paciente presenta factores predictores que sugieran la presencia de una enfermedad agresiva, rápidamente progresiva y con peor pronóstico para tomar la decisión de instaurar un tratamiento más agresivo reconociendo a su vez a los pacientes con enfermedad más benigna y evitar así toxicidad innecesaria derivada de un "sobre-tratamiento".
Tratamiento
1. Tratamiento no farmacológico
No hay ensayos clínicos en este campo en artritis temprana pero se considera que las recomendaciones pueden extrapolarse de las desarrolladas para AR establecida. Ejercicios articulares específicos dinámicos mejoran la fuerza y la función física en AR, la terapia ocupacional ejerce un efecto positivo en el autocuidado y capacidad funcional. El paciente debe evitar el sobrepeso y es fundamental dejar de fumar pues está demostrado que el cigarrillo se correlaciona con mayor dolor, limitación funcional y progresión clínica y radiológica de la enfermedad18. El efecto del cigarrillo en la ocurrencia y la progresión de la AR permanece durante años después de la suspensión. Es necesario tener en cuenta que el paciente con actividad aguda de la enfermedad estará incapacitado para actividades que incluyan movimientos activos y/o pasivos y en ese período de tiempo se recomienda reposo.
Hay resultados variados en aspectos como hidroterapia, dieta, acupuntura, láser, estimulación nerviosa transcutánea, guantes de compresión, ultrasonido, termoterapia, uso de ortesis, homeopatía; en general, aquellos que muestran resultados favorables no tienen efecto en actividad de la enfermedad, únicamente en alivio de síntomas19.
2. Tratamiento farmacológico
Las erosiones ocurren de manera temprana y en más del 80% de pacientes que tienen menos de dos años de enfermedad hay evidencia radiológica de erosiones. El tiempo de enfermedad al momento del inicio de DMARD es el principal predictor de la respuesta a estos medicamentos y la evidencia que soporta su uso temprano para evitar daño articular y discapacidad es amplia.
El tratamiento debe monitorearse de forma cercana incluyendo evaluación de articulaciones dolorosas e inflamadas, evaluación global por el médico y por el paciente, VSG y PCR, determinación del DAS 28 y HAQ (Health Assessment Questionnaire). La valoración debe realizarse cada uno a tres meses hasta alcanzar la remisión y el daño estructural cada seis a doce meses con radiografías simples de manos y pies por los primeros años14.
- Aniti-inflamatorios no esteroideos: tanto los no selectivos como los COX-2 selectivos son más efectivos que analgésicos simples en la resolución de signos y síntomas relacionados con la actividad de la enfermedad. Debe valorarse previamente la posibilidad de efectos adversos gastrointestinales, renales o cardiovasculares de forma individualizada. Nivel evidencia Ia. Recomendación grado B.
- Glucocorticoides: la terapia sistémica en dosis de 10mg día de prednisona o su equivalente reduce el dolor y el edema y deben considerarse asociados a los DMARD. Sin embargo deben planearse idealmente como un recurso temporal, dados los efectos adversos derivados de su uso. Dosis superiores a 15mg día no ofrecen beneficio adicional y para garantizar un mejor efecto en la disminución de la rigidez, del dolor y de la actividad de la enfermedad debería dividirse en dos dosis diarias tratando de que la segunda sea lo más tarde posible. Un estudio demostró que el esteroide debe administrarse de acuerdo a la curva que describen las citoquinas pro-inflamatorias en el ritmo circadiano, esto es cuando el factor de necrosis tumoral alfa (TNF) está incrementando sus niveles. Según los hallazgos de este estudio hay mayor efecto al prescribir prednisona a las 2 a.m. frente a las 7 a.m. (cuando los niveles del TNF están en descenso)20, 21.
La aplicación de esteroides intraarticulares se considera para el alivio de síntomas locales inflamatorios. No hay evidencia suficiente que apoye la teoría de algunos autores acerca de una posible remisión en pacientes con artritis no diferenciada con el uso de una dosis única de esteroide intramuscular o intrarticular. Igualmente no hay evidencia contundente acerca de la posible efectividad de estos medicamentos en la disminución de la progresión radiológica en artritis temprana y establecida. Nivel de evidencia Ia. Recomendación A.
- DMARDs: el metotrexate (MTX) es efectivo durante largos períodos, se ha comprobado su eficacia en el control de la progresión radiológica y tiene un perfil de toxicidad mejor a otros medicamentos modificadores. Además puede combinarse con medicamentos bloqueadores del factor de necrosis tumoral alfa (anti-TNF ? ). Dos ensayos clínicos aleatorizados controlados evidenciaron una igualdad en la efectividad del metotrexate (dosis 20mg/semanal) comparado con terapia anti-TNF ? en AR temprana. La combinación de metotrexate con anti-TNF ? provee el máximo efecto terapéutico disponible actualmente tanto en AR temprana como establecida19. Leflunomida es tan efectiva como metotrexate en la disminución de progresión radiológica; sulfasalazina (SSZ), en cambio, al parecer, es inferior a leflunomida o metotrexate a largo plazo.
Puede considerarse el metotrexate como el medicamento de elección en AR tanto en monoterapia o combinada con otros DMARD con un Nivel de evidencia Ia, Recomendación A.
Hay amplia evidencia de que el tratamiento combinado con o sin agentes biológicos permite alcanzar la remisión clínica5. La combinación de DMARDs (MTX, SSZ con prednisona22 o MTX, SSZ, Hidroxicloroquina (HCQ) con prednisona23) ha demostrado ser superior a la monoterapia con tasas de remisión mayores, menor ausentismo laboral y menor progresión radiológica. Igualmente el uso de anti-TNF? , principalmente combinado con MTX, genera mayor tasa de remisión clínica y menor progresión radiológica comparado con monoterapia con el DMARD. El estudio BeSt comparó cuatro estrategias de tratamiento diferentes: monoterapia (MTX dosis inicio 15 mg/semanal con incremento hasta 25-30 mg/semana si el DAS44 ? 2,4), terapia combinada en dosis ascendentes (MTX dosis inicio 15 mg/semana hasta 25–30 mg/semana si DAS44 era ? 2,4 más adición de SSZ, HCQ y luego prednisona si no había respuesta), terapia combinada con prednisona (MTX 7,5 mg/semana, 2g/día de SSZ y 60 mg/día de prednisona con disminución a 7,5 mg/día en siete semanas) y anti-TNF con MTX (MTX 25-30 mg/semana con 3 mg/kg de infliximab semanas 0, 2, 6 y cada ocho semanas). Los dos últimos grupos mostraron una respuesta clínica más rápida y un mejor desenlace radiológico que la monoterapia secuencial o dosis incremental de DMARD sin diferencia significativa en efectos adversos o en suspensión de la terapia respecto a los demás grupos24.
El tratamiento combinado tiene un Nivel de evidencia Ib. Recomendación A.
- Inhibidores del factor de necrosis tumoral alfa (anti-TNF ? ).
En AR establecida los inhibidores del TNF alfa han demostrado una alta eficacia en el control de signos y síntomas, disminución de progresión de daño articular, mejoría en calidad de vida y preservación del estado funcional. Los estudios fármacoeconómicos han mostrado que los tres anti-TNF disponibles son costo-efectivos en AR severa25.
Diferentes estudios han evaluado el papel de los inhibidores del factor de necrosis tumoral alfa en la artritis reumatoidea temprana. Todos, en términos generales, demostraron que el uso de infliximab en dosis de 3mg/kg o 6mg/kg con MTX frente a MTX con placebo se relaciona con mayor posibilidad de cumplir criterios de respuesta ACR26, menor progresión radiológica27,28 y mayor probabilidad de mantener la capacidad laboral29 con resultados más favorables que en pacientes con AR establecida.
Además al utilizar MTX en dosis altas con infliximab como tratamiento inicial se observó que el 56% de los pacientes presentó remisión de la enfermedad permitiendo la suspensión del biológico y continuar mantenimiento con dosis bajas de metotrexate30. Otro estudio adicionalmente indagó sobre las preferencias de los pacientes entre el uso de múltiples DMARDs con prednisona y MTX con infliximab, reportando predilección por la estrategia que incluye el anti-TNF ?31. Sin embargo, éste es un estudio que obtiene sus conclusiones a partir de un cuestionario dirigido a los pacientes que participaron en el estudio BeSt24 dos años antes.
Igualmente hay evidencia que sostiene que el uso de etanercept y adalimumab frente a MTX produce menor actividad de la enfermedad, detención en la progresión radiológica y menor discapacidad laboral32,33 con una tolerancia adecuada y eficacia sostenida a los cinco años de su uso34.
Las enfermedades crónicas son una carga para el sistema de salud y una de las medidas más costo-efectivas es la prevención, lo que justifica, por ejemplo, la implementación de clínicas de riesgo cardiovascular. Desafortunadamente hasta el momento no es posible prevenir la aparición de enfermedades reumatológicas crónicas como la AR pero sí es posible evitar la discapacidad. Los pacientes que se presentan con menos de un año de enfermedad muestran respuesta (control de dolor, inflamación) en 53% mientras que grupos con uno a dos años, dos a cinco, cinco a diez y más de diez años muestran respuestas progresivas menores, medidas por criterios ACR20. Igualmente la oportunidad para la mejoría funcional se pierde a medida que se retrasa el tratamiento. La introducción temprana de la terapia anti-TNF demuestra no solamente mejoría en el daño estructural sino que la actividad de la enfermedad se controla de forma temprana y de manera sostenida no solo a los doce meses sino hasta dos años de seguimiento. Además las diferencias en calidad de vida y funcionalidad frente al placebo se mantienen a los dos años35.
Si se tiene en cuenta que los costos atribuibles a la enfermedad empiezan en los estadios tempranos, la mayor eficacia de los anti-TNF en AR temprana los hace aún más costo-efectivos y la evidencia de que un grupo importante de pacientes con AR temprana alcanzan remisión con estado funcional completo y sin daño estructural después del tratamiento con anti-TNF implica un ahorro importante para el sistema de salud. Además en pacientes con AR establecida, severa y/o refractaria los anti-TNF son efectivos pero deben continuarse indefinidamente para mantener la remisión y su suspensión implica recaída de la enfermedad. En AR temprana en cambio, dada la ventana de oportunidad, existe la posibilidad de persistencia de la remisión a pesar de la suspensión del biológico. El seguimiento a tres años de los pacientes incluidos en el estudio BeSt demostró que más pacientes pudieron desescalonar y suspender los medicamentos antirreumáticos sin perder remisión en el grupo 4 respecto a los otros grupos (17% frente a 10%, 5%, 9% respectivamente)36. Adicionalmente al ser pacientes un poco más jóvenes, con mejor estado de salud y menores comorbilidades y polifarmacia es posible que la frecuencia de eventos adversos sea menor con un menor impacto económico tanto monetario como intangible25.
A pesar de los resultados mencionados todos los estudios han comparado la terapia biológica con monoterapia. Igualmente no hay estudios comparando la efectividad de estos nuevos medicamentos con MTX parenteral.
En conclusión, la introducción temprana de los anti-TNF es efectiva y posiblemente sea mandatoria en pacientes con criterios de mal pronóstico pero solamente la realización de estudios clínicos que comparen estos medicamentos con la mejor combinación de DMARDs disponible y que incluyan una evaluación económica completa arrojarán respuestas concretas que justifiquen su implementación en un país como el nuestro, con recursos limitados y problemas graves derivados de la pobreza.
El modulador de co-estimuladores del linfocito T abatacept está siendo utilizado en Colombia en el tratamiento de la artritis reumatoide. Los estudios realizados hasta el momento sugieren que este medicamento es una opción aceptable por seguridad y eficacia para el tratamiento de pacientes con respuesta inadecuada a antiTNF.
Igualmente los estudios han incluido pacientes que no han recibido biológico pero en promedio tienen una duración de enfermedad mayor a 3 años. Se necesitan entonces más estudios, específicamente datos a largo plazo y dirigidos a pacientes con artritis temprana, que permitan establecer directrices claras respecto al uso de abatacept en ART43. Se estima que para el 2009 en enero finalizará un estudio que busca determinar la tasa de remisión con este medicamento en ART. (ClinicalTrials.gov Identifier NCT00122382).
Por otra parte medicamentos biológicos con acción anti-CD 20 como el rituximab no han sido evaluados en ART temprana y se reservan actualmente para casos refractarios a los inhibidores del factor de necrosis tumoral alfa o con contraindicación para el uso de los mismos. Se está desarrollando en el momento un ensayo clínico que busca explorar precisamente este tema (Clinical- Trials.gov Identifier NCT00396812).
El uso de terapia biológica tipo anti-TNF como inducción en AR temprana tiene un Nivel de evidencia Ib. Recomendación B.
- Criterios de remisión de la AR según ACR38:
- Rigidez matinal ausente o no mayor a 15 minutos.
- Ausencia de cansancio.
- Ausencia de dolor articular en la anamnesis.
- Ausencia de dolor articular a la presión.
- Ausencia de tumefacción sinovial y tenosinovial.
- Eritrosedimentación normal.
- Criterios de remisión de la AR según EULAR38:
- DAS 28 < 2,6 se considera ingreso en remisión.
Seguimiento
La evolución del paciente debe incluir el número de articulaciones inflamadas y dolorosas, evaluación global por el médico y por el paciente, VSG y PCR, DAS 28. La actividad de la enfermedad debe evaluarse cada uno a tres meses hasta alcanzar la remisión. El daño estructural debe evaluarse a través de radiografía simple cada seis a doce meses durante los primeros años. Durante el monitoreo de actividad puede complementarse con la evaluación de funcionalidad, usando el HAQ.
El objetivo final del tratamiento es alcanzar la remisión de la enfermedad y en este sentido deben distinguirse dos estadios diferentes. En el primero la remisión se define como el estado en que hay ausencia de actividad de la enfermedad sin el uso concomitante de medicamentos lo cual sería compatible con la cura de la AR. Este estado requiere la ausencia de evidencia clínica de artritis y de progresión de daño radiológico durante un período específico de tiempo en ausencia de tratamiento con DMARDs. Este tipo de remisión lo alcanza un pequeño porcentaje de pacientes y es inducido por medicamentos o es resultado del curso natural de la enfermedad (remisión natural). El segundo estadio incluye pacientes con baja actividad de la enfermedad durante el uso de DMARDs11.
Por lo tanto en el seguimiento de estos pacientes debe establecerse la respuesta al tratamiento y si presenta criterios de remisión.
Evaluación de respuesta al tratamiento
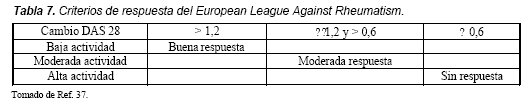
Los pacientes pueden clasificarse en: buenos respondedores, moderados respondedores y no respondedores (criterios de respuesta del European League Against Rheumatism –EULAR–) usando el cambio entre el DAS 28 basal y el nivel del mismo alcanzado luego del tratamiento (Tabla 7)37.
Es necesario advertir que si bien el DAS 28 es una guía útil para las decisiones terapéuticas, no debe reemplazar la evaluación cuidadosa del paciente con particular atención de las articulaciones no evaluadas en el mismo (caderas, tobillos y pies).
Criterios de remisión
Existen dos criterios de remisión de AR, uno establecido por el ACR y otro por el EULAR que se basa en la evaluación por DAS 28. Creemos importante tener en cuenta a ambos, ya que el primero se basa en una evaluación global y el segundo evalúa la remisión por el DAS 28.
La presencia de al menos cinco de estos criterios, durante dos meses o más son suficientes para catalogar a un paciente en remisión completa de su enfermedad.
Los pacientes en remisión de la enfermedad deben ser vistos cada seis o doce meses, mientras que los pacientes de reciente comienzo, brotes frecuentes o actividad persistente deben ser vistos cada mes o a demanda en caso de necesidad.
Conflictos de Interés: Los autores no declaran ningún conflicto de interés.
Referencias
1. Avouac J, Gossec L, Dougados M. Diagnostic and predictive value of anti-cyclic citrullinated protein antibodies in rheumatoid arthritis: a systematic literature review. Ann Rheum Dis 2006; 65: 845-851. [ Links ]
2. Guzmán R, Restrepo J. Artritis reumatoide temprana. Rev Colomb Reumatol 2002; 9(3): 171-175. [ Links ]
3. Choy EHS, Panayi GS. Cytokine pathways, and joint inflammation in rheumatoid arthritis. N Engl J Med 2001; 344: 907-176. [ Links ]
4. Merkesdal S, Ruof J, Schoffski O, et al. Indirect medical cost in early rheumatoid Arthritis. Arthritis Rheum 2001; 44: 528-534. [ Links ]
5. Combe B. Early rheumatoid arthritis: strategies for prevention and management. Best Pract Res Clin Rheumatol 2007; 21(1): 27-42. [ Links ]
6. Guyatt G, Sinclair J, Cook D, Glasziou P. Users' Guides to the Medical Literature: XVI. How to Use a Treatment Recommendation. JAMA 1999; 281: 1836-1843. [ Links ]
7. Guyatt G, Haynes B, Jaeschke R, et al. Users' Guides to the Medical Literature: XXV. Evidence-Based Medicine: Principles for applying the Users Guides to Patient Care. JAMA 2000; 284: 1290-1296. [ Links ]
8. McGinn T, Guyatt G, et al. Users' Guides to the Medical Literature: XXII: How to Use articles about clinical decision rules. JAMA 2000; 284: 79-84. [ Links ]
9. Dans A, Dans L, Guyatt G, Richardson S. Users' Guides to the Medical Literature: XIV. How to decide on the applicability of clinical trial results to your patient. JAMA 1998; 279: 545-549. [ Links ]
10. Lutteri L, Malaise M, Chapelle JP. Comparison of secondand third-generation anti-cyclic citrullinated peptide antibodies assays for detecting rheumatoid arthritis. Clin Chim Acta 2007; 386(1-2): 76-81. [ Links ]
11. Van der Helm-van Mil A, Breedveld F, Huizinga T. Aspects of early arthritis Definition of disease states in early arthritis: remission versus minimal disease activity. Arthritis Res Ther 2006; 8: 216. [ Links ]
12. Nell V, Machold K, Eberl G, Stamm T, Uffmann M, Smolen J. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology 2004; 43: 906-914. [ Links ]
13. Saraux A, Berthelot JM, Chales G, et al. Ability of the American College of Rheumatology 1987 criteria to predict rheumatoid arthritis in patients with early arthritis and classification of these patients two years later. Arthritis Rheum 2001; 44: 2485-2491. [ Links ]
14. Dao K, Cush J. Acute polyarthritis. Best Pract Res Clin Rheumatol 2006; 20(4): 653-672. [ Links ]
15. Visser H, Cessie S, Vos K, Breedveld F, Hazes J. How to Diagnose Rheumatoid Arthritis Early. A Prediction Model for Persistent (Erosive) Arthritis. Arthritis Rheum 2002; 46(2): 357-365. [ Links ]
16. Gormley G, Steele K, Gilliland D, et al. Can rheumatologists agree on a diagnosis of inflammatory arthritis in an early synovitis clinic?. Ann Rheum Dis 2001; 60: 638-639. [ Links ]
17. Landewé R. Predictive Markers in Rapidly Progressing Rheumatoid Artritis. J Rheumatol 2007; 34 Suppl 80: 8-15. [ Links ]
18. Klareskog L, Stolt P, Lundberg K, et al. New model for an etiology of rheumatoid arthritis: smoking may trigger HLADR (shared epitope)-restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum 2006; 54: 38-46. [ Links ]
19. Combe B, Landewe R, Lukas C, Bolosiu HD, Breedveld F, Dougados M, Emery P, Ferraccioli G, Hazes JMW, Klareskog L, Machold K, Martin-Mola E, Nielsen H, Silman A, Smolen J, Yazici H. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2007; 66: 34-45. [ Links ]
20. Arvidson NG, Gudbjornsson B, Larsson A, Hallgren R. The timing of glucocorticoid administration in rheumatoid arthritis. Ann Rheum Dis 1997; 56: 27-31. [ Links ]
21. Straub R, Cutolo M. Circadian Rhythms in Rheumatoid Arthritis Implications for Pathophysiology and Therapeutic Management. Arthritis Rheum 2007; 56(2): 399-408. [ Links ]
22. Landewe RB, Boers M, Verhoeven AC, et al. COBRA combination therapy in patients with early rheumatoid arthritis: long-term structural benefits of a brief intervention. Arthritis Rheum 2002; 46: 347-356. [ Links ]
23. Korpela M, Laasonen L, Hannonen P, et al. Retardation of joint damage in patients with early rheumatoid arthritis by initial aggressive treatment with disease-modifying antirheumatic drugs: five-year experience from the FIN-RACo study. Arthritis Rheum 2004; 50: 2072-2081. [ Links ]
24. Goekoop-Ruiterman YP, de Vries-Bouwstra JK, Allaart CF, et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arthritis Rheum 2005; 52: 3381-3390. [ Links ]
25. Kavanaugh A. Is there a pharmacoeconomic argument supporting the use of tumor necrosis factor inhibitors in early rheumatoid arthritis? Nat Clin Pract Rheumatol. 2006; 2(7): 346-347. [ Links ]
26. St.Clair E W, Van der Heijde D, Smolen J, Maini R, Bathon J, Emery P, Keystone E, Schiff M, Kalden J, Wang B, DeWoody K, Weiss R, Baker D. Combination of Infliximab and Methotrexate Therapy for Early Rheumatoid Arthritis, A Randomized, Controlled Trial. Arthritis Rheum 2004; 50(11): 3432-3443. [ Links ]
27. Breedveld FC, Emery P, Keystone E, Patel K, Furst DE, Kalden JR, St Clair EW, Weisman M, Smolen J, Lipsky P E, Maini RN. Infliximab in active early rheumatoid arthritis. Ann Rheum Dis 2004; 63: 149-155. [ Links ]
28. Smolen J, Van der Heijde D, St.Clair EW, Emery P, Bathon JM, Keystone E, Maini R, Kalden J, Schiff M, Baker D, Han C, Han J, Bala M. Predictors of joint damage in patients with early rheumatoid arthritis treated with high-dose methotrexate with or without concomitant infliximab. Results from the ASPIRE trial. Arthritis Rheum 2006; 54(3): 702-710. [ Links ]
29. Smolen J, Han C, Van der Heijde D, Emery P, Bathon J, Keystone E, Kalden J, Schiff M, Bala M, Baker D, Han J, Maini R, St.Clair W. Infliximab treatment maintains employability in patients with early rheumatoid arthritis. Arthritis Rheum 2006; 54(3): 716-722. [ Links ]
30. Van der Bijl AE, Goekoop-Ruiterman YP, Vries-Bouwstra JK, Ten Wolde S, Han KH, van Krugten MV, Allaart CF, Breedveld FC, Dijkmans BAC. Infliximab and methotrexate as induction therapy in patients with early rheumatoid arthritis. Arthritis Rheum 2007; 56(7): 2129-2134. [ Links ]
31. Goekoop-Ruiterman Y, de Vries-Bouwstra J, Allaart C, et al. Patient preferences for treatment: report from a randomised comparison of treatment strategies in early rheumatoid arthritis (BeSt trial). Ann Rheum Dis 2007; 66: 1227-1232. [ Links ]
32. Genovese M, Bathon J, Martin R, Fleischmann R, Keystone E, et al. Etanercept versus methotrexate in patients with early rheumatoid arthritis, two-year radiographic and clinical outcomes. Arthritis Rheum 2002; 46(6): 1443-1450. [ Links ]
33. Bathon JM, Martin RW, Fleischmann RM, Tesser JR, Schiff MH, Keystone EC, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. N Engl J Med 2000; 343:1586-1593. [ Links ]
34. Genovese M, Bathon J, Martin R, Fleischmann R, Keystone E, et al. Longterm safety, efficacy, and radiographic outcome with etanercept treatment in patients with early rheumatoid arthritis. J Rheumatol 2005; 32: 1232-1242. [ Links ]
35. Quinn MA, Emery P. Window of opportunity in early rheumatoid arthritis: Possibility of altering the disease process with early intervention. Clin Exp Rheumatol 2003; 21(Suppl. 31): S154-S157. [ Links ]
36. Allaart C, Breedveld F, Dijkmans B. Treatment of Recent- Onset Rheumatoid Arthritis: Lessons from the BeSt Study. J Rheumatol 2007; 34(Suppl. 80): 25-33. [ Links ]
37. Van Gestel AM, Anderson JJ, van Riel PL, et al. ACR and EULAR improvement criteria have comparable validity in rheumatoid arthritis trials. J Rheumatol 1999; 26: 705-711. [ Links ]
38. Felson DT, Anderson JJ, Boers M, et al. The American College of Rheumatology preliminary core set of disease activity measures for rheumatoid arthritis clinical trials. Arthritis Rheum 1993; 36: 729-740. [ Links ]
39. Goekoop-Ruiterman Y, de Vries-Bouwstra J, Allaart C, et al. Comparison of treatment strategies in early rheumatoid arthritis a randomized trial. Ann Intern Med 2007; 146: 406-415. [ Links ]
40. Nishimura K, Sugiyama D, Kogata Y, Tsuji G, Nakazawa T, Kawano S, et al. Meta-analysis: diagnostic accuracy of anticyclic citrullinated peptide antibody and rheumatoid factor for rheumatoid arthritis. Ann Intern Med 2007; 146: 797-808. [ Links ]
41. Conaghan PG, O'Connor P, McGonagle D, Astin P, Wakefield RJ, Gibbon WW, et al. Elucidation of the relationship between synovitis and bone damage: a randomized magnetic resonance imaging study of individual joints in patients with early rheumatoid arthritis. Arthritis Rheum 2003; 48: 64-71. [ Links ]
42. Burlingame RW, Piette AL, Binder WL. Development of CCP3, a more sensitive anti-Cyclic Citrullinated Peptide (CCP) ELISA. Manuscript in preparation. [ Links ]
43. Kremer JM, Genant HK, Moreland LW, Russell AS, Emery P, Abud-Mendoza C, et al. Effects of abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006; 144: 865-876. [ Links ]