Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. v.15 n.4 Bogotá out./dez. 2008
INVESTIGACIÓN ORIGINAL
Recibido: octubre 31 de 2008. Aceptado: diciembre 2 de 2008
Resumen
El Lupus Eritematoso Sistémico (LES) es una enfermedad heterogénea en su presentación clínica y serológica, pero factores raciales, etarios e inmunológicos determinan subgrupos más homogéneos tanto en sus manifestaciones como en su pronóstico. El LES en los hombres cursa con mayor actividad y daño acumulado y mayor frecuencia y gravedad del compromiso renal; los hombres afroamericanos tienen un rápido desarrollo de LES después del primer síntoma y manifestaciones graves renales, neurológicas, hematológicas y compromiso de las serosas desde el inicio de la enfermedad. El grupo de inicio antes de los 18 años cursa con mayor actividad, adenopatías, visceromegalias, citopenias y nefritis mientras que los que inician después de los 50 años tienen menos actividad lúpica y nefritis pero más daño acumulado, comorbilidades y compromiso cardiovascular. Los diferentes autoanticuerpos se asocian a ciertos subgrupos. Los anti-DNA predicen nefropatía y LES activo, los anti-Ro se asocian a fotosensibilidad, lupus neonatal y LES de inicio tardío y los anti-fosfolípidos (AFL) se asocian a daño orgánico trombótico.
Palabras clave: lupus eritematoso sistémico, subgrupos, nefritis, edad, raza, género, autoanticuerpos.
Summary
Systemic Lupus Erythematosus (SLE) is a heterogeneus disease; clinical, serologic and epidemiologic subsets are determinated by age, race and genetic factors. Male lupus patiens have a worst prognosis with more lupus nephritis and disease activity; African-American male have an early severe compromise with lupus nephritis (LN) pleuritis and cytopenias. In children SLE has more lupus nephritis, lymph node enlargement and splenomegaly. In older than 50 years at diagnosis SLE has accrual damage and cardiovascular disease.
Antibodies are predictive of clinical subsets; anti-DNA is associated with LN and SLE activity; Anti-Ro is asociated with neonatal lupus syndrome, fotosensitivity and late onset SLE; Antiphospholipid antibodies are predictive of organ damage in SLE.
Key words: systemic lupus erythematosus, subsets, nephritis, race, sex, age, autoantibodies.
El Lupus Eritematoso Sistémico (LES) es una enfermedad inflamatoria crónica, multisistémica que afecta principalmente a las mujeres, con una relación mujer hombre de 9:1 y que se diagnostica, generalmente, entre los 20 y los 50 años; sin embargo entre el 15 y el 18,5% de los casos se diagnostican antes de los 18 años y entre el 18 y el 24,5% después de los 50 años de edad.
La expresión clínica del LES puede variar entre una forma leve e indolente a través de los años y una fulminante con afección multisistémica desde su presentación.
Osler1 describió la enfermedad con el nombre de Eritema Exudativo Multiforme y desde el principio llamó la atención sobre la variabilidad clínica y el carácter recurrente de su evolución y caracterizó, de manera preliminar, algunos subgrupos:
- ... de etiología desconocida, con lesiones cutáneas polimórficas, hiperemia, edema y hemorragia, ocasionalmente artritis y un número variable de manifestaciones viscerales, de las cuales las más importantes son: las crisis gastrointestinales, endocarditis, pericarditis, nefritis aguda y hemorragia de las superficies mucosas. La recurrencia es un hallazgo especial de la enfermedad, y los ataques pueden venir mes a mes o a través de un largo período de años [
]. Los ataques pueden no estar caracterizados por manifestaciones cutáneas; los síntomas viscerales pueden presentarse solos y el paciente puede no mostrar eritema exudativo.
Independiente de la amplia diversidad clínica y serológica, algunas evidencias sugieren que los pacientes lúpicos pueden ser divididos en subgrupos más homogéneos; la raza, el sexo, la edad al diagnóstico y el perfil de autoanticuerpos son factores modificadores del curso y el pronóstico del LES, se asocian a manifestaciones clínicas particulares y determinan subgrupos especiales2.
Es así como se describe un comportamiento clínico y pronóstico diferente entre los hombres y las mujeres, entre los diagnosticados antes de los 18 años (LES juvenil), entre los 18 y los 50 y después de los 50 años (LES de inicio tardío), así como en las diferentes razas.
Lupus en hombres
Molina JF3 y colaboradores publicaron un estudio que incluye 107 hombres con LES en una cohorte de 1316 pacientes de tres poblaciones latinoamericanas (dos colombianas y una mexicana), encontrando que el diagnóstico se hizo, en promedio, a los 26 años en los hombres y a los 28 en las mujeres y se tardó seis meses en ellos y ocho en ellas. Durante la evolución los hombres tuvieron más trombosis, anticuerpos anti-DNA y mayor frecuencia de nefritis y las mujeres tuvieron más fenómeno de Raynaud (Tabla 1).

El curso clínico de la nefropatía fue más grave en los hombres con una mayor prevalencia de síndrome nefrótico en éstos pero la anatomía patológica renal fue similar en ambos sexos; la glomerulonefritis IV OMS representó el 59% de las biopsias en los hombres y el 60% en las mujeres.
No hubo diferencias estadísticas en la mortalidad global, pero el 80% de las muertes en el grupo masculino fueron por causas relacionadas al LES frente al 39% de las muertes en el grupo de mujeres. La nefritis lúpica (NL) como causa de muerte fue significativamente mayor en los hombres (6/10 frente a 15/94, p < 0,05).
Otro de los marcadores indirectos de gravedad fue la mayor dosis de esteroides requerida por el grupo de los hombres; el 93% de estos en comparación con el 85% de las mujeres necesitaron dosis continuas de prednisolona mayores a 15 miligramos por día (p: 0,01).
Los autores coinciden con otras series de la literatura que demuestran LES más grave en los hombres con mayor frecuencia y gravedad de NL, mayor requerimiento de esteroides, mayor frecuencia de anticuerpos anti-DNA y mayor riesgo de trombosis vascular, independiente de no haber diferencias en la frecuencia de anticuerpos antifosfolípidos.
López P. y colaboradores4 encontraron una prevalencia de LES de 8,33/100.000 en los hombres y de 57,91/100.000 y en las mujeres y una incidencia anual de 3,64/100.000 en las mujeres y de 0,54/100.000 en los hombres en una población del norte de España. La única diferencia inmunológica encontrada entre hombres y mujeres, en esta población caucásica, fue la mayor prevalencia de anticuerpos anti-Ro en ellas (34,6 vs. 18,6% OR 2,31 95% IC 1,01-18,6, p: 0,047).
Arbuckle MR y colaboradores5 evaluaron 130 pacientes en quienes se diagnosticó LES mientras prestaban servicio militar en los Estados Unidos, y analizaron 633 muestras de suero de estos pacientes, tomadas antes del diagnóstico. La cohorte contaba con 65% de mujeres, 62% de afroamericanos, 26% de caucásicos, 9% de latinos y 3% de asiáticos.
No encontraron diferencias entre la raza y el sexo para la edad al primer síntoma de LES (28,8 ± 6,5 años), pero el tiempo entre éste y el cumplimiento de cuatro criterios de clasificación ACR fue más corto en los hombres que en las mujeres (0,29 vs. 0,67 años, p: 0,04); la diferencia se debió casi exclusivamente a que los hombres afroamericanos progresaron más rápido al diagnóstico de LES después del primer síntoma (0,17 años).
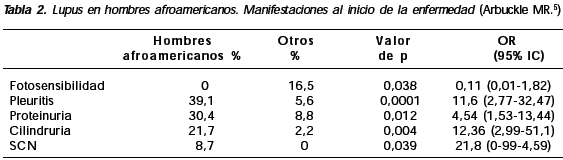
Los pacientes con NL también tuvieron un tiempo más corto para acumular cuatro criterios que los que no la tuvieron (p: 0,014), y en especial los que debutaron con NL (p: 0,0002). Al inicio de la enfermedad, los hombres afroamericanos tuvieron mayor frecuencia de pleuritis, proteinuria, cilindruria y compromiso del sistema nervioso central (SNC) y menos fotosensibilidad (Tabla 2).
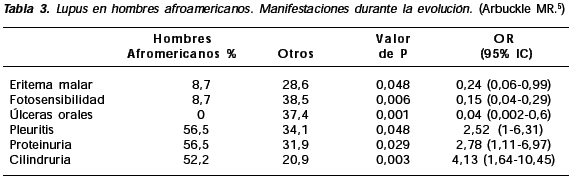
Durante la evolución estos pacientes presentaron menos fotosensibilidad y úlceras orales pero más proteinuria, cilindruria, anti-Sm y anti-RNP (Tabla 3).
La mayoría de los estudios de cohorte6 muestran que los síntomas iniciales del LES suelen ser articulares y cutáneos; sin embargo, el 61% de estos hombres afroamericanos tenían pleuritis, convulsiones y LN como sus manifestaciones iniciales en comparación con el 14% de los otros grupos incluidos (caucásicos, asiáticos y mujeres afroamericanas); esto explicaría la rápida progresión y la mayor gravedad de la enfermedad en este subgrupo.
El Grupo Latinoamericano de Lupus (GLADEL) es una de las más grandes cohortes del mundo7 e incluye 1214 pacientes de 34 hospitales en nueve países; El sexo masculino representa el 10,1% de la población (123 pacientes).
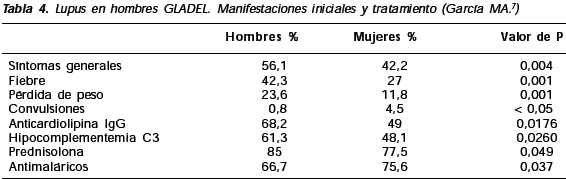
En esta cohorte, el diagnóstico fue más temprano en los hombres (p: 0,011) y se encontraron algunas diferencias clínicas con el grupo de mujeres: al inicio de la enfermedad los hombres tuvieron más síntomas constitucionales, mayor frecuencia de fiebre y pérdida de peso y menor frecuencia de convulsiones (Tabla 4).
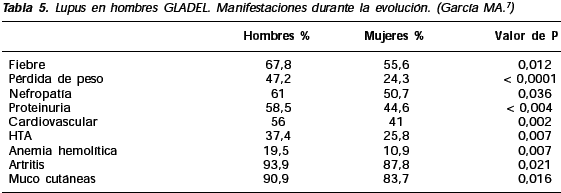
En el curso de la enfermedad también hubo diferencias de sexo; los hombres tuvieron mayor frecuencia de fiebre, nefritis, proteinuria y cilindruria, enfermedad cardiovascular, hipertensión arterial y anemia inmunohemolítica.
El grupo de mujeres presentó más artritis y manifestaciones cutáneas (Tabla 5).
Sólo dos estudios de laboratorio mostraron diferencias: los hombres tuvieron más anticardiolipina (ACL) IgG (68,2 vs. 49%, p: 0,0176) e hipocomple-mentemia C3 (61,3 vs. 48,1%, p: 0,026). También se observaron diferencias en el tratamiento: las mujeres recibieron más antimaláricos (75,6 vs. 66,7%, p: 0,037) y los hombres recibieron más corticosteroides (85,7 vs. 77,5%, p: 0,049). A pesar de tener mayor frecuencia de ACL, los hombres no presentaron más trombosis.
Después de ajustar variables de confusión como la raza, la edad al diagnóstico, el acceso a la seguridad social, el nivel educativo y el retardo para el diagnóstico, no se demostró que el género masculino se asociara a mayor actividad lúpica (SLEDAI), daño orgánico acumulado (SLICC/ACR) y riesgo de infecciones, pero sí a mayor riesgo de sufrir enfermedades cardiovasculares (82% mayor, OR ajustado 1,83, 95% IC 1,25-2,67).
La mortalidad fue similar (4,1% en los hombres y 2,7% en las mujeres, p: 0,38).
Influencia de la edad de inicio del LES en las manifestaciones clínicas e inmunológicas
En Asturias4, el 72% de los casos de LES se diagnosticó entre los 15 y los 49 años, el 24,5% en personas con 50 años o más y sólo el 3,3% antes de los 15 años de edad. El pico de edad al diagnóstico se presentó entre los 29 y 35 años, la distribución por edades fue más homogénea en los hombres y la relación mujer/hombre fue de 50/1 entre los 22 y 28 años. En los subgrupos de mayores de 50 y menores de 15 años al diagnóstico, la relación mujer/hombre es más estrecha; sólo el 25% de los hombres se diagnosticó antes de los 40 y 20% de las mujeres después de los 50 años.
El análisis por regresión logística mostró una marcada asociación entre la edad al diagnóstico y las manifestaciones inmunológicas; el mayor número de auto-anticuerpos se encontró en los menores de 15 y el menor en el subgrupo de inicio después de los 50 años. Las diferencias fueron estadísticamente significativas para anti-RNP (33 vs. 7,8%, OR 6,14, 95% IC 1,45-25,45, p: 0,014) y para anti-Sm (16,7 vs. 2,2%, OR 11,63, 95% IC 1,28-105, p: 0,03).
Carreño L. y colaboradores8 publicaron un estudio prospectivo que incluye 179 pacientes consecutivos con LES, en un centro español y uno canadiense, clasificándolos como LES juvenil (diagnóstico antes de los 18 años) y LES del adulto (diagnóstico después de los 18 años).
El grupo de LES juvenil representó el 27,3% de los casos; en éstos la relación mujer: hombre fue de 6:1 y tuvieron mayor frecuencia de:
- Vasculitis cutánea (44.8 vs. 27,6%, OR 2,12, 95% IC 1,08-4,15)
- Lupus discoide (26.5 vs. 13,8%, OR 2,24, 95% IC 1-4,93)
- Nefropatía (67.3 vs. 48,4%, OR 2,19, 95% IC 1.1-4,32)
- Neuropsiquiátrico (36,7 vs. 20%, OR 2,32, 95% IC 1,13-4,73)
- Convulsiones (18,3 vs. 7,6% OR 2,7, 95% IC 1,04-6,94)
Los adultos representaron el 82,7% de la cohorte; en éstos la relación mujer:hombre fue de 9,8:1 y tuvieron mayor frecuencia de artritis, tanto al inicio (39,2% vs. 22,4%, p < 0,05, 95% IC 1,05-4,71), como durante la evolución (96,1 vs. 85%, OR 4,16, 95% IC 1,3-12,77); no hubo diferencias serológicas entre los grupos.
En la cohorte de la Universidad de Antioquia9, en Medellín, Colombia, se demostró una mayor frecuencia de nefropatía (75%), hepatomegalia, esplenomegalia y adenopatías, mayor actividad y peor pronóstico en el grupo de LES juvenil en comparación con los pacientes diagnosticados después de los 18 años.
Ramírez LA y colaboradores10 describen el subgrupo de LES de inicio en la infancia de la cohorte GLADEL. El 18,9% de la población correspondió al grupo de niños con una relación mujer:hombre de 9:1 que fue igual a la de los adultos.
EL 92,2% de este grupo se diagnosticó entre los 10 y 18 años y el 7,8% restante entre 0 y 9 años; no hubo diferencias entre niños y adultos en el tiempo de retardo para el diagnóstico pero los primeros acumularon cuatro criterios de clasificación ACR más rápidamente (2,04 vs. 4,4 meses, p < 0,001).
La edad promedio del diagnóstico en los niños fue de 15,3 años (13,2-16,7) y en los adultos de 29,1 años (23,2-37,5). El grupo de niños mostró un mayor número de criterios ACR y mayor actividad lúpica por SLEDAI y MEXSLEDAI, mientras que los adultos tuvieron mayor daño acumulado por LES (SDI).
Los niños mostraron mayor frecuencia de fiebre, úlceras orales, corea, enfermedad cerebrovascular (ECV), isquemia cerebral transitoria (ICT), pseudo tumor cerebral, trombocitopenia, anemia inmunohemolítica, eritema malar y anticardiolipina IgM.
Los adultos presentaron más mialgias, síntomas secos, neuropatías craneales y creatinina mayor a 1,5 mg/dL.
Las causas de muerte en el grupo infantil con LES activo fueron NL (47,1%), septicemia 29,4%, neumonía (17,5%), compromiso multisistémico (14,7%), compromiso neurológico (11,8%), hemorragia pulmonar (8,8%) y peritonitis (8,8%). La menor frecuencia de NL encontrada en el grupo juvenil es atribuida por los autores al punto de corte predefinido de 1,5 mg/dL para la creatinina. Tradicionalmente se ha considerado que el LES de inicio tardío constituye un subgrupo benigno caracterizado por un mejor pronóstico, menor frecuencia de nefropatía y mayor de síntomas secos y fibrosis pulmonar11,12; otros autores, por el contrario, encuentran que el diagnóstico a edad avanzada constituye un factor de mal pronóstico13.
Bertoli A14 en la cohorte LUMINA (Lupus in minorities, Nature versus Nurture), describe las diferencias entre el LES de inicio tardío (diagnóstico a los 50 años o más) y LES de inicio temprano (40 años o menos al diagnóstico); el análisis multivariado mostró que el subgrupo de inicio después de los 50 años presentó más compromiso neurológico, eventos oclusivos arteriales e hipertrigliceridemia, y mayor daño orgánico acumulado y mortalidad que su contraparte de inicio antes de los 40 años. Por su parte estos últimos presentaron más nefropatía, anticuerpos anti-Sm y mayor actividad lúpica basal (Tabla 6).

La evolución de esta cohorte muestra que el LES de inicio tardío no es una entidad benigna como se ha tratado de expresar por algunos autores11,12; si bien cursa con menor actividad por SLEDAI y menor frecuencia de NL, tiene un mayor índice de daño acumulado por SLICC-ACR, más comorbilidades, mayor compromiso neurológico y arterial y mayor mortalidad. Papel de los autoanticuerpos como marcadores de subgrupos de LES Autoanticuerpos individuales se han asociado estadísticamente con manifestaciones específicas de LES. Los anticuerpos anti-DNA nativo se asocian con nefropatía y se correlacionan bastante bien con la actividad lúpica; títulos altos son predictores de recaída de la enfermedad, en los meses siguientes15, mientras que una brusca disminución de los títulos coincide con la recaída16.
Los anticuerpos anti-RNP marcan un subgrupo que cursa con fenómeno de Raynaud, enfermedad pulmonar intersticial, miopatía, disfagia y menor frecuencia de LN, un comportamiento clínico similar a la EMTC17.
Los anticuerpos antifosfolípidos determinan el subgrupo de LES mejor establecido y caracterizado por trombosis venosa y arterial, enfermedad cerebrovascular, recurrencia de la trombosis, morbilidad gestacional y citopenias autoinmunes, además de mayor frecuencia de enfermedad microvascular, dislipidemias, aterosclerosis y mayor mortalidad18-21.Los anticuerpos anti-Ro son los más asociados a subgrupos clínicos de LES, que incluyen el síndrome de lupus neonatal, el LES con anticuerpos antinucleares negativos (con fotosensibilidad, lupus cutáneo subagudo y HLA- DR6) y el LES de inicio en el anciano caracterizado por queratoconjuntivitis sicca, fibrosis pulmonar y menor frecuencia de nefropatía22-24.
To y Petri8 evalúan la asociación entre grupos de autoanticuerpos y subgrupos clínicos de LES. Describen tres "clusters", en la cohorte de John Hopkins:
El primer "cluster" mostró la asociación de Anti-Sm y anti-RNP y cursó con menor frecuencia de anemia (p < 0,001), hemólisis (p: 0,026), leucopenia (p: 0,013), linfopenia (p < 0,001), trombocitopenia (p < 0,001), proteinuria (p < 0,001) y síndrome nefrótico (p < 0,007); este grupo tuvo un comportamiento benigno, con menor frecuencia de anti-DNA y de manifestaciones renales y hematológicas y predominio de las dermatológicas.
El segundo "cluster" mostró la asociación de anti-DNA con anti-Ro y anti-La y cursó con mayor frecuencia de síndrome de Sjögren secundario (p < 0,001) y síndrome nefrótico persistente (p: 0,05).
En el tercer "cluster" se asociaron los anticuerpos anti-DNA, anticardiolipinas y anticoagulante lúpico; este subgrupo se caracterizó por mayor frecuencia de ECV, trombosis arterial y venosa profunda, livedo reticularis (p < 0,001) y fracturas por osteoporosis (p: 0,049).
Estos resultados soportan el concepto de que los anticuerpos antifosfolípidos son los mayores predictores de daño orgánico en LES además de la edad avanzada al diagnóstico, la actividad lúpica persistente, la duración de la enfermedad, la dosis acumulada de corticosteroides y el uso de ciclofosfamida2.
En conclusión, existen verdaderos subgrupos clínicos, serológicos y epidemiológicos de LES; su adecuada caracterización puede ser de gran ayuda práctica, porque implica diferentes manifestaciones clínicas, compromisos orgánicos, pronóstico y requerimientos terapéuticos. La edad de inicio, el género, la raza y el perfil de autoanticuerpos determinan, hasta cierto punto, el curso clínico de la enfermedad.
Referencias
1. Osler W. On The visceral complications of erythema exudativum multiforme. Am J Med Sci 1895; 110: 629-646. [ Links ]
2. Yee CS, Hussein H, Skan J, Bowman S, Situkinayake D, Gordon C, et al. duration in systemic lupus erythematosus. Rheumatology 2003; 42: 276-279. [ Links ]
3. Molina JF, Drenkard C, Molina J, Cardiel MH, Uribe O, Anaya JM, et al. Systemic lupus erythematosus in males. A study of 107 Latin American patients. Medicine 1996; 75: 124-130. [ Links ]
4. López P, Mozo L, Gutiérrez C, Suárez A. Epidemiology of systemic lupus erythematosus in a Nothern Spanish population; gender and age influence on immunological features. Lupus 2003; 12: 860-865. [ Links ]
5. Arbuckle MR, James JA, Dennis GJ, Rubertone MD, McClain MT, Kim XR, et al. Rapid clinical progesion to diagnosis among African-American men with systemic lupus erythematosus. Lupus 2003; 12: 99-106. [ Links ]
6. Cervera R, Kamastha MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al. Systemic lupus erythematosus: clinical and immunological patterns of disease expression in a cohort of 1.000 patients. Medicine 1993; 72: 113-124. [ Links ]
7. García MA, Marcos JC, Marcos AI, Pons-Estel B, Wojdyla D, Arturo A, et al. Male systemic lupus erythematosus in a Latin-American inception cohort of 1214 patients. Lupus 2005; 14: 938-946. [ Links ]
8. Carreño L, López-Longo FJ, Monteagudo I, Rodríguez- Mahou M, Bascones M, Gonzáles M, et al. Immunological and clinical differences between juvenil and Adult onset of systemic lupus erytematosus. Lupus 1999; 8: 287-292. [ Links ]
9. Ramírez LA, Builes CA, Maya C, et al. Lupus eritematoso sistémico en niños. Rev Col Reumatol 1998; 5: 11-17. [ Links ]
10. Ramírez LA, Uribe O, Osío O, Grisales Romero H, Cardiel MH, Wojdyla D, et al. Childhood systemic lupus erythematosus in Latin America. The GLADEL experience in 230 children. Lupus 2008; 17: 596-604. [ Links ]
11. Boddaert J, Thi Huong DL, Amoura Z, Wechsler B, Godeau P, Piette JC, et al. Late-onset Systemic Lupus Erythematosus. A personal series of 47 patients and pooled analysis of 714 cases in the literature. Medicine 2004; 83: 348-359. [ Links ]
12. Ward MM, Polisson RP A meta-analysis of the clinical manifestations of older-onset systemic lupus Erythematosus. Arthritis Rheum 1989; 32: 1226-1232. [ Links ]
13. Reveille JD, Bartolucci A, Alarcon GS. Prognosis in systemic lupus erythematosus. Negative impact of increasing age at onset, black race, and thrombocytopenia, as well as causes of death. Arthritis Rheum 1990; 33: 37-48. [ Links ]
14. Bertoli A, Alarcón G, Calvo-Alén J, Fernández M, Vilá L, Reveille J. Systemic lupus erythematosus in a multietnic US cohort. Clinical features, course, and outcome in patients with late-onset disease. Arth Rheum 2006; 54 (5): 1580-1587. [ Links ]
15. Ter Borg EJ, Horst G, Hummel EJ, Limburg PC, Kallenberg CG. Measurement of increases in antidouble- stranded DNA antibodies levels as a predictor of disease exacerbation in systemic lupus erythematosus: a long-term, prospective study. Arthritis Rheum 1990; 33: 634-643. [ Links ]
16. Ho A, Magder LS, Barr SG, Petri M. Decreases in antidouble- stranded DNA levels are associated with concurrent flares in patients with systemic lupus erythematosus. Arthritis Rheum 2001; 44: 2342-2349. [ Links ]
17. Ter Borg EJ, Groen H, Horst G, Limburg PC, Wouda AA, Kallemberg CG. Clinical associations of antiribonucleoprotein antibodies in patients with systemic lupus erythematosus. Semin Arthritis Rheum 1990; 20: 164-173. [ Links ]
18. Vargas F, Pinto LF, Molina JF, Donado JH, Eraso RM, Tobón A, et al. Síndrome antifosfolípido: morbilidad y evolución de una cohorte del noroccidente Colombiano. Rev Col Reumatol 2006; 13: 109-119. [ Links ]
19. Alarcón-Segovia D, Pérez-Ruiz A, Villa AR. Long-term prognosis of antiphospholpid syndrome in patients with systemic lupus erythematosus. J Autoimmun 2000; 15: 157-161. [ Links ]
20. Toubi E, Khamashta M, Panarra A, Huges G. Association of antiphospholipid antibodies with central nervous system disease in systemic lupus erythematosus Am J Med 1995; 99: 397-401. [ Links ]
21. Asherson RA, Khamashta M, Gil A, Vázquez JJ, Chan O, Baguley E, et al. Cerebrovascular disease and antiphospholipid antibodies in systemic lupus erythematosus, lupus-like disease and the primary antiphospholipid syndrome. Am J Med 1989; 86: 391-399. [ Links ]
22. Hoffman IE, Peene I, Meheus L, Huizinga TW, Cebecauer L, Isemberg D, et al. Specific antinuclear antibodies are associated with clinical features in systemic lupus erythematosus. Ann Rheum Dis 2004; 63: 1155-1158. [ Links ]
23. Simmons-O´Brien E, Chen S, Watson R, Antony C, Petri M, Hochberg M, et al. One hundred anti-Ro (SSA) antibody positive patients: a 10-year follow-up. Medicine 1995; 74: 109-1030. [ Links ]
24. Tapanes FJ, Vásquez M, Ramírez R, Matheus C, Rodríguez MA, Bianco N. Cluster analysis of antinuclear antibodies in the prognosis of SLE nephropathy: are anti-extractable nuclear antibodies protective? Lupus 2000; 9: 437-444. [ Links ]
25. To C.H. and Petri M. Is antibody clustering predictive of clinical subsets and damage in systemic lupus erythematosus. Arth Rheum 2005; 52: 4003-4010. [ Links ]














