Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.16 no.4 Bogotá Oct./Dec. 2009
PRESENTACIÓN DE CASOS Y REVISIÓN DE LA LITERATURA
Retroperitoneal fibrosis: a medical enigma
Publio Giovanni Saavedra Ramírez1, Marcos Arango Barrientos2, Luis Alonso González Naranjo3
1. Médico internista-reumatólogo, Hospital Universitario San Vicente de Paúl, Medellín. Correo electrónico: publiosaa@hotmail.com
2. Médico residente de medicina interna, Universidad de Antioquia-Hospital Universitario San Vicente de Paúl, Medellín.
3. Profesor Sección de Reumatología, Hospital Universitario San Vicente de Paúl, Universidad de Antioquia. Medellín, Colombia.
Recibido: Noviembre 5 de 2009 Aceptado: Diciembre 5 de 2009
Resumen
La fibrosis retroperitoneal es una enfermedad rara de causa desconocida. Fue descrita por primera vez en la literatura inglesa en 1948 por Ormond. Sin embargo, la primera descripción conocida de esta enfermedad fue realizada por el urólogo francés Albarran en 1905. Se caracteriza por una inflamación crónica e inespecífica del retroperitoneo, la cual puede atrapar y obstruir las estructuras que allí se encuentran, particularmente a los uréteres. Es frecuente que la enfermedad se detecte en etapas avanzadas, cuando se manifiesta por falla renal crónica. Los avances en las técnicas imaginológicas y el mayor conocimiento de la entidad han permitido que el diagnóstico se realice con mayor frecuencia en etapas más tempranas, cuando los pacientes aún no se encuentran obstruidos. Como resultado de las observaciones que muestran que los aneurismas inflamatorios de la aorta abdominal difieren de la enfermedad de Ormond sólo en el diámetro de la aorta inflamada, se ha sugerido que ambos síndromes representan variaciones de la misma patología, la cual se ha llamado "periaortitis crónica".
Palabras clave: fibrosis retroperitoneal idiopática, enfermedad de Ormond, obstrucción ureteral, periaortitis crónica.
Summary
Retroperitoneal fibrosis is an uncommon disease of unclear cause. It was described for the first time in English literature by Ormond, in 1948. However, the first known description of this disease was done by the French urologist Albarran, around 1905. It is characterized by chronic nonspecific inflammation of the retroperitoneum that can entrap and obstruct retroperitoneal structures, notably the urethers. This disease frequently is detected only after severe renal failure is present. However, advances in imaging techniques and increased awareness of the disease have resulted in an earlier diagnosis in unobstructed patients. As a result of the observations that showed that the only difference between an inflammatory aneurysm of the abdominal aorta and Ormond's disease is the diameter of the vessel, it had been suggested that both syndromes represent variations of the same pathology, which has been named "chronic periaortitis".
Key words: idiopathic retroperitoneal fibrosis, Ormond's disease, Ureteral obstruction, chronic periaortitis.
Presentación del caso
Hombre de 49 años que consulta por cuadro clínico de 2 meses de evolución caracterizado por edema y dolor testicular. El dolor comprometía también la región lumbar baja, fosas ilíacas e hipogastrio. Además, refería parestesias en la región posterior de las piernas y fiebre no cuantificada. El paciente era fumador pesado (70 paquetes/ año). Al examen físico se encontraba en buen estado general, con signos vitales normales. Hígado palpable 1 cm por debajo del reborde costal derecho; hidrocele bilateral, aumento en la temperatura de ambos testículos y edema con fóvea de miembros inferiores grado 2.
Los exámenes paraclínicos de ingreso (tabla 1) mostraron: anemia microcítica hipocrómica, aumento de reactantes de fase aguda (RFA), pruebas de función renal y hepáticas normales. El servicio de Urología diagnostica una orquiepididimitis bilateral y ordena ecografía testicular, la cual reportó hidrocele y varicocele bilateral. Una ecografía renal y de vías urinarias mostró una mínima ectasia renal derecha; sin embargo, en la tomografía de vías urinarias no se evidenció obstrucción del sistema colector.
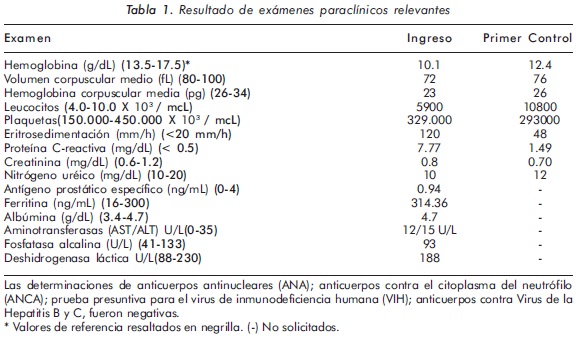
Con el fin de evaluar las estructuras del retroperitoneo, se solicitó una tomografía contrastada de abdomen en la que se evidenció un hígado aumentado de tamaño (192 mm), esplenomegalia (132 mm), y múltiples adenopatías confluentes de localización retroperitoneal y peri-aórtica (Figura 1). En este momento surgieron como posibilidades diagnósticas una enfermedad linfoproliferativa o tuberculosis. Estudios directos para búsqueda de micobacterias en orina fueron negativos. La electroforesis de proteínas mostró un leve incremento de las fracciones alfa-2, beta y gamma, además de un incremento notorio en la fracción alfa-1. El paciente fue llevado a laparotomía exploratoria, donde se encontró una masa retroperitoneal, de consistencia dura, de 6 por 5 cms. y muy vascularizada.
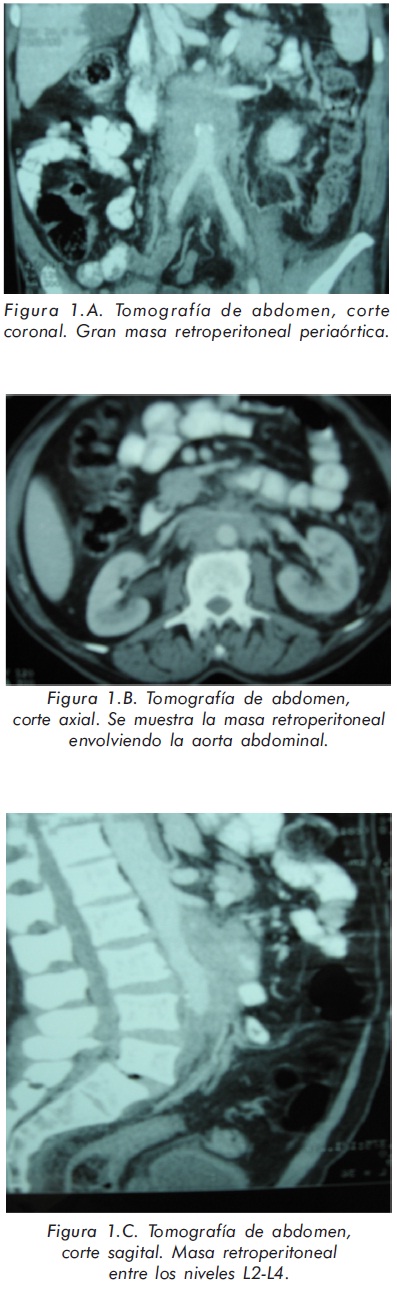
Los estudios microbiológicos directos para hongos y micobacterias fueron negativos. La histología de dicha lesión reportó hallazgos compatibles con fibrosis retroperitoneal (FR) idiopática (Figura 2). Con este diagnóstico se inició prednisona 60 mg/día. Las imágenes de la tomografía contrastada de abdomen fueron revisadas nuevamente con el servicio de radiología y se llegó a la conclusión de que lo que inicialmente se interpretó como múltiples adenopatías confluentes, correspondía a una gran masa retroperitoneal (Figura 1).
El paciente evolucionó satisfactoriamente, con mejoría del dolor lumbar y testicular, por lo cual dio de alta luego de 4 semanas de hospitalización. Asistió a su primer control dos meses después y persistía el aumento de volumen testicular pero se apreciaba bastante mejoría respecto al ingreso. Los exámenes de control mostraron mejoría de la anemia, descenso marcado en los niveles de los RFA y normalidad en las pruebas de función renal (tabla 1). Se inició descenso gradual de prednisolona.
Introducción
Dado que sus síntomas y signos de presentación comprometen con mayor frecuencia al sistema genitourinario, la FR es más conocida en el ámbito de la urología. Sin embargo, algunas manifestaciones tempranas como el dolor lumbar crónico, la fiebre, los síntomas constitucionales y su ocasional asociación con otras enfermedades autoinmunes, hacen que sea necesario su reconocimiento por el reumatólogo. Estudios recientes enfocados en su fisiopatología, sugieren una posible etiología autoinmune.
Historia
La primera descripción de esta enfermedad fue realizada en 1905 por el urólogo francés Albarran, quien informó el tratamiento quirúrgico de un extenso proceso fibrótico retroperitoneal que causaba obstrucción ureteral1. Sin embargo, no se reconoció como una entidad clínica hasta 1948, cuando Ormond hace la primera publicación sobre esta enfermedad en la literatura, al informar los casos clínicos de dos pacientes que presentaban dolor lumbar crónico, malestar general, anemia y anuria asociados a inflamación perivascular retroperitoneal2. La enfermedad se ha conocido desde entonces con una variedad de nombres como periuretritis fibrosa, granuloma retroperitoneal esclerosante y retroperitonitis fibrosa. En 1960 se le designó su nombre actual, ya que este término describía mejor la patología y la extensión de su compromiso. Algunos autores han sugerido otros nombres como "periaortitis crónica" o el de "periaortitis auto-alérgica", puesto que en la actualidad se conoce un poco mejor sobre su etiopatogénesis3. El uso de glucocorticoides ha mejorado el pronóstico4. La tomografía axial computarizada (TAC) o las imágenes por resonancia magnética (IRM), son métodos de diagnóstico confiables y no-invasivos, los cuales son útiles también para el seguimiento de los pacientes5.
Definición
La FR se caracteriza por la presencia de un tejido retroperitoneal inflamatorio crónico y marcada fibrosis que se desarrolla alrededor de la aorta y los vasos ilíacos, atrapando los uréteres y otros órganos abdominales5-7. Dos tercios de los casos son idiopáticos, pero puede ser secundaria a neoplasias, infecciones, trauma, cirugía, medicamentos y radioterapia8.
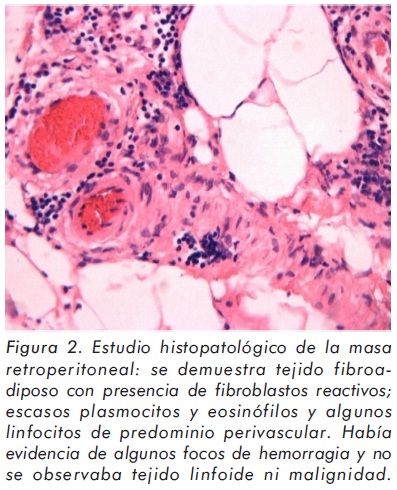
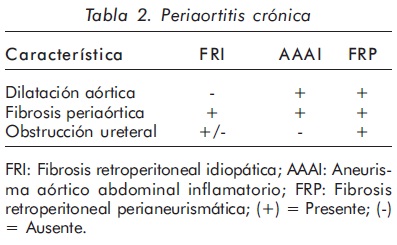
La FR puede presentarse de manera aislada o desarrollarse en el seno de una enfermedad sistémica caracterizada por fibrosis en otros órganos7. Diversos estudios enfocados en su patogénesis han sugerido que la FR puede ser incluida bajo el término más amplio de "periaortitis crónica", junto con los aneurismas inflamatorios de la aorta abdominal y la fibrosis retroperitoneal perianeurismática (FRP) (Figura 3)9,10. Estas tres entidades presentan características histopatológicas similares como inflamación de la adventicia y de la peri-adventicia, adelgazamiento de la media y aterosclerosis avanzada (Tabla 2)5,9. Aunque la fibrosis es un componente característico, aparece de manera tardía. En sus comienzos y hacia los bordes activos, la masa retroperitoneal es altamente inflamatoria. El término fibrosis puede llevar a pensar que se trata de una condición de pobre respuesta al tratamiento. Sin embargo, la mayoría de pacientes responden bien al tratamiento con desaparición de la masa6,9.
Epidemiología
Dado que es una entidad poco frecuente, no hay datos contundentes sobre su incidencia y prevalencia a nivel mundial. Su incidencia anual varía entre 0.1-1.3 por 100.000 habitantes y su prevalencia informada es de 1.38 por 100.000 habitantes11,12. La mayor incidencia se presenta entre los 40 y los 60 años de edad; sin embargo, se han descrito casos en todas las edades. La enfermedad es más frecuente en los hombres que en las mujeres con una relación de 2-3:1 y no se ha establecido una clara predisposición étnica5,7,12. No se conocen datos epidemiológicos acerca de las formas secundarias.
Patogénesis
Hasta la fecha no se ha encontrado una causa identificable de la FR idiopática. Su patogénesis es multifactorial. Los factores genéticos pueden jugar un papel importante. Se ha demostrado una asociación significativa entre el desarrollo de la enfermedad y la presencia de ciertos alelos del complejo mayor de histocompatibilidad, particularmente con el HLA-DRB1*03, un alelo que se encuentra ligado a varias enfermedades autoinmunes, como la diabetes mellitus tipo 1, el lupus eritematoso sistémico y la miastenia gravis13.
Según la teoría propuesta por Mitchinson y Parums, la enfermedad es causada por una respuesta inflamatoria local contra algunos componentes de la placa de ateroma presentes en la aorta abdominal: las LDL-oxidadas y el ceroide (un polímero lipoprotéico producto de la oxidación de las LDL por los macrófagos presentes en la placa)10,14. Estos lípidos oxidados son presentados por los macrófagos de la placa a linfocitos T y linfocitos B, lo cual, posteriormente, desencadena inflamación de la pared aórtica, principalmente en la media y la adventicia5. En pacientes con periaortitis crónica se han detectado inmunoglobulinas (Ig) cerca de las placas de ateroma; la masa inflamatoria, así como la media y la adventicia de la aorta, contienen linfocitos T CD4 + activados, linfocitos B policlonales y células plasmáticas que producen IgM e IgG. La inmunoglobulina dominante es la IgG que se localiza principalmente en las placas de ateroma donde hay mayor concentración de LDL-oxidada y de ceroide. También se han detectado macrófagos cargados de ceroide en la adventicia de la aorta y en los ganglios linfáticos cercanos3,5. En 1990, Parums y cols.14, informaron la presencia de autoanticuerpos dirigidos contra el ceroide y la LDL-oxidada en pacientes con periaortitis crónica. Dichos autoanticuerpos también se documentaron en pacientes con enfermedad coronaria y en pacientes ancianos (controles), pero estaban ausentes en controles adultos jóvenes. Se concluyó que posiblemente la periaortitis crónica es causada por una reacción "autoalérgica" dirigida contra la LDL-oxidada en una placa de ateroma, la cual se encuentra normalmente secuestrada a menos que la túnica media de la aorta se haya roto. A este respecto, algunos autores consideran que una masa inflamatoria periaórtica sólo se forma cuando la media de la aorta se encuentra adelgazada o ha sufrido una ruptura10,14. Los pacientes con FR idiopática frecuentemente manifiestan síntomas constitucionales, aumento en los niveles de RFA, autoanticuerpos, compromiso de otros órganos y enfermedades autoinmunes asociadas. Además, el proceso inflamatorio no sólo afecta la aorta abdominal y las arterias ilíacas comunes, sino que también se extiende a la aorta torácica y sus ramas. Un hallazgo frecuente en la FR idiopática es la presencia de vasculitis de la vasa vasorum de la adventicia aórtica y de vasos retroperitoneales periaórticos de pequeño calibre. Estos hechos sugieren que la FR idiopática es una manifestación de una enfermedad autoinmune sistémica, más que una reacción local exagerada a la aterosclerosis6,7,15,16.
Además de los factores genéticos, existen factores ambientales que incrementan el riesgo de FR como la exposición laboral a asbestos y el tabaquismo4,11. En un estudio retrospectivo de 20 pacientes con FR y aneurisma aórtico inflamatorio, el 90% de ellos eran fumadores pesados17.
La aterosclerosis es frecuente en pacientes con FR idiopática, con una prevalencia del 20% al 40%12,18. Aunque estas frecuencias son muy altas, no respaldan completamente la hipótesis de que la aterosclerosis avanzada es el único factor causal de FR idiopática9. Por el contrario, más bien la aterosclerosis puede ser sólo una condición predispondente en pacientes susceptibles13.
Fibrosis retroperitoneal secundaria
El uso de medicamentos como metisergida y otros derivados del ergot, se ha asociado con el desarrollo de formas secundarias de FR19. El riesgo de que se desarrollen estas complicaciones fibróticas es de 1:1500 y pueden revertir al descontinuar el medicamento5. El mecanismo fisiopatológico no está claro pero es probable que se encuentre mediado por una vía serotoninérgica20. Otros medicamentos implicados en el desarrollo de FR son los agonistas dopaminérgicos (metildopa)21, B-bloqueadores22, Hidralazina23 y analgésicos (fenacetina)24.
Existen algunas entidades que inducen FR secundaria, como ciertos tumores (carcinoma de próstata, mama y colon) que pueden producir metástasis a dicho nivel y originar una respuesta desmoplásica exuberante. Además, diversos tumores primarios ubicados en el retroperitoneo como linfomas y sarcomas pueden producir fibrosis del espacio retroperitoneal25,26. Los tumores carcinoides también pueden inducir FR a través de un mecanismo mediado por serotonina o por la liberación de factores de crecimiento profibróticos27,28. Otras entidades que pueden asociarse con el desarrollo de FR son: tuberculosis29, actinomicosis30, trauma5, cirugía abdominal mayor31, histiocitosis32, amiloidosis33, enfermedad de Erdheim-Chester34 y la radioterapia35.
Manifestaciones clínicas
Los síntomas y signos son inespecíficos y pueden ser clasificados en dos etapas: una etapa temprana donde son producto de la inflamación local y sistémica; y una etapa avanzada, donde las manifestaciones son aquellas producidas por el efecto compresivo de la masa a nivel ureteral y por la falla renal secundaria a esta obstrucción36.
El síntoma más común es el dolor, el cual se localiza a nivel abdominal, lumbar o en los flancos y se presenta hasta en el 95% de los casos. El dolor suele ser de comienzo insidioso, progresivo en intensidad, constante y no se modifica con la actividad física o por los cambios de posición. El paciente lo refiere como sordo, profundo o como una sensación de pesadez. Sin embargo, al progresar la enfermedad y al producir obstrucción ureteral, el dolor puede tener características de tipo cólico5,8,12,19,37-39. La respuesta a analgésicos y antiinflamatorios no esteroideos es variable y transitoria. Otro síntoma frecuente de presentación es la pérdida de peso, informada hasta en un 50% de los casos 8,12,19,37-39, así como otros síntomas constitucionales o sistémicos como fiebre de bajo grado, fatiga, nauseas, anorexia y mialgias15. El dolor testicular, hidrocele y varicocele presentados por nuestro paciente son manifestaciones clínicas menos frecuentes y probablemente son por compromiso de los vasos sanguíneos gonadales5,7. El edema de miembros inferiores se debe a obstrucción de venas y vasos linfáticos retroperitoneales. En casos avanzados, puede presentarse trombosis venosa profunda como producto de la obstrucción y compresión venosa crónica20. Puede ocurrir claudicación de miembros inferiores por obstrucción de vasos arteriales, aunque menos frecuente. En presencia de una obstrucción ureteral bilateral severa puede observarse oligoanuria y síntomas urémicos debidos a falla renal crónica de origen postrenal.40 Ocasionalmente, los pacientes se quejan de disuria, poliuria y frecuencia urinaria aún en ausencia de infección del tracto urinario12. El estreñimiento es moderadamente frecuente, mientras que la obstrucción del intestino delgado debido a compromiso directo del duodeno, la claudicación y la isquemia intestinal es inusual26,41.
El compromiso ureteral se ha informado en el 80-100% de los casos y puede favorecer el desarrollo de falla renal15,39. La obstrucción ureteral parece tener un origen más dinámico que exclusivamente mecánico debido a la inhibición de la peristalsis de estas estructuras por el proceso inflamatorio periureteral36.
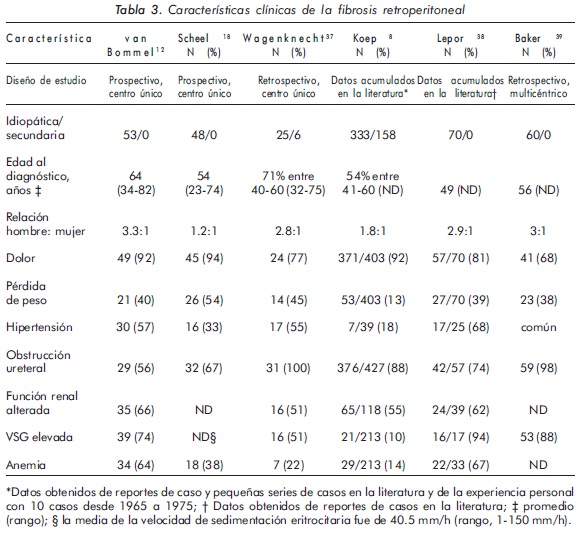
Algunos pacientes pueden tener dolor a la palpación abdominal o lumbar, soplos periumbilicales, particularmente si existe dilatación aneurismática de la aorta, o una masa abdominal palpable y dolorosa. Es importante anotar que ante la presencia de varicocele e hidrocele de reciente aparición, en un sujeto previamente sano y con dolor lumbar o abdominal, debe considerarse como un posible diagnóstico una lesión retroperitoneal5,7. En la tabla 3 se resumen los hallazgos clínicos más frecuentes informados en la literatura.
Los hallazgos de laboratorio son inespecíficos y frecuentes (80-100%): elevaciones en los RFA como la velocidad de eritrosedimentación, proteína C-reactiva y ferritina; también es frecuente la presencia de anemia (enfermedad crónica o por falla renal crónica) y uremia en casos avanzados. En algunos pacientes se observa hipergamaglobulinemia policlonal; ocasionalmente hay leucocitosis, eosinofilia, hematuria microscópica y proteinuria5-7.
Se ha descrito también la presencia en títulos bajos de algunos autoanticuerpos [anticuerpos antinucleares (60% de los casos), factor reumatoide, anticuerpos contra el citoplasma de neutrófilo, anticuerpos contra músculo liso y anticuerpos anti-tiroideos]. También se ha informado sobre asociaciones de vasculitis sistémicas con FR idiopática5-7,42-45.
Diagnóstico
Debido a las manifestaciones inespecíficas de la enfermedad y a su rareza, el diagnóstico usualmente es tardío. Los hallazgos clínicos, de laboratorio e imaginológicos pueden sugerir el diagnóstico apropiado. Sin embargo, se requiere el estudio histopatológico de la masa para confirmar el diagnóstico clínico. Respecto a las imágenes diagnósticas, la urografía excretora (UE) fue considerada como el estudio de elección para la detección temprana de la entidad, hasta la disponibilidad de la TAC y la IRM, las cuales ofrecen ventajas notables frente a la radiología convencional. En la UE se puede observar una desviación medial del uréter, usualmente en su tercio medio, empezando a nivel de la tercera y cuarta vértebra lumbar. Esto contrasta con el hecho de que la mayoría de neoplasias retroperitoneales desplazan lateralmente los uréteres. También se pueden apreciar grados variables de obstrucción e hidronefrosis y un "borramiento" del uréter a medida que penetra por la masa inflamatoria36. La obstrucción usualmente es bilateral, pero puede ser asimétrica y unilateral. Hasta un tercio de los pacientes pueden presentarse con riñones no funcionales como resultado de la obstrucción crónica5,36. Sin embargo, la desviación medial y compresión de los uréteres y la presencia de hidronefrosis pueden ser causados también por tumores ureterales y adenopatías. Además, hasta en un 20% de los individuos sanos se puede apreciar una ubicación medial de los uréteres45.
Los hallazgos en ultrasonografía (US) pueden mostrar la presencia de una masa centrada en el promontorio sacro, que se puede extender hacia la bifurcación aórtica o hacia la pelvis, de bordes irregulares y relativamente libre de ecos (hipoecoica) en su interior. La US puede detectar, además, la presencia de cambios hidronefróticos5.
Actualmente, las técnicas de mayor utilidad para el diagnóstico y la evaluación de la respuesta al tratamiento son la TAC y la IRM. La mayoría de pacientes presentan una masa bien definida, con densidad de tejidos blandos que rodea a los aspectos anterior y lateral de la aorta abdominal y de la vena cava inferior. Además, causa con frecuencia desviación medial y compresión extrínseca de los uréteres. La extensión craneocaudal de la masa abarca desde el origen de las arterias renales hasta los vasos ilíacos comunes y en algunos casos compromete la arteria mesentérica superior o los vasos ilíacos internos o externos. En algunas ocasiones, el compromiso puede ser asimétrico o puede afectar los espacios retrocrural, peripancreático, perirenal o presacro. Incluso se puede presentar como múltiples masas con densidad de tejido blando y bordes irregulares, similar a lo que se puede observar en un tumor retroperitoneal primario o en linfadenopatías neoplásicas. A diferencia de los tumores retroperitoneales, la masa inflamatoria de la FR idiopática no causa desplazamiento anterior de la aorta o desplazamiento lateral de los uréteres, ni resulta en destrucción ósea. Debido a la apariencia variable de la FR idiopática, las causas malignas no se pueden diferenciar de las causas no malignas basados solamente en los hallazgos imaginológicos. Si se sospecha una causa maligna, se debe practicar una biopsia de la lesión. En tales situaciones se recomienda tomar múltiples muestras profundas, debido a que puede haber un número relativamente bajo de células malignas entremezcladas con tejido inflamatorio7. En estadios tempranos hay un mayor realce de la masa con el medio de contraste, ya que el componente inflamatorio es mayor y la masa tiene mayor vascularización y celularidad7. Finalmente, en pacientes con falla renal obstructiva, el método de elección es la IRM, debido a la relativa baja nefrotoxicidad del gadolinio como medio de contraste. Además, la IRM ofrece una mejor definición de los tejidos circundantes, especialmente cuando se utilizan técnicas de supresión grasa5,7. La FR idiopática es hipointensa en T1; en T2 hay mayor intensidad en fases tempranas y activas de la enfermedad debido al edema tisular y una mayor celularidad, mientras que en fases tardías hay una baja intensidad46.
Otra técnica imaginológica útil para evaluar la extensión y la actividad de la FR es la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa (FDG). Esta técnica se basa en la captación diferencial de la FDG por las células metabólicamente activas. Dada la avidez de las células neoplásicas por la glucosa, la FDG se acumula en mayores cantidades en este tipo de células. Sin embargo, células como los fibroblastos, neutrófilos, macrófagos y linfocitos también pueden captar la FDG, particularmente bajo condiciones de activación. Por lo tanto, la FDG también se acumula en algunas enfermedades inflamatorias, como tuberculosis, sarcoidosis y FR. Con esta técnica se puede apreciar una intensa captación de la FDG en las áreas afectadas; por ejemplo, la región periaortoilíaca y el mediastino en casos de fibrosis mediastinal asociada47. Esta técnica no permite descartar neoplasias como causantes de afección retroperitoneal.
Diagnóstico diferencial
Más del 60% de los casos son idiopáticos. Una vez descartadas ciertas medicinas, el diagnóstico diferencial recae sobre neoplasias e infecciones. Las neoplasias primarias que pueden cursar con masas retroperitoneales son los sarcomas y los linfomas. Dentro de las infecciones se destacan las causadas por micobacterias y actinomices. El retroperitoneo también puede verse afectado por otro grupo de enfermedades fibrosantes caracterizadas por proliferación de fibroblastos y que pueden o no estar asociadas con un componente inflamatorio53. Entre estas enfermedades están: la fibromatosis retroperitoneal, el tumor miofibroblástico inflamatorio y el histiocitoma fibroso maligno inflamatorio48, 49.
Patología
La apariencia macroscópica típica de la FR idiopática es la de una masa blanca-grisácea dura, de grosor variable, que se extiende desde el origen de los vasos renales hasta el borde del estrecho superior de la pelvis y envuelve a la aorta abdominal, los vasos ilíacos, la vena cava inferior y los uréteres5, 7. No es infrecuente encontrar que el tejido fibroso se bifurque y siga el curso de las arterias ilíacas comunes. Rara vez el proceso fibroso puede extenderse anteriormente hacia la raíz del mesenterio, posteriormente hacia la médula espinal o pasar a través de la crura diafragmática y continuar como una mediastinitis fibrosa. Enfermedades fibrosantes idiopáticas similares se han reportado a nivel de la tiroides (tiroiditis de Reidel), órbitas (pseudotumor orbitario) y árbol biliar (colangitis esclerosante)5.
El estudio histopatológico muestra grados variables de inflamación y fibrosis. El componente inflamatorio se encuentra representado por linfocitos (células B CD 20+ que por lo general superan en número a las células T, que son principalmente CD4), macrófagos, células plasmáticas, y algunos eosinófilos. Los polimorfonucleares neutrófilos son escasos. El infiltrado inflamatorio puede ser tanto perivascular (alrededor de los pequeños vasos retroperitoneales) como difuso (dispuesto entre las fibras colágenas)5, 7. Los macrófagos usualmente se encuentran cargados de lípidos. Por otra parte, el aspecto fibrótico de la masa consiste en una matriz esclerótica abundante, compuesta por fibras de colágeno tipo I y por células en forma de huso cuyas características inmunohistoquímicas corresponden con las de los fibroblastos y miofibroblastos7. Los estudios de inmunofluorescencia revelan la presencia de depósitos de IgG en la región periaórtica y dentro de la pared del vaso y en las placas ateroescleróticas50. En el 10-50% de los casos hay evidencia de vasculitis y necrosis fibrinoide comprometiendo arterias retroperitoneales de pequeño y mediano calibre7, 16.
Tratamiento
No se cuentan con suficientes estudios clínicos que evalúen y comparen las diferentes alternativas terapéuticas existentes para su manejo. En la literatura se ha documentado la eficacia de diferentes técnicas quirúrgicas y del manejo conservador con glucocorticoides, solos o acompañados de inmunosupresores. En algunos casos es necesario hacer una combinación del manejo médico con el manejo quirúrgico, ya sea este invasivo o por medio de técnicas que no requieren grandes procedimientos operatorios, tales como la inserción por cistoscopia de un catéter ureteral doble- J o por medio de tubos de nefrostomía5-7,51. Los objetivos que se pretenden con el tratamiento son: detener la progresión del proceso fibrótico, aliviar la obstrucción de los uréteres y de otras estructuras retroperitoneales, controlar las manifestaciones sistémicas y evitar recaídas o recurrencias5-7.
En pacientes que se presentan en una etapa más avanzada de su enfermedad y que cursan con obstrucción ureteral asociada a disfunción renal, se plantean dos aproximaciones terapéuticas: la primera consiste en la liberación quirúrgica de la obstrucción por medio de una ureterolisis (abierta o laparoscópica) con o sin envolvimiento omental de los uréteres, seguido o no por glucocorticoides sistémicos. La segunda consiste en el manejo de la obstrucción mediante la inserción de un catéter ureteral (uni o bilateral), y uso de glucocorticoides con o sin inmunosupresores asociados51. En la mayoría de los casos es relativamente sencillo avanzar un catéter doble-J a través de los uréteres, lo cual reafirma que el fenómeno obstructivo es en gran medida secundario a la pérdida de un peristaltismo normal de estas estructuras5,51.
La ureterolisis quirúrgica frecuentemente se cita como el procedimiento operatorio de elección debido a que permite aliviar la obstrucción y practicar la toma de biopsias del tejido fibro-inflamatorio para confirmar el diagnóstico y excluir otras patologías8. Esta cirugía es un procedimiento mayor que no está exento de graves complicaciones como filtrado de orina, obstrucción intestinal o tromboembolismo pulmonar. Además, el tratamiento quirúrgico no previene la progresión de la enfermedad y tampoco su recurrencia, así mismo, carece de efecto sobre las manifestaciones sistémicas de la enfermedad; es por esto que el manejo médico con esteroides solos o con inmunosupresores asociados, siempre está indicado5- 7. Por todo lo anterior, en casos "típicos" en los cuales las imágenes diagnósticas realizadas (TAC/IRM) no sugieran la presencia de una causa diferente a la FR idiopática, no estaría indicada este tipo de intervención quirúrgica, reservándose sólo para aquellos casos refractarios donde incluso la terapia médica ha sido insuficiente para prevenir las complicaciones obstructivas de la enfermedad3,5-7.
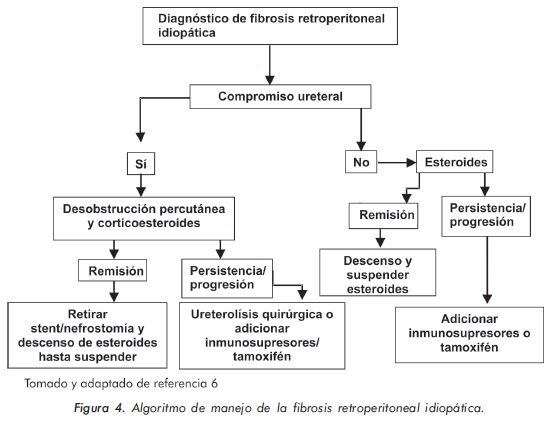
La dosis apropiada o la duración del tratamiento con los glucocorticoides no se han evaluado de manera sistemática, debido a la falta de estudios controlados, prospectivos y con un alto número de pacientes. La recomendación es la de iniciar con una dosis de 40-60 mg/día de prednisona y practicar lentos descensos en las dosis según la evolución de la sintomatología y por el abatimiento en los niveles de los reactantes de fase aguda. Cuando el paciente no mejora con esteroides o tiene contraindicaciones para su uso, se pueden utilizar inmunosupresores como azatioprina, metotrexate, ciclofosfamida, micofenolato mofetil, tamoxifen y ciclosporina18,52. Un algoritmo terapéutico se ilustra en la figura 4.
El seguimiento de la respuesta terapéutica se hace por medio de la mejoría de los síntomas, el descenso en los valores de los RFA, así como de los niveles de creatinina y los cambios obstructivos documentados por medio de ultrasonografía. Se recomienda hacer un control imaginológico con TAC ó IRM a los 2-4 meses luego de haber comenzado el manejo. Una falla en la detección de la mejoría radiológica debe alertar sobre la presencia de un diagnóstico diferente5-7.
Un estudio retrospectivo con 24 pacientes demostró que el tratamiento conservador con prednisolona por 1 año y descompresión renal urgente, en caso de necesidad, condujo a resultados satisfactorios iniciales en el 75% de los casos. El 92% de los pacientes informaron resolución significativa o completa de sus síntomas a las 2 semanas de iniciado el manejo con prednisolona. La mejoría en los parámetros de laboratorio como la creatinina y los RFA se dio de manera significativa a partir de la semana 6 del tratamiento53.
Pronóstico
La sobrevida en pacientes bien manejados entre los años 70s y 80s del siglo pasado fue del 86% a un año y del 78% a dos años luego del tratamiento quirúrgico. Los pacientes más ancianos y aquellos con síntomas urémicos al momento del diagnóstico, tuvieron más probabilidades de fallecer3. En pacientes tratados solamente con cirugía, la posibilidad de recurrencia de la obstrucción ureteral se estima en hasta un 50%. Para aquellos que son tratados con glucocorticoides además del procedimiento quirúrgico, la tasa de recurrencia es del 10%3,50. En el estudio de van Bommel y cols.53, 6/24 pacientes presentaron falla al tratamiento conservador mostrando obstrución ureteral persistente o ausencia de regresión de la masa luego de 1 año de tratamiento continuo con prednisolona. Se registraron ademas 23 recurrencias a los 10 meses luego de haber suspendido la prednisolona en 13 de 18 pacientes que habían tenido buena respuesta inicial al tratamiento. Al final del periodo de seguimiento (mediana de 55 meses), 7 pacientes presentaron alteración de la función renal y un paciente progresó a falla renal crónica terminal. La tasa de mortalidad fue del 8%.
Debido a que la fibrosis retroperitoneal idiopática posee el potencial para recaer, los pacientes deben seguir siendo monitorizados una vez se suspenda el tratamiento con esteroides o inmunosupresores. Las recaidas pueden presentarse incluso varios años después de que el paciente ha estado libre de síntomas5,7.
Referencias
1. Albarran J. Retention renale par peri-ureterite: liberation externe de l'uretere. Assoc Fr Urol 1905; 9:511-517. [ Links ]
2. Ormond JK. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol 1948;59:1072-1079. [ Links ]
3. Baker L.R.I. Auto-allergic periaortitis (Idiopathic Retroperitoneal Fibrosis). BJU Int. 2003;92:663-665. [ Links ]
4. Mitchinson MJ, Withycombe JF, Jones RA. The response of idiopathic retroperitoneal fibrosis to corticosteroids. Br J Urol 1971;43:44–49. [ Links ]
5. Vaglio A, Salvarani C, Buzio C. Retroperitoneal fibrosis. Lancet 2006;367:241-251. [ Links ]
6. Gilkeson GS, Allen NB. Retroperitoneal fibrosis: a true connective tissue disease. Rheum Dis Clin North Am 1996;22:23-38. [ Links ]
7. Vaglio A, Palmisano A, Corradi D, Salvarani C, Buzio C. Retroperitoneal fibrosis: Evolving Concepts. Rheum Dis Clin N Am 2007;33:803-817. [ Links ]
8. Koep L, Zuidema GD. The clinical significance of retroperitoneal fibrosis. Surgery 1977;81:250-257. [ Links ]
9. Parums DV. The spectrum of chronic periaortitis. Histopathology 1990;16:423-431. [ Links ]
10. Mitchinson MJ. Chronic periaortitis and periarteritis. Histopathology 1984;8:589-600. [ Links ]
11. Uibu T, Oksa P, Auvinen A, et al. Asbestos exposure as a risk factors for retroperitoneal fibrosis. Lancet 2004;363:1422-1426. [ Links ]
12. van Bommel EF, Jansen I, Hendriksz TR, Aarnoudse AL. Idiopathic retroperitoneal fibrosis: prospective evaluation of incidence and clinicoradiologic presentation. Medicine (Baltimore). 2009;88:193-201. [ Links ]
13. Martorana D, Vaglio A, Greco P, et al. Chronic periaortitis and HLA-DRB1*03: another clue to an autoimmune origin. Arthritis Rheum 2006;55:126-130. [ Links ]
14. Parums DV, Brown DL, Mitchinson MJ. Serum antibodies to oxidized low-density lipoproteins and ceroid in chronic periaortitis. Arch Pathol Lab Med 1990;114: 383-387. [ Links ]
15. Vaglio A, Corradi D, Manenti L, et al. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003;114:454-62. [ Links ]
16. Lindell OI, Sariola HV, Lehtonen TA. The occurrence of vasculitis in perianeurysmal retroperitoneal fibrosis. J Urol 1987;138:727-729. [ Links ]
17. Warnatz K, Keskin AG, Uhl C, et al. Immunosuppressive treatment of chronic periaortitis: a retrospective study of 20 patients with chronic periaortitis and a review of the literature. Ann Rheum Dis 2005;64:828-833. [ Links ]
18. Scheel PJ Jr, Feeley N. Retroperitoneal fibrosis: the clinical, laboratory, and radiographic presentation. Medicine (Baltimore). 2009;88:202-207. [ Links ]
19. Elkind AH, Friedman AP, Bachman A, et al. Silent retroperitoneal fibrosis associated with methysergide therapy. JAMA 1968; 206:1041-1044. [ Links ]
20. Kottra JJ, Dunnick NR. Retroperitoneal fibrosis. Radiol Clin North Am 1996; 43: 1259-1275. [ Links ]
21. Ahmad S. Methyldopa and retroperitoneal fibrosis. Am Heart J 1983;105:1037-1038. [ Links ]
22. Laakso M, Arvala I, Tervonen S, Sotarauta M. Retroperitoneal fibrosis associated with sotalol. Br Med J 1982; 285:1085-1086. [ Links ]
23. Waters VV. Hydralazine, hydrochlorothiazide and ampicillin associated with retroperitoneal fibrosis: case report. J Urol 1989;141:936-937. [ Links ]
24. Lewis CT, Molland EA, Marshall VR, et al. Analgesic abuse, ureteric obstruction, and retroperitoneal fibrosis. Br Med J 1975;2:76-78. [ Links ]
25. Thomas MH, Chisholm GD. Retroperitoneal fibrosis associated with malignant disease. Br J Cancer 1973;28:453-458. [ Links ]
26. Stower MJ, Hardcastle JD. Malignant retroperitoneal sarcoma: a review of 32 cases. Clin Oncol 1982;8:257-263. [ Links ]
27. Chander S, Ergun EL, Chugani HT, et al. High 2- deoxy-2-[18F]- fluoro-D-glucose accumulation in a case of retroperitoneal fibrosis following resection of carcinoid tumor. Mol Imaging Biol 2002;4:363-368. [ Links ]
28. Modlin IM, Shapiro BS, Kidd M. Carcinoid tumors and fibrosis: an association with no explanation. Am J Gastroenterol 2004;99:2466-7248. [ Links ]
29. Seth A, Ansari MS, Trikha V, Mittal R. Retroperitoneal fibrosis: a rare complication of Pott's disease. J Urol 2001;166:622-623. [ Links ]
30. Milam MR, Schultenover SJ, Crispens M, Parker L. Retroperitoneal fibrosis secondary to actinomycosis with nointrauterine device. Obstet Gynecol 2004;104: 1134-1136. [ Links ]
31. Wilson MC, Berry AR, McNair TJ, Thomson JW. Obstructive uropathy after pan-proctocolectomy for ulcerative colitis. Gut 1980;21:808–809. [ Links ]
32. Garcia JF, Sanchez E, Lloret E, et al. Crystal-storing histiocytosis and immunocytoma associated with multifocal fibrosclerosis. Histopathology 1998;33: 459-464. [ Links ]
33. Glynn TP Jr, Kreipke DL, Irons JM. Amyloidosis: diffuse involvement of the retroperitoneum. Radiology 1989;170:726. [ Links ]
34. Serratrice J, Granel B, De Roux C, et al. "Coated aorta": a new sign of Erdheim-Chester disease. J Rheumatol 2000;27:1550-1553. [ Links ]
35. Hoekstra HJ, Restrepo C, Kinsella TJ, Sindelar WF. Histopathological effects of intraoperative radiotherapy on pancreas and adjacent tissues: a postmortem analysis. J Surg Oncol 1988;37:104-108. [ Links ]
36. Resnick M, Kursh E. Extrinsic obstruction of the ureter. In Walsh P, Retik A, Vaughan E, Wein A (eds): Campbell's Urology. 7th edition. Philadelphia: WB Saunders, 1998, pp 403-722. [ Links ]
37. Wagenknecht LV, Auvert J. Symptoms and diagnosis of retroperitoneal fibrosis. Urol Int. 1971;26:185-195. [ Links ]
38. Lepor H, Walsh PC. Idiopathic retroperitoneal fibrosis. J Urol. 1979;122:1-6. [ Links ]
39. Baker LR, Mallinson WJ, Gregory MC, Menzies EA, Cattell WR, Whitfield HN, Hendry WF, Wickham JE, Joekes AM. Idiopathic retroperitoneal fibrosis. A retrospective analysis of 60 cases. Br J Urol. 1987;60:497-503. [ Links ]
40. Jois RN, Gaffney K, Marshall T, et al. Chronic periaortitis. Rheumatology 2004; 43:1441-1446. [ Links ]
41. Yamada H, Komatsu R, Nagae H, et al. Idiopathic retroperitoneal fibrosis with duodenal obstruction successfully treated with corticosteroids. Intern Med 1998;37: 592-598. [ Links ]
42. Okada H, Takahira S, Sugahara S, et al. Retroperitoneal fibrosis and systemic lupus erythematosus. Nephrol Dial Transplant 1999;14:1300-1302. [ Links ]
43. Mavragani CP, Voulgarelis M. Retroperitoneal fibrosis and c-ANCA positivity. Clin Rheumatol 2007;26:115- 116. [ Links ]
44. Armigliato M, Paolini R, Bianchini E, et al. Hashimoto's thyroiditis and Graves' disease associated with retroperitoneal fibrosis. Thyroid 2002;12:829-831. [ Links ]
45. Saldino RM, Palubinskas AJ. Medial placement of the ureter: a normal variant, which may simulate retroperitoneal fibrosis. J Urol 1972;107:582-585. [ Links ]
46. Vivas I, Nicolas AI, Velásquez P, et al. Retroperitoneal fibrosis: typical and atypical manifestations. Br j Radiol 2000;73:214-222. [ Links ]
47. Nakajo M, Jinnouchi S, Tanabe H, et al. 18FFluorodeoxyglucose Positron Emission Tomography Features of Idiophatic Retroperitoneal Fibrosis. J Comput Assist Tomogr 2007;31:539-543. [ Links ]
48. Petras RE. Nonneoplastic intestinal diseases. In: Mills S, Carter D, Greenson JK, Oberman HA, Reuter V, Stoler MH, eds. Sternberg's diagnostic surgical pathology, 4th edn. Philadelphia: Lippincott Williams and Wilkins, 2004:1475-1542. [ Links ]
49. Coffin CM, Watterson J, Priest JR, Dehner LP. Extrapulmonary inflammatory myofibroblastic tumor (inflammatory pseudotumor): a clinicopathologic and immunohistochemical study of 84 cases. Am J Surg Pathol 1995;19:859-872. [ Links ]
50. Parums DV, Chadwick DR, Mitchinson MJ. The localization of immunoglobulin in chronic periaortitis. Atherosclerosis 1986;61:117-123. [ Links ]
51. Ilie C, Pemberton R,Tolley D. Idiopathic retroperitoneal fibrosis: the case for nonsurgical treatment. BJU Int 2006;98:137-140. [ Links ]
52. Marcolongo R, Tavolini IM, Laveder F, et al. Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases. Am J Med 2004;116:194-197. [ Links ]
53. van Bommel EF, Siemes C, Hak LE, et al. Long-term renal and patient outcome in idiopathic retroperitoneal fibrosis treated with prednisone. Am J Kidney Dis 2007;49:615-625. [ Links ]














