Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.16 no.4 Bogotá Oct./Dec. 2009
PRESENTACIÓN DE CASOS Y REVISIÓN DE LA LITERATURA
Successful autologous Stem Cell transplantation in a woman with Severe Systemic Sclerosis, refractory to immunosuppressive therapy
Elsa Reyes1,3,4, Ana Milena Arbeláez1,3, Luz Mabel Ávila Portillo1,3,4,
Benjamín Ospino2,3, Juan Manuel Bello1,3, Diego Jaimes1,3,4,
John Londoño1,4, Rafael Valle Oñate1,4.
1 Reumatología, Universidad Militar Nueva Granada - Hospital Militar Central.
2 Hematología, Hospital Militar Central.
3 Stem Medicina Regenerativa.
4 Grupo de Espondiloartropatías Universidad De La Sabana - Hospital Militar Central.
Recibido: Octubre 5/2008 Aceptado: Diciembre 5/2009
Resumen
Describimos el caso de una paciente femenina de 49 años con esclerosis sistémica difusa con compromiso cutáneo y pulmonar severo, rápidamente progresivo, sin respuesta al manejo inmunosupresor convencional; quien fue sometida a transplante de células madres hematopoyéticas (TCMH) con mejoría sostenida del compromiso cutáneo y pulmonar a los 6 meses post-TCMH.
Palabras clave: transplante de células progenitoras hematopoyéticas, terapia inmunosupresora, enfermedades autoinmunes, esclerosis sistémica.
Summary
The following case presents a 49 year-old patient with diffuse SSc and poor evolution given by rapidly progressive of severe skin and lung involvement, who had undergone autologous stem cell transplantation in December 2008. Sustained improvement of skin thickening and of major organ involvement was achieved at six months.
Key words: autologous stem cell transplantation, immunosuppressive therapy, autoimmune diseases, systemic sclerosis.
Introducción
La esclerosis sistémica (ES) es una enfermedad crónica del tejido conectivo, multiorgánica, caracterizada por sobreproducción y depósito de colágeno en la piel y algunos órganos viscerales (tracto gastrointestinal, pulmón, corazón y riñón). El desarrollo de trastornos vasculares y el depósito excesivo de colágeno que caracteriza a la enfermedad tienen su origen en un proceso de tipo autoinmune primario1.
Es una enfermedad poco frecuente, con una incidencia en países como Estados Unidos e Islandia, de 1,9 casos por 100.000 habitantes/año y de 0,38 casos por 100.000 habitantes/año, respectivamente2,3. La prevalencia de esta enfermedad es de alrededor 24,2 casos por 100.000 adultos en Estados Unidos y de 7,1 casos por 100.000 adultos en Islandia2,3. Afecta predominantemente a las mujeres (80%), con un pico entre los 45 y 55 años2. Compromete de manera significativa la calidad de vida de las personas y tiene, a su vez, la más alta mortalidad por caso específico entre las enfermedades reumatológicas autoinmunes4.
Clínicamente, el tipo de compromiso cutáneo y de órganos internos, y la asociación con ciertos auto anticuerpos permiten distinguir inicialmente dos grupos de pacientes: los pacientes que tienen formas leves de la enfermedad con compromiso cutáneo limitado y lenta progresión de la disfunción orgánica visceral, esclerosis sistémica cutánea limitada (ESL) y los que exhiben un compromiso cutáneo agresivo y compromiso orgánico visceral rápidamente progresivo, esclerosis sistémica cutánea difusa (ESD)5.
Cuando se presenta clínicamente con compromiso pulmonar, renal o cardíaco en los primeros 3 a 5 años de la enfermedad, la tasa de sobrevida disminuye del 35% al 45% en los 3 - 5 años posteriores6. No existe aún un tratamiento efectivo para controlar la enfermedad o revertir la fibrosis. En los últimos años se ha utilizado la ciclofosfamida endovenosa para el compromiso pulmonar con resultados controvertidos7,8 y es de anotar que existen pacientes con compromiso orgánico severo refractario a la terapia inmunosupresora.
El transplante de células madres hematopoyéticas (TCMH), se utiliza en el tratamiento de numerosas enfermedades incluyendo leucemias y linfomas. Hoy en día es posible utilizar esta técnica para el tratamiento de enfermedades autoinmunes graves y refractarias a la terapia convencional, como ocurre con un subgrupo de pacientes con ES9. El TCMH se basa en un régimen de acondicionamiento linfoablativo, es decir, en la eliminación de la clona linfoide auto reactiva. Teóricamente, la regeneración del sistema inmune luego de esta linfopenia grave resultaría en la eliminación de la autoinmunidad y en una re inducción de la auto-tolerancia a través del desarrollo de nuevos linfocitos T en el timo10,11.
El potencial terapéutico del TCMH en las enfermedades autoinmunes fue descrito por primera vez en pacientes con artritis reumatoide tratados con transplante alogénico de médula ósea por anemia aplásica inducida por sales de oro9. Se consideró que el uso de altas dosis de quimioterapia seguidas de rescate con TCMH podría revertir el proceso de autoinmunidad8, motivo por el cual un grupo de trabajo multidisciplinario en enfermedades autoinmunes fue fundado por el European Group for Blood and Marrow Transplantation (EBMT) y el European League against Rheumatism (EULAR), para coordinar, a partir del año 1995, estudios de fase I/II, con el fin de unificar la experiencia colectiva en este tópico13,14. Actualmente se encuentran dos estudios multicéntricos, prospectivos y aleatorizados en fase III, a cargo de dos grupos internacionales: El grupo ASTIS15 (Autologous Stem Cell Transplantation International Scleroderma Trial) y el grupo SCOT16 (Scleroderma: cyclophosphamide or Transplantation), cuyos resultados demuestran mejoría mayor del 50% en el compromiso cutáneo con estabilización del compromiso pulmonar, renal y cardíaco.
El objetivo de este trabajo es presentar a una mujer con ESD severa, refractaria a múltiples tratamientos inmunosupresores; quien mejoró sustancialmente su compromiso cutáneo y orgánico con el TCMH. Esta observación, junto con otra semejante presentada en el XII Congreso Colombiano de Reumatología por el grupo de reumatología del Hospital Pablo Tobón Uribe, Medellín, Colombia, constituyen los dos primeros ensayos terapéuticos con resultados exitosos, derivados de la aplicación del TCMH para esta indicación en nuestro país17.
Presentación del caso
Mujer de 49 años con ES difusa diagnosticada con base en los hallazgos clínicos, con informe de biopsia de piel del tórax y de dedos compatible con esclerosis cutánea. Presencia de anticuerpos antinucleares en títulos de 1/1280 con patrón nucleolar y de 1/640 con patrón homogéneo; presencia de anticuerpos anti-topoisomerasa I en 194 UI/ml. La enfermedad tenía 17 meses de evolución, con compromiso cutáneo severo por una medición del score de Rodnan modificado de 36 y apertura oral de 2 cms.
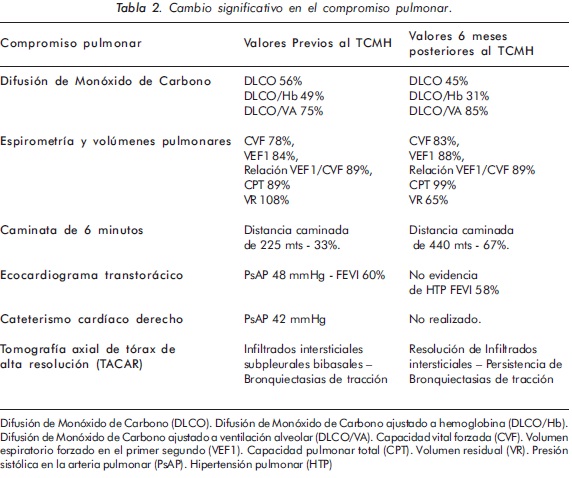
La paciente presentó compromiso pulmonar con deterioro en los últimos 6 meses, consistente en disnea clase funcional III/IV, patrón restrictivo en las pruebas de función pulmonar y notable compromiso en la distancia caminada durante la prueba de 6 minutos como puede evidenciarse en la Tabla 1. Infiltrados intersticiales bibasales en la tomografía computarizada de alta resolución (TACAR) y desarrollo de hipertensión pulmonar (HTP) evidenciada por ecocardiograma transtorácico y por cateterismo cardíaco derecho. (Figura 1)
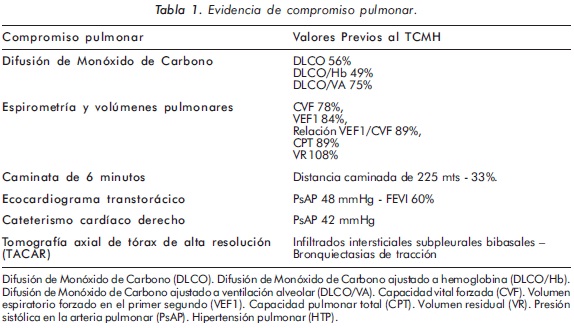
La paciente recibió tratamiento con Dpenicilamina 250 mg/día, metotrexate 25 mg/ semanales IM, cloroquina 250 mg/día, colchicina 0,5 mg c/12 horas, nifedipino 30 mg c/12 horas, losartan 50 mg/día, sildenafil 25 mg c/8 horas y ASA 100 mg/día. Por el compromiso cutáneo y pulmonar severos, se iniciaron bolos mensuales de ciclofosfamida en dosis de 600 mg/m2 de superficie corporal (m2SC) por 6 meses, sin respuesta adecuada al manejo; considerándose que la paciente tenía ES severa, refractaria al manejo inmunosupresor. Un equipo multidisciplinario constituido por el servicio de Reumatología, Hematología, Inmunología y Neumología del Hospital Militar Central, decidió someter a la paciente a la realización de un TCMH, terapia llevada a cabo en diciembre de 2008.
El protocolo de transplante incluyó los siguientes pasos: movilización, recolección, acondicionamiento y re infusión.
La movilización de células madres fue realizada con ciclofosfamida (3 g/m2 SC), acompañada del uso de amifostina (1000 mg SC), tiofosfato orgánico que protege de manera selectiva los tejidos normales de la citotoxicidad de los agentes quimioterápicos y de mesna (Mercapto Etiletano Sulfonato de Sodio) por sus efectos uroprotectores, para prevenir los efectos colaterales urotóxicos asociados con la quimioterapia con citostáticos oxazafosforínicos como la ciclofosfamida.
A las 24 horas de la administración de ciclofosfamida, se administró por vía SC filgrastim (Factor estimulador de colonias de granulocitos - G-CSF) en dosis de 300 mg subcutáneo/día por 7 días. Se obtuvieron 2,4 millones de células CD 34+/Kg, que fueron criopreservadas a menos de 196°C.
El régimen de acondicionamiento de la paciente se realizó con ciclofosfamida en dosis de 50 mg/Kg/día x 4 días, globulina anti-timocito 7,5 mg/kg, amifostina (2 dosis de 500 mg por vía SC) y mesna (1200 mg IV a las horas 0, 4 y 8 de iniciada la infusión de ciclofosfamida). La infusión de células madres criopreservadas se llevó a cabo a las 48 horas de la última dosis de ciclofosfamida (4 de diciembre de 2008).
Como este tratamiento induce inmunosupresión importante se realizó profilaxis contra oportunistas comunes con aciclovir 400 mg por vía oral c/12 horas, fluconazol 200 mg por vía oral / día y profilaxis anti-pneumocistis con trimetropin/ sulfametoxazol 160/800 mg 2 veces por semana.
La paciente presentó mucositis grado II de la mucosa oral y episodio de neutropenia febril (recuento de neutrófilos inferior a 500 células/mm3 con una temperatura oral de 38,3°C) con neumonía para lo cual se inició tratamiento antibiótico con piperacilina/tazobactam y filgrastim 300 mg SC/día por 10 días, sin poderse obtener en la paciente aislamientos microbiológicos en dos sets de hemocultivos.
La recuperación de citopenias secundarias al transplante se realizó en el siguiente orden: resolución de neutropenia, trombocitopenia y de la línea roja a los 14, 18 y 23 días post-transplante, respectivamente.
Se realizó valoración del compromiso cutáneo mediante el uso del score de Rodnan modificado, al igual que del compromiso pulmonar y cardíaco en los 6 meses posteriores al TCMH.
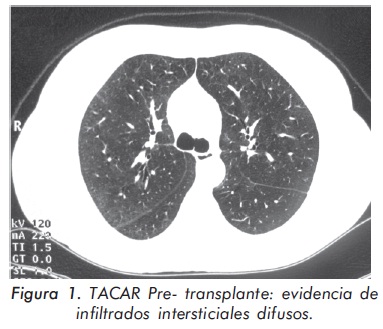
La paciente presentó una disminución del score de Rodnan mayor al 50%, con una apertura oral de 4,5 cms. (Figuras 2 y 3), cambio significativo del compromiso pulmonar dado por mejoría en la escala de disnea a grado I/IV, resolución del patrón restrictivo en las pruebas de función pulmonar, TACAR control con ausencia de infiltrados intersticiales y presencia de bronquiectasias de tracción; no evidencia de HTP por ecocardiografía. (Tabla 2) - (Figura 2)
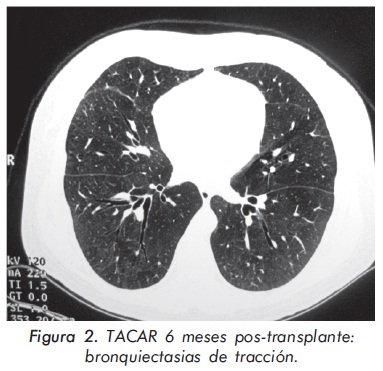
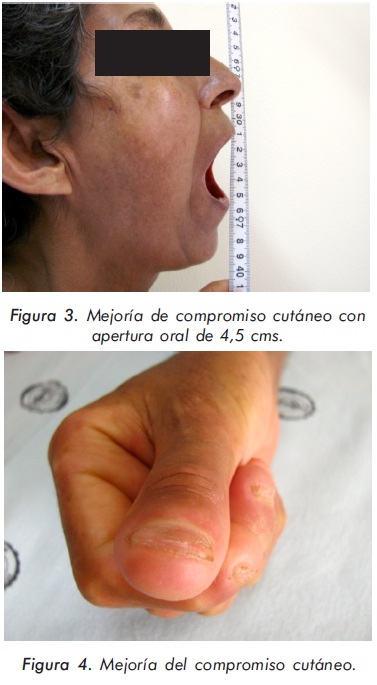
Discusión
En el actual informe de caso podemos evidenciar la evolución exitosa del TCMH en una paciente con ES severa con compromiso cutáneo y pulmonar progresivo, quien no había respondido a los esquemas terapéuticos convencionales.
El mayor beneficio se presentó en el grado de compromiso cutáneo, con una mejoría mayor del 50%. Las pruebas de función pulmonar indicaron una resolución del patrón restrictivo con una mejoría del 100% en la caminata de 6 minutos, lo cual se traduce en bienestar y mejor calidad de vida de la paciente. Durante la evaluación ecocardiográfica a los 6 meses postransplante no se evidenciaron signos indirectos de HTP; sin embargo, no se presentó mejoría en los parámetros de la DLCO, probablemente por persistencia de vasculopatía pulmonar.
Los datos obtenidos del estudio retrospectivo realizado por el EBMT sobre 110 centros participantes, evaluando los resultados del TCMH en enfermedades autoinmunes desde 1995 al 2005, demostraron claras evidencias de que el TCMH puede detener la progresión de la enfermedad e inducir una remisión estable en pacientes seleccionados con enfermedades autoinmunes graves12- 14. A pesar de la heterogeneidad de los diferentes centros, el impacto en los resultados se observó en todas las categorías de enfermedades y en todos los grupos de pacientes12-14.
Los primeros 65 pacientes transplantados reportados por el EBMT/EULAR presentaron una mejoría mayor del 25% en el score cutáneo. En el 70% de los pacientes, con estabilización de la función pulmonar y renal y una tasa de mortalidad relacionada con el transplante (TMR) del 12,5%14; sin embargo, el refinamiento de los criterios de selección y la experiencia alcanzada por los distintos equipos han permitido una disminución de la TMR a 2,5% comparada con la reportada inicialmente15, 16.
En Julio de 2008, el grupo ASTIS15 reportó resultados prometedores posterior a un seguimiento medio de 30 meses de un total de 123 pacientes pertenecientes a 25 centros en 10 países, aleatorizados a recibir TCMH (n=66) o bolos mensuales de ciclofosfamida (n=57). En este mismo orden, el grupo SCOT16 reportó, después de un seguimiento medio de 4 años, una mejoría del compromiso cutáneo en el 70% de los pacientes y estabilización del compromiso orgánico en el 55%.
Nuestra paciente cumplía con los criterios de inclusión propuestos por los dos distintos grupos, los cuales consideran a los pacientes con diagnóstico reciente de la enfermedad como los mejores candidatos. En primer lugar, pacientes con menos de 4 años de evolución de su enfermedad, con un score de Rodnan modificado ≥ 15 y con compromiso de un órgano interno (Pulmonar: definido por una CVF o DLCO < 80% del predicho predicho o enfermedad pulmonar intersticial demostrada por TACAR, radiografía, lavado bronco alveolar o biopsia; compromiso renal secundario a la enfermedad de base y compromiso cardíaco definido por la presencia de trastornos de la conducción o falla cardiaca congestiva reversible). Y en segundo lugar, pacientes con esclerosis sistémica difusa de 2 años de evolución con un score de Rodnan modificado > 20 asociado a eritrosedimentación > 25 mm en la 1ra hora y/o hemoglobina < 11g/dl, no explicable por otras causas15,16.
El compromiso orgánico severo asociado a mayor morbimortalidad en relación al TCMH corresponde a la presencia de hipertensión pulmonar severa con PsAP > 50 mmHg, disfunción miocárdica con FEVI < 45%, severo compromiso en la difusión de Monóxido de Carbono dado por DLCO < 40% y compromiso renal importante con una depuración de creatinina < 40 ml/min15,16.
La toxicidad del procedimiento ha demostrado ser comparable con los resultados reportados por los diferentes grupos en TCMH para enfermedades malignas avanzadas y enfermedades autoinmunes12,13. Es de anotar que en la fase de acondicionamiento del protocolo del TCMH utilizado en nuestra paciente se incluyó una modificación consistente con el uso de amifostina, agente utilizado en hematología, oncología y radioterapia como citoprotector; lo cual pudo haberse relacionado con la pronta recuperación hematológica (Citopenias - células lesionadas con potencial de reversibilidad).
En resumen, nuestra paciente con ES severa con menos de 2 años de evolución, refractaria al tratamiento inmunosupresor para esta entidad, mejoró sustancialmente con el TCMH. Esta observación abre el camino para continuar utilizando esta terapia en nuestro medio.
Referencias
1. Medsger TA Jr. Natural history of systemic sclerosis and the assessment of disease activity, severity, functional status, and psychologic wellbeing. Rheum Dis Clin North Am. 2003;29:225-273. [ Links ]
2. Mayers MD, Lacey JV Jr., Beebe Dimmer J, Gillespie BW, Cooper B, Laing TJ, Schottenfeld D. Prevalence, incidence, survival, and disease characteristics of systemic sclerosis in a large US population. Arthritis Rheum. 2003;48:226-255. [ Links ] [ Links ]
4. Steen VD, Medsger TA Jr. Changes in causes of death in systemic sclerosis. Ann Rheum Dis 2007;66:940- 944. [ Links ]
5. LeRoy EC, Black C, Fleischmajer R, Jablonska S, Krieg T, Medsger TA Jr, Rowell N, Wollheim F. Scleroderma (systemic sclerosis): classification, subsets and pathogenesis. J Rheumatol. 1998;15:202-205. [ Links ]
6. Steen VD, Medsger TA Jr. Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheum 2000;43:2437-2444. [ Links ]
7. Tashkin et al (Tashkin DP, Elashoff R, Clements PJ, Goldin J, Roth MD, Furst DE, et al. Research Group. Cyclophosphamide versus placebo in scleroderma lung disease. N Engl J Med. 2006;354:2655-2666. [ Links ]
8. Hoyles, R.K. et al. A multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma. Arth. Rheum. 2006;54:3962-3970. [ Links ]
9. J M van Laar, D Farge and A Tyndall. Stem cell transplantation: a treatment option for severe systemic sclerosis?.Ann Rheum Dis 2008;67:iii35-iii38 [ Links ]
10. Van Bekkum DW. Stem cell transplantation for autoimmune disorders. Preclinical experiments. Best Pract Res Clin Haematol 2004;17:201-222. [ Links ]
11. Farge D, Henegar C, Carmagnat M, Daneshpouy M, Marjanovic Z, Rabian C, et al. Analysis of immune reconstitution after autologous bone marrow transplantation in systemic sclerosis. Arthritis Rheum 2005;52:1555-1563. [ Links ]
12. Gratwohl A, Passweg J, Bocelli-Tyndall C, Fassas A, van Laar JM, Farge D, et al. Autologous hematopoietic stem cell transplantation for autoimmune diseases. Bone Marrow Transplant 2005;35:869-879. [ Links ]
13. Farge D, Passweg J, van Laar JM, Marjanovic Z, Besenthal C, Finke J, et al. Autologous stem cell transplantation in the treatment of systemic sclerosis: report from the EBMT/EULAR Registry. Ann Rheum Dis 2004;63:974-981. [ Links ]
14. Binks M, Passweg JR, Furst D, Tyndall. A Phase I/II trial of autologous stem cell transplantation in systemic sclerosis: procedure related mortality and impact on skin disease. Ann Rheum Dis. 2001;60:577-584. [ Links ]
15. Van Laar JM, Farge D, Tyndall A. Autologous Stem Cell Transplantation International Scleroderma (ASTIS) trial: hope on the horizon for patients with severe systemic sclerosis. Ann Rheum Dis 2005;64:1515. [ Links ]
16. Nash RA, McSweeney PA, Crofford LJ, Abidi M, Chen CS, Godwin JD, et al. Highdose immunosuppressive therapy and autologous hematopoietic cell transplantation for severe systemic sclerosis: long-term followup of the US multicenter pilot study. Blood 2007;110:1388-1396. [ Links ]
17. C.J. Velásquez, A.H. Ospina, J.D. Duque, J.D. Márquez y L.F. Pinto. Respuesta adecuada y sostenida a transplante autólogo de médula ósea en un paciente con esclerosis sistémica rápidamente progresiva y refractaria: Reporte de caso. Revista Colombiana de Reumatología. 2009;16(2):211. [ Links ]














